光駆動型のNa+ポンプKR2の構造機能解析
加藤英明1・井上圭一2・神取秀樹2・濡木 理1
(1東京大学大学院理学系研究科 生物科学専攻構造生命科学研究室,2名古屋工業大学大学院工学研究科 未来材料創成工学専攻ナノ・ライフ変換科学分野)
email:加藤英明,井上圭一,神取秀樹,濡木 理
DOI: 10.7875/first.author.2015.040
Structural basis for Na+ transport mechanism by a light-driven Na+ pump.
Hideaki E. Kato, Keiichi Inoue, Rei Abe-Yoshizumi, Yoshitaka Kato, Hikaru Ono, Masae Konno, Shoko Hososhima, Toru Ishizuka, Mohammad Razuanul Hoque, Hirofumi Kunitomo, Jumpei Ito, Susumu Yoshizawa, Keitaro Yamashita, Mizuki Takemoto, Tomohiro Nishizawa, Reiya Taniguchi, Kazuhiro Kogure, Andrés D. Maturana, Yuichi Iino, Hiromu Yawo, Ryuichiro Ishitani, Hideki Kandori, Osamu Nureki
Nature, 521, 48-53 (2015)
ヒトを含め多くの生物はロドプシンとよばれるタンパク質を用いて光を受容するが,近年,一部のロドプシンは,光の照射により任意のニューロンを興奮あるいは抑制させることのできる理想的なツールとして,とくに神経科学の分野において光遺伝学として非常に注目されている.そのような状況のもと,最近,光を受容してNa+を細胞の外へと排出する新規の微生物型ロドプシンが発見され,KR2と名づけられた.しかしながら,それまで40年近くものあいだ,微生物型ロドプシンによるH+以外の陽イオンの排出はその分子機構から不可能と考えられていたため,この新規のロドプシンがどのようにしてH+以外の陽イオンを細胞の外に排出するのか,説明がもとめられていた.今回,筆者らは,KR2の結晶構造を2つの異なる状態において決定した.さらに,これらの構造の情報をもとにした機能解析により,KR2がどのようにH+以外の陽イオンを輸送するのかを明らかにした.さらに,立体構造をもとにアミノ酸配列を改変することで,自然界には存在しない光駆動型のK+ポンプを合理的にデザインし作製するとともに,哺乳類のニューロンや線虫を用いた実験により,KR2が光遺伝学におけるツールとして利用可能であることを実証した.今回の結果は,微生物型ロドプシンによるNa+の輸送の分子機構という約40年にわたる問題に答えただけでなく,新規のロドプシンの設計および創製に対する道標となり,また,神経科学の分野に新たなツールを提供したという点で,幅広い研究分野に大きな影響をあたえるものと期待される.
ヒトから微生物まで,ほとんどの生物は光を受容し,その情報に応じた行動をとるが,多くの場合,この光の受容はロドプシンとよばれるタンパク質が担う.通常,ロドプシンはタンパク質部分であるオプシンにビタミンAの誘導体であるレチナールが結合した状態で機能しており,オプシンのアミノ酸配列の違いにより動物型ロドプシンと微生物型ロドプシンとに大別される.動物型ロドプシンと微生物型ロドプシンは結合するレチナールの構造が異なるが,どちらもレチナールが光を吸収しその構造を変化させることによりさまざまな機能を発揮するという点では同じである.たとえば,ヒトの眼に存在する視物質ロドプシン(動物型ロドプシン)は,光を吸収すると3量体Gタンパク質を活性化することにより視覚の形成において重要な役割をはたす.また,一部の微生物がもつバクテリオロドプシン(微生物型ロドプシン)は,光を吸収すると細胞の外へとH+を排出しH+の濃度勾配を形成することにより,とくに嫌気条件でのエネルギーの獲得において重要なはたらきをもつ.このように,ひとくちにロドプシンといってもその機能は多岐にわたることが知られているが,なかでも近年,イオン輸送型の微生物型ロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして利用可能であることが判明し,とくに,神経科学の分野において光遺伝学(optogenetics)として非常に注目されている.
イオン輸送型のロドプシンは大きくチャネル型とポンプ型とに分類することができるが,2002年にはじめて発見されたチャネル型ロドプシン(チャネルロドプシン)と比べ1),ポンプ型ロドプシンの研究の歴史は非常に古い.1971年に初の微生物型ロドプシンにして初のH+ポンプ型ロドプシンであるバクテリオロドプシンが発見され2),1977年に初のCl-ポンプ型ロドプシンであるハロロドプシンが発見されてから3),さまざまなポンプ型ロドプシンが発見された.しかしながらその一方で,ポンプ型ロドプシンの機能は,H+を細胞外に排出する“外向きH+ポンプ”と,Cl-を細胞内に取り込む“内向きCl-ポンプ”に限定されてきた.とくに,のちの研究によりCl-ポンプ型ロドプシンについてはCl-以外の陰イオンであるBr-やI-も輸送できることがわかったが,H+以外の陽イオンを輸送するポンプ型ロドプシンはひとつとして発見されなかった.
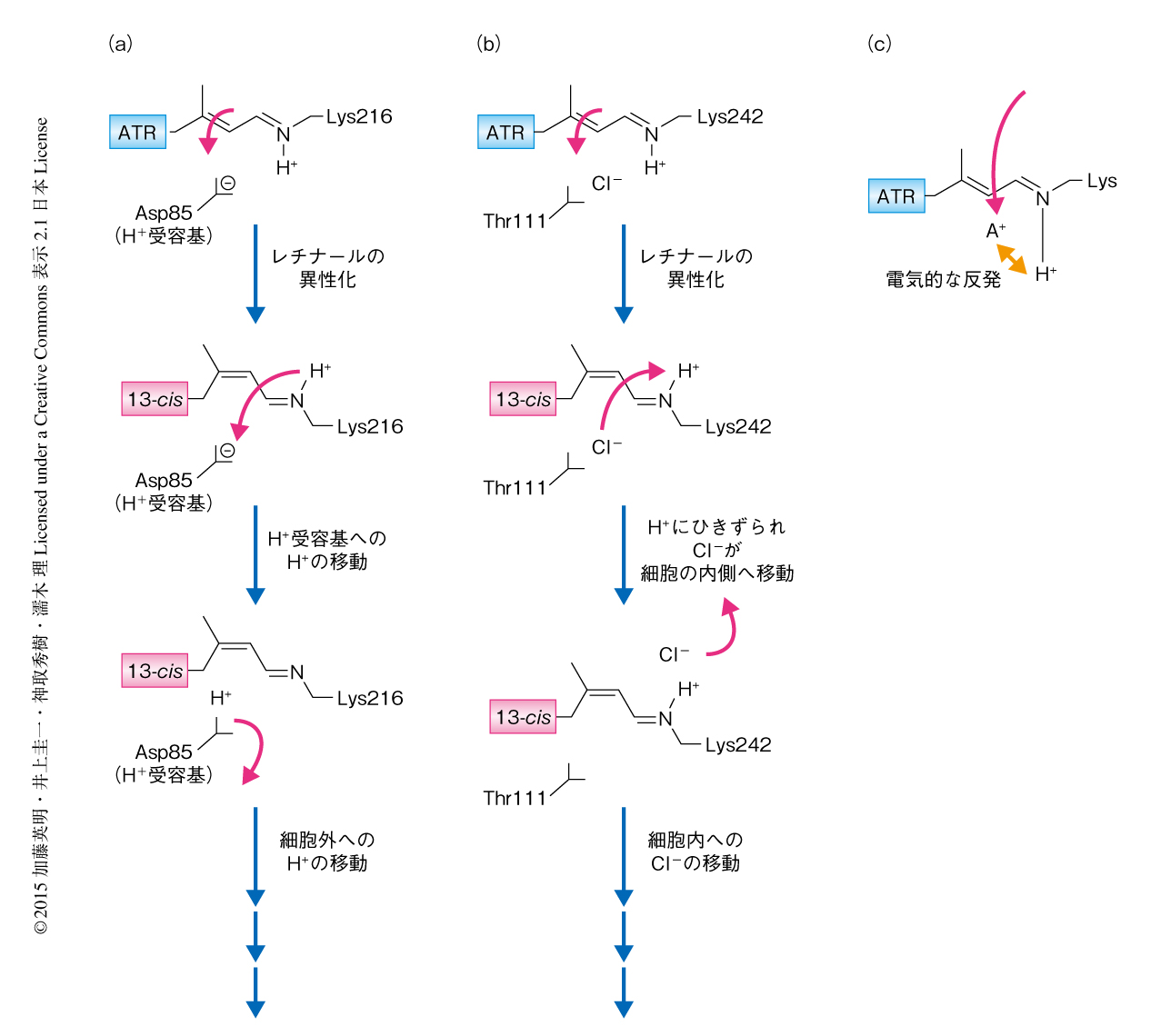
さらに研究が進むにつれ,H+以外の陽イオンを輸送するポンプ型ロドプシンが発見されないのは不思議ではないと考えられるようになった.H+ポンプ型あるいはCl-ポンプ型にかぎらず,すべての微生物型ロドプシンにおいてはレチナールがシッフ塩基を介しオプシンと結合している.そして,光があたるまえの暗状態ではこのシッフ塩基の窒素原子がプロトン化されている.ここで重要なのは,H+ポンプ型であろうとCl-ポンプ型であろうと,ポンプ型ロドプシンにおけるイオンの輸送経路はこのシッフ塩基のすぐ近傍に位置し,シッフ塩基と結合したH+が輸送経路をふさぐようなかたちで存在することである.H+ポンプ型ロドプシンの場合,光を吸収したレチナールが異性化されシッフ塩基の向きを変化させると,シッフ塩基と結合したH+は細胞の外側に存在する負電荷を帯びたアミノ酸残基(H+受容基とよばれ,通常はAspがこの役割をはたす)に受け渡され,そのH+がさらに細胞の外側へと移動することにより,細胞の外へのH+の輸送が可能になっている4)(図1a).すなわち,シッフ塩基と結合したH+それ自体が輸送基質となっている.一方,Cl-ポンプ型ロドプシンではCl-がプロトン化したシッフ塩基の正電荷を安定化させるように結合しており,光を吸収したレチナールが異性化されシッフ塩基の向きを変化させると,Cl-がシッフ塩基と結合したH+にひきずられるように細胞の外側から内側へと移動し,Cl-はそのまま細胞の内部へと輸送される4)(図1b).しかし,H+以外の陽イオンを輸送しようとすると,そううまくはいかない.陽イオンはCl-とは異なり,イオンの輸送経路の中心に位置するシッフ塩基と結合したH+と電気的な反発を起こすからである(図1c).そのため,H+ポンプ型ロドプシンおよびCl-ポンプ型ロドプシンによるイオンの輸送機構から演繹して,H+以外の陽イオンを細胞の外へと排出するロドプシンはおそらく原理的に存在しないだろうし,作製することも困難だろうと考えられてきた.
ところが2013年に,Krokinobacter eikastusとよばれる海洋微生物からKR2(Krokinobacter rhodopsin 2)と名づけられた新規のロドプシンが発見されたことにより5),そうした状況が一変した.このKR2は,それまで存在しないと考えられていた外向きNa+ポンプ型ロドプシンだったのである.
KR2の結晶構造を明らかにし,そのイオンの輸送機構を解明するため,KR2を大腸菌において発現させ,これを精製し,脂質キュービック法を用いて結晶化した.pH 3.8~4.0という強酸性条件から得られた結晶を用いて2.3Åという高分解能のデータを取得することに成功し,分子置換法を用いて位相を決定した.
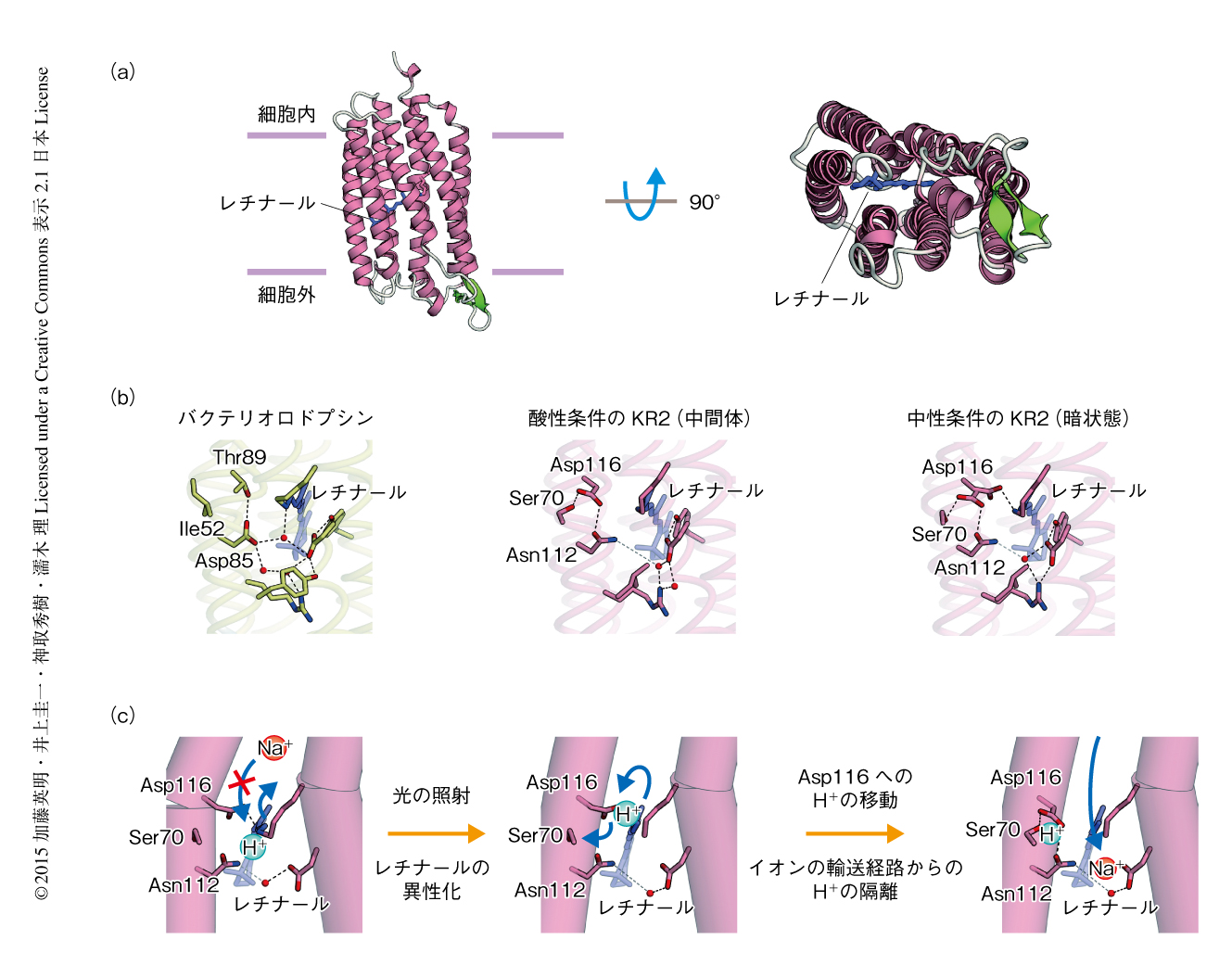
KR2はほかの微生物型ロドプシンと同様に7回膜貫通型タンパク質であったが,N末端側に特有のヘリックス構造が存在した(図2a).また,H+ポンプ型ロドプシンであるバクテリオロドプシンにおいてH+受容基としてはたらくAsp85がAsn112と置換されており,代わりに,バクテリオロドプシンにおいてシッフ塩基の真横に存在するThr89はAsp116と置換されていた(図2b).特筆すべきはAsp116の位置とその向きであり,Asp116はシッフ塩基の真横に位置するにもかかわらず,シッフ塩基とは真逆の方向をむいており,近傍のAsn112およびSer70との水素結合によりその位置は固定されていた.このAsp116におけるH+の状態をさらにくわしく調べるため,野生型KR2およびAsp116をAsnと置換した変異体を用いて異なるpH条件における吸収波長を測定した.その結果,Asp116は中性条件では脱プロトン化されているが,酸性条件ではプロトン化されていることが判明した.さらに,得られた立体構造を用いてAsp116のpKaを算出したところ,酸性条件における結晶構造では実際にAsp116がプロトン化されていることがわかった.ここで,Asp116をAsnと置換した変異体を用いた先行研究により,KR2ではAsp85に対応するAsn112ではなく,Thr89に対応するAsp116がH+受容基としてはたらくことがわかっていたため5),この酸性条件で得られた構造はAsp116がシッフ塩基からH+を受け取ったあとの中間体の構造を反映していると考えられた.実際,先行研究において,バクテリオロドプシンは酸性条件において光照射ののちの前期中間体状態と類似した状態をとることが報告されていたことも6),この仮説を支持した.そこで,光があたるまえの暗状態の構造の情報を得るため,中性条件において結晶構造を得ようと試みた.
KR2を中性条件において結晶化したところ,結晶から得られた回折像の分解能はどれも6~7Å,最高でも4Å程度であった.そのため,酸性条件において得られた結晶を中性の結晶化溶液に浸すことにより,結晶の内部のpHを変化させた.酸性条件において得られたKR2の結晶をpH 7.5~8.5の溶液に浸したところ,結晶の色が紫色から赤色に変化したことから,Asp116が脱プロトン化されたことが推測された.この赤色の結晶を用いたところ,最終的に2.3Åという高分解能のデータを取得することに成功し,その結晶構造を決定することができた.
中性条件と酸性条件の結晶構造を比較すると,全体構造はほぼ同じであったが,シッフ塩基の近傍に大きな差を生じていた.さきに述べたAsp116の向きに着目すると,Ser70およびAsn112と水素結合を形成するものにくわえ,シッフ塩基の方向をむくものが混じっていたのである.この結果から,脱プロトン化状態のAsp116はシッフ塩基の方向をむくが,プロトン化状態のAsp116はその向きを変えSer70およびAsn112と水素結合を形成したほうが安定であると推測された.ここで重要なのは,Asp116がシッフ塩基のH+受容基としてはたらくこと,そして,Asp116がシッフ塩基からH+を受け取り,Ser70およびAsn112の方向をむくことによりイオンの輸送経路の中心からH+が遠ざかることである.すでに先行研究において,Asp116をAsnと置換した変異体,つまり,シッフ塩基からH+を受け取ることのできない変異体はNa+輸送能を失うことが報告されていた5).そのため,シッフ塩基からH+を受け取るだけではなく,プロトン化および脱プロトン化にともなうAsp116の向きの変化がNa+の輸送に必須の過程であることを示すために,Ser70あるいはAsn112について複数の変異体を作製しそのNa+輸送能を測定した.その結果,Asp116と水素結合を形成することのできない変異体ではNa+輸送能が完全に消失したが,Asp116と水素結合を維持できる変異体ではNa+輸送能は失われないことを見い出した.
これまでの結果から想定された,KR2によるNa+の輸送モデルは以下である.光のあたっていない暗状態のとき,イオンの輸送経路の中央に位置するシッフ塩基はプロトン化されており,そのH+の正電荷が陽イオンの輸送を阻害している(図2c).しかし,レチナールが光を吸収し異性化反応を起こすと,シッフ塩基と結合したH+はAsp116に受け渡される.プロトン化されたAsp116はその向きを変え,Ser70およびAsn112と水素結合を形成することにより,H+をイオンの輸送経路から隔離する.これによりNa+の輸送に必要なエネルギー障壁が低下し,Na+の輸送が可能になる.
この輸送モデルによると,KR2はシッフ塩基の近傍においてH+をイオンの輸送経路から隔離することによりH+以外の陽イオンの輸送を可能にしているだけであり,この領域においてNa+を選択的に認識しているわけではないことになる.そのため,シッフ塩基よりもイオンの輸送経路の入り口の側(細胞の内側)に別に,Na+を選択的に認識する機構が存在するのではないかと考えた.この推測が正しければ,輸送経路の入り口付近の形状を変化させることにより,Na+以外の陽イオンを輸送するロドプシンを創製できるかもしれない.そこで,イオンの輸送経路の入り口を構成するAsn61およびGly263に着目し,それらに対する複数の変異体を作製してイオン選択性を調べた.その結果,Asn61をProと置換した変異体およびGly263をTyrと置換した変異体ではNa+にくわえK+を輸送すること,そして,この2つの変異を組み合わせた変異体はNa+よりK+を優先的に輸送することが判明した.この結果は,さきの仮説を裏づけたとともに,初の光駆動型のK+ポンプが創製されたことを意味した.
イオン輸送型の微生物型ロドプシンが注目されるもっとも大きな理由のひとつが,光遺伝学への応用である.光を吸収して細胞の外にNa+を排出するKR2は,現在,光遺伝学において用いられている外向きH+ポンプや内向きCl-ポンプのように,光に依存して目的のニューロンの活動を抑制するツールとして利用できると考えられた.そこで,哺乳類のニューロンおよび線虫を用いた実験により,実際に,KR2が光遺伝学のツールとして利用可能であることを示すことにした.
ラットの大脳皮質のニューロンにKR2を発現させ,光の照射によりKR2に由来する電流が流れるか,また,KR2に由来する電流によりニューロンの活動を抑制することができるかをパッチクランプ法を用いて検証したところ,ニューロンの興奮が抑制されることが確認された.また,線虫のニューロンにKR2を発現させ光照射の前後で線虫の移動速度を測定したところ,KR2に由来する電流によりニューロンの興奮が抑制されることで,行動が抑制されることが確認された.微生物型ロドプシンは真核生物,真正細菌,古細菌のすべてから見い出されているが,現在まで光遺伝学のツールとして利用されてきたのは真核生物あるいは古細菌に由来するものであった.そのため,今回の成果は,光遺伝学のツールとして利用可能な微生物型ロドプシンが真正細菌から見い出されたはじめての例になった.また,細胞外へのNa+の輸送およびK+の輸送は,H+やCl-の輸送と比較して細胞毒性が低く,酸感受性チャネルに影響しにくいなどの利点があるため,今後,KR2やその変異体がニューロンの興奮を抑制するツールとして有効にはたらく場面が存在すると期待される.
KR2の構造解析のプロジェクトがはじまったのは2012年のことであった.以前のチャネルロドプシンの構造解析(新着論文レビュー でも掲載)のときとは異なり,KR2の発現量,また,精製したのちの純度は,はじめから非常に高かったことを覚えている.ゲルろ過クロマトグラフィーにより得られたピークの形状も上々で,実際に結晶化してみたところ初期スクリーニングで結晶が得られ,分解能7Å程度の反射も示された.しかし,“これなら解ける”と思って意気揚々と結晶化条件の最適化を試みたものの状況は一向に改善されず,大した進展もないまま1年半もの月日が経過した.もちろん,無為に時間を浪費していたわけではなく,末端配列の最適化,T4リゾチームやBRILの導入,細胞内ループあるいは細胞外ループの短縮,界面活性剤の変更,脂質キュービック法で用いる脂質の変更,など,いろいろなことを試していたが大きな効果はなかった.“卒業までに構造を解くのはむずかしいかもな…”と弱気になりつつあった筆者に喝を入れたのは,同じく筆者らの研究室でチャレンジされていたCas9の構造解析(新着論文レビュー でも掲載)であった.KR2の構造解析よりもあとからはじまったにもかかわらず,瞬く間にその立体構造が明らかにされたのをまのあたりにして,“このままではいけない.これが解けなかったら卒業しないくらいの気持ちで取り組もう”と思ったのが博士課程3年の夏のことであった.
いろいろな条件を見直し,最後にたどりついたのが結晶化のスクリーニングキットであった.初期スクリーニングには自作のキットを用いていたが,このキットではpH 5~8の範囲を検討していた.極端に低いあるいは高いpHでは結晶が壊れると考えられていたからである.だが,よくよく思い返してみると,ヒスタミン受容体の構造解析ではpH 4.5の条件で結晶化に成功している.“もう少し広げてみよう”と新しくデザインしたpH 4~9の範囲のスクリーニングキットを用いたところ,pH 4という強酸性条件においてみなれない紫色の結晶が得られた.形は悪く,大きさも小さく,しかも,結晶化から24時間以内に析出するが,48時間もたつとヒビが入り,72~96時間で崩壊してしまうという不安定な代物だった.大した期待もせずにX線を照射したところ,これが分解能2.5Åの反射を叩き出した.博士論文の審査を2カ月後に控えた2013年11月のことであった.
今回の教訓は,“あまり先入観にとらわれずにスクリーニングをしよう”“結晶観察はマメにしよう”そして“ギリギリまで思考も手も止めずにがんばろう”といったところであろうか.そして最後にひとつ.Nature誌に投稿した際,ひとりのレビュアーが“これはチャネルロドプシンの構造以来,もっともおもしろい微生物型レチナールタンパク質の構造論文だ.(中略)この論文はNature誌にてpublishすべきである”とコメントした.これを読んだ際に思わず目頭が熱くなったことをよく覚えている.留学の直後でいろいろな不安を感じていた当時の筆者にとり,大きな心の支えとなった言葉であった.今後も,このレビュアーが(意図せず)かけてくれた言葉を忘れず,いままで以上に質の高いScienceをしていきたい.
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年より米国Stanford大学School of Medicine研究員.
研究テーマ:膜タンパク質の構造機能解析.
抱負:つねに質の高いScienceを.
井上 圭一(Keiichi Inoue)
名古屋工業大学大学院工学研究科 助教.
神取 秀樹(Hideki Kandori)
名古屋工業大学大学院工学研究科 教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2015 加藤英明・井上圭一・神取秀樹・濡木 理 Licensed under CC 表示 2.1 日本
(1東京大学大学院理学系研究科 生物科学専攻構造生命科学研究室,2名古屋工業大学大学院工学研究科 未来材料創成工学専攻ナノ・ライフ変換科学分野)
email:加藤英明,井上圭一,神取秀樹,濡木 理
DOI: 10.7875/first.author.2015.040
Structural basis for Na+ transport mechanism by a light-driven Na+ pump.
Hideaki E. Kato, Keiichi Inoue, Rei Abe-Yoshizumi, Yoshitaka Kato, Hikaru Ono, Masae Konno, Shoko Hososhima, Toru Ishizuka, Mohammad Razuanul Hoque, Hirofumi Kunitomo, Jumpei Ito, Susumu Yoshizawa, Keitaro Yamashita, Mizuki Takemoto, Tomohiro Nishizawa, Reiya Taniguchi, Kazuhiro Kogure, Andrés D. Maturana, Yuichi Iino, Hiromu Yawo, Ryuichiro Ishitani, Hideki Kandori, Osamu Nureki
Nature, 521, 48-53 (2015)
要 約
ヒトを含め多くの生物はロドプシンとよばれるタンパク質を用いて光を受容するが,近年,一部のロドプシンは,光の照射により任意のニューロンを興奮あるいは抑制させることのできる理想的なツールとして,とくに神経科学の分野において光遺伝学として非常に注目されている.そのような状況のもと,最近,光を受容してNa+を細胞の外へと排出する新規の微生物型ロドプシンが発見され,KR2と名づけられた.しかしながら,それまで40年近くものあいだ,微生物型ロドプシンによるH+以外の陽イオンの排出はその分子機構から不可能と考えられていたため,この新規のロドプシンがどのようにしてH+以外の陽イオンを細胞の外に排出するのか,説明がもとめられていた.今回,筆者らは,KR2の結晶構造を2つの異なる状態において決定した.さらに,これらの構造の情報をもとにした機能解析により,KR2がどのようにH+以外の陽イオンを輸送するのかを明らかにした.さらに,立体構造をもとにアミノ酸配列を改変することで,自然界には存在しない光駆動型のK+ポンプを合理的にデザインし作製するとともに,哺乳類のニューロンや線虫を用いた実験により,KR2が光遺伝学におけるツールとして利用可能であることを実証した.今回の結果は,微生物型ロドプシンによるNa+の輸送の分子機構という約40年にわたる問題に答えただけでなく,新規のロドプシンの設計および創製に対する道標となり,また,神経科学の分野に新たなツールを提供したという点で,幅広い研究分野に大きな影響をあたえるものと期待される.
はじめに
ヒトから微生物まで,ほとんどの生物は光を受容し,その情報に応じた行動をとるが,多くの場合,この光の受容はロドプシンとよばれるタンパク質が担う.通常,ロドプシンはタンパク質部分であるオプシンにビタミンAの誘導体であるレチナールが結合した状態で機能しており,オプシンのアミノ酸配列の違いにより動物型ロドプシンと微生物型ロドプシンとに大別される.動物型ロドプシンと微生物型ロドプシンは結合するレチナールの構造が異なるが,どちらもレチナールが光を吸収しその構造を変化させることによりさまざまな機能を発揮するという点では同じである.たとえば,ヒトの眼に存在する視物質ロドプシン(動物型ロドプシン)は,光を吸収すると3量体Gタンパク質を活性化することにより視覚の形成において重要な役割をはたす.また,一部の微生物がもつバクテリオロドプシン(微生物型ロドプシン)は,光を吸収すると細胞の外へとH+を排出しH+の濃度勾配を形成することにより,とくに嫌気条件でのエネルギーの獲得において重要なはたらきをもつ.このように,ひとくちにロドプシンといってもその機能は多岐にわたることが知られているが,なかでも近年,イオン輸送型の微生物型ロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして利用可能であることが判明し,とくに,神経科学の分野において光遺伝学(optogenetics)として非常に注目されている.
イオン輸送型のロドプシンは大きくチャネル型とポンプ型とに分類することができるが,2002年にはじめて発見されたチャネル型ロドプシン(チャネルロドプシン)と比べ1),ポンプ型ロドプシンの研究の歴史は非常に古い.1971年に初の微生物型ロドプシンにして初のH+ポンプ型ロドプシンであるバクテリオロドプシンが発見され2),1977年に初のCl-ポンプ型ロドプシンであるハロロドプシンが発見されてから3),さまざまなポンプ型ロドプシンが発見された.しかしながらその一方で,ポンプ型ロドプシンの機能は,H+を細胞外に排出する“外向きH+ポンプ”と,Cl-を細胞内に取り込む“内向きCl-ポンプ”に限定されてきた.とくに,のちの研究によりCl-ポンプ型ロドプシンについてはCl-以外の陰イオンであるBr-やI-も輸送できることがわかったが,H+以外の陽イオンを輸送するポンプ型ロドプシンはひとつとして発見されなかった.
さらに研究が進むにつれ,H+以外の陽イオンを輸送するポンプ型ロドプシンが発見されないのは不思議ではないと考えられるようになった.H+ポンプ型あるいはCl-ポンプ型にかぎらず,すべての微生物型ロドプシンにおいてはレチナールがシッフ塩基を介しオプシンと結合している.そして,光があたるまえの暗状態ではこのシッフ塩基の窒素原子がプロトン化されている.ここで重要なのは,H+ポンプ型であろうとCl-ポンプ型であろうと,ポンプ型ロドプシンにおけるイオンの輸送経路はこのシッフ塩基のすぐ近傍に位置し,シッフ塩基と結合したH+が輸送経路をふさぐようなかたちで存在することである.H+ポンプ型ロドプシンの場合,光を吸収したレチナールが異性化されシッフ塩基の向きを変化させると,シッフ塩基と結合したH+は細胞の外側に存在する負電荷を帯びたアミノ酸残基(H+受容基とよばれ,通常はAspがこの役割をはたす)に受け渡され,そのH+がさらに細胞の外側へと移動することにより,細胞の外へのH+の輸送が可能になっている4)(図1a).すなわち,シッフ塩基と結合したH+それ自体が輸送基質となっている.一方,Cl-ポンプ型ロドプシンではCl-がプロトン化したシッフ塩基の正電荷を安定化させるように結合しており,光を吸収したレチナールが異性化されシッフ塩基の向きを変化させると,Cl-がシッフ塩基と結合したH+にひきずられるように細胞の外側から内側へと移動し,Cl-はそのまま細胞の内部へと輸送される4)(図1b).しかし,H+以外の陽イオンを輸送しようとすると,そううまくはいかない.陽イオンはCl-とは異なり,イオンの輸送経路の中心に位置するシッフ塩基と結合したH+と電気的な反発を起こすからである(図1c).そのため,H+ポンプ型ロドプシンおよびCl-ポンプ型ロドプシンによるイオンの輸送機構から演繹して,H+以外の陽イオンを細胞の外へと排出するロドプシンはおそらく原理的に存在しないだろうし,作製することも困難だろうと考えられてきた.
ところが2013年に,Krokinobacter eikastusとよばれる海洋微生物からKR2(Krokinobacter rhodopsin 2)と名づけられた新規のロドプシンが発見されたことにより5),そうした状況が一変した.このKR2は,それまで存在しないと考えられていた外向きNa+ポンプ型ロドプシンだったのである.
1.KR2の酸性条件における結晶構造解析
KR2の結晶構造を明らかにし,そのイオンの輸送機構を解明するため,KR2を大腸菌において発現させ,これを精製し,脂質キュービック法を用いて結晶化した.pH 3.8~4.0という強酸性条件から得られた結晶を用いて2.3Åという高分解能のデータを取得することに成功し,分子置換法を用いて位相を決定した.
KR2はほかの微生物型ロドプシンと同様に7回膜貫通型タンパク質であったが,N末端側に特有のヘリックス構造が存在した(図2a).また,H+ポンプ型ロドプシンであるバクテリオロドプシンにおいてH+受容基としてはたらくAsp85がAsn112と置換されており,代わりに,バクテリオロドプシンにおいてシッフ塩基の真横に存在するThr89はAsp116と置換されていた(図2b).特筆すべきはAsp116の位置とその向きであり,Asp116はシッフ塩基の真横に位置するにもかかわらず,シッフ塩基とは真逆の方向をむいており,近傍のAsn112およびSer70との水素結合によりその位置は固定されていた.このAsp116におけるH+の状態をさらにくわしく調べるため,野生型KR2およびAsp116をAsnと置換した変異体を用いて異なるpH条件における吸収波長を測定した.その結果,Asp116は中性条件では脱プロトン化されているが,酸性条件ではプロトン化されていることが判明した.さらに,得られた立体構造を用いてAsp116のpKaを算出したところ,酸性条件における結晶構造では実際にAsp116がプロトン化されていることがわかった.ここで,Asp116をAsnと置換した変異体を用いた先行研究により,KR2ではAsp85に対応するAsn112ではなく,Thr89に対応するAsp116がH+受容基としてはたらくことがわかっていたため5),この酸性条件で得られた構造はAsp116がシッフ塩基からH+を受け取ったあとの中間体の構造を反映していると考えられた.実際,先行研究において,バクテリオロドプシンは酸性条件において光照射ののちの前期中間体状態と類似した状態をとることが報告されていたことも6),この仮説を支持した.そこで,光があたるまえの暗状態の構造の情報を得るため,中性条件において結晶構造を得ようと試みた.
2.KR2の中性条件における結晶構造解析
KR2を中性条件において結晶化したところ,結晶から得られた回折像の分解能はどれも6~7Å,最高でも4Å程度であった.そのため,酸性条件において得られた結晶を中性の結晶化溶液に浸すことにより,結晶の内部のpHを変化させた.酸性条件において得られたKR2の結晶をpH 7.5~8.5の溶液に浸したところ,結晶の色が紫色から赤色に変化したことから,Asp116が脱プロトン化されたことが推測された.この赤色の結晶を用いたところ,最終的に2.3Åという高分解能のデータを取得することに成功し,その結晶構造を決定することができた.
中性条件と酸性条件の結晶構造を比較すると,全体構造はほぼ同じであったが,シッフ塩基の近傍に大きな差を生じていた.さきに述べたAsp116の向きに着目すると,Ser70およびAsn112と水素結合を形成するものにくわえ,シッフ塩基の方向をむくものが混じっていたのである.この結果から,脱プロトン化状態のAsp116はシッフ塩基の方向をむくが,プロトン化状態のAsp116はその向きを変えSer70およびAsn112と水素結合を形成したほうが安定であると推測された.ここで重要なのは,Asp116がシッフ塩基のH+受容基としてはたらくこと,そして,Asp116がシッフ塩基からH+を受け取り,Ser70およびAsn112の方向をむくことによりイオンの輸送経路の中心からH+が遠ざかることである.すでに先行研究において,Asp116をAsnと置換した変異体,つまり,シッフ塩基からH+を受け取ることのできない変異体はNa+輸送能を失うことが報告されていた5).そのため,シッフ塩基からH+を受け取るだけではなく,プロトン化および脱プロトン化にともなうAsp116の向きの変化がNa+の輸送に必須の過程であることを示すために,Ser70あるいはAsn112について複数の変異体を作製しそのNa+輸送能を測定した.その結果,Asp116と水素結合を形成することのできない変異体ではNa+輸送能が完全に消失したが,Asp116と水素結合を維持できる変異体ではNa+輸送能は失われないことを見い出した.
3.KR2によるNa+の輸送モデル
これまでの結果から想定された,KR2によるNa+の輸送モデルは以下である.光のあたっていない暗状態のとき,イオンの輸送経路の中央に位置するシッフ塩基はプロトン化されており,そのH+の正電荷が陽イオンの輸送を阻害している(図2c).しかし,レチナールが光を吸収し異性化反応を起こすと,シッフ塩基と結合したH+はAsp116に受け渡される.プロトン化されたAsp116はその向きを変え,Ser70およびAsn112と水素結合を形成することにより,H+をイオンの輸送経路から隔離する.これによりNa+の輸送に必要なエネルギー障壁が低下し,Na+の輸送が可能になる.
4.光駆動型のK+ポンプ型ロドプシンの創製
この輸送モデルによると,KR2はシッフ塩基の近傍においてH+をイオンの輸送経路から隔離することによりH+以外の陽イオンの輸送を可能にしているだけであり,この領域においてNa+を選択的に認識しているわけではないことになる.そのため,シッフ塩基よりもイオンの輸送経路の入り口の側(細胞の内側)に別に,Na+を選択的に認識する機構が存在するのではないかと考えた.この推測が正しければ,輸送経路の入り口付近の形状を変化させることにより,Na+以外の陽イオンを輸送するロドプシンを創製できるかもしれない.そこで,イオンの輸送経路の入り口を構成するAsn61およびGly263に着目し,それらに対する複数の変異体を作製してイオン選択性を調べた.その結果,Asn61をProと置換した変異体およびGly263をTyrと置換した変異体ではNa+にくわえK+を輸送すること,そして,この2つの変異を組み合わせた変異体はNa+よりK+を優先的に輸送することが判明した.この結果は,さきの仮説を裏づけたとともに,初の光駆動型のK+ポンプが創製されたことを意味した.
5.光遺伝学への応用
イオン輸送型の微生物型ロドプシンが注目されるもっとも大きな理由のひとつが,光遺伝学への応用である.光を吸収して細胞の外にNa+を排出するKR2は,現在,光遺伝学において用いられている外向きH+ポンプや内向きCl-ポンプのように,光に依存して目的のニューロンの活動を抑制するツールとして利用できると考えられた.そこで,哺乳類のニューロンおよび線虫を用いた実験により,実際に,KR2が光遺伝学のツールとして利用可能であることを示すことにした.
ラットの大脳皮質のニューロンにKR2を発現させ,光の照射によりKR2に由来する電流が流れるか,また,KR2に由来する電流によりニューロンの活動を抑制することができるかをパッチクランプ法を用いて検証したところ,ニューロンの興奮が抑制されることが確認された.また,線虫のニューロンにKR2を発現させ光照射の前後で線虫の移動速度を測定したところ,KR2に由来する電流によりニューロンの興奮が抑制されることで,行動が抑制されることが確認された.微生物型ロドプシンは真核生物,真正細菌,古細菌のすべてから見い出されているが,現在まで光遺伝学のツールとして利用されてきたのは真核生物あるいは古細菌に由来するものであった.そのため,今回の成果は,光遺伝学のツールとして利用可能な微生物型ロドプシンが真正細菌から見い出されたはじめての例になった.また,細胞外へのNa+の輸送およびK+の輸送は,H+やCl-の輸送と比較して細胞毒性が低く,酸感受性チャネルに影響しにくいなどの利点があるため,今後,KR2やその変異体がニューロンの興奮を抑制するツールとして有効にはたらく場面が存在すると期待される.
おわりに
KR2の構造解析のプロジェクトがはじまったのは2012年のことであった.以前のチャネルロドプシンの構造解析(新着論文レビュー でも掲載)のときとは異なり,KR2の発現量,また,精製したのちの純度は,はじめから非常に高かったことを覚えている.ゲルろ過クロマトグラフィーにより得られたピークの形状も上々で,実際に結晶化してみたところ初期スクリーニングで結晶が得られ,分解能7Å程度の反射も示された.しかし,“これなら解ける”と思って意気揚々と結晶化条件の最適化を試みたものの状況は一向に改善されず,大した進展もないまま1年半もの月日が経過した.もちろん,無為に時間を浪費していたわけではなく,末端配列の最適化,T4リゾチームやBRILの導入,細胞内ループあるいは細胞外ループの短縮,界面活性剤の変更,脂質キュービック法で用いる脂質の変更,など,いろいろなことを試していたが大きな効果はなかった.“卒業までに構造を解くのはむずかしいかもな…”と弱気になりつつあった筆者に喝を入れたのは,同じく筆者らの研究室でチャレンジされていたCas9の構造解析(新着論文レビュー でも掲載)であった.KR2の構造解析よりもあとからはじまったにもかかわらず,瞬く間にその立体構造が明らかにされたのをまのあたりにして,“このままではいけない.これが解けなかったら卒業しないくらいの気持ちで取り組もう”と思ったのが博士課程3年の夏のことであった.
いろいろな条件を見直し,最後にたどりついたのが結晶化のスクリーニングキットであった.初期スクリーニングには自作のキットを用いていたが,このキットではpH 5~8の範囲を検討していた.極端に低いあるいは高いpHでは結晶が壊れると考えられていたからである.だが,よくよく思い返してみると,ヒスタミン受容体の構造解析ではpH 4.5の条件で結晶化に成功している.“もう少し広げてみよう”と新しくデザインしたpH 4~9の範囲のスクリーニングキットを用いたところ,pH 4という強酸性条件においてみなれない紫色の結晶が得られた.形は悪く,大きさも小さく,しかも,結晶化から24時間以内に析出するが,48時間もたつとヒビが入り,72~96時間で崩壊してしまうという不安定な代物だった.大した期待もせずにX線を照射したところ,これが分解能2.5Åの反射を叩き出した.博士論文の審査を2カ月後に控えた2013年11月のことであった.
今回の教訓は,“あまり先入観にとらわれずにスクリーニングをしよう”“結晶観察はマメにしよう”そして“ギリギリまで思考も手も止めずにがんばろう”といったところであろうか.そして最後にひとつ.Nature誌に投稿した際,ひとりのレビュアーが“これはチャネルロドプシンの構造以来,もっともおもしろい微生物型レチナールタンパク質の構造論文だ.(中略)この論文はNature誌にてpublishすべきである”とコメントした.これを読んだ際に思わず目頭が熱くなったことをよく覚えている.留学の直後でいろいろな不安を感じていた当時の筆者にとり,大きな心の支えとなった言葉であった.今後も,このレビュアーが(意図せず)かけてくれた言葉を忘れず,いままで以上に質の高いScienceをしていきたい.
文 献
- Nagel, G., Ollig, D., Fuhrmann, M. et al.: Channelrhodopsin-1: a light-gated proton channel in green algae. Science, 296, 2395-2398 (2002)[PubMed]
- Oesterhelt, D. & Stoeckenius, W.: Rhodopsin-like protein from the purple membrane of Halobacterium halobium. Nat. New Biol., 233, 149-152 (1971)[PubMed]
- Matsuno-Yagi, A. & Mukohata, Y.: Two possible roles of bacteriorhodopsin; a comparative study of strains of Halobacterium halobium differing in pigmentation. Biochem. Biophys. Res. Commun., 78, 237-243 (1977)[PubMed]
- Ernst, O. P., Lodowski, D. T., Elstner, M. et al.: Microbial and animal rhodopsins: structures, functions, and molecular mechanisms. Chem. Rev., 114, 126-163 (2014)[PubMed]
- Inoue, K., Ono, H., Abe-Yoshizumi, R. et al.: A light-driven sodium ion pump in marine bacteria. Nat. Commun., 4, 1678 (2013)[PubMed]
- Okumura, H., Murakami, M. & Kouyama, T.: Crystal structures of acid blue and alkaline purple forms of bacteriorhodopsin. J. Mol. Biol., 351, 481-495 (2005)[PubMed]
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年より米国Stanford大学School of Medicine研究員.
研究テーマ:膜タンパク質の構造機能解析.
抱負:つねに質の高いScienceを.
井上 圭一(Keiichi Inoue)
名古屋工業大学大学院工学研究科 助教.
神取 秀樹(Hideki Kandori)
名古屋工業大学大学院工学研究科 教授.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2015 加藤英明・井上圭一・神取秀樹・濡木 理 Licensed under CC 表示 2.1 日本