ニトロ化ヌクレオチドは細菌に対する選択的なオートファジーにおける内因性の誘導因子である
伊藤千秋・斉藤洋平・有本博一
(東北大学大学院生命科学研究科 分子情報化学分野)
email:有本博一
DOI: 10.7875/first.author.2013.157
Endogenous nitrated nucleotide is a key mediator of autophagy and innate defense against bacteria.
Chiaki Ito, Yohei Saito, Takashi Nozawa, Shigemoto Fujii, Tomohiro Sawa, Hirofumi Inoue, Tetsuro Matsunaga, Shahzada Khan, Soichiro Akashi, Ryota Hashimoto, Chihiro Aikawa, Eriko Takahashi, Hiroshi Sagara, Masaaki Komatsu, Keiji Tanaka, Takaaki Akaike, Ichiro Nakagawa, Hirokazu Arimoto
Molecular Cell, 52, 794-804 (2013)
オートファジーはプロテアソーム系とならび細胞における主要な分解系である.この論文において,筆者らは,8-ニトロcGMPが内因性のオートファジー誘導因子であることを見い出した.8-ニトロcGMPは細胞に侵入した細菌のオートファジーによる排除を促進することも明らかにされた.細胞に侵入した細菌の排除に機能するオートファジーにおいて,細菌の表面に集積したユビキチン鎖が選択的なオートファジーの標識になると考えられている.今回,細菌の表面において8-ニトロcGMPによる顕著なS-グアニル化修飾が観察された.そして,S-グアニル化修飾に陽性を示す細菌は,そうでない細菌と比べ高い確率でユビキチン化されていた.このことから,細菌の表面にみられるタンパク質のS-グアニル化修飾は選択的なオートファジーにおける初期の標識として機能していると結論した.
オートファジーは栄養飢餓との関係が広く知られ,非選択的な分解系というイメージが強い.しかし,最近の研究から,細胞に蓄積したタンパク質凝集体や細胞に侵入した細菌を選択的に捕捉して分解する役割が明らかになり,現在では,生体における恒常性の維持に欠かせない分解系として非常に注目されている.オートファジーは定常状態においてもつねに起こっているが,細菌の感染およびレドックスバランスがくずれるようなストレス条件において活性化される.たとえば,細菌の構成成分などの病原体関連分子パターン(pathogen-associated molecular patterns:PAMP)がToll様受容体に結合すると,そこからのシグナル伝達系が活性化されてオートファジーが誘導される1).一方,活性酸素種とオートファジーとの関係については多くの研究があり,活性酸素種によりオートファジーが制御されることがわかっている2).
筆者らは,NOの下流において機能するメディエーターとして,ニトロ化ヌクレオチドのひとつ8-ニトロcGMPを研究の対象とした3).8-ニトロcGMPのもつニトロ基はNOおよび活性酸素種の両方に直接に由来する.すなわち,細胞がストレスにさらされNOおよび活性酸素種の産生量がともに増加すると,8-ニトロcGMPの産生量も増加する.この研究は,NOシグナル伝達系が下流の分子を介しオートファジーを制御するしくみをはじめて明らかにした.
細胞の外から投与した8-ニトロcGMPがオートファジーにあたえる影響について評価した.一般に,オートファジーの活性はマーカータンパク質であるLC3により評価することができる4).LC3にはLC3-IとLC3-IIの2つのタイプがあり,細胞質ではLC3-Iとして存在する一方,ホスファチジルエタノールアミンと結合したLC3-IIはオートファゴソーム膜に局在する.8-ニトロcGMPをマクロファージ様のRAW264.7細胞に投与したところ,オートファゴソームの数は増加した.LC3-IIの量の増加はウェスタンブロット法によっても確認された.また,Atg5をノックアウトしたマウス胎仔線維芽細胞を用いた実験により,8-ニトロcGMPにより誘導されたオートファジーはAtg5に依存する古典的な経路によるものであることも明らかになった.
リポ多糖による刺激は細胞に炎症を起こすとともにオートファジーを誘導する.これまでに,心筋細胞を用いた研究により,この誘導には細胞に存在するNOが必要であることが明らかにされている1).マクロファージにおいて,NO合成酵素の阻害剤であるL-NMMAはリポ多糖の刺激によるオートファジーの誘導を抑制した.一方,リポ多糖による刺激は細胞に存在する8-ニトロcGMPの量を増加させ,L-NMMAはこの8-ニトロcGMPの産生を阻害することが示されている3).これらの結果から,8-ニトロcGMPは内因性のオートファジー誘導因子のひとつであると考えられた.
細菌の感染における8-ニトロcGMPの作用を評価した.A群連鎖球菌は細胞に侵入するとファゴソームから細胞質へと脱出するが,最終的にはオートファジーにより排除されることが知られている5).すなわち,二重膜からなるオートファゴソーム様の構造体により捕捉されオートファジーにより分解される5).8-ニトロcGMPを処理したRAW264.7細胞では,このオートファゴソーム様の構造体の形成率が有意に上昇した.また,細胞におけるA群連鎖球菌の生存率も8-ニトロcGMPの処理により低下した.つまり,8-ニトロcGMPはオートファジーを活性化することにより細菌の排除を促進する効果のあることが明らかになった.
A群連鎖球菌に感染した細胞において産生される内因性の8-ニトロcGMPに注目して解析を行った.阻害剤により内因性の8-ニトロcGMPの量を減少させると,A群連鎖球菌の排除にはたらくオートファゴソーム様の構造体の形成率は低下し,A群連鎖球菌の排除は遅延した.さらに,8-ニトロcGMPを消去するNaHSの処理6) により,同様にオートファゴソーム様の構造体の形成率は低下し,A群連鎖球菌の排除も抑制された.これらの結果は,細菌を排除するオートファジー(少なくとも,A群連鎖球菌の排除)において,NOシグナル伝達系,とくに内因性の8-ニトロcGMPが主要な役割をはたすことを示した.
8-ニトロcGMPの特徴のひとつは,タンパク質と直接に反応し翻訳後修飾を行う点である.すなわち,8-ニトロcGMPに存在するニトロ基はタンパク質のシステイン残基と求核置換反応を起こす.この反応はタンパク質S-グアニル化反応とよばれる3).8-ニトロcGMPのもつ生理機能として酸化ストレス条件における細胞保護の効果3) や心筋細胞の老化6) が報告されているが,これらはストレスセンサーであるKeap1 3),および,H-RAS 6) のS-グアニル化修飾を介している.そこで,オートファジーによる細菌の排除においてもS-グアニル化修飾が重要な役割をはたすとの仮説をたてた.細胞に感染したA群連鎖球菌を免疫化学染色により観察したところ,細菌の表面には8-ニトロcGMPによるS-グアニル化修飾が集積していた.ファゴソームから抜け出すことのできないSLO変異株5) ではこのS-グアニル化修飾が有意に抑制されたことから,細菌はファゴソームから細胞質へと移行したのちにS-グアニル化修飾をうけることがわかった.一方,細胞質に存在する細菌と比較して,オートファゴソームに捕捉された細菌は顕著にS-グアニル化修飾されていたことから,S-グアニル化修飾は細菌の捕捉において直接的な役割をはたしていると考えた.
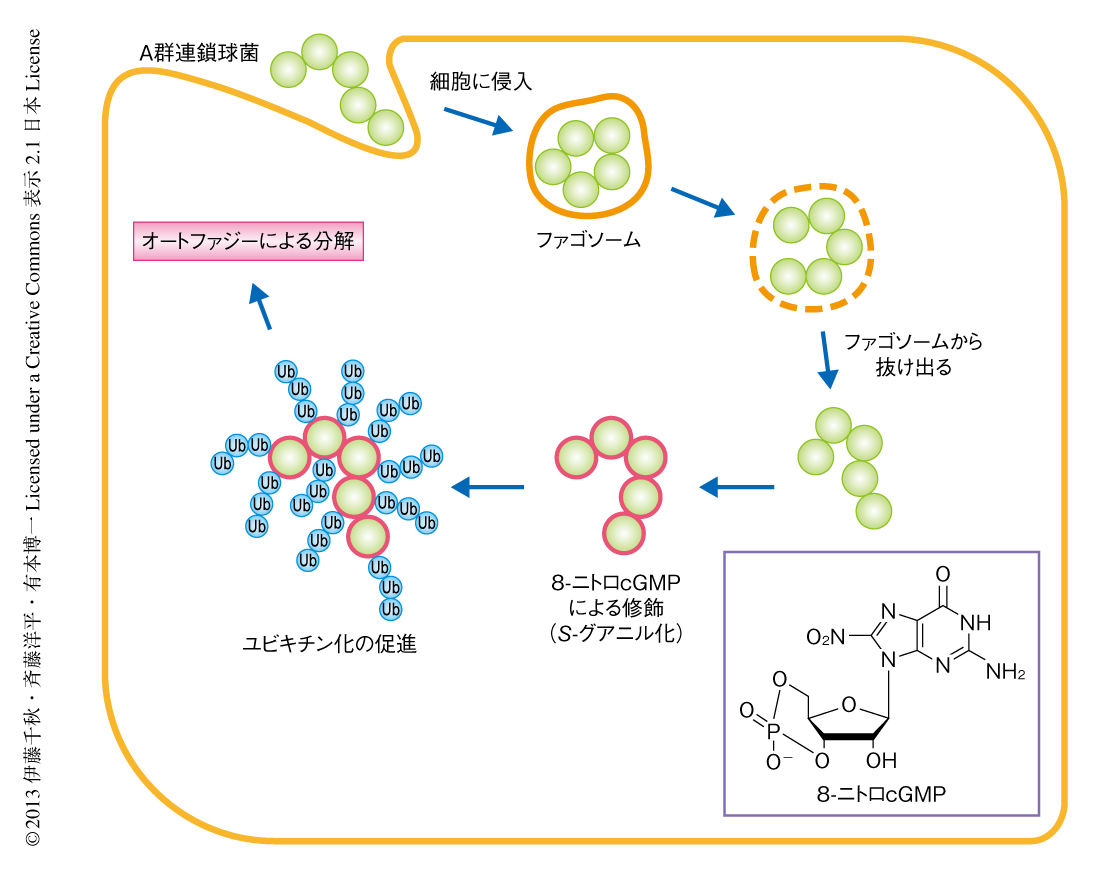
細胞に侵入した細菌はユビキチン化されNDP52やp62などアダプタータンパク質の介在により選択的なオートファジーにより分解されるという報告がある7).このアダプタータンパク質はユビキチン鎖とオートファゴソーム膜に存在するLC3の両方と相互作用することができ,細菌の取り込みを仲介する.よって,細菌のユビキチン化は選択的なオートファジーのタグとして機能しているといえる.そこで,S-グアニル化修飾とユビキチン化とのあいだに相関がみられるかどうか検証した.マクロファージに感染したA群連鎖球菌の表面におけるS-グアニル化修飾およびユビキチン化を,とくにLys63型ポリユビキチン鎖に注目して観察した.その結果,ユビキチン化にさきだち,感染後1時間においておよそ半数の細菌においてS-グアニル化修飾がみられた.阻害剤により8-ニトロcGMPの量を低下させ細菌の表面におけるS-グアニル化修飾を抑制すると,ユビキチン化も抑制された.一方で,ユビキチン活性化酵素の阻害剤を用いてユビキチン化を抑制しても,S-グアニル化修飾は影響をうけなかった.これらの実験の結果は,細菌の表面にS-グアニル化修飾が集積したのち,それを目印としてユビキチン化が起こることを示唆した.すなわち,S-グアニル化修飾はユビキチン化にさきだつ細菌の排除の標識であるといえた.筆者らの提案する8-ニトロcGMPによる細菌の排除のモデルを示す(図1).
細胞の外からの8-ニトロcGMPの投与はオートファジーを誘導した.変異ユビキチンを用いた実験から,8-ニトロcGMPによるオートファジーの誘導はLys63型ポリユビキチン鎖を必要とすることがわかった.また,8-ニトロcGMPの処理によりLys63型ポリユビキチン鎖と共局在するオートファゴソームの数は増加し,この場合も,ユビキチン化された基質は選択的にオートファゴソームへと移行していると推察された.同様の結果はウェスタンブロットによる解析からも得られた.すなわち,Lys63型ポリユビキチン鎖により修飾されたタンパク質について,8-ニトロcGMPの処理によりオートファジーによる分解が促進された.これらの結果は,細菌の排除以外の系においても,基質のS-グアニル化修飾がLys63型ポリユビキチン鎖による修飾を促進しオートファジーを活性化するという機構をもつことを想像させた.
この研究は,8-ニトロcGMPが内因性のオートファジー誘導因子であることを明らかにした.さらに,8-ニトロcGMPは細胞に侵入したA群連鎖球菌のオートファジーによる排除を促進した.活性酸素種とオートファジーとの関係が活発に研究されてきたのに対し,NOとオートファジーの関係について理解は進んでいなかった.リポ多糖の処理により誘導されるオートファジーにおいて活性酸素種とともにNOが深く関与していることが報告されてはいたが1),分子レベルでの理解は十分ではなかった.今回の研究により,リポ多糖の処理により細胞においてNOおよび活性酸素種に由来する8-ニトロcGMPが産生され,オートファジーの誘導に主要な役割をはたしていることが明らかになった.
医薬への展開をめざして,すでに認可されている医薬や化合物ライブラリーからオートファジー誘導剤を探索する試みが行われている8).しかし,内因性かつ低分子のオートファジー誘導因子はほとんど知られていない.今後は,8-ニトロcGMPをもとにした医薬化学的な研究が活発になると予想される.8-ニトロcGMPはmTORに非依存的にオートファジーを誘導することから,mTORを介した従来型の誘導剤とは異なり,各種のシグナル伝達系に対する影響は低減されると考えられる.また,阻害剤など用いて特定の臓器や病変など局所において8-ニトロcGMPの量を制御することにより,オートファジーに関連する疾患である感染症や神経変性疾患の制御が可能になると期待している.
略歴:2011年 東北大学大学院生命科学研究科博士後期課程 在学中.
研究テーマ:内因性のニトロ化ヌクレオチドの生理機能.
斉藤 洋平(Yohei Saito)
科学技術振興機構ERATO袖岡生細胞分子化学プロジェクト 研究員.
有本 博一(Hirokazu Arimoto)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.agri.tohoku.ac.jp/bunseki/index-j.html
© 2013 伊藤千秋・斉藤洋平・有本博一 Licensed under CC 表示 2.1 日本
(東北大学大学院生命科学研究科 分子情報化学分野)
email:有本博一
DOI: 10.7875/first.author.2013.157
Endogenous nitrated nucleotide is a key mediator of autophagy and innate defense against bacteria.
Chiaki Ito, Yohei Saito, Takashi Nozawa, Shigemoto Fujii, Tomohiro Sawa, Hirofumi Inoue, Tetsuro Matsunaga, Shahzada Khan, Soichiro Akashi, Ryota Hashimoto, Chihiro Aikawa, Eriko Takahashi, Hiroshi Sagara, Masaaki Komatsu, Keiji Tanaka, Takaaki Akaike, Ichiro Nakagawa, Hirokazu Arimoto
Molecular Cell, 52, 794-804 (2013)
要 約
オートファジーはプロテアソーム系とならび細胞における主要な分解系である.この論文において,筆者らは,8-ニトロcGMPが内因性のオートファジー誘導因子であることを見い出した.8-ニトロcGMPは細胞に侵入した細菌のオートファジーによる排除を促進することも明らかにされた.細胞に侵入した細菌の排除に機能するオートファジーにおいて,細菌の表面に集積したユビキチン鎖が選択的なオートファジーの標識になると考えられている.今回,細菌の表面において8-ニトロcGMPによる顕著なS-グアニル化修飾が観察された.そして,S-グアニル化修飾に陽性を示す細菌は,そうでない細菌と比べ高い確率でユビキチン化されていた.このことから,細菌の表面にみられるタンパク質のS-グアニル化修飾は選択的なオートファジーにおける初期の標識として機能していると結論した.
はじめに
オートファジーは栄養飢餓との関係が広く知られ,非選択的な分解系というイメージが強い.しかし,最近の研究から,細胞に蓄積したタンパク質凝集体や細胞に侵入した細菌を選択的に捕捉して分解する役割が明らかになり,現在では,生体における恒常性の維持に欠かせない分解系として非常に注目されている.オートファジーは定常状態においてもつねに起こっているが,細菌の感染およびレドックスバランスがくずれるようなストレス条件において活性化される.たとえば,細菌の構成成分などの病原体関連分子パターン(pathogen-associated molecular patterns:PAMP)がToll様受容体に結合すると,そこからのシグナル伝達系が活性化されてオートファジーが誘導される1).一方,活性酸素種とオートファジーとの関係については多くの研究があり,活性酸素種によりオートファジーが制御されることがわかっている2).
筆者らは,NOの下流において機能するメディエーターとして,ニトロ化ヌクレオチドのひとつ8-ニトロcGMPを研究の対象とした3).8-ニトロcGMPのもつニトロ基はNOおよび活性酸素種の両方に直接に由来する.すなわち,細胞がストレスにさらされNOおよび活性酸素種の産生量がともに増加すると,8-ニトロcGMPの産生量も増加する.この研究は,NOシグナル伝達系が下流の分子を介しオートファジーを制御するしくみをはじめて明らかにした.
1.8-ニトロcGMPはオートファジーの誘導能をもつ
細胞の外から投与した8-ニトロcGMPがオートファジーにあたえる影響について評価した.一般に,オートファジーの活性はマーカータンパク質であるLC3により評価することができる4).LC3にはLC3-IとLC3-IIの2つのタイプがあり,細胞質ではLC3-Iとして存在する一方,ホスファチジルエタノールアミンと結合したLC3-IIはオートファゴソーム膜に局在する.8-ニトロcGMPをマクロファージ様のRAW264.7細胞に投与したところ,オートファゴソームの数は増加した.LC3-IIの量の増加はウェスタンブロット法によっても確認された.また,Atg5をノックアウトしたマウス胎仔線維芽細胞を用いた実験により,8-ニトロcGMPにより誘導されたオートファジーはAtg5に依存する古典的な経路によるものであることも明らかになった.
2.リポ多糖の刺激による8-ニトロcGMPの産生とオートファジーの誘導
リポ多糖による刺激は細胞に炎症を起こすとともにオートファジーを誘導する.これまでに,心筋細胞を用いた研究により,この誘導には細胞に存在するNOが必要であることが明らかにされている1).マクロファージにおいて,NO合成酵素の阻害剤であるL-NMMAはリポ多糖の刺激によるオートファジーの誘導を抑制した.一方,リポ多糖による刺激は細胞に存在する8-ニトロcGMPの量を増加させ,L-NMMAはこの8-ニトロcGMPの産生を阻害することが示されている3).これらの結果から,8-ニトロcGMPは内因性のオートファジー誘導因子のひとつであると考えられた.
3.8-ニトロcGMPは細胞に侵入した細菌の排除を促進する
細菌の感染における8-ニトロcGMPの作用を評価した.A群連鎖球菌は細胞に侵入するとファゴソームから細胞質へと脱出するが,最終的にはオートファジーにより排除されることが知られている5).すなわち,二重膜からなるオートファゴソーム様の構造体により捕捉されオートファジーにより分解される5).8-ニトロcGMPを処理したRAW264.7細胞では,このオートファゴソーム様の構造体の形成率が有意に上昇した.また,細胞におけるA群連鎖球菌の生存率も8-ニトロcGMPの処理により低下した.つまり,8-ニトロcGMPはオートファジーを活性化することにより細菌の排除を促進する効果のあることが明らかになった.
A群連鎖球菌に感染した細胞において産生される内因性の8-ニトロcGMPに注目して解析を行った.阻害剤により内因性の8-ニトロcGMPの量を減少させると,A群連鎖球菌の排除にはたらくオートファゴソーム様の構造体の形成率は低下し,A群連鎖球菌の排除は遅延した.さらに,8-ニトロcGMPを消去するNaHSの処理6) により,同様にオートファゴソーム様の構造体の形成率は低下し,A群連鎖球菌の排除も抑制された.これらの結果は,細菌を排除するオートファジー(少なくとも,A群連鎖球菌の排除)において,NOシグナル伝達系,とくに内因性の8-ニトロcGMPが主要な役割をはたすことを示した.
4.8-ニトロcGMPは細菌の表面を修飾しオートファジーの目印となる
8-ニトロcGMPの特徴のひとつは,タンパク質と直接に反応し翻訳後修飾を行う点である.すなわち,8-ニトロcGMPに存在するニトロ基はタンパク質のシステイン残基と求核置換反応を起こす.この反応はタンパク質S-グアニル化反応とよばれる3).8-ニトロcGMPのもつ生理機能として酸化ストレス条件における細胞保護の効果3) や心筋細胞の老化6) が報告されているが,これらはストレスセンサーであるKeap1 3),および,H-RAS 6) のS-グアニル化修飾を介している.そこで,オートファジーによる細菌の排除においてもS-グアニル化修飾が重要な役割をはたすとの仮説をたてた.細胞に感染したA群連鎖球菌を免疫化学染色により観察したところ,細菌の表面には8-ニトロcGMPによるS-グアニル化修飾が集積していた.ファゴソームから抜け出すことのできないSLO変異株5) ではこのS-グアニル化修飾が有意に抑制されたことから,細菌はファゴソームから細胞質へと移行したのちにS-グアニル化修飾をうけることがわかった.一方,細胞質に存在する細菌と比較して,オートファゴソームに捕捉された細菌は顕著にS-グアニル化修飾されていたことから,S-グアニル化修飾は細菌の捕捉において直接的な役割をはたしていると考えた.
細胞に侵入した細菌はユビキチン化されNDP52やp62などアダプタータンパク質の介在により選択的なオートファジーにより分解されるという報告がある7).このアダプタータンパク質はユビキチン鎖とオートファゴソーム膜に存在するLC3の両方と相互作用することができ,細菌の取り込みを仲介する.よって,細菌のユビキチン化は選択的なオートファジーのタグとして機能しているといえる.そこで,S-グアニル化修飾とユビキチン化とのあいだに相関がみられるかどうか検証した.マクロファージに感染したA群連鎖球菌の表面におけるS-グアニル化修飾およびユビキチン化を,とくにLys63型ポリユビキチン鎖に注目して観察した.その結果,ユビキチン化にさきだち,感染後1時間においておよそ半数の細菌においてS-グアニル化修飾がみられた.阻害剤により8-ニトロcGMPの量を低下させ細菌の表面におけるS-グアニル化修飾を抑制すると,ユビキチン化も抑制された.一方で,ユビキチン活性化酵素の阻害剤を用いてユビキチン化を抑制しても,S-グアニル化修飾は影響をうけなかった.これらの実験の結果は,細菌の表面にS-グアニル化修飾が集積したのち,それを目印としてユビキチン化が起こることを示唆した.すなわち,S-グアニル化修飾はユビキチン化にさきだつ細菌の排除の標識であるといえた.筆者らの提案する8-ニトロcGMPによる細菌の排除のモデルを示す(図1).
5.8-ニトロcGMPにより誘導されるオートファジーとユビキチンとの関係
細胞の外からの8-ニトロcGMPの投与はオートファジーを誘導した.変異ユビキチンを用いた実験から,8-ニトロcGMPによるオートファジーの誘導はLys63型ポリユビキチン鎖を必要とすることがわかった.また,8-ニトロcGMPの処理によりLys63型ポリユビキチン鎖と共局在するオートファゴソームの数は増加し,この場合も,ユビキチン化された基質は選択的にオートファゴソームへと移行していると推察された.同様の結果はウェスタンブロットによる解析からも得られた.すなわち,Lys63型ポリユビキチン鎖により修飾されたタンパク質について,8-ニトロcGMPの処理によりオートファジーによる分解が促進された.これらの結果は,細菌の排除以外の系においても,基質のS-グアニル化修飾がLys63型ポリユビキチン鎖による修飾を促進しオートファジーを活性化するという機構をもつことを想像させた.
おわりに
この研究は,8-ニトロcGMPが内因性のオートファジー誘導因子であることを明らかにした.さらに,8-ニトロcGMPは細胞に侵入したA群連鎖球菌のオートファジーによる排除を促進した.活性酸素種とオートファジーとの関係が活発に研究されてきたのに対し,NOとオートファジーの関係について理解は進んでいなかった.リポ多糖の処理により誘導されるオートファジーにおいて活性酸素種とともにNOが深く関与していることが報告されてはいたが1),分子レベルでの理解は十分ではなかった.今回の研究により,リポ多糖の処理により細胞においてNOおよび活性酸素種に由来する8-ニトロcGMPが産生され,オートファジーの誘導に主要な役割をはたしていることが明らかになった.
医薬への展開をめざして,すでに認可されている医薬や化合物ライブラリーからオートファジー誘導剤を探索する試みが行われている8).しかし,内因性かつ低分子のオートファジー誘導因子はほとんど知られていない.今後は,8-ニトロcGMPをもとにした医薬化学的な研究が活発になると予想される.8-ニトロcGMPはmTORに非依存的にオートファジーを誘導することから,mTORを介した従来型の誘導剤とは異なり,各種のシグナル伝達系に対する影響は低減されると考えられる.また,阻害剤など用いて特定の臓器や病変など局所において8-ニトロcGMPの量を制御することにより,オートファジーに関連する疾患である感染症や神経変性疾患の制御が可能になると期待している.
文 献
- Yuan, H., Perry, C. N., Huang, C. et al.: LPS-induced autophagy is mediated by oxidative signaling in cardiomyocytes and is associated with cytoprotection. Am. J. Physiol. Heart Circ. Physiol., 296, H470-H479 (2009)[PubMed]
- Scherz-Shouval, R. & Elazar, Z.: Regulation of autophagy by ROS: physiology and pathology. Trends Biochem. Sci., 36, 30-38 (2011)[PubMed]
- Sawa, T., Zaki, M. H., Okamoto, T. et al.: Protein S-guanylation by the biological signal 8-nitroguanosine 3',5'-cyclic monophosphate. Nat. Chem. Biol., 3, 727-735 (2007)[PubMed]
- Mizushima, N., Yoshimori, T. & Levine, B.: Methods in mammalian autophagy reaserch. Cell, 140, 313-326 (2010)[PubMed]
- Nakagawa, I., Amano, A., Mizushima, N. et al.: Autophagy defends cells against invading group A Streptococcus. Science, 306, 1037-1040 (2004)[PubMed]
- Nishida, M., Sawa, T., Kitajima, N. et al.: Hydrogen sulfide anion regulates redox signaling via electrophile sulfhydration. Nat. Chem. Biol., 8, 714-724 (2012)[PubMed] [新着論文レビュー]
- Shaid, S., Brandts, C. H., Serve, H. et al.: Ubiquitination and selective autophagy. Cell Death Differ., 20, 21-30 (2013)[PubMed]
- Williams, A., Sarker, S., Cuddon, P. et al.: Novel targets for Huntington's disease in an mTOR-independent autophagy pathway. Nat. Chem. Biol., 4, 295-305 (2008)[PubMed]
著者プロフィール
略歴:2011年 東北大学大学院生命科学研究科博士後期課程 在学中.
研究テーマ:内因性のニトロ化ヌクレオチドの生理機能.
斉藤 洋平(Yohei Saito)
科学技術振興機構ERATO袖岡生細胞分子化学プロジェクト 研究員.
有本 博一(Hirokazu Arimoto)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.agri.tohoku.ac.jp/bunseki/index-j.html
© 2013 伊藤千秋・斉藤洋平・有本博一 Licensed under CC 表示 2.1 日本