硫化水素イオンは親電子物質のスルフヒドリル化を介しレドックスシグナル伝達系を制御する
澤 智裕1・西田基宏2・赤池孝章1
(1熊本大学大学院生命科学研究部 微生物学分野,2九州大学大学院薬学研究院 創薬育薬産学官連携分野)
email:赤池孝章
DOI: 10.7875/first.author.2012.095
Hydrogen sulfide anion regulates redox signaling via electrophile sulfhydration.
Motohiro Nishida, Tomohiro Sawa, Naoyuki Kitajima, Katsuhiko Ono, Hirofumi Inoue, Hideshi Ihara, Hozumi Motohashi, Masayuki Yamamoto, Makoto Suematsu, Hitoshi Kurose, Albert van der Vliet, Bruce A. Freeman, Takahiro Shibata, Koji Uchida, Yoshito Kumagai, Takaaki Akaike
Nature Chemical Biology, 8, 714-724 (2012)
活性酸素や一酸化窒素あるいは炎症関連酵素との反応から二次的に生成される親電子性の物質,たとえば,ニトロ化環状ヌクレオチドである8-ニトロ-cGMPやニトロ化あるいはケト化された不飽和脂肪酸が細胞のシグナル伝達系の制御にかかわっていることが明らかになり,その分子機構の解明が注目されている.今回,筆者らは,酵素により内因性に産生される硫化水素イオンがさまざまな親電子物質の代謝を制御し,その結果,それら親電子物質によるシグナル伝達系の活性を制御していることを明らかにした.また,硫化水素イオンによる親電子物質の代謝制御にはSH基の付加反応であるスルヒドリル化というきわめてユニークな反応が寄与していることを,代表的な親電子物質である8-ニトロ-cGMPを用いた解析から明らかにした.そして,心筋梗塞ののち心臓組織には8-ニトロ-cGMPが過剰に蓄積しており,それが低分子量Gタンパク質であるH-Rasの活性化を介して心筋細胞の早期の老化を誘導し心不全の発症にかかわることを見い出した.このような親電子物質による心不全の発症に対し硫化水素イオンは保護的にはたらくことが明らかになったが,これには8-ニトロ-cGMPをはじめとする親電子物質に対するスルヒドリル化が重要な分子機構であることを明らかにした.
近年,活性酸素種が細胞においてシグナル伝達分子として機能し,細胞の分化,増殖,代謝機能など多彩な生命機能の制御にかかわっていることが明らかになり,その生理機能や疾患との関連が注目されている1,2).親電子物質は活性酸素種と生体分子との反応から生成する二次代謝産物であり,活性酸素種シグナル伝達系の特異的な発現において重要な役割をはたしている.すなわち,レドックスセンサータンパク質あるいはレドックスエフェクタータンパク質とよばれる,分子内に活性酸素種あるいは親電子物質と反応しやすい(レドックス感受性の高い)システイン残基をもつタンパク質に対し,親電子物質が求核置換あるいはMichael付加により反応しS-アルキル化あるいはS-アリル化することでそれらタンパク質の構造や機能(たとえば,酵素活性など)を変化させて,それがシグナルとなり伝達されることが明らかになってきた3).このような活性酸素種シグナル伝達系にかかわる内因性の親電子物質として,ニトロ化環状ヌクレオチドである8-ニトロ-cGMP,ニトロ化脂肪酸,プロスタグランジンJ2,ヒドロキシノネナールなどがある1,3).好気性生物は活性酸素種による酸化ストレスから身を守るため,活性酸素種を消去するさまざまな酵素系や低分子性の抗酸化物質をもつ.一方,活性酸素種から生成する親電子物質によるシグナル伝達系の活性や毒性の制御に関しては,システイン含有ペプチドであるグルタチオンを除き,これまで明らかにされていない.
硫化水素(H2S)は腐った卵の匂いのするガス状の分子であるが,最近,哺乳動物の細胞からも産生されることが明らかになりその生理機能が注目されている4).しかしながら,生体におけるその化学的な特性や生理機能の制御機構については不明な点が多い.今回の研究において,筆者らは,H2Sから派生する硫化水素イオン(HS-)が,内因性の親電子物質のスルヒドリル化(SH基の付加)というユニークな分子機構により,その代謝とシグナル伝達系の活性を制御することを明らかにした.今回の結果は,いまだ不明な点の多いH2Sの生理機能を明らかにしたとともに,レドックスシグナル伝達系の新しい制御機構を示したものとして画期的な成果と考えられる.
親電子物質が細胞においてどのように代謝され,また,そのシグナル伝達系の活性がどのように制御されているのかを明らかにするため,RNAiを用いたスクリーニングアッセイを行った.このアッセイでは,システインの代謝とレドックス制御に関連する代謝経路に焦点をあてたRNAiライブラリーを用い,親電子物質として8-ニトロ-cGMPの代謝を解析した.8-ニトロ-cGMPはタンパク質のもつシステイン残基に対し求核置換反応し,cGMP構造を付加する,いわゆるタンパク質S-グアニル化をもたらす.この反応の際,ニトロ基は脱離してNO2-として放出される.システイン代謝酵素であるシスタチオニンβ-シンターゼおよびシスタチオニンγ-リアーゼはともにH2S産生酵素であるが,これらの酵素をノックダウンするとA549細胞,HepG2細胞,C6細胞などの培養細胞において8-ニトロ-cGMPによるタンパク質S-グアニル化は著しく増強した.このとき,培養上清のNO2-はシスタチオニンβ-シンターゼあるいはシスタチオニンγ-リアーゼのノックダウンにより減少した.このことから,シスタチオニンβ-シンターゼやシスタチオニンγ-リアーゼにより産生されたH2Sが,8-ニトロ-cGMPを分解し代謝していることが示唆された.H2Sと8-ニトロ-cGMPとの反応を試験管内においてより直接的に検討したところ,H2Sそのものではなく,H2Sから派生したHS-が8-ニトロ-cGMPに求核的に反応しまったく新規な化合物である8-SH-cGMPを生成していることがわかった.実際,H2Sの酸解離定数(pKa)は6.76であり,pH 7.4の水溶液では80%近くがHS-として存在している5).さらに興味深いことに,8-SH-cGMPは過酸化水素などの活性酸素種と反応し,SH基がはずれcGMPへと変換していることがわかった.したがって,8-ニトロ-cGMPは細胞においてH2Sが産生されるとHS-の作用によりスルヒドリル化されて8-SH-cGMPとなり,さらに活性酸素種の作用によりcGMPへと代謝されることが示唆された.
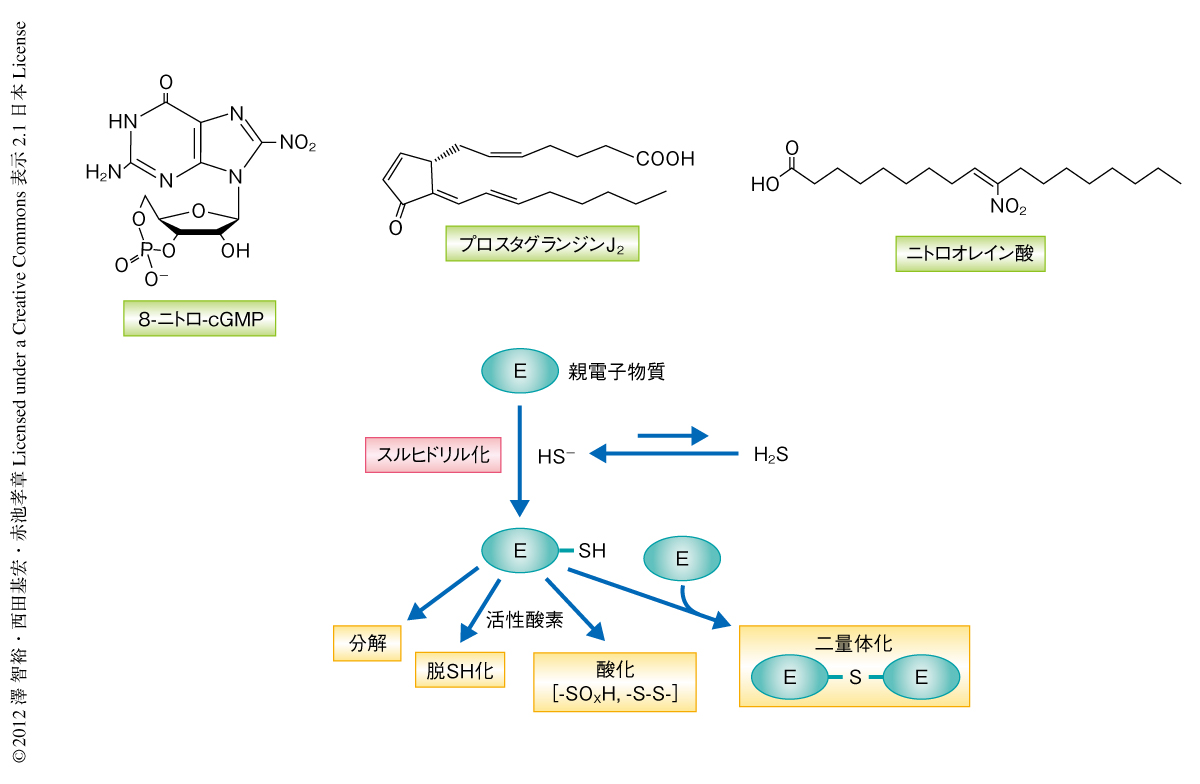
HS-によるスルヒドリル化はさまざまな親電子物質に対し起こることがわかった(図1).すなわち,内因性の親電子物質であるプロスタグランジンJ2やヒドロキシノネナール,ニトロ脂肪酸,さらには,環境性あるいは外因性の親電子物質であるアクロレインやナフトキノンなどがHS-と反応した.スルヒドリル化された親電子物質にはさらに分解し代謝されるものがあったが,それには親電子物質そのものの特性が大きくかかわっていた.さきに述べたように,8-ニトロ-cGMPからは比較的安定なSH付加体である8-SH-cGMPが生成したが,さらに活性酸素種があると脱SH基反応というユニークな反応によりcGMPへと変換された.プロスタグランジンJ2からはまずSH化プロスタグランジンが生成したが,さらに共存する酸素によりSH基が酸化され硫酸化(-SO3H)プロスタグランジンJ2が生成した.ニトロ脂肪酸やナフトキノンはSH化されたのち,そのSH付加体に対しもう1分子の親電子が反応して硫黄原子により架橋することで二量体が形成された.また,実際に培養細胞を用いた解析において,シスタチオニンβ-シンターゼのノックダウンによりナフトキノンやアクロレインによるタンパク質付加体の形成が顕著に増強された.これらのことから,内因性のHS-は親電子物質によるタンパク質のシステイン残基の修飾を親電子物質のスルヒドリル化により制御していることが明らかになった.
実際に,細胞からはどの程度のHS-が産生されているのか,また,それらの産生はシスタチオニンβ-シンターゼやシスタチオニンγ-リアーゼにどのくらい依存しているのかを解析するため,HS-の高感度かつ特異的な測定法を開発した.具体的には,親電子性の蛍光試薬であるモノブロモビマンを用い,これとHS-との反応産物であるS-ビマン二量体を液体クロマトグラフィー-タンデム質量分析法により検出する新しい分析系を構築した.この方法により種々の培養細胞において産生されるHS-を定量したところ,A549細胞,HepG2細胞,C6細胞などのがん細胞は内因性のHS-を活発に産生しており,シスタチオニンβ-シンターゼあるいはシスタチオニンγ-リアーゼをノックダウンするとその発現量の変化ときわめてよい相関をもってHS-の産生量は抑制された.また,この定量法のメリットは,グルタチオン,システイン,ホモシステインなど,ほかの低分子チオール化合物の定量も同時に行えることである.たとえば,シスタチオニンβ-シンターゼをノックダウンするとHS-の量は著しく減少したが,グルタチオンやシステインの量はその影響をうけなかった.また,シスタチオニンβ-シンターゼの基質であるホモシステインの量はシスタチオニンβ-シンターゼのノックダウンによりわずかに増加した.これらのことから,シスタチオニンβ-シンターゼのノックダウンによる8-ニトロ-cGMPをはじめとする親電子物質の代謝への影響は,グルタチオンやシステインなどのチオール化合物ではなく,HS-によることが強く示唆された.一方,心筋細胞や心線維芽細胞の初代培養細胞は,がん細胞に比べきわめて少ない量のHS-を産生していた.このことは,シスタチオニンβ-シンターゼおよびシスタチオニンγ-リアーゼの発現量ともよく一致していた.すなわち,心臓組織では内因性に産生されるHS-はかぎられており,親電子物質に対する応答性の高い臓器であるといえた.そこで,炎症性の心疾患モデルを用いて,病態発現における親電子物質のシグナル伝達系とそのHS-による制御機構を解析した.
心筋梗塞ののちの慢性心不全は世界的にも主要な死因であり,その病態機構の理解と治療の開発は重要な課題である6).これまでに,心不全の進展において炎症反応にもとづく酸化ストレスの関与が示唆されている.実際に,心筋梗塞および圧負荷による心不全のモデルマウスを作製しその心臓組織を調べると,誘導型NO合成酵素の発現が高まっているとともに,8-ニトロ-cGMPの著しい蓄積がみられた.
これまで,酸化ストレスと心不全の発症において低分子量Gタンパク質であるH-Rasの活性化を介した心筋細胞の早期の老化が密接にかかわっていることが示唆されていた.さらに興味深いことに,H-Rasのもつシステイン残基の酸化還元の状態がH-Rasの活性制御にかかわっていることが示唆されていた7).そこで,8-ニトロ-cGMPがH-Rasを活性化するかどうかを解析した.その結果,心筋梗塞モデルマウスの心臓組織においてH-Rasは顕著に活性化されており,さらに,H-Rasは8-ニトロ-cGMPによりS-グアニル化修飾されていた.組換えタンパク質ならびに質量分析による解析の結果,H-Rasの184番目のシステイン残基が特異的にS-グアニル化されていることが明らかになった.また,もっとも重要なことに,心筋梗塞モデルマウスに対しHS-の供与体である硫化水素ナトリウム(NaHS)を持続的に投与すると,心臓組織における8-ニトロ-cGMPの蓄積,H-Rasの活性化,S-グアニル化H-Rasのいずれもが著明に減少することにくわえ,心機能の有意な改善効果が認められた.すなわち,心筋梗塞ののちの心臓組織において過剰に生成した活性酸素種は,8-ニトロ-cGMPの産生を介してH-Rasを活性化し,それが心筋細胞の老化を促進していること,さらに,HS-はこのような心筋細胞の老化を親電子物質のスルヒドリル化によりきわめて効果的に抑制していることが示唆された.
8-ニトロ-cGMPによるH-RasのS-グアニル化は,その下流のリン酸化シグナル伝達系の活性化と非常によい相関を示していた.すなわち,心筋細胞や培養がん細胞を8-ニトロ-cGMPにより処理すると,H-Rasの活性化とともに,ERK,p38 MAPキナーゼ,p53,Rbの活性化がみられた.このとき,細胞をNaHSで同時に処理するとH-RasのS-グアニル化と活性化が抑制されるとともに,ERK,p38 MAPキナーゼ,p53,Rbの活性化も抑制された.これらの細胞は8-ニトロ-cGMPによる処理により老化が促進されたが,NaHSによる処理によりそれが抑制されるとともに,ERKの阻害剤およびp38 MAPキナーゼの阻害剤によっても老化は阻害された.
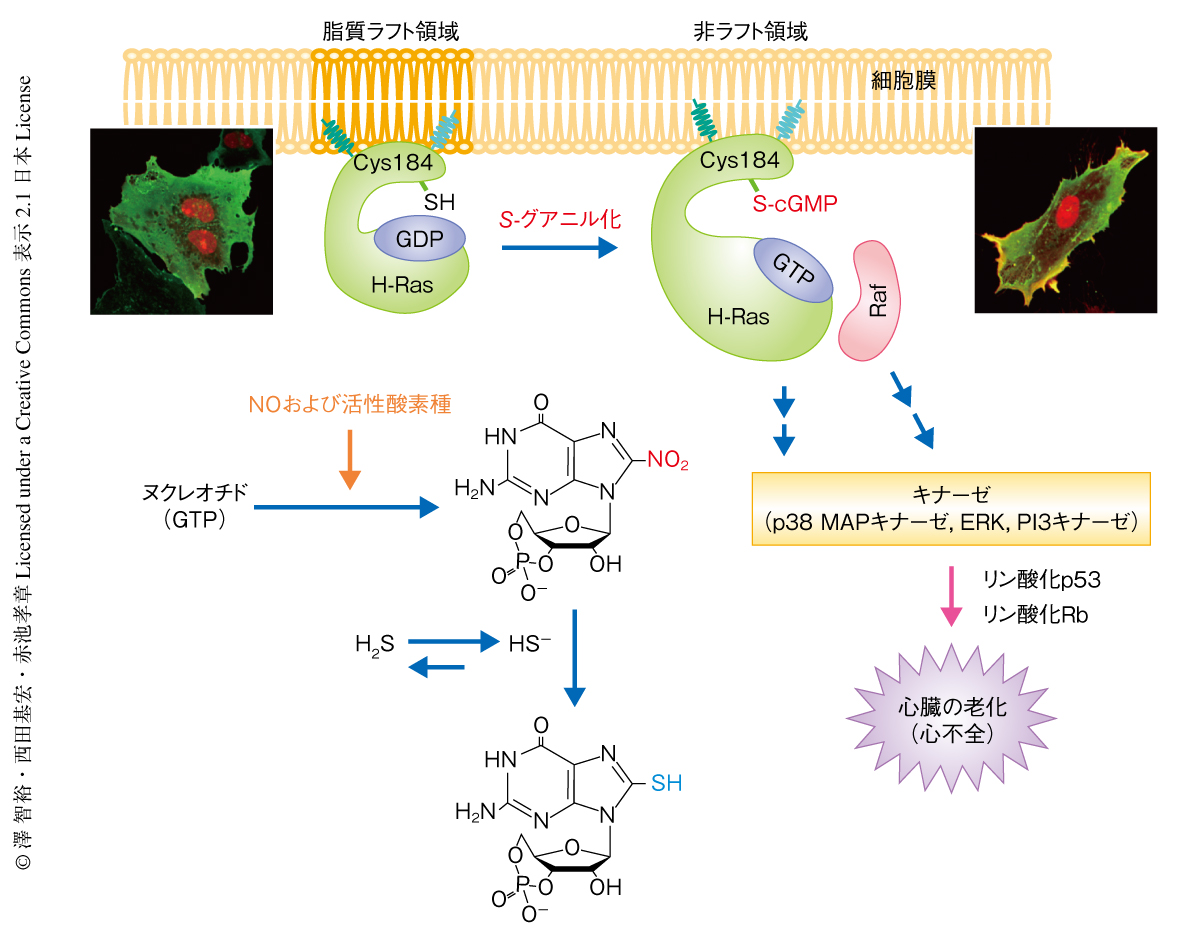
H-RasのC末端側には,181番目,184番目,186番目に3つのシステイン残基があり,それらは脂質修飾により細胞膜への局在が制御されている8).今回,同定した184番目のシステイン残基のS-グアニル化がH-Rasの局在にどのように影響するのかについて,細胞膜の成分を密度勾配によりラフト画分と非ラフト画分とに分画することで解析した結果,細胞を8-ニトロ-cGMPにより処理することでH-Rasは非ラフト画分へと移行することがわかった.さらに,このH-Rasの非ラフト画分への移行はNaHSによる処理によりほぼ完全に抑制された.H-Rasは非ラフト領域へと移行したのち,そのエフェクタータンパク質であるRafと結合することが知られている.そこで,GFP融合H-RasとDsRed融合c-Rafを共発現させた細胞を8-ニトロ-cGMPにより処理すると,細胞膜においてH-RasとRafとが共局在することが明らかになった.さらに,184番目のシステイン残基をセリン残基に置換したH-Ras変異体を用いると,8-ニトロ-cGMPによるこのような非ラフト画分への移行とRafとの共局在はまったくみられなくなった.以上の結果から,H-Rasの184番目のシステイン残基が内因性の親電子物質の機能的なセンサーとしてはたらき,そのS-グアニル化修飾がH-Rasの非ラフト領域への移行を促進して下流のリン酸化シグナル伝達系を活性化していることが明らかになった(図2).
H2Sには抗炎症作用や抗酸化作用が報告されていたが,それら作用の分子機構についてはほとんどわかっていない.今回,筆者らは,HS-には,活性酸素種シグナル伝達系の重要なメディエーターである親電子物質をスルヒドリル化することによりその活性を負に制御するというまったく新しい作用のあることを見い出した.今後,親電子物質に対するスルヒドリル化を分子基盤とした活性酸素種シグナル伝達系およびレドックスシグナル伝達系の統合的な理解がよりいっそう進展することが期待される.一方,活性酸素種シグナル伝達系の異常による酸化ストレス病態の予防および治療という観点からも,親電子物質のスルヒドリル化は興味深い.H2Sそのものは高濃度では毒性のあることや不安定で取り扱いにくいことなどから,ヒトへの治療へ応用するには,今後,H2Sと同様のはたらきのある安全で取り扱いの容易な治療剤の開発が期待される.
略歴:1996年 京都大学大学院工学研究科博士課程 単位取得退学,博士(工学),同年 熊本大学医学部 助手,2000年 米国National Cancer Institute在外研究員,2002年 世界保健機関International Agency for Research on Cancer科学官を経て,2007年より熊本大学大学院医学薬学研究部 准教授(現 熊本大学大学院生命科学研究部).2011年より科学技術振興機構さきがけ研究者 兼任.
研究テーマ:活性酸素および親電子物質によるシグナル伝達系の機構.
西田 基宏(Motohiro Nishida)
九州大学大学院薬学研究院 准教授.
赤池 孝章(Takaaki Akaike)
熊本大学大学院生命科学研究部 教授.
研究室URL:http://kumadai-bisei.com/
© 2012 澤 智裕・西田基宏・赤池孝章 Licensed under CC 表示 2.1 日本
(1熊本大学大学院生命科学研究部 微生物学分野,2九州大学大学院薬学研究院 創薬育薬産学官連携分野)
email:赤池孝章
DOI: 10.7875/first.author.2012.095
Hydrogen sulfide anion regulates redox signaling via electrophile sulfhydration.
Motohiro Nishida, Tomohiro Sawa, Naoyuki Kitajima, Katsuhiko Ono, Hirofumi Inoue, Hideshi Ihara, Hozumi Motohashi, Masayuki Yamamoto, Makoto Suematsu, Hitoshi Kurose, Albert van der Vliet, Bruce A. Freeman, Takahiro Shibata, Koji Uchida, Yoshito Kumagai, Takaaki Akaike
Nature Chemical Biology, 8, 714-724 (2012)
要 約
活性酸素や一酸化窒素あるいは炎症関連酵素との反応から二次的に生成される親電子性の物質,たとえば,ニトロ化環状ヌクレオチドである8-ニトロ-cGMPやニトロ化あるいはケト化された不飽和脂肪酸が細胞のシグナル伝達系の制御にかかわっていることが明らかになり,その分子機構の解明が注目されている.今回,筆者らは,酵素により内因性に産生される硫化水素イオンがさまざまな親電子物質の代謝を制御し,その結果,それら親電子物質によるシグナル伝達系の活性を制御していることを明らかにした.また,硫化水素イオンによる親電子物質の代謝制御にはSH基の付加反応であるスルヒドリル化というきわめてユニークな反応が寄与していることを,代表的な親電子物質である8-ニトロ-cGMPを用いた解析から明らかにした.そして,心筋梗塞ののち心臓組織には8-ニトロ-cGMPが過剰に蓄積しており,それが低分子量Gタンパク質であるH-Rasの活性化を介して心筋細胞の早期の老化を誘導し心不全の発症にかかわることを見い出した.このような親電子物質による心不全の発症に対し硫化水素イオンは保護的にはたらくことが明らかになったが,これには8-ニトロ-cGMPをはじめとする親電子物質に対するスルヒドリル化が重要な分子機構であることを明らかにした.
はじめに
近年,活性酸素種が細胞においてシグナル伝達分子として機能し,細胞の分化,増殖,代謝機能など多彩な生命機能の制御にかかわっていることが明らかになり,その生理機能や疾患との関連が注目されている1,2).親電子物質は活性酸素種と生体分子との反応から生成する二次代謝産物であり,活性酸素種シグナル伝達系の特異的な発現において重要な役割をはたしている.すなわち,レドックスセンサータンパク質あるいはレドックスエフェクタータンパク質とよばれる,分子内に活性酸素種あるいは親電子物質と反応しやすい(レドックス感受性の高い)システイン残基をもつタンパク質に対し,親電子物質が求核置換あるいはMichael付加により反応しS-アルキル化あるいはS-アリル化することでそれらタンパク質の構造や機能(たとえば,酵素活性など)を変化させて,それがシグナルとなり伝達されることが明らかになってきた3).このような活性酸素種シグナル伝達系にかかわる内因性の親電子物質として,ニトロ化環状ヌクレオチドである8-ニトロ-cGMP,ニトロ化脂肪酸,プロスタグランジンJ2,ヒドロキシノネナールなどがある1,3).好気性生物は活性酸素種による酸化ストレスから身を守るため,活性酸素種を消去するさまざまな酵素系や低分子性の抗酸化物質をもつ.一方,活性酸素種から生成する親電子物質によるシグナル伝達系の活性や毒性の制御に関しては,システイン含有ペプチドであるグルタチオンを除き,これまで明らかにされていない.
硫化水素(H2S)は腐った卵の匂いのするガス状の分子であるが,最近,哺乳動物の細胞からも産生されることが明らかになりその生理機能が注目されている4).しかしながら,生体におけるその化学的な特性や生理機能の制御機構については不明な点が多い.今回の研究において,筆者らは,H2Sから派生する硫化水素イオン(HS-)が,内因性の親電子物質のスルヒドリル化(SH基の付加)というユニークな分子機構により,その代謝とシグナル伝達系の活性を制御することを明らかにした.今回の結果は,いまだ不明な点の多いH2Sの生理機能を明らかにしたとともに,レドックスシグナル伝達系の新しい制御機構を示したものとして画期的な成果と考えられる.
1.HS-産生酵素は親電子物質の代謝に関与する
親電子物質が細胞においてどのように代謝され,また,そのシグナル伝達系の活性がどのように制御されているのかを明らかにするため,RNAiを用いたスクリーニングアッセイを行った.このアッセイでは,システインの代謝とレドックス制御に関連する代謝経路に焦点をあてたRNAiライブラリーを用い,親電子物質として8-ニトロ-cGMPの代謝を解析した.8-ニトロ-cGMPはタンパク質のもつシステイン残基に対し求核置換反応し,cGMP構造を付加する,いわゆるタンパク質S-グアニル化をもたらす.この反応の際,ニトロ基は脱離してNO2-として放出される.システイン代謝酵素であるシスタチオニンβ-シンターゼおよびシスタチオニンγ-リアーゼはともにH2S産生酵素であるが,これらの酵素をノックダウンするとA549細胞,HepG2細胞,C6細胞などの培養細胞において8-ニトロ-cGMPによるタンパク質S-グアニル化は著しく増強した.このとき,培養上清のNO2-はシスタチオニンβ-シンターゼあるいはシスタチオニンγ-リアーゼのノックダウンにより減少した.このことから,シスタチオニンβ-シンターゼやシスタチオニンγ-リアーゼにより産生されたH2Sが,8-ニトロ-cGMPを分解し代謝していることが示唆された.H2Sと8-ニトロ-cGMPとの反応を試験管内においてより直接的に検討したところ,H2Sそのものではなく,H2Sから派生したHS-が8-ニトロ-cGMPに求核的に反応しまったく新規な化合物である8-SH-cGMPを生成していることがわかった.実際,H2Sの酸解離定数(pKa)は6.76であり,pH 7.4の水溶液では80%近くがHS-として存在している5).さらに興味深いことに,8-SH-cGMPは過酸化水素などの活性酸素種と反応し,SH基がはずれcGMPへと変換していることがわかった.したがって,8-ニトロ-cGMPは細胞においてH2Sが産生されるとHS-の作用によりスルヒドリル化されて8-SH-cGMPとなり,さらに活性酸素種の作用によりcGMPへと代謝されることが示唆された.
2.HS-はさまざまな親電子物質をスルフヒドリル化する
HS-によるスルヒドリル化はさまざまな親電子物質に対し起こることがわかった(図1).すなわち,内因性の親電子物質であるプロスタグランジンJ2やヒドロキシノネナール,ニトロ脂肪酸,さらには,環境性あるいは外因性の親電子物質であるアクロレインやナフトキノンなどがHS-と反応した.スルヒドリル化された親電子物質にはさらに分解し代謝されるものがあったが,それには親電子物質そのものの特性が大きくかかわっていた.さきに述べたように,8-ニトロ-cGMPからは比較的安定なSH付加体である8-SH-cGMPが生成したが,さらに活性酸素種があると脱SH基反応というユニークな反応によりcGMPへと変換された.プロスタグランジンJ2からはまずSH化プロスタグランジンが生成したが,さらに共存する酸素によりSH基が酸化され硫酸化(-SO3H)プロスタグランジンJ2が生成した.ニトロ脂肪酸やナフトキノンはSH化されたのち,そのSH付加体に対しもう1分子の親電子が反応して硫黄原子により架橋することで二量体が形成された.また,実際に培養細胞を用いた解析において,シスタチオニンβ-シンターゼのノックダウンによりナフトキノンやアクロレインによるタンパク質付加体の形成が顕著に増強された.これらのことから,内因性のHS-は親電子物質によるタンパク質のシステイン残基の修飾を親電子物質のスルヒドリル化により制御していることが明らかになった.
3.培養細胞および心臓組織におけるHS-の産生
実際に,細胞からはどの程度のHS-が産生されているのか,また,それらの産生はシスタチオニンβ-シンターゼやシスタチオニンγ-リアーゼにどのくらい依存しているのかを解析するため,HS-の高感度かつ特異的な測定法を開発した.具体的には,親電子性の蛍光試薬であるモノブロモビマンを用い,これとHS-との反応産物であるS-ビマン二量体を液体クロマトグラフィー-タンデム質量分析法により検出する新しい分析系を構築した.この方法により種々の培養細胞において産生されるHS-を定量したところ,A549細胞,HepG2細胞,C6細胞などのがん細胞は内因性のHS-を活発に産生しており,シスタチオニンβ-シンターゼあるいはシスタチオニンγ-リアーゼをノックダウンするとその発現量の変化ときわめてよい相関をもってHS-の産生量は抑制された.また,この定量法のメリットは,グルタチオン,システイン,ホモシステインなど,ほかの低分子チオール化合物の定量も同時に行えることである.たとえば,シスタチオニンβ-シンターゼをノックダウンするとHS-の量は著しく減少したが,グルタチオンやシステインの量はその影響をうけなかった.また,シスタチオニンβ-シンターゼの基質であるホモシステインの量はシスタチオニンβ-シンターゼのノックダウンによりわずかに増加した.これらのことから,シスタチオニンβ-シンターゼのノックダウンによる8-ニトロ-cGMPをはじめとする親電子物質の代謝への影響は,グルタチオンやシステインなどのチオール化合物ではなく,HS-によることが強く示唆された.一方,心筋細胞や心線維芽細胞の初代培養細胞は,がん細胞に比べきわめて少ない量のHS-を産生していた.このことは,シスタチオニンβ-シンターゼおよびシスタチオニンγ-リアーゼの発現量ともよく一致していた.すなわち,心臓組織では内因性に産生されるHS-はかぎられており,親電子物質に対する応答性の高い臓器であるといえた.そこで,炎症性の心疾患モデルを用いて,病態発現における親電子物質のシグナル伝達系とそのHS-による制御機構を解析した.
4.HS-による心筋の保護作用の分子機構
心筋梗塞ののちの慢性心不全は世界的にも主要な死因であり,その病態機構の理解と治療の開発は重要な課題である6).これまでに,心不全の進展において炎症反応にもとづく酸化ストレスの関与が示唆されている.実際に,心筋梗塞および圧負荷による心不全のモデルマウスを作製しその心臓組織を調べると,誘導型NO合成酵素の発現が高まっているとともに,8-ニトロ-cGMPの著しい蓄積がみられた.
これまで,酸化ストレスと心不全の発症において低分子量Gタンパク質であるH-Rasの活性化を介した心筋細胞の早期の老化が密接にかかわっていることが示唆されていた.さらに興味深いことに,H-Rasのもつシステイン残基の酸化還元の状態がH-Rasの活性制御にかかわっていることが示唆されていた7).そこで,8-ニトロ-cGMPがH-Rasを活性化するかどうかを解析した.その結果,心筋梗塞モデルマウスの心臓組織においてH-Rasは顕著に活性化されており,さらに,H-Rasは8-ニトロ-cGMPによりS-グアニル化修飾されていた.組換えタンパク質ならびに質量分析による解析の結果,H-Rasの184番目のシステイン残基が特異的にS-グアニル化されていることが明らかになった.また,もっとも重要なことに,心筋梗塞モデルマウスに対しHS-の供与体である硫化水素ナトリウム(NaHS)を持続的に投与すると,心臓組織における8-ニトロ-cGMPの蓄積,H-Rasの活性化,S-グアニル化H-Rasのいずれもが著明に減少することにくわえ,心機能の有意な改善効果が認められた.すなわち,心筋梗塞ののちの心臓組織において過剰に生成した活性酸素種は,8-ニトロ-cGMPの産生を介してH-Rasを活性化し,それが心筋細胞の老化を促進していること,さらに,HS-はこのような心筋細胞の老化を親電子物質のスルヒドリル化によりきわめて効果的に抑制していることが示唆された.
8-ニトロ-cGMPによるH-RasのS-グアニル化は,その下流のリン酸化シグナル伝達系の活性化と非常によい相関を示していた.すなわち,心筋細胞や培養がん細胞を8-ニトロ-cGMPにより処理すると,H-Rasの活性化とともに,ERK,p38 MAPキナーゼ,p53,Rbの活性化がみられた.このとき,細胞をNaHSで同時に処理するとH-RasのS-グアニル化と活性化が抑制されるとともに,ERK,p38 MAPキナーゼ,p53,Rbの活性化も抑制された.これらの細胞は8-ニトロ-cGMPによる処理により老化が促進されたが,NaHSによる処理によりそれが抑制されるとともに,ERKの阻害剤およびp38 MAPキナーゼの阻害剤によっても老化は阻害された.
H-RasのC末端側には,181番目,184番目,186番目に3つのシステイン残基があり,それらは脂質修飾により細胞膜への局在が制御されている8).今回,同定した184番目のシステイン残基のS-グアニル化がH-Rasの局在にどのように影響するのかについて,細胞膜の成分を密度勾配によりラフト画分と非ラフト画分とに分画することで解析した結果,細胞を8-ニトロ-cGMPにより処理することでH-Rasは非ラフト画分へと移行することがわかった.さらに,このH-Rasの非ラフト画分への移行はNaHSによる処理によりほぼ完全に抑制された.H-Rasは非ラフト領域へと移行したのち,そのエフェクタータンパク質であるRafと結合することが知られている.そこで,GFP融合H-RasとDsRed融合c-Rafを共発現させた細胞を8-ニトロ-cGMPにより処理すると,細胞膜においてH-RasとRafとが共局在することが明らかになった.さらに,184番目のシステイン残基をセリン残基に置換したH-Ras変異体を用いると,8-ニトロ-cGMPによるこのような非ラフト画分への移行とRafとの共局在はまったくみられなくなった.以上の結果から,H-Rasの184番目のシステイン残基が内因性の親電子物質の機能的なセンサーとしてはたらき,そのS-グアニル化修飾がH-Rasの非ラフト領域への移行を促進して下流のリン酸化シグナル伝達系を活性化していることが明らかになった(図2).
おわりに
H2Sには抗炎症作用や抗酸化作用が報告されていたが,それら作用の分子機構についてはほとんどわかっていない.今回,筆者らは,HS-には,活性酸素種シグナル伝達系の重要なメディエーターである親電子物質をスルヒドリル化することによりその活性を負に制御するというまったく新しい作用のあることを見い出した.今後,親電子物質に対するスルヒドリル化を分子基盤とした活性酸素種シグナル伝達系およびレドックスシグナル伝達系の統合的な理解がよりいっそう進展することが期待される.一方,活性酸素種シグナル伝達系の異常による酸化ストレス病態の予防および治療という観点からも,親電子物質のスルヒドリル化は興味深い.H2Sそのものは高濃度では毒性のあることや不安定で取り扱いにくいことなどから,ヒトへの治療へ応用するには,今後,H2Sと同様のはたらきのある安全で取り扱いの容易な治療剤の開発が期待される.
文 献
- Sawa, T., Zaki, M H., Okamoto, T, et al.: Protein S-guanylation by the biological signal 8-nitroguanosine 3’,5’-cyclic monophosphate. Nat. Chem. Biol., 3, 727-735 (2007)[PubMed]
- D’Autreaux, B. & Toledano, M. B.: ROS as signaling molecules: mechanisms that generate specificity in ROS homeostasis. Nat. Rev. Mol. Cell Biol., 8, 813-824 (2007)[PubMed]
- Akaike, T., Fujii, S., Sawa, T. et al.: Cell signaling mediated by nitrated cyclic guanine nucleotide. Nitric Oxide, 23, 166-174 (2010)[PubMed]
- Li, L., Rose, P. & Moore, P. K.: Hydrogen sulfide and cell signaling. Annu. Rev. Pharmacol. Toxicol., 51, 169-187 (2011)[PubMed]
- Hughes, M. N., Centelles, M. N. & Moore, K. P.: Making and working with hydrogen sulfide: the chemistry and generation of hydrogen sulfide in vitro and its measurement in vivo: a review. Free Radic. Biol. Med., 47, 1346-1353 (2009)[PubMed]
- Shih, H., Lee, B., Lee, R. J. et al.: The aging heart and post-infarction left ventricular remodeling. J. Am. Coll. Cardiol., 57, 9-17 (2011)[PubMed]
- Gelb, B. D. & Tartaglia, M.: Ras signaling pathway mutations and hypertrophic cardiomyopathy: getting into and out of the thick of it. J. Clin. Invest., 121, 844-847 (2011)[PubMed]
- Hancock, J. F.: Ras proteins: different signals from different locations. Nat. Rev. Mol. Cell Biol., 4, 373-384 (2003)[PubMed]
著者プロフィール
略歴:1996年 京都大学大学院工学研究科博士課程 単位取得退学,博士(工学),同年 熊本大学医学部 助手,2000年 米国National Cancer Institute在外研究員,2002年 世界保健機関International Agency for Research on Cancer科学官を経て,2007年より熊本大学大学院医学薬学研究部 准教授(現 熊本大学大学院生命科学研究部).2011年より科学技術振興機構さきがけ研究者 兼任.
研究テーマ:活性酸素および親電子物質によるシグナル伝達系の機構.
西田 基宏(Motohiro Nishida)
九州大学大学院薬学研究院 准教授.
赤池 孝章(Takaaki Akaike)
熊本大学大学院生命科学研究部 教授.
研究室URL:http://kumadai-bisei.com/
© 2012 澤 智裕・西田基宏・赤池孝章 Licensed under CC 表示 2.1 日本