トランスシナプス標識法を用いた嗅球における局所的な神経回路の解析
宮道 和成
(米国Stanford大学Department of Biology)
email:宮道和成
DOI: 10.7875/first.author.2013.152
Dissecting local circuits: parvalbumin interneurons underlie broad feedback control of olfactory bulb output.
Kazunari Miyamichi, Yael Shlomai-Fuchs, Marvin Shu, Brandon C. Weissbourd, Liqun Luo, Adi Mizrahi
Neuron, 80, 1232-1245 (2013)
嗅球において糸球体の活動パターンとして表現される匂い情報は,多様な介在ニューロンから入力される演算を反映したかたちで高次の嗅覚皮質へと伝達される.これら介在ニューロンは電気生理学的および形態学的に多様であるため,個々のタイプの機能はほとんどわかっていない.この研究では,改良版のトランスシナプス標識法を用いて,嗅球の出力を担う僧帽細胞に直接に情報を伝達するシナプス前細胞を体系的に標識した.その結果,パルブアルブミン陽性ニューロンが広範な僧帽細胞と密な相互接続を形成していることを見い出した.このパルブアルブミン陽性ニューロンは多様な匂い分子に対し非選択的な応答を示したのに対し,僧帽細胞の側方抑制にかかわるとされる顆粒細胞ははるかに選択的に狭い匂い受容野をもっていた.パルブアルブミン陽性ニューロンを介するフィードバックループには僧帽細胞の活動をグローバルに制御する役割が想定された.また,この研究において用いた神経回路の可視化および電気生理学的な解析法は,ほかの局所な神経回路の解析にも広く適用できる.
われわれの脳のなかでは,膨大な種類のニューロンが自らの特異性をふまえて互いに連結し,機能的に異なるさまざまな神経回路が形成されている.そこで行われる情報処理の原理を理解するには,研究の対象となる特定のニューロンを選び出し,そのニューロンの形成する神経回路の構造,そのニューロンの電気生理学的な性質,そして,そのニューロンの活動を操作した場合の影響を調べる技術が必要である.その際,ニューロンを神経回路から切り離してしまうとその性質の重要な部分の多くが失われることから,生体の環境に近い状況において神経回路の可視化あるいは機能解析を行うことが望ましい.近年の分子遺伝学的なツールやイメージング技術は,まさしくそのような要請にもとづいて発展している.
神経回路の可視化に関しては,筆者らを含む複数のグループにより,狂犬病ウイルスの変異体を用いたトランスシナプス標識法が実装されている1-3).この方法では,マウスの脳の任意の領域に存在する遺伝学的に同定の可能な細胞集団から出発して,1段階だけ上流に位置するシナプス前細胞を逆行性に可視化することができる.この研究では,このトランスシナプス標識法を改良し,局所的な神経回路の可視化に適した系を構築した.そして,この手法を用いて嗅球の出力を担う僧帽細胞の活動を制御する神経回路を可視化し,従来,ほとんど注意をはらわれていなかった一群の介在ニューロンが僧帽細胞と非常に広範で密な相互接続を形成していることを見い出した.
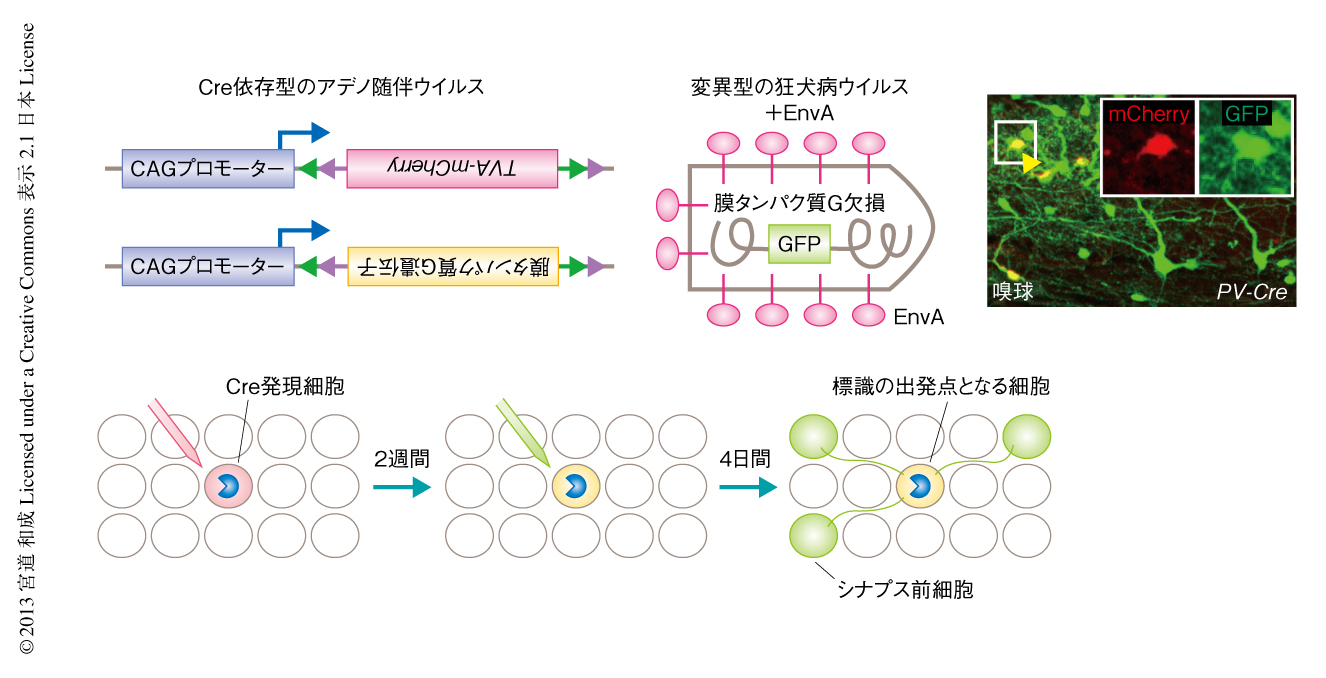
変異型の狂犬病ウイルスを用いたトランスシナプス標識法は,安全性,汎用性,簡便性をみたし,シナプス接続のレベルの解像度で神経回路を可視化できる手法である.その作動原理は以前の報告1)(新着論文レビュー でも掲載)にゆずるが,変異型の狂犬病ウイルスの取り込みに必須のTVA受容体と,狂犬病ウイルスの再構成に必要な膜タンパク質Gとを同時に発現したニューロンを起点として,その1段階だけ上流のシナプス前細胞を特異的に標識することができる.複雑な神経回路において標識の出発点となる細胞の種類を制御する戦略として,特定の遺伝子プロモーターから組換え酵素Cre(あるいは,薬剤依存型のCreER)を発現するトランスジェニック動物が用いられる1-3).
この研究では,Cre発現マウスを用いて標識の出発点となる細胞の種類を制御する方法2) に2点の改良をくわえた.2種類のCre依存型アデノ随伴ウイルスを使用し,脳の目的の領域に定位固定装置を用いて遺伝子導入する(図1).1つ目のアデノ随伴ウイルスはCreを発現したニューロンにTVA受容体と赤色蛍光タンパク質mCherryとの融合タンパク質を発現し,標識の出発点となる細胞を可視化すると同時に,変異型の狂犬病ウイルスの取り込みを可能にする.2つ目のアデノ随伴ウイルスはCreを発現したニューロンにおいて膜タンパク質Gを発現し,狂犬病ウイルスの再構成を可能にする.これら2種類の遺伝子を発現した細胞が2週間後に注入される変異型の狂犬病ウイルスを受け取ると標識の出発点となる細胞(mCherryとGFPの二重陽性)となり,その4日後にはシナプス前細胞(GFP単独の陽性)の標識が確認できる.
mCherryが標識の出発点となる細胞の検出の要であるため,十分な発現量が必要である.そのため,遺伝子プロモーターと発現カセットの最適化を行った.このアデノ随伴ウイルス(TCBカセット)を用いると,in vivoのさまざまな脳領域において効率よくCre発現ニューロンを標識の出発点となる細胞に変換しトランスシナプス標識ができる.しかし,TVA受容体の発現効率が高すぎるため,Creの発現していないニューロンにおいてもごく微量のTVA受容体が漏れ出し,これが狂犬病ウイルスを注入した領域の周辺において変異型の狂犬病ウイルスを受け取りGFP陽性になるという非特異的な標識が問題となった.この偽陽性の標識はウイルスを注入した領域のほかにはみられないので長距離に存在するシナプス前細胞の解析には問題ないが,ウイルスを注入した周辺の局所的な神経回路の研究には妨害となる.そこでEnvA外殻ウイルスの感染効率が約1/10に低下することの知られていたTVA受容体の点変異体TVA66Tを組み込んでアデノ随伴ウイルス(TC66Tカセット)を作製したところ,mCherryの高発現はそのままに,Creに非依存的な狂犬病ウイルスの感染をほぼゼロにまで落とすことができた.以上の結果から,TCBカセットは効率よく長距離のトランスシナプス標識を行うことができるが,ウイルス注入部位における非特異的なバックグラウンドに注意をはらう必要がある一方,TC66Tカセットはトランスシナプス標識の効率は落ちるものの,ウイルス注入部位の周辺の局所的な神経回路の可視化には好適な系といえる.以下では,TC66Tカセットを用いる系の有用性を検証するため,嗅球をモデルに実験を行った.
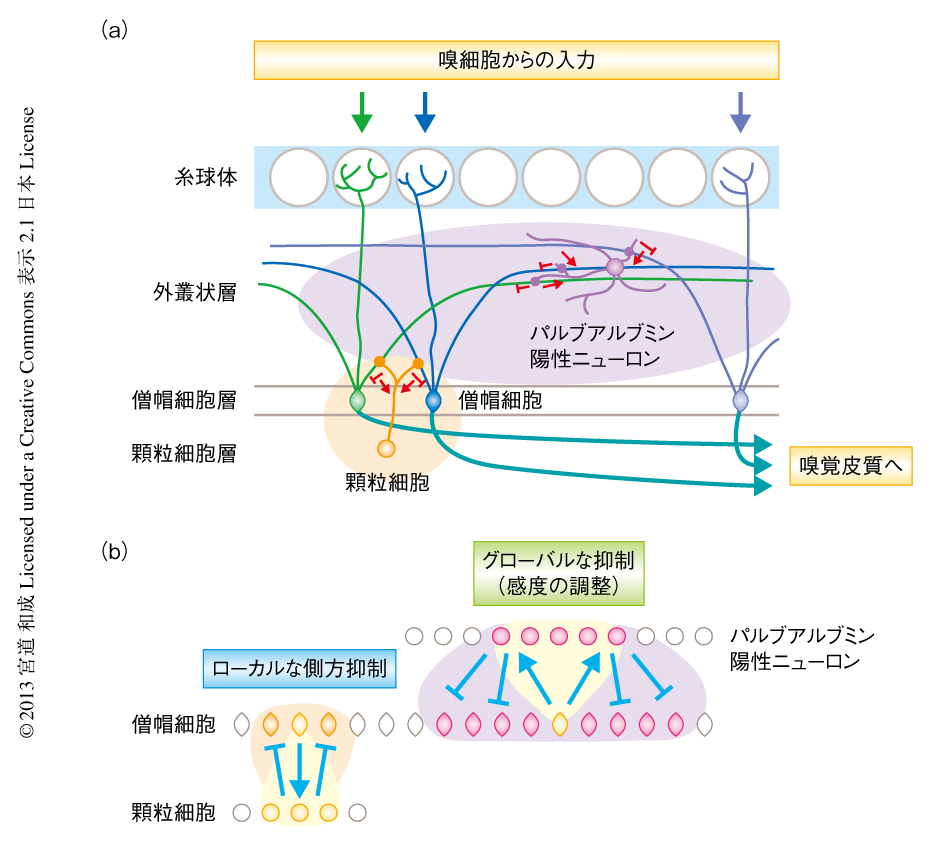
匂いはその種類や濃度の情報も含め,嗅球において糸球体の活動パターンとして表現される(図2a).この糸球体に展開された匂い地図は,そのまま高次の嗅覚皮質へと伝達されるわけではない.1つの糸球体に接続している嗅球の細胞を層ごとに分類しその匂い応答性を比較した研究によると,糸球体→房飾細胞→僧帽細胞と情報が進むにつれ細胞の匂い反応性は複雑化していく4).それは,嗅球に僧帽細胞の100倍近く存在するさまざまな介在ニューロン5) が匂い情報を処理演算するからである.これら介在ニューロンはその電気生理学的な性質も嗅球における神経接続パターンも多様なため,個々の機能解析はほとんど進んでいない.そこで,嗅球の出力を制御するシナプス前細胞の種類と空間的な分布を体系的に明らかにするため,僧帽細胞および房飾細胞に特異的にCreを発現するPcdh21-Creマウスを用いてトランスシナプス標識を行った.
標識の出発点となる細胞は標的領域の僧帽細胞および房飾細胞に限局し,そのシナプス前細胞は嗅球の全層にわたり標識の出発点となる細胞よりも広い範囲に空間分布していた.なかでも特徴的であったのが糸球体と僧帽細胞とのあいだに位置する外叢状層とよばれる領域の細胞で,GFPにより標識される僧帽細胞および房飾細胞のシナプス前細胞のおよそ4割はこの知名度の低い領域に局在した.さまざまな抗体を用いて細胞の種類を検討したところ,外叢状層のGFP陽性細胞のじつに9割が,Ca2+結合タンパク質であるパルブアルブミンを発現する特定のタイプの抑制性の介在ニューロンであることが判明した.別の実験から,このパルブアルブミン陽性ニューロンは外叢状層の3割程度をしめるにすぎないことがわかっていたので,パルブアルブミン陽性ニューロンから僧帽細胞および房飾細胞への接続は非常に特異的で密であることが示唆された.以上の結果から,僧帽細胞および房飾細胞は嗅球の広い範囲に存在するパルブアルブミン陽性ニューロンから抑制をうけることがわかった.
では,パルブアルブミン陽性ニューロンはどのような電気生理学的な性質をもつのだろう? パルブアルブミン陽性ニューロンは嗅球において数が少ないので,やみくもに電極を差し込んでも偶然に記録できる可能性は低い.そこで,パルブアルブミン陽性ニューロンを遺伝学的に標識したマウスを麻酔したうえで頭蓋を固定し,二光子顕微鏡によりパルブアルブミン陽性ニューロンを同定してからパッチクランプ記録を行った.この際,記録領域を活性化させることのわかっている5種類の匂い分子をランダムにくり返しあたえ,個々のニューロンの電気応答を記録した.その結果,パルブアルブミン陽性ニューロンは嗅球において例外的に広い匂い受容野をもつことがわかった.40%のパルブアルブミン陽性ニューロンはあたえたすべての匂い分子に非選択的に反応し,ほぼすべてのパルブアルブミン陽性ニューロンが3種類以上の匂い分子に応答した.そのほとんどは活動電位の頻度が上昇する興奮性の匂い応答だった.対照的に,古典的な嗅球の抑制性ニューロンである顆粒細胞は,はるかに選択的な匂い応答性を示した.たとえば,3種類以上の匂い分子に応答した顆粒細胞はわずか10%以下だった.この結果は,麻酔をしていない状態でのイメージング実験により,独立に支持されている6)(新着論文レビュー でも掲載).
では,パルブアルブミン陽性ニューロンが顆粒細胞に比較して広い匂い受容野をもつのは神経回路におけるどのような構造によるのだろう? このヒントを得るため,パルブアルブミン陽性ニューロンおよび顆粒細胞からそれぞれ特異的にトランスシナプス標識を行った.パルブアルブミン陽性ニューロンに特異的にCreを発現するマウスを用いた場合,標識の出発点となるパルブアルブミン陽性ニューロン1個あたり平均して約7個の僧帽細胞が標識され,その空間分布は標識の出発点となるパルブアルブミン陽性ニューロンよりはるかに広いことがわかった.おのおののパルブアルブミン陽性ニューロンが広い範囲に存在する複数の僧帽細胞から興奮性の入力を集めることにより,広い匂い受容野を獲得すると推定された(図2a).
顆粒細胞に関しては特異的なCreマウス系統が知られていなかったが,嗅球の深部に密集する抑制性ニューロンなので,抑制性ニューロンの汎用CreマウスであるGAD2-Creマウスを用いてスクリーニングすることにより,標識の出発点となる細胞が顆粒細胞に限局したデータが得られた.その結果,標識の出発点となる顆粒細胞は平均してわずか0.54個の僧帽細胞を標識するにすぎず,その空間分布も標識の出発点となる顆粒細胞の周辺にクラスターを形成していることがわかった.顆粒細胞が狭い範囲の少数の僧帽細胞から情報を集めていることは,顆粒細胞の匂い応答性が狭く選択的であることと整合的であった(図2a).
これらの結果の解釈には2点の注意が必要である.まず,筆者らのトランスシナプス標識法はすべてのシナプス前細胞を同定するわけではなく,実際の接続の頻度を過小評価している.さらに,細胞ごとに変異型の狂犬病ウイルスの産生効率や伝播効率が異なる可能性があるので,異なる標識の出発点となる細胞から得られた接続パターンを単純に水平比較するのは危険である.これらの注意点にもかかわらず,僧帽細胞からパルブアルブミン陽性ニューロンへの接続の頻度は,僧帽細胞から顆粒細胞への接続の頻度のおよそ13倍であり,この値は,独立に行われた嗅球の切片における電気生理学的なデータと驚くほどよく一致した6)(新着論文レビュー でも掲載).トランスシナプス標識法により得られたデータが,高い信頼性をもって扱われるペア電気記録法のデータと一致したのは心強い.
以上の結果から,僧帽細胞は嗅球の内部において少なくとも2種類のフィードバックループに組み込まれていることがわかった(図2b).顆粒細胞を介するループは空間的に狭く匂い応答性も選択的であるため,近接する僧帽細胞の活動にコントラストをつける側方抑制を担うのに適した構造である.一方,パルブアルブミン陽性ニューロンを介するループは空間的に広く分布し匂い応答性も非選択的であるため,特定の匂いの種類をコードするというより,外界の匂いの濃度にあわせて僧帽細胞の活動の頻度を調整する“スピーカーのボリューム”のような機能が想定される.実際,パルブアルブミン陽性ニューロンの不活性化が僧帽細胞の匂い選択性をそのままに応答性を底上げすることが示され6)(新着論文レビュー でも掲載),パルブアルブミン陽性ニューロンが僧帽細胞の感度の調整を担うことが明確になっている.
この研究において用いたトランスシナプス標識法は,Creを発現する細胞があれば任意の脳領域において標識の出発点となる細胞を作製できるため,ハイスループットな解析に適している.長距離のシナプス接続の効率的な可視化にはTCBカセット,局所の神経回路の詳細な解析にはTC66Tカセットと,用途に応じて使い分けることができる.今後の展望として,神経回路の機能的な側面に注目した解析,遺伝子をノックアウトしたニューロンの形成する神経回路の解析,そして,マウスのほかのモデル動物への応用の3点を簡潔に議論したい.
脳のなかでは同じCreを発現する細胞のなかにも膨大な多様性があり,異なる外界の刺激に反応し,異なる情報をコードし,異なる行動エピソードの発現にかかわる.そこで,おのおのの細胞の機能にもとづいて神経回路を可視化する技術が望まれる.最近,神経活動に依存的に発現する前初期遺伝子のプロモーターにより薬剤に依存型のCreERを発現させることで,薬剤の投与ののち短期間において活発に活動したニューロンを“トラップ”する系が開発された7,8).これを用いて,たとえば,“特定のフェロモンに応答するニューロン”から出発して,機能的な神経回路の構造や,個々の細胞の受容野の形成の機構を神経回路のレベルで解析できるようになるかもしれない.
トランスシナプス標識法において標識の出発点となる細胞を指定するために用いるCreは,同時に,loxP配列で挟まれた任意の遺伝子を欠損させノックアウト細胞を作製することができる.そのシナプス前細胞の分布や出現の頻度を観察すれば,おのおのの遺伝子の神経回路の形成にはたす役割を詳細に調べられる.従来,軸索ガイダンスの研究は巨視的な“領域 対 領域”のレベルで行われており,シナプス接続のレベルでどの程度の特異性があるのか,どのような分子機構により制御されているのか,ショウジョウバエや線虫においては少なからぬ知見があるものの,哺乳類ではほとんどわかっていない.神経疾患のモデル動物における神経回路のレベルの病変を検討するうえでも役だつに違いない.
最後に,現在は逆遺伝学のおよんでいないモデル生物においても,ウイルスを用いてCreを発現させることによりトランスシナプス標識法が可能である.なかでも,投射経路に依存してCreを発現させることのできる逆行性レンチウイルスの系9) が有望である.将来的には,DNA組換え技術の発展によりさまざまなCre発現動物が作製されると,神経回路のレベルにおいて比較神経科学の発展する余地が大いにあるように思う.
生命において機能はかたちに宿る.これは分子,細胞,臓器,社会性にいたるさまざまなレベルにおいて汎用性の高い考えである.詳細なシナプス接続マップを得ることなくして,脳の機能に関する研究に展望をえがくことはむずかしい.一方,かたちだけで機能が決まるわけではないことも周知のとおりで,われわれは約300個の細胞からなる神経回路ですら,そのかたちだけから演算の詳細を論じることができないのだ10).そこで,神経回路のかたちから入って電気生理学的な手法と機能解析までを一筋につなぐような研究として入出力のわかりやすい嗅球の局所の神経回路をモデルしようと考えたのが,この研究のきっかけである.
トランスシナプス標識法に関しては,以前の複雑な手法1)(新着論文レビュー でも掲載)から,シンプルで非特異的な標識のない方法にいたるのに1年半ほどかかった.一方,神経回路の機能解析に関しては,僧帽細胞のin vivo Ca2+イメージング系を立ち上げ,薬理遺伝学的な手法によりパルブアルブミン陽性ニューロンの活動を特異的に増減させる系を検討した.系の立ち上げは完了し,予備実験の結果も好感触であったのだが,効率化に手間どっているうちに競合する論文6) が完成してしまったため,この論文ではパルブアルブミン陽性ニューロンの機能解析を扱うことができなかったのが心残りである.じつは,2012年秋,日本神経科学会大会において小宮山尚樹・Jeffry S. Isaacsonグループの加藤紘之博士と同じセッションに発表の機会を得た際,筆者はこの研究の原型を話したのだが,いまだ完成までは遠くスクープされても無理のない状況だった.にもかかわらず,2013年2月,小宮山博士からたいへん紳士的なことに,いっしょに論文を投稿するよう提案をうけたのは望外の幸運だった.その際の検討より,未完成な要素の多いin vivo Ca2+イメージング系と機能解析についてはこの論文から切り離し,トランスシナプス標識法と電気生理学的な手法に特化してこれを急ピッチで強化し,6月上旬に同時投稿にこぎつけた.科学的な正確さのために付記しておくと,筆者らの論文のデータとIsaacson・小宮山グループの論文6)(新着論文レビュー でも掲載)のデータは完全に独立しており,双方とも投稿の3日前に原稿を交換するまで相手の内容を知らなかった.驚いたのは,2つの論文がなにひとつ同じ技術を使うことなく,ほとんど同じ結論に行き着いたことである.これは,トランスシナプス標識法にとり力強いサポートになった.
新規の手法に参入することのむずかしさを痛感した数年間だったが,かといって,得意な技術にしがみつくだけではいずれ時代に取り残されてしまう.分子遺伝学的なツールの進展は迅速で技術競争は苛烈である.得意な技術に磨きをかけながら,攻めの姿勢を貫くほかないようだ.
略歴:2006年 東京大学大学院理学系研究科 修了,同年 米国Stanford大学 博士研究員を経て,2013年より東京大学大学院農学生命科学研究科 特任准教授.
研究テーマ:高次の脳神経回路の形成の機構と機能.
抱負:ひさしぶりに日本にもどり,大学院生にかこまれて研究のできる愉悦を堪能しています.日本から世界に届く神経回路の機能の研究を発信していきたいです.
© 2013 宮道 和成 Licensed under CC 表示 2.1 日本
(米国Stanford大学Department of Biology)
email:宮道和成
DOI: 10.7875/first.author.2013.152
Dissecting local circuits: parvalbumin interneurons underlie broad feedback control of olfactory bulb output.
Kazunari Miyamichi, Yael Shlomai-Fuchs, Marvin Shu, Brandon C. Weissbourd, Liqun Luo, Adi Mizrahi
Neuron, 80, 1232-1245 (2013)
要 約
嗅球において糸球体の活動パターンとして表現される匂い情報は,多様な介在ニューロンから入力される演算を反映したかたちで高次の嗅覚皮質へと伝達される.これら介在ニューロンは電気生理学的および形態学的に多様であるため,個々のタイプの機能はほとんどわかっていない.この研究では,改良版のトランスシナプス標識法を用いて,嗅球の出力を担う僧帽細胞に直接に情報を伝達するシナプス前細胞を体系的に標識した.その結果,パルブアルブミン陽性ニューロンが広範な僧帽細胞と密な相互接続を形成していることを見い出した.このパルブアルブミン陽性ニューロンは多様な匂い分子に対し非選択的な応答を示したのに対し,僧帽細胞の側方抑制にかかわるとされる顆粒細胞ははるかに選択的に狭い匂い受容野をもっていた.パルブアルブミン陽性ニューロンを介するフィードバックループには僧帽細胞の活動をグローバルに制御する役割が想定された.また,この研究において用いた神経回路の可視化および電気生理学的な解析法は,ほかの局所な神経回路の解析にも広く適用できる.
はじめに
われわれの脳のなかでは,膨大な種類のニューロンが自らの特異性をふまえて互いに連結し,機能的に異なるさまざまな神経回路が形成されている.そこで行われる情報処理の原理を理解するには,研究の対象となる特定のニューロンを選び出し,そのニューロンの形成する神経回路の構造,そのニューロンの電気生理学的な性質,そして,そのニューロンの活動を操作した場合の影響を調べる技術が必要である.その際,ニューロンを神経回路から切り離してしまうとその性質の重要な部分の多くが失われることから,生体の環境に近い状況において神経回路の可視化あるいは機能解析を行うことが望ましい.近年の分子遺伝学的なツールやイメージング技術は,まさしくそのような要請にもとづいて発展している.
神経回路の可視化に関しては,筆者らを含む複数のグループにより,狂犬病ウイルスの変異体を用いたトランスシナプス標識法が実装されている1-3).この方法では,マウスの脳の任意の領域に存在する遺伝学的に同定の可能な細胞集団から出発して,1段階だけ上流に位置するシナプス前細胞を逆行性に可視化することができる.この研究では,このトランスシナプス標識法を改良し,局所的な神経回路の可視化に適した系を構築した.そして,この手法を用いて嗅球の出力を担う僧帽細胞の活動を制御する神経回路を可視化し,従来,ほとんど注意をはらわれていなかった一群の介在ニューロンが僧帽細胞と非常に広範で密な相互接続を形成していることを見い出した.
1.トランスシナプス標識法の改良
変異型の狂犬病ウイルスを用いたトランスシナプス標識法は,安全性,汎用性,簡便性をみたし,シナプス接続のレベルの解像度で神経回路を可視化できる手法である.その作動原理は以前の報告1)(新着論文レビュー でも掲載)にゆずるが,変異型の狂犬病ウイルスの取り込みに必須のTVA受容体と,狂犬病ウイルスの再構成に必要な膜タンパク質Gとを同時に発現したニューロンを起点として,その1段階だけ上流のシナプス前細胞を特異的に標識することができる.複雑な神経回路において標識の出発点となる細胞の種類を制御する戦略として,特定の遺伝子プロモーターから組換え酵素Cre(あるいは,薬剤依存型のCreER)を発現するトランスジェニック動物が用いられる1-3).
この研究では,Cre発現マウスを用いて標識の出発点となる細胞の種類を制御する方法2) に2点の改良をくわえた.2種類のCre依存型アデノ随伴ウイルスを使用し,脳の目的の領域に定位固定装置を用いて遺伝子導入する(図1).1つ目のアデノ随伴ウイルスはCreを発現したニューロンにTVA受容体と赤色蛍光タンパク質mCherryとの融合タンパク質を発現し,標識の出発点となる細胞を可視化すると同時に,変異型の狂犬病ウイルスの取り込みを可能にする.2つ目のアデノ随伴ウイルスはCreを発現したニューロンにおいて膜タンパク質Gを発現し,狂犬病ウイルスの再構成を可能にする.これら2種類の遺伝子を発現した細胞が2週間後に注入される変異型の狂犬病ウイルスを受け取ると標識の出発点となる細胞(mCherryとGFPの二重陽性)となり,その4日後にはシナプス前細胞(GFP単独の陽性)の標識が確認できる.
mCherryが標識の出発点となる細胞の検出の要であるため,十分な発現量が必要である.そのため,遺伝子プロモーターと発現カセットの最適化を行った.このアデノ随伴ウイルス(TCBカセット)を用いると,in vivoのさまざまな脳領域において効率よくCre発現ニューロンを標識の出発点となる細胞に変換しトランスシナプス標識ができる.しかし,TVA受容体の発現効率が高すぎるため,Creの発現していないニューロンにおいてもごく微量のTVA受容体が漏れ出し,これが狂犬病ウイルスを注入した領域の周辺において変異型の狂犬病ウイルスを受け取りGFP陽性になるという非特異的な標識が問題となった.この偽陽性の標識はウイルスを注入した領域のほかにはみられないので長距離に存在するシナプス前細胞の解析には問題ないが,ウイルスを注入した周辺の局所的な神経回路の研究には妨害となる.そこでEnvA外殻ウイルスの感染効率が約1/10に低下することの知られていたTVA受容体の点変異体TVA66Tを組み込んでアデノ随伴ウイルス(TC66Tカセット)を作製したところ,mCherryの高発現はそのままに,Creに非依存的な狂犬病ウイルスの感染をほぼゼロにまで落とすことができた.以上の結果から,TCBカセットは効率よく長距離のトランスシナプス標識を行うことができるが,ウイルス注入部位における非特異的なバックグラウンドに注意をはらう必要がある一方,TC66Tカセットはトランスシナプス標識の効率は落ちるものの,ウイルス注入部位の周辺の局所的な神経回路の可視化には好適な系といえる.以下では,TC66Tカセットを用いる系の有用性を検証するため,嗅球をモデルに実験を行った.
2.僧帽細胞のシナプス前細胞の分布
匂いはその種類や濃度の情報も含め,嗅球において糸球体の活動パターンとして表現される(図2a).この糸球体に展開された匂い地図は,そのまま高次の嗅覚皮質へと伝達されるわけではない.1つの糸球体に接続している嗅球の細胞を層ごとに分類しその匂い応答性を比較した研究によると,糸球体→房飾細胞→僧帽細胞と情報が進むにつれ細胞の匂い反応性は複雑化していく4).それは,嗅球に僧帽細胞の100倍近く存在するさまざまな介在ニューロン5) が匂い情報を処理演算するからである.これら介在ニューロンはその電気生理学的な性質も嗅球における神経接続パターンも多様なため,個々の機能解析はほとんど進んでいない.そこで,嗅球の出力を制御するシナプス前細胞の種類と空間的な分布を体系的に明らかにするため,僧帽細胞および房飾細胞に特異的にCreを発現するPcdh21-Creマウスを用いてトランスシナプス標識を行った.
標識の出発点となる細胞は標的領域の僧帽細胞および房飾細胞に限局し,そのシナプス前細胞は嗅球の全層にわたり標識の出発点となる細胞よりも広い範囲に空間分布していた.なかでも特徴的であったのが糸球体と僧帽細胞とのあいだに位置する外叢状層とよばれる領域の細胞で,GFPにより標識される僧帽細胞および房飾細胞のシナプス前細胞のおよそ4割はこの知名度の低い領域に局在した.さまざまな抗体を用いて細胞の種類を検討したところ,外叢状層のGFP陽性細胞のじつに9割が,Ca2+結合タンパク質であるパルブアルブミンを発現する特定のタイプの抑制性の介在ニューロンであることが判明した.別の実験から,このパルブアルブミン陽性ニューロンは外叢状層の3割程度をしめるにすぎないことがわかっていたので,パルブアルブミン陽性ニューロンから僧帽細胞および房飾細胞への接続は非常に特異的で密であることが示唆された.以上の結果から,僧帽細胞および房飾細胞は嗅球の広い範囲に存在するパルブアルブミン陽性ニューロンから抑制をうけることがわかった.
3.パルブアルブミン陽性ニューロンは広い匂い受容野をもつ
では,パルブアルブミン陽性ニューロンはどのような電気生理学的な性質をもつのだろう? パルブアルブミン陽性ニューロンは嗅球において数が少ないので,やみくもに電極を差し込んでも偶然に記録できる可能性は低い.そこで,パルブアルブミン陽性ニューロンを遺伝学的に標識したマウスを麻酔したうえで頭蓋を固定し,二光子顕微鏡によりパルブアルブミン陽性ニューロンを同定してからパッチクランプ記録を行った.この際,記録領域を活性化させることのわかっている5種類の匂い分子をランダムにくり返しあたえ,個々のニューロンの電気応答を記録した.その結果,パルブアルブミン陽性ニューロンは嗅球において例外的に広い匂い受容野をもつことがわかった.40%のパルブアルブミン陽性ニューロンはあたえたすべての匂い分子に非選択的に反応し,ほぼすべてのパルブアルブミン陽性ニューロンが3種類以上の匂い分子に応答した.そのほとんどは活動電位の頻度が上昇する興奮性の匂い応答だった.対照的に,古典的な嗅球の抑制性ニューロンである顆粒細胞は,はるかに選択的な匂い応答性を示した.たとえば,3種類以上の匂い分子に応答した顆粒細胞はわずか10%以下だった.この結果は,麻酔をしていない状態でのイメージング実験により,独立に支持されている6)(新着論文レビュー でも掲載).
4.パルブアルブミン陽性ニューロンは広範な僧帽細胞から情報を集める
では,パルブアルブミン陽性ニューロンが顆粒細胞に比較して広い匂い受容野をもつのは神経回路におけるどのような構造によるのだろう? このヒントを得るため,パルブアルブミン陽性ニューロンおよび顆粒細胞からそれぞれ特異的にトランスシナプス標識を行った.パルブアルブミン陽性ニューロンに特異的にCreを発現するマウスを用いた場合,標識の出発点となるパルブアルブミン陽性ニューロン1個あたり平均して約7個の僧帽細胞が標識され,その空間分布は標識の出発点となるパルブアルブミン陽性ニューロンよりはるかに広いことがわかった.おのおののパルブアルブミン陽性ニューロンが広い範囲に存在する複数の僧帽細胞から興奮性の入力を集めることにより,広い匂い受容野を獲得すると推定された(図2a).
顆粒細胞に関しては特異的なCreマウス系統が知られていなかったが,嗅球の深部に密集する抑制性ニューロンなので,抑制性ニューロンの汎用CreマウスであるGAD2-Creマウスを用いてスクリーニングすることにより,標識の出発点となる細胞が顆粒細胞に限局したデータが得られた.その結果,標識の出発点となる顆粒細胞は平均してわずか0.54個の僧帽細胞を標識するにすぎず,その空間分布も標識の出発点となる顆粒細胞の周辺にクラスターを形成していることがわかった.顆粒細胞が狭い範囲の少数の僧帽細胞から情報を集めていることは,顆粒細胞の匂い応答性が狭く選択的であることと整合的であった(図2a).
これらの結果の解釈には2点の注意が必要である.まず,筆者らのトランスシナプス標識法はすべてのシナプス前細胞を同定するわけではなく,実際の接続の頻度を過小評価している.さらに,細胞ごとに変異型の狂犬病ウイルスの産生効率や伝播効率が異なる可能性があるので,異なる標識の出発点となる細胞から得られた接続パターンを単純に水平比較するのは危険である.これらの注意点にもかかわらず,僧帽細胞からパルブアルブミン陽性ニューロンへの接続の頻度は,僧帽細胞から顆粒細胞への接続の頻度のおよそ13倍であり,この値は,独立に行われた嗅球の切片における電気生理学的なデータと驚くほどよく一致した6)(新着論文レビュー でも掲載).トランスシナプス標識法により得られたデータが,高い信頼性をもって扱われるペア電気記録法のデータと一致したのは心強い.
以上の結果から,僧帽細胞は嗅球の内部において少なくとも2種類のフィードバックループに組み込まれていることがわかった(図2b).顆粒細胞を介するループは空間的に狭く匂い応答性も選択的であるため,近接する僧帽細胞の活動にコントラストをつける側方抑制を担うのに適した構造である.一方,パルブアルブミン陽性ニューロンを介するループは空間的に広く分布し匂い応答性も非選択的であるため,特定の匂いの種類をコードするというより,外界の匂いの濃度にあわせて僧帽細胞の活動の頻度を調整する“スピーカーのボリューム”のような機能が想定される.実際,パルブアルブミン陽性ニューロンの不活性化が僧帽細胞の匂い選択性をそのままに応答性を底上げすることが示され6)(新着論文レビュー でも掲載),パルブアルブミン陽性ニューロンが僧帽細胞の感度の調整を担うことが明確になっている.
5.トランスシナプス標識法の展望
この研究において用いたトランスシナプス標識法は,Creを発現する細胞があれば任意の脳領域において標識の出発点となる細胞を作製できるため,ハイスループットな解析に適している.長距離のシナプス接続の効率的な可視化にはTCBカセット,局所の神経回路の詳細な解析にはTC66Tカセットと,用途に応じて使い分けることができる.今後の展望として,神経回路の機能的な側面に注目した解析,遺伝子をノックアウトしたニューロンの形成する神経回路の解析,そして,マウスのほかのモデル動物への応用の3点を簡潔に議論したい.
脳のなかでは同じCreを発現する細胞のなかにも膨大な多様性があり,異なる外界の刺激に反応し,異なる情報をコードし,異なる行動エピソードの発現にかかわる.そこで,おのおのの細胞の機能にもとづいて神経回路を可視化する技術が望まれる.最近,神経活動に依存的に発現する前初期遺伝子のプロモーターにより薬剤に依存型のCreERを発現させることで,薬剤の投与ののち短期間において活発に活動したニューロンを“トラップ”する系が開発された7,8).これを用いて,たとえば,“特定のフェロモンに応答するニューロン”から出発して,機能的な神経回路の構造や,個々の細胞の受容野の形成の機構を神経回路のレベルで解析できるようになるかもしれない.
トランスシナプス標識法において標識の出発点となる細胞を指定するために用いるCreは,同時に,loxP配列で挟まれた任意の遺伝子を欠損させノックアウト細胞を作製することができる.そのシナプス前細胞の分布や出現の頻度を観察すれば,おのおのの遺伝子の神経回路の形成にはたす役割を詳細に調べられる.従来,軸索ガイダンスの研究は巨視的な“領域 対 領域”のレベルで行われており,シナプス接続のレベルでどの程度の特異性があるのか,どのような分子機構により制御されているのか,ショウジョウバエや線虫においては少なからぬ知見があるものの,哺乳類ではほとんどわかっていない.神経疾患のモデル動物における神経回路のレベルの病変を検討するうえでも役だつに違いない.
最後に,現在は逆遺伝学のおよんでいないモデル生物においても,ウイルスを用いてCreを発現させることによりトランスシナプス標識法が可能である.なかでも,投射経路に依存してCreを発現させることのできる逆行性レンチウイルスの系9) が有望である.将来的には,DNA組換え技術の発展によりさまざまなCre発現動物が作製されると,神経回路のレベルにおいて比較神経科学の発展する余地が大いにあるように思う.
おわりに
生命において機能はかたちに宿る.これは分子,細胞,臓器,社会性にいたるさまざまなレベルにおいて汎用性の高い考えである.詳細なシナプス接続マップを得ることなくして,脳の機能に関する研究に展望をえがくことはむずかしい.一方,かたちだけで機能が決まるわけではないことも周知のとおりで,われわれは約300個の細胞からなる神経回路ですら,そのかたちだけから演算の詳細を論じることができないのだ10).そこで,神経回路のかたちから入って電気生理学的な手法と機能解析までを一筋につなぐような研究として入出力のわかりやすい嗅球の局所の神経回路をモデルしようと考えたのが,この研究のきっかけである.
トランスシナプス標識法に関しては,以前の複雑な手法1)(新着論文レビュー でも掲載)から,シンプルで非特異的な標識のない方法にいたるのに1年半ほどかかった.一方,神経回路の機能解析に関しては,僧帽細胞のin vivo Ca2+イメージング系を立ち上げ,薬理遺伝学的な手法によりパルブアルブミン陽性ニューロンの活動を特異的に増減させる系を検討した.系の立ち上げは完了し,予備実験の結果も好感触であったのだが,効率化に手間どっているうちに競合する論文6) が完成してしまったため,この論文ではパルブアルブミン陽性ニューロンの機能解析を扱うことができなかったのが心残りである.じつは,2012年秋,日本神経科学会大会において小宮山尚樹・Jeffry S. Isaacsonグループの加藤紘之博士と同じセッションに発表の機会を得た際,筆者はこの研究の原型を話したのだが,いまだ完成までは遠くスクープされても無理のない状況だった.にもかかわらず,2013年2月,小宮山博士からたいへん紳士的なことに,いっしょに論文を投稿するよう提案をうけたのは望外の幸運だった.その際の検討より,未完成な要素の多いin vivo Ca2+イメージング系と機能解析についてはこの論文から切り離し,トランスシナプス標識法と電気生理学的な手法に特化してこれを急ピッチで強化し,6月上旬に同時投稿にこぎつけた.科学的な正確さのために付記しておくと,筆者らの論文のデータとIsaacson・小宮山グループの論文6)(新着論文レビュー でも掲載)のデータは完全に独立しており,双方とも投稿の3日前に原稿を交換するまで相手の内容を知らなかった.驚いたのは,2つの論文がなにひとつ同じ技術を使うことなく,ほとんど同じ結論に行き着いたことである.これは,トランスシナプス標識法にとり力強いサポートになった.
新規の手法に参入することのむずかしさを痛感した数年間だったが,かといって,得意な技術にしがみつくだけではいずれ時代に取り残されてしまう.分子遺伝学的なツールの進展は迅速で技術競争は苛烈である.得意な技術に磨きをかけながら,攻めの姿勢を貫くほかないようだ.
文 献
- Miyamichi, K., Amat, F., Moussavi, F. et al.: Cortical representations of olfactory input by trans-synaptic tracing. Nature, 472, 191-196 (2011)[PubMed] [新着論文レビュー]
- Watabe-Uchida, M., Zhu, L., Ogawa, S. K. et al.: Whole-brain mapping of direct inputs to midbrain dopamine neurons. Neuron, 74, 858-873 (2012)[PubMed]
- Wall, N. R., Wickersham, I. R., Cetin, A. et al.: Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proc. Natl. Acad. Sci. USA, 107, 21848-21853 (2010)[PubMed]
- Kikuta, S., Fletcher, M. L., Homma, R. et al.: Odorant response properties of individual neurons in an olfactory glomerular module. Neuron, 77, 1122-1135 (2013)[PubMed]
- Batista-Brito, R., Close, J., Machold, R. et al.: The distinct temporal origins of olfactory bulb interneuron subtypes. J. Neurosci., 28, 3966-3975 (2008)[PubMed]
- Kato, H. K., Gillet, S. N., Peters, A. J. et al.: Parvalbumin-expressing interneurons linearly control olfactory bulb output. Neuron, 80, 1218-1231 (2013)[PubMed] [新着論文レビュー]
- Guenthner, C. J., Miyamichi, K., Yang, H. H. et al.: Permanent genetic access to transiently active neurons via TRAP: targeted recombination in active populations. Neuron, 78, 773-784 (2013)[PubMed]
- Kawashima, T., Kitamura, K., Suzuki, K. et al.: Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE. Nature Methods, 10, 889-895 (2013)[PubMed] [新着論文レビュー]
- Kato, S., Kobayashi, K., Inoue, K. et al.: A lentiviral strategy for highly efficient retrograde gene transfer by pseudotyping with fusion envelope glycoprotein. Hum. Gene Ther., 22, 197-206 (2011)[PubMed]
- Bargmann, C. I. & Marder, E.: From the connectome to brain function. Nat. Methods, 10, 483-490 (2013)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科 修了,同年 米国Stanford大学 博士研究員を経て,2013年より東京大学大学院農学生命科学研究科 特任准教授.
研究テーマ:高次の脳神経回路の形成の機構と機能.
抱負:ひさしぶりに日本にもどり,大学院生にかこまれて研究のできる愉悦を堪能しています.日本から世界に届く神経回路の機能の研究を発信していきたいです.
© 2013 宮道 和成 Licensed under CC 表示 2.1 日本