トランスシナプス標識法による嗅球から嗅覚皮質への神経接続の解析
宮道 和成
(米国Stanford大学Department of Biology)
email:宮道 和成
DOI: 10.7875/first.author.2011.019
Cortical representations of olfactory input by trans-synaptic tracing.
Kazunari Miyamichi, Fernando Amat, Farshid Moussavi, Chen Wang, Ian Wickersham, Nicholas R. Wall, Hiroki Taniguchi, Bosiljka Tasic, Z. Josh Huang, Zhigang He, Edward M. Callaway, Mark A. Horowitz, Liqun Luo
Nature, 472, 191-196 (2011)
嗅球には嗅覚受容体の種類に対応した約1000対の糸球が分布し,同じ受容体を発現する嗅覚ニューロンはそのうち特定の1対に対し軸索を投射する.嗅上皮でどの嗅覚ニューロンが活性化されたかという匂い分子の情報は,嗅球の表面ではどの糸球が活性化されたかという位置情報,すなわち,匂い地図へと変換される.この匂い地図が嗅覚皮質でどのように展開されているのかは未解明の重要な問題である.この研究では,狂犬病ウイルスを用いた逆行性のトランスシナプス標識法を改良してウイルスをはじめに感染させた細胞の位置,細胞種,および,概数を遺伝学的に制御できるようにした.この手法により嗅覚皮質の個々のニューロンは嗅球の広い範囲に分布する複数の糸球から僧帽細胞を介して入力を受け取っていることが明らかになった.また,嗅覚皮質の領域により嗅球からの入力様式には相違があり,たとえば,扁桃体は嗅球の背側領域からの入力を優先的にうけるのに対し,梨状皮質への入力には明白なかたよりはみられなかった.これらの違いは,それぞれの皮質領域が先天的な匂いの偏好性や匂いに関する連想記憶といった異なる機能を担うことを反映しているのかもしれない.ここに報告したトランスシナプス標識法はマウスの神経系において神経接続の地図を作製するための一般的な手法となりうるものである.
脳の機能は相互に複雑にからみあったニューロンのネットワークの生み出す時空間的な活動電位のパターンに担保されている.神経回路を正確に記述することはそこで行われる情報処理の原理を理解する第一歩である.局所的な回路はそれぞれの細胞の樹状突起や軸索を丹念に追跡することで予測でき,脳切片の電気生理学な手法による解析により検証できる.さらには,電子顕微鏡による高解像度の3次元再構成像が得られれば完全な接続様式の理解へとつながるだろう.一方,長距離の軸索投射による回路を正確に記述するのはきわめて困難である.多くの手法は低解像度で定性的な軸索投射を記述するにすぎず,離れた脳領域のどの細胞とどの細胞とが接続しているのかはわからない.このような状況で,脳の異なる領域が協調的に情報処理する過程を理解するのは不可能である.この研究では,シナプスをこえて移動する狂犬病ウイルス変異体を用いてマウス脳の任意の領域の任意の細胞種に限定的にウイルスを感染させ,その細胞に入力を送っている細胞(前シナプス細胞)のみを選択的に蛍光タンパク質で可視化する手法を開発した.この手法を用いることで,これまで困難だった長距離の軸索投射を介する神経接続を定量的に記述することができた.この手法の応用としてマウスの嗅覚系に着目し,嗅覚皮質の異なる領域および異なる細胞種から出発して嗅球の僧帽細胞を標識しその空間分布を3次元再構成して解析した.
狂犬病ウイルスは自然のつくりだしたすぐれたトランスシナプストレーサーであるが問題もあった.このウイルスは末梢組織に侵入すると軸索の末端に効率的に取り込まれ,細胞体まで逆行性に輸送されてそこで自己複製したのち,シナプスをへて上流のニューロンへとさかのぼることで脳全体に広がり,やがて個体を死にいたらしめる.神経回路を解析するツールとしての第1の問題はウイルスの病原性である.第2の問題は,ウイルスが無制限に広がってしまうのでウイルスが検出された細胞がはじめに感染させた標識の出発点となる細胞と直接的に接続していたのか,それとも,2段階以上のシナプスをへて間接的につながっていたのかを区別できないという点である.
数年前,これらの問題を解決する画期的な狂犬病ウイルス変異体が作製された1).まず,狂犬病ウイルスのゲノムからウイルスの構成に必須の膜タンパク質(G)をコードする遺伝子を除き,代わりに,赤色蛍光タンパク質mCherryの遺伝子を挿入した変異型ウイルスゲノムが作製された.つぎにこれをトリ由来のEnvAを発現する培養細胞に導入し,ゲノムはG遺伝子を欠損した狂犬病ウイルスであるが外殻はトリのウイルスに偽型された変異体をつくりだしたのである.この変異体ウイルスはもはや哺乳類の細胞には感染できず,仮に感染しても増えることはない.しかし,標的の細胞にEnvAの受容体であるTVAを遺伝学的に強制発現すればウイルスを感染させることができ,さらに同じ細胞に狂犬病ウイルスの膜タンパク質Gを強制発現すれば狂犬病ウイルスのゲノムが相補されその細胞にかぎって機能的なウイルス粒子が再構成される.再構成されたウイルスは前シナプス細胞にシナプスをこえて感染しmCherryによりその細胞を標識する.しかし,前シナプス細胞は膜タンパク質Gを発現していないのでウイルスはこれ以上は広がることができず,はじめに感染させた標識の出発点となる細胞から1段階のシナプスを移動したところで止まる.このようにして,ウイルスの病原性と,多段階の移動により接続様式の解析にあいまいさがもち込まれることの両者は同時に解決されたのである.
過去数年の課題は,いかにして実験動物の脳の標的細胞(少数であるほうが好ましい)にTVAと膜タンパク質Gとを選択的に発現させるかということであった.2010年後半になって,複数の研究室がそれぞれの生物学的な興味にあわせてさまざまな手法を発表している.たとえば,電気生理学的な手法を用いて脳表層の単一細胞にTVAと膜タンパク質Gを強制発現させることでその細胞への神経接続が解析されている2).この手法は1細胞の解像度をもつ点で画期的だが脳表層にしか使えない.特定の筋肉に接続している運動神経に特異的にTVAと膜タンパク質Gとを発現させる方法も編み出されている3).美しい手法だが筋肉のようにほかの神経回路と物理的に離れている場合にしか使えない.同様の手法は網膜の神経回路の解析にもみごとに利用されている4)(新着論文レビュー でも掲載).
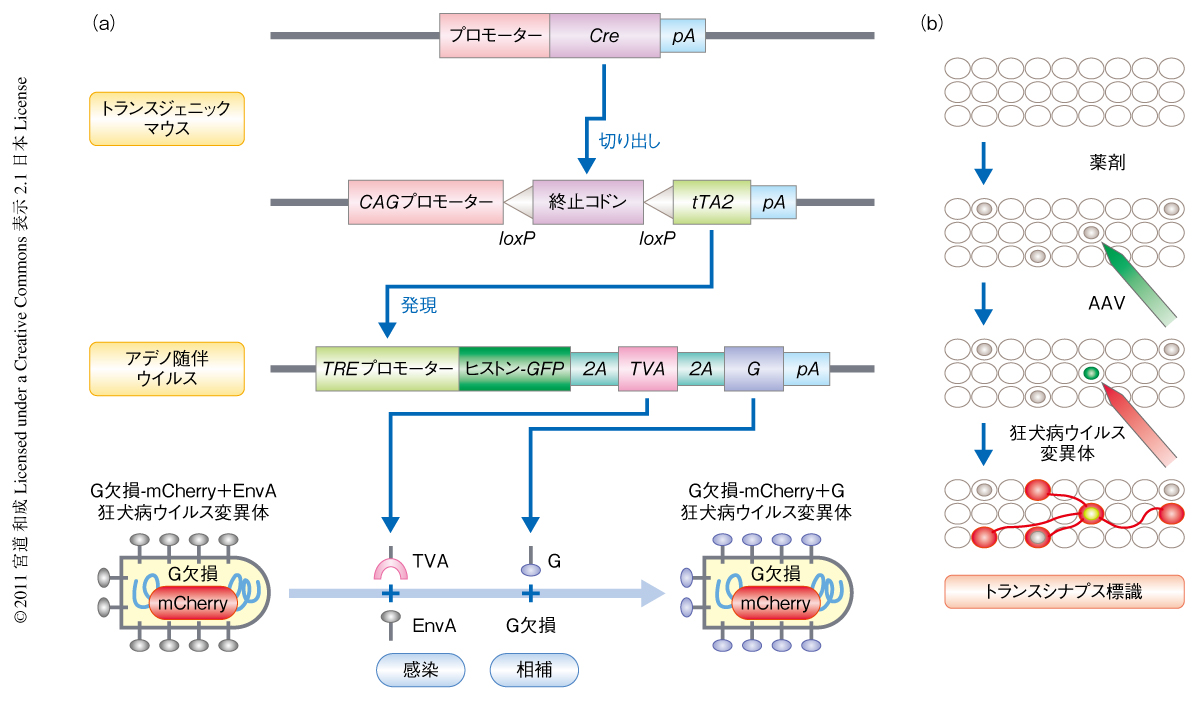
この研究では,マウス遺伝学とウイルスベクターとを組み合わせてTVAと膜タンパク質Gとを脳の任意の領域の任意の細胞種に導入できるようにし,さらに,導入される細胞の概数も制御可能とした(図1).実験動物は2種類のトランスジェニックマウスを掛け合わせて作製した.ひとつは,任意のプロモーターから薬剤誘導の可能なCreリコンビナーゼを発現する.もうひとつは,すべての細胞で転写活性のあるCAGプロモーターから転写因子tTA2を発現するが,loxP-終止コドン-loxPカセットにより翻訳が遮断されている.薬剤を適量あたえることでCreリコンビナーゼを発現する細胞の一部で組換えが起こってこのカセットが取り除かれtTA2が発現する.つぎに,脳の目的の領域にアデノ随伴ウイルスベクターを用いてヒストン-GFP融合タンパク質の遺伝子,TVA遺伝子,狂犬病ウイルスG遺伝子の3つの遺伝子を定位固定して導入する.これら3つの遺伝子産物はtTA2に駆動されるTREプロモーターによって転写され,2Aペプチドにより単一のmRNAから同量だけ翻訳される.このアデノ随伴ウイルスベクターは導入された場所で局所的に感染するので標的の領域を細かく設定することができる.最後に,同じ標的の領域にさきに述べた狂犬病ウイルス変異体を導入することでトランスシナプス標識が開始される.このように,標識の出発点となる細胞の種類はCreリコンビナーゼを駆動するプロモーターを選ぶことで,概数は薬剤の量を調整することで,そして,標的の領域はアデノ随伴ウイルスベクターを定位固定して導入することで,制御することができた.
大脳皮質における予備実験によりこの系が機能し,標的の領域に限局した少数の細胞から出発して数百~数千のシナプス前細胞がmCherryにより標識されることが確認された.種々の対照実験により,このトランスシナプス標識はアデノ随伴ウイルスベクターに完全に依存しており,100%逆行性であって単に標識の出発点となる細胞の近くを通過している軸索には取り込まれない(シナプスの接続を経由する必要がある)ことを確認した.
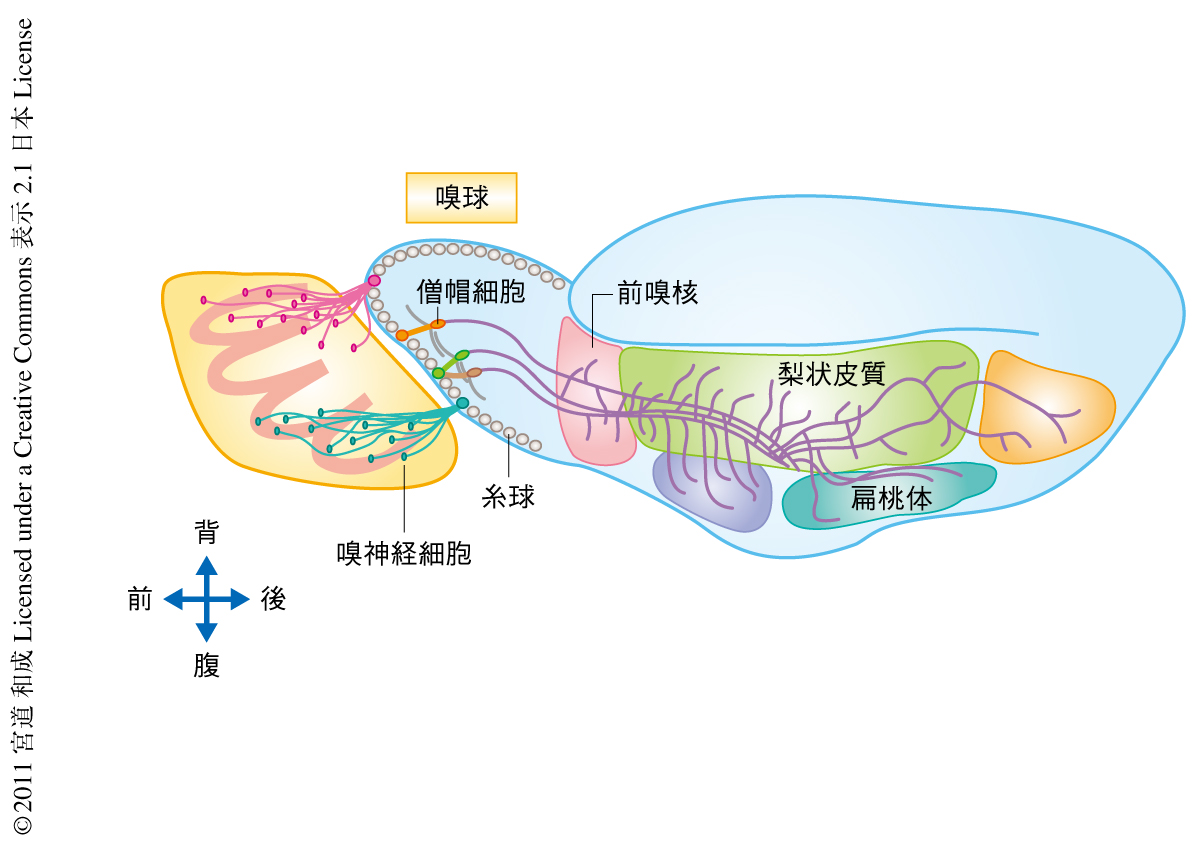
嗅覚系は視覚系に比べて理解が遅れていたが,1991年に嗅覚受容体遺伝子が発見されると5),急速に研究が進展した.マウスには1000種類をこえる嗅覚受容体遺伝子が存在し,個々の嗅覚ニューロンはそのうち1種類のみを相互排他的に発現する(図2).同一の嗅覚受容体を発現する数千の嗅覚ニューロンは嗅球において特定の糸球に軸索を収斂させる.このようにして,嗅上皮で匂い分子がどの受容体に結合したかという情報は嗅球ではどの糸球が活動したかという2次元の位置情報(匂い地図)へと変換される6).嗅球に存在する2次ニューロンである僧帽細胞は樹状突起を単一の糸球へ伸ばし,1種類の嗅覚ニューロンから直接入力を受け取ると軸索をはるか嗅覚皮質へと伸ばし複数の領域に情報を送る.しかし,その接続様式に関してはよくわかっていない.
この研究では,前嗅核,梨状皮質,扁桃体のそれぞれ局所的な領域の数個から数十個の細胞を標識の出発点とし,それらの細胞に僧帽細胞を介して入力を送る糸球の位置を嗅球の連続切片の3次元再構成アルゴリズムにより定量的に解析した.その結果は,嗅球から嗅覚皮質への接続に関する3つの基本的な原理として要約することができた.
1)統合:調べた3つの領域に共通して,標識の出発点となる細胞の数よりもトランスシナプス標識される僧帽細胞の数,糸球の数のほうがはるかに多かった.この結果は,複数の糸球に由来する情報が嗅覚皮質では個々の細胞レベルで統合されていることを示すものであった.平均すると少なくとも4種類の糸球に由来する情報がひとつの細胞に集約されることになるが,1000種類のチャネルから4種類を選ぶ組合せだけを考えても400億をこえマウスのすべての脳細胞の数を凌駕してしまう.したがって,嗅覚皮質の細胞は可能な糸球の組合せのごくごく一部を実現しているにすぎないのだが,どのようなしくみで糸球の組み合わせを選び取るのか,それは経験や学習によって変化していくものなのか,などさまざまな疑問が残されている.いずれにせよ,この統合の原理は嗅球で糸球の組合せによって表現されていた匂い情報が嗅覚皮質で分析される基盤のひとつだと考えられる.おもしろいことに,嗅覚皮質の第1層に存在する抑制性ニューロンは,第2層から第3層に存在する興奮性ニューロンよりもはるかに多くの僧帽細胞から入力を受け取っていた.第2層から第3層の抑制性ニューロンは僧帽細胞からの入力をほとんどうけていなかった.これは,第1層の抑制性ニューロンが広域の抑制を提供する一方,第2層から第3層の抑制性ニューロンが局所的なフィードバック抑制を提供するというモデルを支持した7).
2)広域からの収斂:調べた3つの領域に共通して,嗅覚皮質の狭い局所的な領域に嗅球の全域からの入力が集約されていた.これはほかの一次感覚野(たとえば,体性感覚野)が末梢の位置情報を大脳にいたるまでおおむね保存しているのと対照的であった.同様の“点対点の投射関係がない”という結論は以前から多くの研究で主張されていたことであるが,この研究は標識の出発点となる最小でわずか2~3個の細胞への入力を可視化できるほど高い空間分解能をもち,しかも,神経接続を直接的に解析している点で先行研究の結論を強く補強するものとなった.
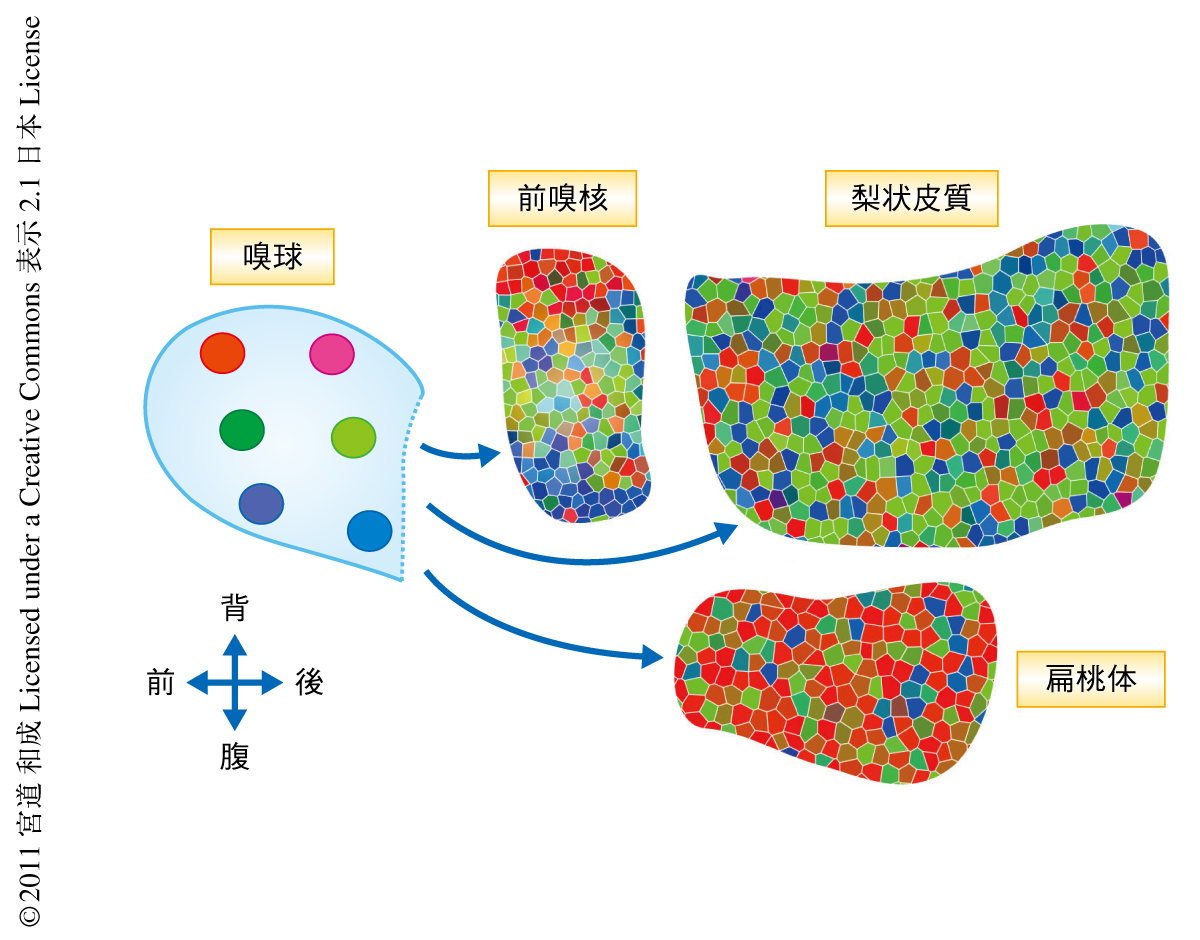
3)接続様式の相違:以上の共通性にもかかわらず,異なる嗅覚皮質は嗅球からの入力様式に顕著な違いがあった(図3).定量的な解析の結果,嗅球の背腹軸と前嗅核の背腹軸とのあいだにはゆるやかな位置の対応関係が認められた.すなわち,嗅球背側の糸球は前嗅核の背側に入力を送る確率が腹側よりも有意に高かった.これは,前嗅核の細胞が糸球の組合せを選ぶとき1000種類すべてのチャネルを均等に選んでいるわけではなく,嗅球の背腹軸にそった匂い情報の質的な相違を反映させるかたちで情報を処理していることを示唆していた.一方,最大の嗅覚皮質である梨状皮質は嗅球の広域から均等に情報を受け取っており,コンピューターシミュレーションを用いた解析によってもランダムな接続様式とは区別できなかった.これは,特定の匂いに反応する細胞は梨状皮質にランダムに分布しているとする最近の電気生理学的な知見8) に解剖学的な基盤をあたえるもので,梨状皮質は嗅覚系の“連合野”として機能するとの仮説を支持した.興味深いことに,扁桃体の神経核は嗅球の背側に由来する入力を腹側に由来する入力よりも多く受け取っていた.近年,マウス嗅球の背側領域は外敵や腐敗臭に対する忌避反応を担っていることが報告されているが9),扁桃体の神経核はこのような生得的に決まった情報を優先して処理するように配線されているのかもしれない.
以上の知見を,嗅覚系の研究の進んだモデル生物ショウジョウバエと比較してみるのは有意義である.ショウジョウバエの嗅覚系は進化的な起源を共有しないにもかかわらず驚くほど哺乳類のそれと酷似している.ショウジョウバエの嗅覚2次ニューロンは哺乳類と同様に単一の糸球からそれぞれ情報を受け取りキノコ体と側角という主要な嗅覚中枢に入力する.2次ニューロンの軸索を高解像度で追跡した結果から,生得的な嗅覚反応にかかわる側角では2次ニューロンの種類ごとに一定の領域に整然と軸索が投射されているのに対し,嗅覚の連合学習にかかわるキノコ体ではそのような生得的に定まった様式がみられない10).したがって,昆虫から哺乳類にいたるまで嗅覚中枢には共通の原理があるように思われる.すなわち,連合学習にかかわる領域は匂い地図から非選択的に広範な情報を抽出できるよう配線されているのに対し,生得的に意味づけられた情報を扱う領域はあらかじめ決められたセットの入力を優先的に受け取るようプログラムされているのではないだろうか.
ここで紹介したトランスシナプス標識法は,嗅覚系にかぎらずマウスの神経系において神経接続の地図を作製するための一般的な手法となりうるものである.今後は,標識の出発点となる細胞の種類を定めるCreリコンビナーゼを発現するトランスジェニックマウスにくふうをこらすことによって,神経回路の解析を精緻化するのみならず,特定の情報処理に特化した神経回路に焦点をあわせていきたい.たとえば,あたえた刺激に強く反応する脳細胞だけをCreリコンビナーゼを用いて捕捉することで,その細胞に入力するシナプス前細胞の分布やその可塑性を追跡できるようになるかもしれない.また,標識の出発点となる細胞に遺伝学的な操作を施すことで,任意の遺伝子が欠損した場合に神経回路がどのように乱されるのかを研究するのもおもしろい.このような系の発展は,単に情報が神経回路をどう流れるかという研究にとどまらず,神経回路が形成され機能する分子機構を研究するのにも大いに役立つことになるだろう.
略歴:2006年 東京大学大学院理学系研究科 修了(理学博士),同年より米国Stanford大学 博士研究員(Liqun Luo研究室).
研究テーマ:分子生物学的な手法を用いた脳神経回路の形成と機能の解析.
抱負:ニューロンの接続様式ばかり研究していたら自分の社会的接続があちこち切れてしまいました(涙).今年は梨状皮質のニューロンのように広範な入力を集め有用な出力を返せるよう精進いたします.
© 2011 宮道 和成 Licensed under CC 表示 2.1 日本
(米国Stanford大学Department of Biology)
email:宮道 和成
DOI: 10.7875/first.author.2011.019
Cortical representations of olfactory input by trans-synaptic tracing.
Kazunari Miyamichi, Fernando Amat, Farshid Moussavi, Chen Wang, Ian Wickersham, Nicholas R. Wall, Hiroki Taniguchi, Bosiljka Tasic, Z. Josh Huang, Zhigang He, Edward M. Callaway, Mark A. Horowitz, Liqun Luo
Nature, 472, 191-196 (2011)
要 約
嗅球には嗅覚受容体の種類に対応した約1000対の糸球が分布し,同じ受容体を発現する嗅覚ニューロンはそのうち特定の1対に対し軸索を投射する.嗅上皮でどの嗅覚ニューロンが活性化されたかという匂い分子の情報は,嗅球の表面ではどの糸球が活性化されたかという位置情報,すなわち,匂い地図へと変換される.この匂い地図が嗅覚皮質でどのように展開されているのかは未解明の重要な問題である.この研究では,狂犬病ウイルスを用いた逆行性のトランスシナプス標識法を改良してウイルスをはじめに感染させた細胞の位置,細胞種,および,概数を遺伝学的に制御できるようにした.この手法により嗅覚皮質の個々のニューロンは嗅球の広い範囲に分布する複数の糸球から僧帽細胞を介して入力を受け取っていることが明らかになった.また,嗅覚皮質の領域により嗅球からの入力様式には相違があり,たとえば,扁桃体は嗅球の背側領域からの入力を優先的にうけるのに対し,梨状皮質への入力には明白なかたよりはみられなかった.これらの違いは,それぞれの皮質領域が先天的な匂いの偏好性や匂いに関する連想記憶といった異なる機能を担うことを反映しているのかもしれない.ここに報告したトランスシナプス標識法はマウスの神経系において神経接続の地図を作製するための一般的な手法となりうるものである.
はじめに
脳の機能は相互に複雑にからみあったニューロンのネットワークの生み出す時空間的な活動電位のパターンに担保されている.神経回路を正確に記述することはそこで行われる情報処理の原理を理解する第一歩である.局所的な回路はそれぞれの細胞の樹状突起や軸索を丹念に追跡することで予測でき,脳切片の電気生理学な手法による解析により検証できる.さらには,電子顕微鏡による高解像度の3次元再構成像が得られれば完全な接続様式の理解へとつながるだろう.一方,長距離の軸索投射による回路を正確に記述するのはきわめて困難である.多くの手法は低解像度で定性的な軸索投射を記述するにすぎず,離れた脳領域のどの細胞とどの細胞とが接続しているのかはわからない.このような状況で,脳の異なる領域が協調的に情報処理する過程を理解するのは不可能である.この研究では,シナプスをこえて移動する狂犬病ウイルス変異体を用いてマウス脳の任意の領域の任意の細胞種に限定的にウイルスを感染させ,その細胞に入力を送っている細胞(前シナプス細胞)のみを選択的に蛍光タンパク質で可視化する手法を開発した.この手法を用いることで,これまで困難だった長距離の軸索投射を介する神経接続を定量的に記述することができた.この手法の応用としてマウスの嗅覚系に着目し,嗅覚皮質の異なる領域および異なる細胞種から出発して嗅球の僧帽細胞を標識しその空間分布を3次元再構成して解析した.
1.狂犬病ウイルスを用いたトランスシナプス標識法
狂犬病ウイルスは自然のつくりだしたすぐれたトランスシナプストレーサーであるが問題もあった.このウイルスは末梢組織に侵入すると軸索の末端に効率的に取り込まれ,細胞体まで逆行性に輸送されてそこで自己複製したのち,シナプスをへて上流のニューロンへとさかのぼることで脳全体に広がり,やがて個体を死にいたらしめる.神経回路を解析するツールとしての第1の問題はウイルスの病原性である.第2の問題は,ウイルスが無制限に広がってしまうのでウイルスが検出された細胞がはじめに感染させた標識の出発点となる細胞と直接的に接続していたのか,それとも,2段階以上のシナプスをへて間接的につながっていたのかを区別できないという点である.
数年前,これらの問題を解決する画期的な狂犬病ウイルス変異体が作製された1).まず,狂犬病ウイルスのゲノムからウイルスの構成に必須の膜タンパク質(G)をコードする遺伝子を除き,代わりに,赤色蛍光タンパク質mCherryの遺伝子を挿入した変異型ウイルスゲノムが作製された.つぎにこれをトリ由来のEnvAを発現する培養細胞に導入し,ゲノムはG遺伝子を欠損した狂犬病ウイルスであるが外殻はトリのウイルスに偽型された変異体をつくりだしたのである.この変異体ウイルスはもはや哺乳類の細胞には感染できず,仮に感染しても増えることはない.しかし,標的の細胞にEnvAの受容体であるTVAを遺伝学的に強制発現すればウイルスを感染させることができ,さらに同じ細胞に狂犬病ウイルスの膜タンパク質Gを強制発現すれば狂犬病ウイルスのゲノムが相補されその細胞にかぎって機能的なウイルス粒子が再構成される.再構成されたウイルスは前シナプス細胞にシナプスをこえて感染しmCherryによりその細胞を標識する.しかし,前シナプス細胞は膜タンパク質Gを発現していないのでウイルスはこれ以上は広がることができず,はじめに感染させた標識の出発点となる細胞から1段階のシナプスを移動したところで止まる.このようにして,ウイルスの病原性と,多段階の移動により接続様式の解析にあいまいさがもち込まれることの両者は同時に解決されたのである.
過去数年の課題は,いかにして実験動物の脳の標的細胞(少数であるほうが好ましい)にTVAと膜タンパク質Gとを選択的に発現させるかということであった.2010年後半になって,複数の研究室がそれぞれの生物学的な興味にあわせてさまざまな手法を発表している.たとえば,電気生理学的な手法を用いて脳表層の単一細胞にTVAと膜タンパク質Gを強制発現させることでその細胞への神経接続が解析されている2).この手法は1細胞の解像度をもつ点で画期的だが脳表層にしか使えない.特定の筋肉に接続している運動神経に特異的にTVAと膜タンパク質Gとを発現させる方法も編み出されている3).美しい手法だが筋肉のようにほかの神経回路と物理的に離れている場合にしか使えない.同様の手法は網膜の神経回路の解析にもみごとに利用されている4)(新着論文レビュー でも掲載).
この研究では,マウス遺伝学とウイルスベクターとを組み合わせてTVAと膜タンパク質Gとを脳の任意の領域の任意の細胞種に導入できるようにし,さらに,導入される細胞の概数も制御可能とした(図1).実験動物は2種類のトランスジェニックマウスを掛け合わせて作製した.ひとつは,任意のプロモーターから薬剤誘導の可能なCreリコンビナーゼを発現する.もうひとつは,すべての細胞で転写活性のあるCAGプロモーターから転写因子tTA2を発現するが,loxP-終止コドン-loxPカセットにより翻訳が遮断されている.薬剤を適量あたえることでCreリコンビナーゼを発現する細胞の一部で組換えが起こってこのカセットが取り除かれtTA2が発現する.つぎに,脳の目的の領域にアデノ随伴ウイルスベクターを用いてヒストン-GFP融合タンパク質の遺伝子,TVA遺伝子,狂犬病ウイルスG遺伝子の3つの遺伝子を定位固定して導入する.これら3つの遺伝子産物はtTA2に駆動されるTREプロモーターによって転写され,2Aペプチドにより単一のmRNAから同量だけ翻訳される.このアデノ随伴ウイルスベクターは導入された場所で局所的に感染するので標的の領域を細かく設定することができる.最後に,同じ標的の領域にさきに述べた狂犬病ウイルス変異体を導入することでトランスシナプス標識が開始される.このように,標識の出発点となる細胞の種類はCreリコンビナーゼを駆動するプロモーターを選ぶことで,概数は薬剤の量を調整することで,そして,標的の領域はアデノ随伴ウイルスベクターを定位固定して導入することで,制御することができた.
大脳皮質における予備実験によりこの系が機能し,標的の領域に限局した少数の細胞から出発して数百~数千のシナプス前細胞がmCherryにより標識されることが確認された.種々の対照実験により,このトランスシナプス標識はアデノ随伴ウイルスベクターに完全に依存しており,100%逆行性であって単に標識の出発点となる細胞の近くを通過している軸索には取り込まれない(シナプスの接続を経由する必要がある)ことを確認した.
2.嗅球から嗅覚皮質への神経の接続様式
嗅覚系は視覚系に比べて理解が遅れていたが,1991年に嗅覚受容体遺伝子が発見されると5),急速に研究が進展した.マウスには1000種類をこえる嗅覚受容体遺伝子が存在し,個々の嗅覚ニューロンはそのうち1種類のみを相互排他的に発現する(図2).同一の嗅覚受容体を発現する数千の嗅覚ニューロンは嗅球において特定の糸球に軸索を収斂させる.このようにして,嗅上皮で匂い分子がどの受容体に結合したかという情報は嗅球ではどの糸球が活動したかという2次元の位置情報(匂い地図)へと変換される6).嗅球に存在する2次ニューロンである僧帽細胞は樹状突起を単一の糸球へ伸ばし,1種類の嗅覚ニューロンから直接入力を受け取ると軸索をはるか嗅覚皮質へと伸ばし複数の領域に情報を送る.しかし,その接続様式に関してはよくわかっていない.
この研究では,前嗅核,梨状皮質,扁桃体のそれぞれ局所的な領域の数個から数十個の細胞を標識の出発点とし,それらの細胞に僧帽細胞を介して入力を送る糸球の位置を嗅球の連続切片の3次元再構成アルゴリズムにより定量的に解析した.その結果は,嗅球から嗅覚皮質への接続に関する3つの基本的な原理として要約することができた.
1)統合:調べた3つの領域に共通して,標識の出発点となる細胞の数よりもトランスシナプス標識される僧帽細胞の数,糸球の数のほうがはるかに多かった.この結果は,複数の糸球に由来する情報が嗅覚皮質では個々の細胞レベルで統合されていることを示すものであった.平均すると少なくとも4種類の糸球に由来する情報がひとつの細胞に集約されることになるが,1000種類のチャネルから4種類を選ぶ組合せだけを考えても400億をこえマウスのすべての脳細胞の数を凌駕してしまう.したがって,嗅覚皮質の細胞は可能な糸球の組合せのごくごく一部を実現しているにすぎないのだが,どのようなしくみで糸球の組み合わせを選び取るのか,それは経験や学習によって変化していくものなのか,などさまざまな疑問が残されている.いずれにせよ,この統合の原理は嗅球で糸球の組合せによって表現されていた匂い情報が嗅覚皮質で分析される基盤のひとつだと考えられる.おもしろいことに,嗅覚皮質の第1層に存在する抑制性ニューロンは,第2層から第3層に存在する興奮性ニューロンよりもはるかに多くの僧帽細胞から入力を受け取っていた.第2層から第3層の抑制性ニューロンは僧帽細胞からの入力をほとんどうけていなかった.これは,第1層の抑制性ニューロンが広域の抑制を提供する一方,第2層から第3層の抑制性ニューロンが局所的なフィードバック抑制を提供するというモデルを支持した7).
2)広域からの収斂:調べた3つの領域に共通して,嗅覚皮質の狭い局所的な領域に嗅球の全域からの入力が集約されていた.これはほかの一次感覚野(たとえば,体性感覚野)が末梢の位置情報を大脳にいたるまでおおむね保存しているのと対照的であった.同様の“点対点の投射関係がない”という結論は以前から多くの研究で主張されていたことであるが,この研究は標識の出発点となる最小でわずか2~3個の細胞への入力を可視化できるほど高い空間分解能をもち,しかも,神経接続を直接的に解析している点で先行研究の結論を強く補強するものとなった.
3)接続様式の相違:以上の共通性にもかかわらず,異なる嗅覚皮質は嗅球からの入力様式に顕著な違いがあった(図3).定量的な解析の結果,嗅球の背腹軸と前嗅核の背腹軸とのあいだにはゆるやかな位置の対応関係が認められた.すなわち,嗅球背側の糸球は前嗅核の背側に入力を送る確率が腹側よりも有意に高かった.これは,前嗅核の細胞が糸球の組合せを選ぶとき1000種類すべてのチャネルを均等に選んでいるわけではなく,嗅球の背腹軸にそった匂い情報の質的な相違を反映させるかたちで情報を処理していることを示唆していた.一方,最大の嗅覚皮質である梨状皮質は嗅球の広域から均等に情報を受け取っており,コンピューターシミュレーションを用いた解析によってもランダムな接続様式とは区別できなかった.これは,特定の匂いに反応する細胞は梨状皮質にランダムに分布しているとする最近の電気生理学的な知見8) に解剖学的な基盤をあたえるもので,梨状皮質は嗅覚系の“連合野”として機能するとの仮説を支持した.興味深いことに,扁桃体の神経核は嗅球の背側に由来する入力を腹側に由来する入力よりも多く受け取っていた.近年,マウス嗅球の背側領域は外敵や腐敗臭に対する忌避反応を担っていることが報告されているが9),扁桃体の神経核はこのような生得的に決まった情報を優先して処理するように配線されているのかもしれない.
以上の知見を,嗅覚系の研究の進んだモデル生物ショウジョウバエと比較してみるのは有意義である.ショウジョウバエの嗅覚系は進化的な起源を共有しないにもかかわらず驚くほど哺乳類のそれと酷似している.ショウジョウバエの嗅覚2次ニューロンは哺乳類と同様に単一の糸球からそれぞれ情報を受け取りキノコ体と側角という主要な嗅覚中枢に入力する.2次ニューロンの軸索を高解像度で追跡した結果から,生得的な嗅覚反応にかかわる側角では2次ニューロンの種類ごとに一定の領域に整然と軸索が投射されているのに対し,嗅覚の連合学習にかかわるキノコ体ではそのような生得的に定まった様式がみられない10).したがって,昆虫から哺乳類にいたるまで嗅覚中枢には共通の原理があるように思われる.すなわち,連合学習にかかわる領域は匂い地図から非選択的に広範な情報を抽出できるよう配線されているのに対し,生得的に意味づけられた情報を扱う領域はあらかじめ決められたセットの入力を優先的に受け取るようプログラムされているのではないだろうか.
おわりに
ここで紹介したトランスシナプス標識法は,嗅覚系にかぎらずマウスの神経系において神経接続の地図を作製するための一般的な手法となりうるものである.今後は,標識の出発点となる細胞の種類を定めるCreリコンビナーゼを発現するトランスジェニックマウスにくふうをこらすことによって,神経回路の解析を精緻化するのみならず,特定の情報処理に特化した神経回路に焦点をあわせていきたい.たとえば,あたえた刺激に強く反応する脳細胞だけをCreリコンビナーゼを用いて捕捉することで,その細胞に入力するシナプス前細胞の分布やその可塑性を追跡できるようになるかもしれない.また,標識の出発点となる細胞に遺伝学的な操作を施すことで,任意の遺伝子が欠損した場合に神経回路がどのように乱されるのかを研究するのもおもしろい.このような系の発展は,単に情報が神経回路をどう流れるかという研究にとどまらず,神経回路が形成され機能する分子機構を研究するのにも大いに役立つことになるだろう.
文 献
- Wickersham, I. R., Lyon, D. C., Barnard, R. J. et al.: Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron, 53, 639-647 (2007)[PubMed]
- Marshel, J. H., Mori, T., Nielsen, K. J. et al.: Targeting single neuronal networks for gene expression and cell labeling in vivo. Neuron, 67, 562-574 (2010)[PubMed]
- Stepien, A. E., Tripodi, M., & Arber, S.: Monosynaptic rabies virus reveals premotor network organization and synaptic specificity of cholinergic partition cells. Neuron, 68, 456-472 (2010)[PubMed]
- Yonehara, K., Balint, K., Noda, M. et al.: Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature, 469, 407-410 (2011)[PubMed] [新着論文レビュー]
- Buck, L. & Axel, R.: A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell, 65, 175-187 (1991)[PubMed]
- Sakano, H.: Neural map formation in the mouse olfactory system. Neuron, 67, 530-542 (2010)[PubMed]
- Stokes, C. C. & Isaacson, J. S.: From dendrite to soma: dynamic routing of inhibition by complementary interneuron microcircuits in olfactory cortex. Neuron, 67, 452-465 (2010)[PubMed]
- Stettler, D. D. & Axel, R.: Representations of odor in the piriform cortex. Neuron, 63, 854-864 (2009)[PubMed]
- Kobayakawa, K., Kobayakawa, R., Matsumoto, H. et al.: Innate versus learned odour processing in the mouse olfactory bulb. Nature, 450, 503-508 (2007)[PubMed]
- Jefferis, G. S., Potter, C. J., Chan, A. M. et al.: Comprehensive maps of Drosophila higher olfactory centers: spatially segregated fruit and pheromone representation. Cell, 128, 1187-1203 (2007)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院理学系研究科 修了(理学博士),同年より米国Stanford大学 博士研究員(Liqun Luo研究室).
研究テーマ:分子生物学的な手法を用いた脳神経回路の形成と機能の解析.
抱負:ニューロンの接続様式ばかり研究していたら自分の社会的接続があちこち切れてしまいました(涙).今年は梨状皮質のニューロンのように広範な入力を集め有用な出力を返せるよう精進いたします.
© 2011 宮道 和成 Licensed under CC 表示 2.1 日本