抑制性入力の空間的に非対称的な再編成が運動方向に選択性を示す神経回路を形成する
米原圭祐・Botond Roska
(スイスFriedrich Miescher Institute for Biomedical Research,Neural Circuit Laboratories)
email:米原圭祐
DOI: 10.7875/first.author.2011.017
Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit.
Keisuke Yonehara, Kamill Balint, Masaharu Noda, Georg Nagel, Ernst Bamberg, Botond Roska
Nature, 469, 407-410 (2011)
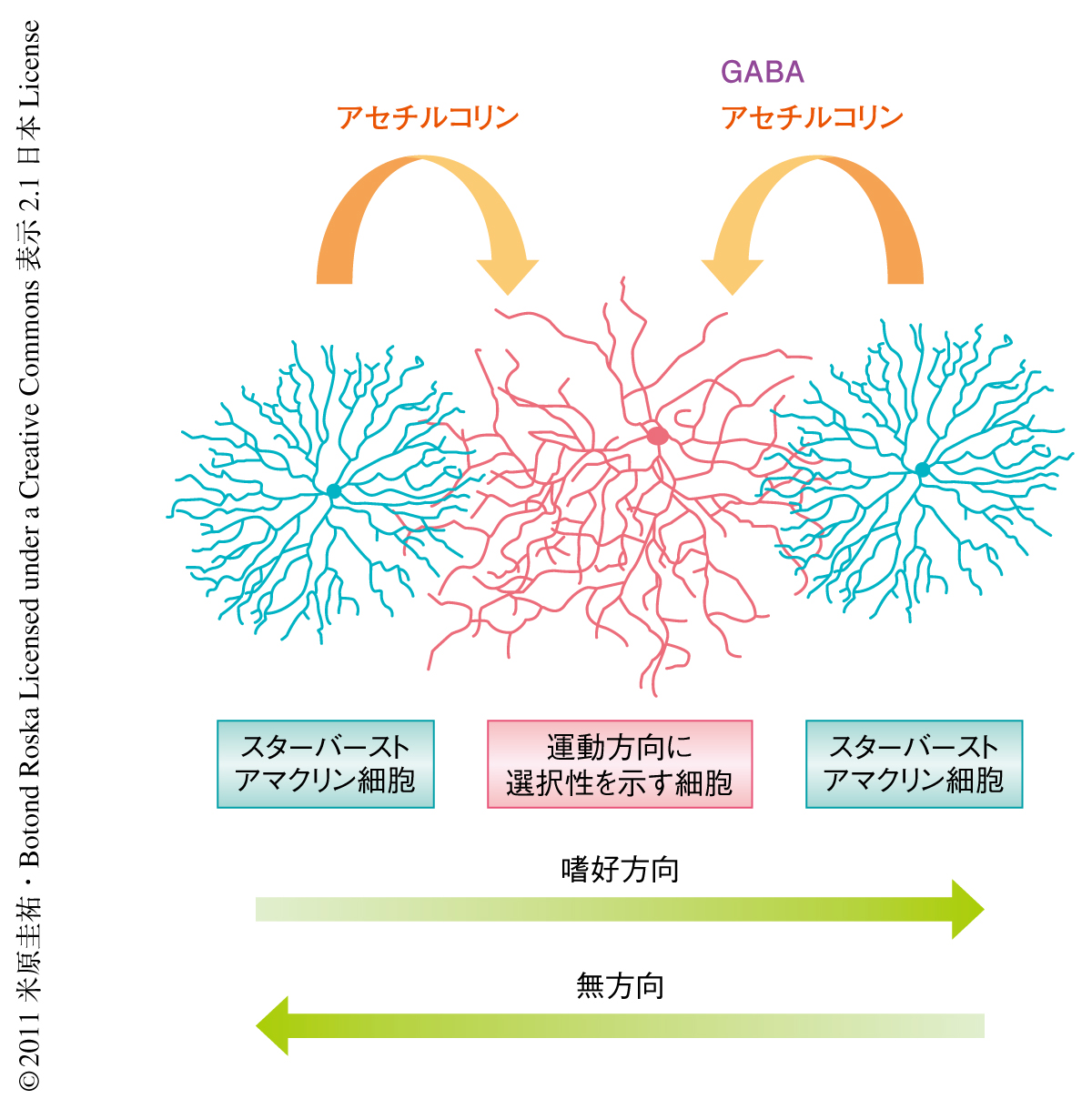
神経結合における空間的な非対称性は神経回路が情報処理を行うための構造的および機能的な基盤となる.運動方向に選択性を示す網膜の神経節細胞において鍵となる回路モジュールはスターバーストアマクリン細胞からうける空間的に非対称的な抑制性のシナプス入力であるが,これまで,この入力の非対称性がいつ,どのようにして形成されるのかは不明であった.筆者らは,これを明らかにするため,光遺伝学を用いたシナプス結合強度の空間マッピング,遺伝子改変狂犬病ウイルスを用いた神経回路の標識などを利用し解析を行った.神経節細胞への抑制性入力は生後6日では空間的に対称的であるが,生後8日までには非対称的な状態へと変化することが明らかになった.一方で,スターバーストアマクリン細胞からの興奮性入力は発達期をとおして空間的により対称的なままであった.ニューロンへの抑制性入力が発達期において空間的に対称的な状態から非対称的な状態へと急速にスイッチする事例が示された.
脳に機能的および構造的な左右差があるように,局所の神経回路あるいは個々のニューロンの機能や構造にも空間的な非対称性が存在する.大脳皮質の方位に選択性を示す細胞や網膜の運動方向に選択性を示す細胞などの例が示すように,神経結合の非対称性は視覚情報処理の重要な基盤となる1,2).網膜の運動方向に選択性を示す神経節細胞は,視覚対象が特定の方向(嗜好の方向)に動くときに最大の発火で応答し,逆方向(無方向)に動くときには最小の応答しかしない.この演算処理の基礎となる神経回路は空間的に非対称的な抑制性入力である.運動方向に選択性を示す神経節細胞は無方向をむいているスターバーストアマクリン細胞の突起からGABAを介した抑制性のシナプス入力をうけるが,嗜好の方向をむいている突起からは抑制性入力をうけない3)(図1).光刺激が神経節細胞の受容野を嗜好の方向に横切る場合は光受容体から双極細胞を経由して神経節細胞に興奮性入力が送られ発火することができるが,光刺激が無方向に動く場合にはまず興奮したスターバーストアマクリン細胞から神経節細胞の樹状突起にGABAが放出されるので,この抑制性入力が双極細胞からの興奮性入力を相殺して神経節細胞は発火できなくなる.これまで,空間的に非対称的な抑制性入力が発達期のいつ,どのようにして形成されるかは不明であった.
マウスでは生後10日ごろから神経節細胞が光受容体から双極細胞を介した光応答性の入力をうけるようになり,生後13日ごろに開眼する.生後11~12日のマウスや暗黒下で飼育された動物の網膜も運動方向に選択性を示すことから4,5),神経回路の発達に視覚経験は必要ないことが示唆されてきた.しかし,生後10日以前の網膜は光に応答しないため神経回路の非対称性がどの時期に形成されるのかを解析することは技術的に困難であった.ON中心型の運動方向に選択性を示す神経節細胞は遅い動きによく応答し視運動性の眼球運動の検出器としてはたらく6).この細胞は3つのサブタイプからなり,それぞれが上方向,下方向,鼻方向の嗜好の方向をもつ.筆者らは,以前,上方向に嗜好の方向をもつサブタイプのみが発達期にGFP標識されたノックインマウス(SPIG1-GFPマウス)を作製しており7,8),このノックインマウスを研究に利用した.
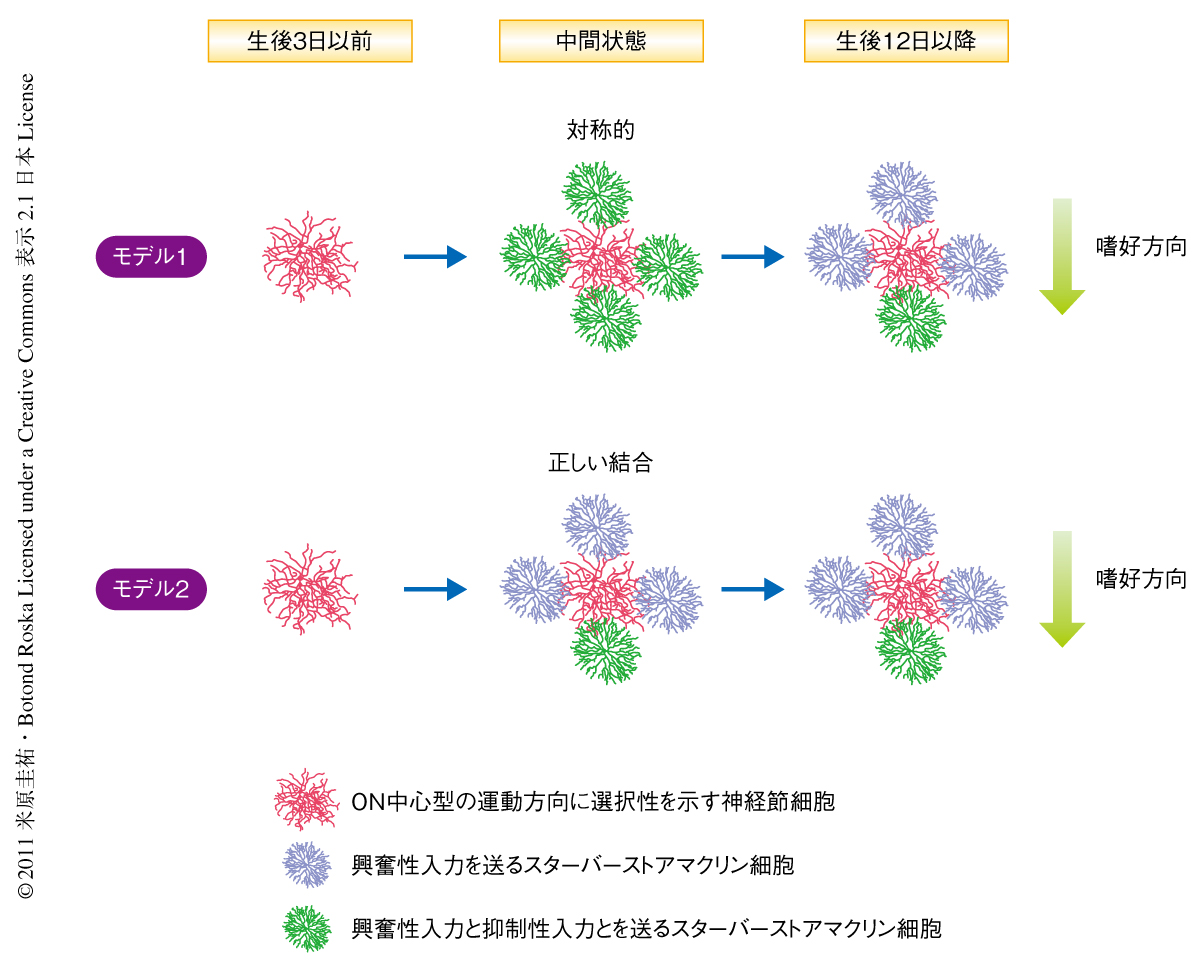
今回,筆者らは,光応答性を獲得する以前(生後1週間前後)のスターバーストアマクリン細胞にチャネルロドプシン2というタンパク質を導入することにより強制的に光応答性を獲得させた.そして,GFP標識された運動方向に選択性を示す細胞から2光子イメージングとパッチクランプ法で記録をとりながら,前シナプス細胞であるスターバーストアマクリン細胞を光パターンで刺激することにより,シナプス結合強度の空間地図が発達期に変化していくようすを調べた.抑制性入力の非対称性の形成機構として,いちど形成された空間的に対称的な入力がのちに再編成されて非対称的となる可能性,あるいは,非対称的な入力がはじめから形成される可能性の2つが考えられたので,どちらのモデルが正しいかを明らかにすることがこの研究の目的であった(図2).
光照射すると細胞に陽イオンを通すチャネルロドプシン2というタンパク質をニューロンに発現させると光刺激により細胞活動を制御することができる.開眼するまえのSPIG1-GFPマウスのスターバーストアマクリン細胞に特異的にチャネルロドプシン2を導入するため,まずSPIG1-GFPマウスをChAT-Creマウスと交配させた.ChAT-Creマウスの網膜ではスターバーストアマクリン細胞に特異的にCreリコンビナーゼが発現する.Creリコンビナーゼに依存的にチャネルロドプシン2と赤色蛍光タンパク質DsRed2を共発現するアデノ随伴ウイルスベクターを作製した.野生型チャネルロドプシン2と比較して約50倍も光感受性の高い改良型チャネルロドプシン2を用いたため9),光刺激にはオーバーヘッドプロジェクターを用いることができた.
生後0日のSPIG1-GFP×ChAT-Creマウスの網膜にウイルスベクターを感染させると,生後6日以降にスターバーストアマクリン細胞に特異的にチャネルロドプシン2とDsRed2が強く発現することを確認した.生後8日に電位固定法によりチャネルロドプシン2発現スターバーストアマクリン細胞の電流応答を測定した.光受容体からの興奮性入力経路を薬剤で遮断しても光応答性の内向き電流が測定されたことから,電流はチャネルロドプシン2に由来することが確認された.また,電流固定法により膜電位の変化を測定したところ,光強度を強めると膜電位もより大きく変化することがわかった.一定の光刺激強度においては細胞体のDsRed2の発現強度と膜電位の変化量とが正の相関を示した.これらの観察から,細胞のチャネルロドプシン2の発現量と光刺激の強度とがわかれば細胞の膜電位の変化量を予想できることが示された.
2光子イメージングと電気生理学的な手法とを組み合わせてGFP標識されたON中心型の運動方向に選択性を示す神経節細胞に対して記録を行うと,光刺激に応答して興奮性シナプス後電流と抑制性シナプス後電流が測定された.興奮性電流はニコチン性アセチルコリン受容体拮抗薬であるクラーレにより遮断され,抑制性電流はGABA受容体拮抗薬であるピクロトキシンにより遮断された.双極細胞からの入力を遮断するグルタミン酸受容体拮抗薬は効果を示さなかった.微小興奮性シナプス後電流もやはりクラーレにより遮断された.これらの結果から,ON中心型の運動方向に選択性を示す神経節細胞はスターバーストアマクリン細胞の光刺激に応じてGABAを介した抑制性入力とアセチルコリンを介した興奮性入力とをうけることが示された.
生後の早い時期からON中心型の運動方向に選択性を示す神経節細胞がスターバーストアマクリン細胞から直接にシナプス入力をうけていることが,シナプス結合強度の空間マッピングを行ううえでの前提条件となる.このことを確かめるため,G遺伝子を欠損した狂犬病ウイルスを用いた単シナプス逆行性の神経回路の標識を行った10).G遺伝子とは狂犬病ウイルスがシナプスを逆行性に(前シナプス細胞に)飛び越えるため必要な遺伝子である.そのため,G遺伝子を欠損した狂犬病ウイルスの単独では最初の細胞には感染することができるが,その細胞からシナプスを飛び越えてつぎの細胞に感染を広げることができない.しかし,ウイルス感染細胞に外部からG遺伝子を相補してやればシナプスをいちどだけ飛び越えさせることができる.
G遺伝子の相補のためG遺伝子を組み込んだ複製欠損ヘルペスウイルスを作製した.赤色蛍光タンパク質であるmCherryを組み込んだG遺伝子欠損型狂犬病ウイルスと,G遺伝子を組み込んだ複製欠損ヘルペスウイルスを混合し,生後1日目,ON中心型の運動方向に選択性を示す神経節細胞の軸索投射先である中脳の副視覚系内側核に注入した.生後6日に網膜を取り出して観察したところ,GFP陽性の神経節細胞がmCherryにより標識され,さらに,それらをとりかこむスターバーストアマクリン細胞も同様にmCherryにより標識されていた.G遺伝子欠損型狂犬病ウイルスのみを注入した場合は神経節細胞のみが標識された.ゆえに,ヘルペスウイルスと狂犬病ウイルスが二重感染した細胞においてG遺伝子の相補が成功し,それらの細胞を起点として狂犬病ウイルスが前シナプス細胞に逆行性に感染したものと考えられた.なお,この場合,G遺伝子はアマクリン細胞や双極細胞では発現していないので,狂犬病ウイルスがシナプスを2回にわたり飛び越えることはない.以上の結果から,生後6日目ですでにスターバーストアマクリン細胞がON中心型の運動方向に選択性を示す神経節細胞に直接にシナプス結合していることが示された.
神経節細胞とスターバーストアマクリン細胞とのあいだのシナプス結合強度の空間分布を調べるため,GFP標識された神経節細胞から興奮性シナプス後電流および抑制性シナプス後電流の記録をとりながら,チャネルロドプシン2を発現したスターバーストアマクリン細胞を光パターンで刺激した.記録細胞をとりかこむような8つの扇形をひとつずつ光パターンで刺激した.生後6日の時点では抑制性入力は空間的に対称的であった.記録細胞の背側と腹側の網膜を光刺激した場合に記録された抑制性入力は同じ程度であった.しかし,生後8日では腹側の網膜を光刺激した場合により大きな抑制性入力が記録された(GFP陽性の神経節細胞の無方向は,腹側から背側へむかう方向である).興味深いことに,スターバーストアマクリン細胞からの興奮性入力は発達期をとおして空間的により対称的なままであった.アデノ随伴ウイルスベクターの網膜への感染が空間的に一様でない可能性があったので,記録細胞の周囲のDsRed2発現細胞の数,および,DsRed2の蛍光強度(スターバーストアマクリン細胞の膜電位の変化量と相関する)を8つの扇形ごとに測定して記録電流の補正を行ったが,いずれの補正も結果には影響しなかった.これらの結果から,スターバーストアマクリン細胞から運動方向に選択性を示す神経節細胞への抑制性入力は生後6日では空間的に対称的であるが,生後8日までには背腹軸にそって非対称的になること,また,興奮性入力は発達期をとおして対称的なままであることが明らかになった.
ON中心型の運動方向に選択性を示す神経節細胞には異なる嗜好の方向(上方向,下方向,鼻方向)をもった3つのサブタイプがあるので(今回,解析したサブタイプは上方向),それぞれのサブタイプが特異的な方向から抑制性入力をうけるようにする機構が存在することになる.スターバーストアマクリン細胞の側からみてみれば,異なる方向をむいている突起は異なるサブタイプの運動方向に選択性を示す神経節細胞に抑制性入力を送っていることになる.このような高度に特異的な神経結合が視覚経験に非依存的,そして,2日間という短期間のうちにどのような分子機構あるいは細胞機構によって形成されるのかは依然として謎につつまれており,今後,明らかにしていきたい.なお,筆者らと同様の結果を報告する論文がほぼ同時に出版されたことからもわかるように11),非常に競争の激しい研究分野である.また,双極細胞から運動方向に選択性を示す神経節細胞への興奮性入力も方向選択性をもつことが知られているが,これを可能にする神経回路の機構は依然として不明である.網膜の運動方向に選択性を示す神経回路の発達機構を研究することが,大脳皮質の方位に選択性を示す細胞などがもつ神経結合の空間的な非対称性の形成機構の基本原理を明らかにすることにつながると期待している.
略歴:2008年 総合研究大学院大学生命科学研究科 修了,同年 基礎生物学研究所 博士研究員,2009年 スイスFriedrich Miescher Institute for Biomedical Research博士研究員を経て,2010年より同EMBO Long-Term Fellow.
研究テーマ:メゾスコピック神経回路の機能と構造およびそれらの発達の解明.
抱負:2光子イメージング,光遺伝学,パッチクランプ,ウイルスによる回路追跡,Ca2+イメージング,マウス遺伝学,分子生物学などの先端技術を組み合わせた研究を行いたい.
Botond Roska
スイスFriedrich Miescher Institute for Biomedical Researchにてシニアグループリーダー.
© 2011 米原圭祐・Botond Roska Licensed under CC 表示 2.1 日本
(スイスFriedrich Miescher Institute for Biomedical Research,Neural Circuit Laboratories)
email:米原圭祐
DOI: 10.7875/first.author.2011.017
Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit.
Keisuke Yonehara, Kamill Balint, Masaharu Noda, Georg Nagel, Ernst Bamberg, Botond Roska
Nature, 469, 407-410 (2011)
要 約
神経結合における空間的な非対称性は神経回路が情報処理を行うための構造的および機能的な基盤となる.運動方向に選択性を示す網膜の神経節細胞において鍵となる回路モジュールはスターバーストアマクリン細胞からうける空間的に非対称的な抑制性のシナプス入力であるが,これまで,この入力の非対称性がいつ,どのようにして形成されるのかは不明であった.筆者らは,これを明らかにするため,光遺伝学を用いたシナプス結合強度の空間マッピング,遺伝子改変狂犬病ウイルスを用いた神経回路の標識などを利用し解析を行った.神経節細胞への抑制性入力は生後6日では空間的に対称的であるが,生後8日までには非対称的な状態へと変化することが明らかになった.一方で,スターバーストアマクリン細胞からの興奮性入力は発達期をとおして空間的により対称的なままであった.ニューロンへの抑制性入力が発達期において空間的に対称的な状態から非対称的な状態へと急速にスイッチする事例が示された.
はじめに
脳に機能的および構造的な左右差があるように,局所の神経回路あるいは個々のニューロンの機能や構造にも空間的な非対称性が存在する.大脳皮質の方位に選択性を示す細胞や網膜の運動方向に選択性を示す細胞などの例が示すように,神経結合の非対称性は視覚情報処理の重要な基盤となる1,2).網膜の運動方向に選択性を示す神経節細胞は,視覚対象が特定の方向(嗜好の方向)に動くときに最大の発火で応答し,逆方向(無方向)に動くときには最小の応答しかしない.この演算処理の基礎となる神経回路は空間的に非対称的な抑制性入力である.運動方向に選択性を示す神経節細胞は無方向をむいているスターバーストアマクリン細胞の突起からGABAを介した抑制性のシナプス入力をうけるが,嗜好の方向をむいている突起からは抑制性入力をうけない3)(図1).光刺激が神経節細胞の受容野を嗜好の方向に横切る場合は光受容体から双極細胞を経由して神経節細胞に興奮性入力が送られ発火することができるが,光刺激が無方向に動く場合にはまず興奮したスターバーストアマクリン細胞から神経節細胞の樹状突起にGABAが放出されるので,この抑制性入力が双極細胞からの興奮性入力を相殺して神経節細胞は発火できなくなる.これまで,空間的に非対称的な抑制性入力が発達期のいつ,どのようにして形成されるかは不明であった.
マウスでは生後10日ごろから神経節細胞が光受容体から双極細胞を介した光応答性の入力をうけるようになり,生後13日ごろに開眼する.生後11~12日のマウスや暗黒下で飼育された動物の網膜も運動方向に選択性を示すことから4,5),神経回路の発達に視覚経験は必要ないことが示唆されてきた.しかし,生後10日以前の網膜は光に応答しないため神経回路の非対称性がどの時期に形成されるのかを解析することは技術的に困難であった.ON中心型の運動方向に選択性を示す神経節細胞は遅い動きによく応答し視運動性の眼球運動の検出器としてはたらく6).この細胞は3つのサブタイプからなり,それぞれが上方向,下方向,鼻方向の嗜好の方向をもつ.筆者らは,以前,上方向に嗜好の方向をもつサブタイプのみが発達期にGFP標識されたノックインマウス(SPIG1-GFPマウス)を作製しており7,8),このノックインマウスを研究に利用した.
今回,筆者らは,光応答性を獲得する以前(生後1週間前後)のスターバーストアマクリン細胞にチャネルロドプシン2というタンパク質を導入することにより強制的に光応答性を獲得させた.そして,GFP標識された運動方向に選択性を示す細胞から2光子イメージングとパッチクランプ法で記録をとりながら,前シナプス細胞であるスターバーストアマクリン細胞を光パターンで刺激することにより,シナプス結合強度の空間地図が発達期に変化していくようすを調べた.抑制性入力の非対称性の形成機構として,いちど形成された空間的に対称的な入力がのちに再編成されて非対称的となる可能性,あるいは,非対称的な入力がはじめから形成される可能性の2つが考えられたので,どちらのモデルが正しいかを明らかにすることがこの研究の目的であった(図2).
1.スターバーストアマクリン細胞に特異的にチャネルロドプシン2を発現させた
光照射すると細胞に陽イオンを通すチャネルロドプシン2というタンパク質をニューロンに発現させると光刺激により細胞活動を制御することができる.開眼するまえのSPIG1-GFPマウスのスターバーストアマクリン細胞に特異的にチャネルロドプシン2を導入するため,まずSPIG1-GFPマウスをChAT-Creマウスと交配させた.ChAT-Creマウスの網膜ではスターバーストアマクリン細胞に特異的にCreリコンビナーゼが発現する.Creリコンビナーゼに依存的にチャネルロドプシン2と赤色蛍光タンパク質DsRed2を共発現するアデノ随伴ウイルスベクターを作製した.野生型チャネルロドプシン2と比較して約50倍も光感受性の高い改良型チャネルロドプシン2を用いたため9),光刺激にはオーバーヘッドプロジェクターを用いることができた.
生後0日のSPIG1-GFP×ChAT-Creマウスの網膜にウイルスベクターを感染させると,生後6日以降にスターバーストアマクリン細胞に特異的にチャネルロドプシン2とDsRed2が強く発現することを確認した.生後8日に電位固定法によりチャネルロドプシン2発現スターバーストアマクリン細胞の電流応答を測定した.光受容体からの興奮性入力経路を薬剤で遮断しても光応答性の内向き電流が測定されたことから,電流はチャネルロドプシン2に由来することが確認された.また,電流固定法により膜電位の変化を測定したところ,光強度を強めると膜電位もより大きく変化することがわかった.一定の光刺激強度においては細胞体のDsRed2の発現強度と膜電位の変化量とが正の相関を示した.これらの観察から,細胞のチャネルロドプシン2の発現量と光刺激の強度とがわかれば細胞の膜電位の変化量を予想できることが示された.
2.スターバーストアマクリン細胞の光刺激に応じて運動方向に選択性を示す神経節細胞は抑制性入力と興奮性入力とをうける
2光子イメージングと電気生理学的な手法とを組み合わせてGFP標識されたON中心型の運動方向に選択性を示す神経節細胞に対して記録を行うと,光刺激に応答して興奮性シナプス後電流と抑制性シナプス後電流が測定された.興奮性電流はニコチン性アセチルコリン受容体拮抗薬であるクラーレにより遮断され,抑制性電流はGABA受容体拮抗薬であるピクロトキシンにより遮断された.双極細胞からの入力を遮断するグルタミン酸受容体拮抗薬は効果を示さなかった.微小興奮性シナプス後電流もやはりクラーレにより遮断された.これらの結果から,ON中心型の運動方向に選択性を示す神経節細胞はスターバーストアマクリン細胞の光刺激に応じてGABAを介した抑制性入力とアセチルコリンを介した興奮性入力とをうけることが示された.
3.スターバーストアマクリン細胞はON中心型の運動方向に選択性を示す神経節細胞と直接にシナプス結合している
生後の早い時期からON中心型の運動方向に選択性を示す神経節細胞がスターバーストアマクリン細胞から直接にシナプス入力をうけていることが,シナプス結合強度の空間マッピングを行ううえでの前提条件となる.このことを確かめるため,G遺伝子を欠損した狂犬病ウイルスを用いた単シナプス逆行性の神経回路の標識を行った10).G遺伝子とは狂犬病ウイルスがシナプスを逆行性に(前シナプス細胞に)飛び越えるため必要な遺伝子である.そのため,G遺伝子を欠損した狂犬病ウイルスの単独では最初の細胞には感染することができるが,その細胞からシナプスを飛び越えてつぎの細胞に感染を広げることができない.しかし,ウイルス感染細胞に外部からG遺伝子を相補してやればシナプスをいちどだけ飛び越えさせることができる.
G遺伝子の相補のためG遺伝子を組み込んだ複製欠損ヘルペスウイルスを作製した.赤色蛍光タンパク質であるmCherryを組み込んだG遺伝子欠損型狂犬病ウイルスと,G遺伝子を組み込んだ複製欠損ヘルペスウイルスを混合し,生後1日目,ON中心型の運動方向に選択性を示す神経節細胞の軸索投射先である中脳の副視覚系内側核に注入した.生後6日に網膜を取り出して観察したところ,GFP陽性の神経節細胞がmCherryにより標識され,さらに,それらをとりかこむスターバーストアマクリン細胞も同様にmCherryにより標識されていた.G遺伝子欠損型狂犬病ウイルスのみを注入した場合は神経節細胞のみが標識された.ゆえに,ヘルペスウイルスと狂犬病ウイルスが二重感染した細胞においてG遺伝子の相補が成功し,それらの細胞を起点として狂犬病ウイルスが前シナプス細胞に逆行性に感染したものと考えられた.なお,この場合,G遺伝子はアマクリン細胞や双極細胞では発現していないので,狂犬病ウイルスがシナプスを2回にわたり飛び越えることはない.以上の結果から,生後6日目ですでにスターバーストアマクリン細胞がON中心型の運動方向に選択性を示す神経節細胞に直接にシナプス結合していることが示された.
4.抑制性入力の空間的な非対称性は生後6日から8日のあいだに獲得される
神経節細胞とスターバーストアマクリン細胞とのあいだのシナプス結合強度の空間分布を調べるため,GFP標識された神経節細胞から興奮性シナプス後電流および抑制性シナプス後電流の記録をとりながら,チャネルロドプシン2を発現したスターバーストアマクリン細胞を光パターンで刺激した.記録細胞をとりかこむような8つの扇形をひとつずつ光パターンで刺激した.生後6日の時点では抑制性入力は空間的に対称的であった.記録細胞の背側と腹側の網膜を光刺激した場合に記録された抑制性入力は同じ程度であった.しかし,生後8日では腹側の網膜を光刺激した場合により大きな抑制性入力が記録された(GFP陽性の神経節細胞の無方向は,腹側から背側へむかう方向である).興味深いことに,スターバーストアマクリン細胞からの興奮性入力は発達期をとおして空間的により対称的なままであった.アデノ随伴ウイルスベクターの網膜への感染が空間的に一様でない可能性があったので,記録細胞の周囲のDsRed2発現細胞の数,および,DsRed2の蛍光強度(スターバーストアマクリン細胞の膜電位の変化量と相関する)を8つの扇形ごとに測定して記録電流の補正を行ったが,いずれの補正も結果には影響しなかった.これらの結果から,スターバーストアマクリン細胞から運動方向に選択性を示す神経節細胞への抑制性入力は生後6日では空間的に対称的であるが,生後8日までには背腹軸にそって非対称的になること,また,興奮性入力は発達期をとおして対称的なままであることが明らかになった.
おわりに
ON中心型の運動方向に選択性を示す神経節細胞には異なる嗜好の方向(上方向,下方向,鼻方向)をもった3つのサブタイプがあるので(今回,解析したサブタイプは上方向),それぞれのサブタイプが特異的な方向から抑制性入力をうけるようにする機構が存在することになる.スターバーストアマクリン細胞の側からみてみれば,異なる方向をむいている突起は異なるサブタイプの運動方向に選択性を示す神経節細胞に抑制性入力を送っていることになる.このような高度に特異的な神経結合が視覚経験に非依存的,そして,2日間という短期間のうちにどのような分子機構あるいは細胞機構によって形成されるのかは依然として謎につつまれており,今後,明らかにしていきたい.なお,筆者らと同様の結果を報告する論文がほぼ同時に出版されたことからもわかるように11),非常に競争の激しい研究分野である.また,双極細胞から運動方向に選択性を示す神経節細胞への興奮性入力も方向選択性をもつことが知られているが,これを可能にする神経回路の機構は依然として不明である.網膜の運動方向に選択性を示す神経回路の発達機構を研究することが,大脳皮質の方位に選択性を示す細胞などがもつ神経結合の空間的な非対称性の形成機構の基本原理を明らかにすることにつながると期待している.
文 献
- Hubel, D.H. & Wiesel, T. N.: Receptive fields, binocular interaction and functional architecture in the cat's visual cortex. J. Physiol., 160, 106-154 (1962)[PubMed]
- Barlow, H. B. & Hill, R. M.: Selective sensitivity to direction of movement in ganglion cells of the rabbit retina. Science, 139, 412-414 (1963)[PubMed]
- Fried, S. I., Munch, T. A. & Werblin, F. S.: Mechanisms and circuitry underlying directional selectivity in the retina. Nature, 420, 411-414 (2002)[PubMed]
- Elstrott, J., Anishchenko, A., Greschner, M. et al.: Direction selectivity in the retina is established independent of visual experience and cholinergic retinal waves. Neuron, 58, 499-506 (2008)[PubMed]
- Chen, M., Weng, S., Deng, Q. et al.: Physiological properties of direction-selective ganglion cells in early postnatal and adult mouse retina. J. Physiol., 587, 819-828 (2009)[PubMed]
- Simpson, J. I.: The accessory optic system. Annu. Rev. Neurosci., 7, 13-41 (1984)[PubMed]
- Yonehara, K., Shintani, T., Suzuki, R. et al.: Expression of SPIG1 reveals development of a retinal ganglion cell subtype projecting to the medial terminal nucleus in the mouse. PLoS One, 3, e1533 (2008)[PubMed]
- Yonehara, K., Ishikane, H., Sakuta, H. et al.: Identification of retinal ganglion cells and their projections involved in central transmission of information about upward and downward image motion. PLoS One, 4, e4320 (2009)[PubMed]
- Bamann, C., Gueta, R., Kleinlogel, S. et al.: Structural guidance of the photocycle of channelrhodopsin-2 by an interhelical hydrogen bond. Biochemistry, 49, 267-278 (2010)[PubMed]
- Wickersham, I. R., Lyon, D. C., Barnard, R. J. et al.: Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron, 53, 639-647 (2007)[PubMed]
- Wei, W., Hamby, A. M., Zhou, K. et al.: Development of asymmetric inhibition underlying direction selectivity in the retina. Nature, 469, 402–406 (2011)[PubMed]
著者プロフィール
略歴:2008年 総合研究大学院大学生命科学研究科 修了,同年 基礎生物学研究所 博士研究員,2009年 スイスFriedrich Miescher Institute for Biomedical Research博士研究員を経て,2010年より同EMBO Long-Term Fellow.
研究テーマ:メゾスコピック神経回路の機能と構造およびそれらの発達の解明.
抱負:2光子イメージング,光遺伝学,パッチクランプ,ウイルスによる回路追跡,Ca2+イメージング,マウス遺伝学,分子生物学などの先端技術を組み合わせた研究を行いたい.
Botond Roska
スイスFriedrich Miescher Institute for Biomedical Researchにてシニアグループリーダー.
© 2011 米原圭祐・Botond Roska Licensed under CC 表示 2.1 日本