神経活動に依存的な新規の遺伝子プロモーターE-SAREによるニューロンと軸索投射の機能的な標識
川島尚之・尾藤晴彦
(東京大学大学院医学系研究科 神経生化学分野)
email:川島尚之,尾藤晴彦
DOI: 10.7875/first.author.2013.109
Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE.
Takashi Kawashima, Kazuo Kitamura, Kanzo Suzuki, Mio Nonaka, Satoshi Kamijo, Sayaka Takemoto-Kimura, Masanobu Kano, Hiroyuki Okuno, Kenichi Ohki, Haruhiko Bito
Nature Methods, 10, 889-895 (2013)
神経活動に依存的な遺伝子プロモーターを使い特定の反応性をもつニューロンを標識する機能的な標識法は,現在の神経科学にとり重要な手法となりつつある.しかしながら,これまでに遺伝子プロモーターの遺伝子工学的な改良は行われておらず,このことがこの手法の発展をさまたげる要因のひとつとなっていた.今回の論文において,筆者らは,前初期遺伝子であるArc遺伝子のエンハンサーであるSARE配列にもとづき,従来よりも発現量を大幅に改良したE-SAREプロモーターの作製に成功した.応用例として,マウスの外側膝状体から1次視覚野に投射する眼入力に特異的な軸索を,生体において観察の可能なかたちで標識することにはじめて成功した.さらには,E-SAREプロモーターの高い発現量を利用して電気生理学的な手法やCa2+イメージング法と組み合わせることにより,これまで長らく不明であった神経活動に依存的な遺伝子プロモーターの発現と神経活動の相関のようすを単一細胞のレベルにおいて明らかにすることにも成功した.E-SAREプロモーターの登場により,今後,機能的な標識法の研究が加速していくことが期待される.
われわれの脳を観察すると同じようにみえるニューロンが整然と並んだ構造をとっているが,ニューロンごとの機能を詳細に観察すると,たとえ解剖学的に同種のニューロンであったとしても,異なる外部刺激または異なる行動様式に対し反応するニューロンが混在している.たとえば,げっ歯類の1次視覚野では,となりあったニューロンがまったく異なる方位選択性をもつことが知られている.このような神経回路の機能を詳細に解析するには,このようなニューロンのなかから特定の反応特性をもつニューロンをあとに残るかたちで標識し,その解剖学的な特徴を詳細に調べ,また,その神経活動を操作して動物の知覚や行動にあたえる影響を調べる技術が不可欠である.
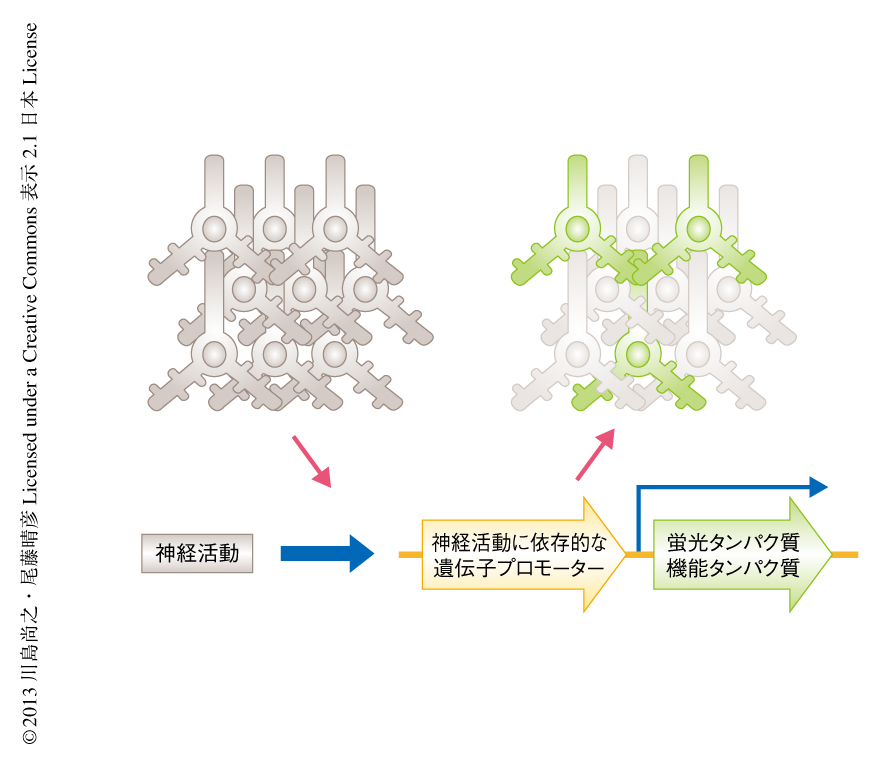
1990年代初頭から,このような機能的な標識を実現する技術として,c-Fos遺伝子やArc遺伝子など神経活動に応答して誘導される遺伝子の発現を免疫染色やin situハイブリダイゼーション法により検出する手法1),または,これらの遺伝子のプロモーターの下流に標識タンパク質を発現させる手法2) により,ある特定の行動をとらせたときに活性化するニューロンを単一細胞のレベルにおいて同定することが行われてきた(図1).これにより,たとえば,外部環境に特異的な海馬ニューロンの活性化などが明らかになり3),さらには,マウスの大脳皮質の全体における神経活動の経時的なイメージングなども実現した4,5).さらには,近年になり開発された神経活動の制御技術と組み合わせることにより,マウスにおいて特定の連合記憶を人工的に操作することも行われている6-8).機能的な標識に用いられてきた前初期遺伝子の神経可塑性における機能については長らくブラックボックスであったが,これらについても徐々に解明されつつある9).しかしながら,すでに15年以上の歴史をもつ手法にもかかわらず,神経活動に依存的な遺伝子プロモーターをより洗練されたツールとして改良する試みは行われておらず,この分野の発展をさまたげる要因のひとつになっていた.
筆者らは,2005年ごろより,独自に開発した培養ニューロンにおける遺伝子プロモーターの活性測定法と最先端の比較ゲノム解析を併用することにより,よりよい神経活動に依存的な遺伝子プロモーターを探索する試みを開始した.その結果,Arc遺伝子の約7000 bp上流に神経活動に依存的な強い転写をひき起こすエンハンサー配列を発見し,この配列をSARE(synaptic activity-responsive element,シナプス活性応答配列)と名づけた10).このSAREは約100 bpの配列にCREB,MEF2,SRFという神経活動に依存的な3つの転写因子に対する結合領域をもち,これらの転写因子が協調することにより強い転写をひき起こしていることが明らかになった.SAREはいわば神経活動に依存的な遺伝子発現の必要最小限が凝縮された配列であり,このようなエンハンサーの報告は世界ではじめてであった10,11).この研究は同時に,SAREが神経活動に依存的な遺伝子プロモーターの改良のための出発点となりうることを明確に示しており,従来よりも改良された神経活動に依存的な遺伝子プロモーターを作製し,機能的な標識の応用範囲を拡大することがつぎの課題となった.
多数のSAREを連結し,その連結の数やSAREどうしの間隔を調節することにより,神経活動に依存的な新規の遺伝子プロモーターであるE-SAREプロモーターを作製することに成功した.E-SAREプロモーターは,もっとも広く使用されているc-Fos遺伝子プロモーターよりも30倍以上も高い発現量をもつことが示された.興味深いことに,5個のSAREを連結することにより7倍の発現量の改善が得られ,このことは,SAREにおける転写因子どうしの協調作用だけでなく,SAREという“モジュール構造”どうしのあいだにもプラスにはたらく協調作用のあることを示唆した.
E-SAREプロモーターが脳において神経活動を標識できるかどうかを示すため,その下流に神経活動のレポーターとして蛍光タンパク質GFPを発現するウイルスベクターを作製した.そのとき,単にE-SAREプロモーターの下流にGFPを発現するだけのベクターでは,動物の脳に感染させたのち切片を観察する場合,GFPを発現していないニューロンがウイルスに感染していないニューロンなのか,それとも,神経活動の低いニューロンなのか区別がつかない.そこで,ゲノムサイズの大きいアデノ随伴ウイルスをベクターとして選択し,E-SAREプロモーターの発現カセットにくわえ,持続的に発現する遺伝子プロモーターの下流に別の蛍光タンパク質RFPを発現する感染マーカーのカセットも組み込むことにした.これまで,アデノ随伴ウイルスベクターに2個の発現カセットを組み込んだ例はなかったため,これがうまくはたらくかは未知の設計であったが,実際には非常によく機能することが示された.たとえば,このウイルスをマウスの大脳皮質の左右両側にある1次視覚野に感染させて片方の眼だけ刺激すると,感染の効率を示すRFPの蛍光は左右で差がなかったにもかかわらず,刺激の入力されたほうの1次視覚野ではGFPの発現は反対側よりも強く誘導された.このことは,E-SAREプロモーターが生体においても神経活動に応答して強い発現をすることを示した.
筆者らの目標は,機能的な標識法に単に技術改良をもたらすことだけでなく,従来は不可能であった単一細胞のレベルでの精密な研究を可能にすることであった.そこで,2光子顕微鏡による生体内観察技術を用いて,生体におけるE-SAREプロモーターの発現と神経活動との相関を明らかにすることをめざした.まず,2光子顕微鏡による観察のもとでの選択的なパッチクランプ法による単一細胞記録を行った.マウスの大脳皮質の感覚野にE-SAREプロモーターのレポーターを組み込んだウイルスを感染させ,ひげ刺激をあたえたときにE-SAREプロモーターの下流のGFPが発現したニューロンと発現していないニューロンとで発火パターンの違いを観察した.その結果,驚くべきことに,GFPの発現はひげ刺激に応答した神経活動にはよく相関したものの,外部からの刺激がない状態での自発的な神経活動には相関しないことが示された.この結果は,E-SAREプロモーターがねらった反応特性をもつニューロンを標識するためのすぐれた選択性をもつことを示しており,自発的な神経活動に影響されない機能的な標識が可能であることが示された.
さらに,E-SAREプロモーターがマウスの大脳皮質の視覚野に存在する方位選択的なニューロンを特異的に標識できるかどうかを観察した.1000個以上のニューロンを使い,Ca2+指示タンパク質であるGCaMPとE-SAREプロモーターのレポーターの発現を同時に観察することにより,E-SAREプロモーターは方位選択的なニューロンも特異的に標識可能なことが示された.このことは,たとえば,マウスの大脳皮質の視覚野のようにさまざまな反応特性をもつニューロンが混在している領域においても,E-SAREプロモーターはある特性をもつニューロンのみを特異的に標識できることを示した.
E-SAREプロモーターのもつ高い発現量には,単に反応に特異的なニューロンを精密に標識できるというだけでなく,さまざまな遺伝子工学的なツールをその下流に発現させ利用できるという意義もある.新しい実験手法の提案として,E-SAREプロモーターの下流にて薬剤に依存性のリコンビナーゼを発現させ,このリコンビナーゼによる組換えにより軸索のトレーサーを長期間にわたり持続的に発現させ,ある特定の反応特性をもつニューロンからの長距離軸索を標識し,その軸索を生体において観察する実験を行った.
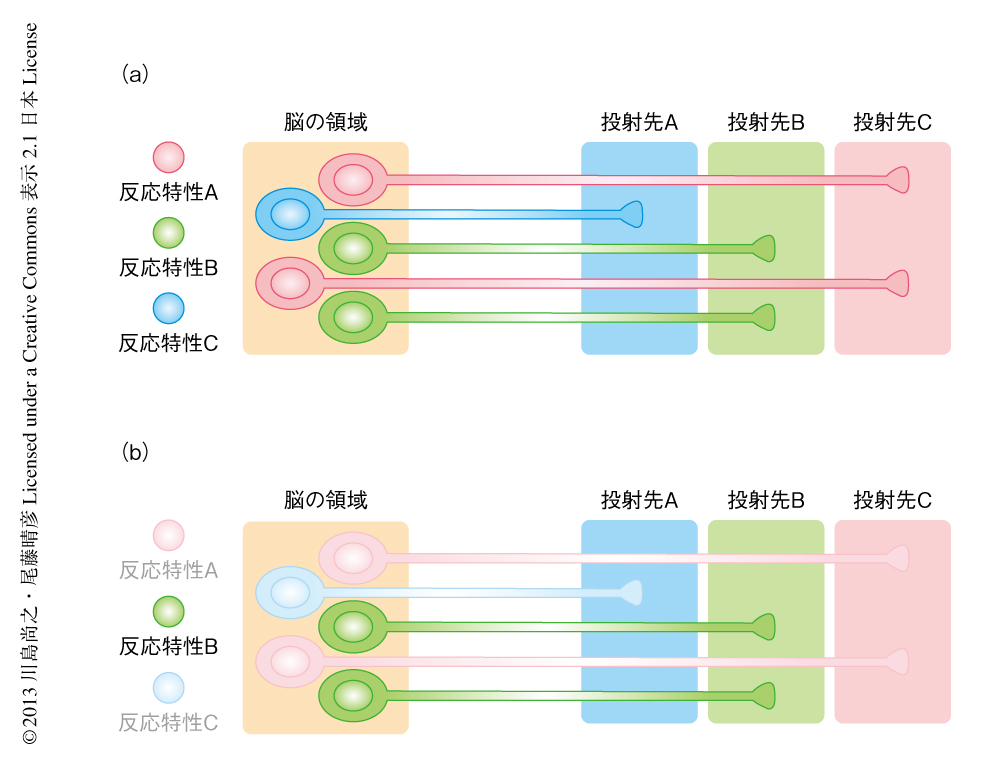
標的にしたのはマウスのもつ外側膝状体という視覚の中継核で,この核にあるニューロンはどちらか片方の眼にのみ反応するが,それらのニューロンは入り混じっており,従来,特定の眼に反応するニューロンのみを標識することは困難であった.E-SAREプロモーターの下流にて薬剤に依存性のリコンビナーゼを発現するウイルスと,リコンビナーゼに依存して軸索のトレーサーを発現するウイルスをマウスの外側膝状体に感染させ,片方の眼への刺激と同時にリコンビナーゼに組換えを起こさせる薬剤を投与した.その結果,片方の眼に反応するニューロンの多い領域に軸索のトレーサーを発現するニューロンが集積し,その軸索は大脳皮質の視覚野において眼に特異的な領域に分布した.さらには,これらの眼に特異的な軸索を生体において観察することにも成功した.この技術は,ある反応特性をもつ軸索がどのような投射パターンを示すか解析することを可能にし,それらの軸索が学習,疾患,加齢などの際にどのように変化していくか追跡することを可能にするものであり,今後,広い応用が期待される(図2).
今回の研究を進めるなかでつねに考えていたのは,機能的な標識法の分野をハードサイエンスに転換したいということであった.今回の研究により,神経活動に依存的な遺伝子プロモーターによる標識に関するすべての疑問に答えられたわけではなく,たとえば,なぜE-SAREプロモーターの発現は自発的な神経活動に相関しないのかなど,いまだ不明な点は多い.しかしながら,この分野にはじめての技術改良をもたらし,これまで欠けていた生体における精密な測定データを供給したことにより,今後の展開のための土台がようやくできたとはいえるのではないだろうか.E-SAREプロモーターは改良の可能な余地をまだ多分に残しており,さらに,光や薬剤による転写制御などと組み合わせることによりさらに精密な標識が可能と考えられ,今後の発展が期待される.
略歴:2013年 東京大学大学院医学系研究科 修了,同年より米国Howard Hughes Medical Institute研究員.
研究テーマ:遺伝子工学,神経活動のイメージング.
関心事:旅行,山登り,大規模データ解析.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2013 川島尚之・尾藤晴彦 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生化学分野)
email:川島尚之,尾藤晴彦
DOI: 10.7875/first.author.2013.109
Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE.
Takashi Kawashima, Kazuo Kitamura, Kanzo Suzuki, Mio Nonaka, Satoshi Kamijo, Sayaka Takemoto-Kimura, Masanobu Kano, Hiroyuki Okuno, Kenichi Ohki, Haruhiko Bito
Nature Methods, 10, 889-895 (2013)
要 約
神経活動に依存的な遺伝子プロモーターを使い特定の反応性をもつニューロンを標識する機能的な標識法は,現在の神経科学にとり重要な手法となりつつある.しかしながら,これまでに遺伝子プロモーターの遺伝子工学的な改良は行われておらず,このことがこの手法の発展をさまたげる要因のひとつとなっていた.今回の論文において,筆者らは,前初期遺伝子であるArc遺伝子のエンハンサーであるSARE配列にもとづき,従来よりも発現量を大幅に改良したE-SAREプロモーターの作製に成功した.応用例として,マウスの外側膝状体から1次視覚野に投射する眼入力に特異的な軸索を,生体において観察の可能なかたちで標識することにはじめて成功した.さらには,E-SAREプロモーターの高い発現量を利用して電気生理学的な手法やCa2+イメージング法と組み合わせることにより,これまで長らく不明であった神経活動に依存的な遺伝子プロモーターの発現と神経活動の相関のようすを単一細胞のレベルにおいて明らかにすることにも成功した.E-SAREプロモーターの登場により,今後,機能的な標識法の研究が加速していくことが期待される.
はじめに
われわれの脳を観察すると同じようにみえるニューロンが整然と並んだ構造をとっているが,ニューロンごとの機能を詳細に観察すると,たとえ解剖学的に同種のニューロンであったとしても,異なる外部刺激または異なる行動様式に対し反応するニューロンが混在している.たとえば,げっ歯類の1次視覚野では,となりあったニューロンがまったく異なる方位選択性をもつことが知られている.このような神経回路の機能を詳細に解析するには,このようなニューロンのなかから特定の反応特性をもつニューロンをあとに残るかたちで標識し,その解剖学的な特徴を詳細に調べ,また,その神経活動を操作して動物の知覚や行動にあたえる影響を調べる技術が不可欠である.
1990年代初頭から,このような機能的な標識を実現する技術として,c-Fos遺伝子やArc遺伝子など神経活動に応答して誘導される遺伝子の発現を免疫染色やin situハイブリダイゼーション法により検出する手法1),または,これらの遺伝子のプロモーターの下流に標識タンパク質を発現させる手法2) により,ある特定の行動をとらせたときに活性化するニューロンを単一細胞のレベルにおいて同定することが行われてきた(図1).これにより,たとえば,外部環境に特異的な海馬ニューロンの活性化などが明らかになり3),さらには,マウスの大脳皮質の全体における神経活動の経時的なイメージングなども実現した4,5).さらには,近年になり開発された神経活動の制御技術と組み合わせることにより,マウスにおいて特定の連合記憶を人工的に操作することも行われている6-8).機能的な標識に用いられてきた前初期遺伝子の神経可塑性における機能については長らくブラックボックスであったが,これらについても徐々に解明されつつある9).しかしながら,すでに15年以上の歴史をもつ手法にもかかわらず,神経活動に依存的な遺伝子プロモーターをより洗練されたツールとして改良する試みは行われておらず,この分野の発展をさまたげる要因のひとつになっていた.
筆者らは,2005年ごろより,独自に開発した培養ニューロンにおける遺伝子プロモーターの活性測定法と最先端の比較ゲノム解析を併用することにより,よりよい神経活動に依存的な遺伝子プロモーターを探索する試みを開始した.その結果,Arc遺伝子の約7000 bp上流に神経活動に依存的な強い転写をひき起こすエンハンサー配列を発見し,この配列をSARE(synaptic activity-responsive element,シナプス活性応答配列)と名づけた10).このSAREは約100 bpの配列にCREB,MEF2,SRFという神経活動に依存的な3つの転写因子に対する結合領域をもち,これらの転写因子が協調することにより強い転写をひき起こしていることが明らかになった.SAREはいわば神経活動に依存的な遺伝子発現の必要最小限が凝縮された配列であり,このようなエンハンサーの報告は世界ではじめてであった10,11).この研究は同時に,SAREが神経活動に依存的な遺伝子プロモーターの改良のための出発点となりうることを明確に示しており,従来よりも改良された神経活動に依存的な遺伝子プロモーターを作製し,機能的な標識の応用範囲を拡大することがつぎの課題となった.
1.E-SAREプロモーターとレポーターウイルスの開発
多数のSAREを連結し,その連結の数やSAREどうしの間隔を調節することにより,神経活動に依存的な新規の遺伝子プロモーターであるE-SAREプロモーターを作製することに成功した.E-SAREプロモーターは,もっとも広く使用されているc-Fos遺伝子プロモーターよりも30倍以上も高い発現量をもつことが示された.興味深いことに,5個のSAREを連結することにより7倍の発現量の改善が得られ,このことは,SAREにおける転写因子どうしの協調作用だけでなく,SAREという“モジュール構造”どうしのあいだにもプラスにはたらく協調作用のあることを示唆した.
E-SAREプロモーターが脳において神経活動を標識できるかどうかを示すため,その下流に神経活動のレポーターとして蛍光タンパク質GFPを発現するウイルスベクターを作製した.そのとき,単にE-SAREプロモーターの下流にGFPを発現するだけのベクターでは,動物の脳に感染させたのち切片を観察する場合,GFPを発現していないニューロンがウイルスに感染していないニューロンなのか,それとも,神経活動の低いニューロンなのか区別がつかない.そこで,ゲノムサイズの大きいアデノ随伴ウイルスをベクターとして選択し,E-SAREプロモーターの発現カセットにくわえ,持続的に発現する遺伝子プロモーターの下流に別の蛍光タンパク質RFPを発現する感染マーカーのカセットも組み込むことにした.これまで,アデノ随伴ウイルスベクターに2個の発現カセットを組み込んだ例はなかったため,これがうまくはたらくかは未知の設計であったが,実際には非常によく機能することが示された.たとえば,このウイルスをマウスの大脳皮質の左右両側にある1次視覚野に感染させて片方の眼だけ刺激すると,感染の効率を示すRFPの蛍光は左右で差がなかったにもかかわらず,刺激の入力されたほうの1次視覚野ではGFPの発現は反対側よりも強く誘導された.このことは,E-SAREプロモーターが生体においても神経活動に応答して強い発現をすることを示した.
2.E-SAREプロモーターの発現と神経活動との単一細胞のレベルにおける相関
筆者らの目標は,機能的な標識法に単に技術改良をもたらすことだけでなく,従来は不可能であった単一細胞のレベルでの精密な研究を可能にすることであった.そこで,2光子顕微鏡による生体内観察技術を用いて,生体におけるE-SAREプロモーターの発現と神経活動との相関を明らかにすることをめざした.まず,2光子顕微鏡による観察のもとでの選択的なパッチクランプ法による単一細胞記録を行った.マウスの大脳皮質の感覚野にE-SAREプロモーターのレポーターを組み込んだウイルスを感染させ,ひげ刺激をあたえたときにE-SAREプロモーターの下流のGFPが発現したニューロンと発現していないニューロンとで発火パターンの違いを観察した.その結果,驚くべきことに,GFPの発現はひげ刺激に応答した神経活動にはよく相関したものの,外部からの刺激がない状態での自発的な神経活動には相関しないことが示された.この結果は,E-SAREプロモーターがねらった反応特性をもつニューロンを標識するためのすぐれた選択性をもつことを示しており,自発的な神経活動に影響されない機能的な標識が可能であることが示された.
さらに,E-SAREプロモーターがマウスの大脳皮質の視覚野に存在する方位選択的なニューロンを特異的に標識できるかどうかを観察した.1000個以上のニューロンを使い,Ca2+指示タンパク質であるGCaMPとE-SAREプロモーターのレポーターの発現を同時に観察することにより,E-SAREプロモーターは方位選択的なニューロンも特異的に標識可能なことが示された.このことは,たとえば,マウスの大脳皮質の視覚野のようにさまざまな反応特性をもつニューロンが混在している領域においても,E-SAREプロモーターはある特性をもつニューロンのみを特異的に標識できることを示した.
3.長距離軸索の機能に特異的な可視化
E-SAREプロモーターのもつ高い発現量には,単に反応に特異的なニューロンを精密に標識できるというだけでなく,さまざまな遺伝子工学的なツールをその下流に発現させ利用できるという意義もある.新しい実験手法の提案として,E-SAREプロモーターの下流にて薬剤に依存性のリコンビナーゼを発現させ,このリコンビナーゼによる組換えにより軸索のトレーサーを長期間にわたり持続的に発現させ,ある特定の反応特性をもつニューロンからの長距離軸索を標識し,その軸索を生体において観察する実験を行った.
標的にしたのはマウスのもつ外側膝状体という視覚の中継核で,この核にあるニューロンはどちらか片方の眼にのみ反応するが,それらのニューロンは入り混じっており,従来,特定の眼に反応するニューロンのみを標識することは困難であった.E-SAREプロモーターの下流にて薬剤に依存性のリコンビナーゼを発現するウイルスと,リコンビナーゼに依存して軸索のトレーサーを発現するウイルスをマウスの外側膝状体に感染させ,片方の眼への刺激と同時にリコンビナーゼに組換えを起こさせる薬剤を投与した.その結果,片方の眼に反応するニューロンの多い領域に軸索のトレーサーを発現するニューロンが集積し,その軸索は大脳皮質の視覚野において眼に特異的な領域に分布した.さらには,これらの眼に特異的な軸索を生体において観察することにも成功した.この技術は,ある反応特性をもつ軸索がどのような投射パターンを示すか解析することを可能にし,それらの軸索が学習,疾患,加齢などの際にどのように変化していくか追跡することを可能にするものであり,今後,広い応用が期待される(図2).
おわりに
今回の研究を進めるなかでつねに考えていたのは,機能的な標識法の分野をハードサイエンスに転換したいということであった.今回の研究により,神経活動に依存的な遺伝子プロモーターによる標識に関するすべての疑問に答えられたわけではなく,たとえば,なぜE-SAREプロモーターの発現は自発的な神経活動に相関しないのかなど,いまだ不明な点は多い.しかしながら,この分野にはじめての技術改良をもたらし,これまで欠けていた生体における精密な測定データを供給したことにより,今後の展開のための土台がようやくできたとはいえるのではないだろうか.E-SAREプロモーターは改良の可能な余地をまだ多分に残しており,さらに,光や薬剤による転写制御などと組み合わせることによりさらに精密な標識が可能と考えられ,今後の発展が期待される.
文 献
- Sagar, S. M., Sharp, F. R. & Curran, T.: Expression of c-fos protein in brain: metabolic mapping at the cellular level. Science, 240, 1328-1331 (1988)[PubMed]
- Schilling, K., Luk, D., Morgan, J. I. et al.: Regulation of a fos-lacZ fusion gene: a paradigm for quantitative analysis of stimulus-transcription coupling. Proc. Natl. Acad. Sci. USA, 88, 5665-5669 (1991)[PubMed]
- Guzowski, J. F., McNaughton, B. L., Barnes, C. A. et al.: Environment-specific expression of the immediate-early gene Arc in hippocampal neuronal ensembles. Nat. Neurosci., 2, 1120-1124 (1999)[PubMed]
- Eguchi, M. & Yamaguchi, S.: In vivo and in vitro visualization of gene expression dynamics over extensive areas of the brain. Neuroimage, 44, 1274-1283 (2009)[PubMed]
- Izumi, H., Ishimoto, T., Yamamoto, H. et al.: Bioluminescence imaging of Arc expression enables detection of activity-dependent and plastic changes in the visual cortex of adult mice. Brain Struct. Funct., 216, 91-104 (2011)[PubMed]
- Liu, X., Ramirez, S., Pang, P. T. et al.: Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 484, 381-385 (2012)[PubMed]
- Garner, A. R., Rowland, D. C., Hwang, S. Y. et al.: Generation of a synthetic memory trace. Science, 335, 1513-1516 (2012)[PubMed]
- Koya, E., Golden, S. A., Harvey, B. K. et al.: Targeted disruption of cocaine-activated nucleus accumbens neurons prevents context-specific sensitization. Nat. Neurosci., 12, 1069-1073 (2009)[PubMed]
- Okuno, H., Akashi, K., Ishii, Y. et al.: Inverse synaptic tagging of inactive synapses via dynamic interaction of Arc/Arg3.1 with CaMKIIβ. Cell, 149, 886-898 (2012)[PubMed] [新着論文レビュー]
- Kawashima, T., Okuno, H., Nonaka, M. et al.: Synaptic activity-responsive element in the Arc/Arg3.1 promoter essential for synapse-to-nucleus signaling in activated neurons. Proc. Natl. Acad. Sci. USA, 106, 316-321 (2009)[PubMed]
- Inoue, M., Yagishita-Kyo, N., Nonaka, M. et al.: Synaptic activity-responsive element (SARE): A unique genomic structure with an unusual sensitivity to neuronal activity. Commun. Integr. Biol., 3, 443-446 (2010)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院医学系研究科 修了,同年より米国Howard Hughes Medical Institute研究員.
研究テーマ:遺伝子工学,神経活動のイメージング.
関心事:旅行,山登り,大規模データ解析.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2013 川島尚之・尾藤晴彦 Licensed under CC 表示 2.1 日本