ArcはCa2+/カルモジュリン依存性キナーゼIIβとの相互作用により不活性なシナプスに集積しAMPA型グルタミン酸受容体のエンドサイトーシスにはたらく
奥野浩行・尾藤晴彦
(東京大学大学院医学系研究科 神経生化学分野)
email:奥野浩行,尾藤晴彦
DOI: 10.7875/first.author.2012.061
Inverse synaptic tagging of inactive synapses via dynamic interaction of Arc/Arg3.1 with CaMKIIβ.
Hiroyuki Okuno, Kaori Akashi, Yuichiro Ishii, Nan Yagishita-Kyo, Kanzo Suzuki, Mio Nonaka, Takashi Kawashima, Hajime Fujii, Sayaka Takemoto-Kimura, Manabu Abe, Rie Natsume, Shoaib Chowdhury, Kenji Sakimura, Paul F. Worley, Haruhiko Bito
Cell, 149, 886-898 (2012)
ニューロンに強いシナプスへの刺激をくわえると,すみやかかつ一過的に遺伝子発現がひき起こされる.このような神経活動に依存的な遺伝子発現は神経回路の形成やシナプスの可塑性,さらに,長期記憶の形成などに必須であることが知られている.神経活動に依存的に発現する前初期遺伝子にコードされるArcは,AMPA型グルタミン酸受容体のエンドサイトーシスにかかわり長期的なシナプス可塑性に重要な役割をはたしている.しかしながら,このArcがどのようにシナプスに対する選択性をもつのかについては長らく不明であった.今回,筆者らは,シナプスの活動とシナプスにおけるArcの動態との関係を解析し,Arcは活動の少ない不活性なシナプスに多く集積することを明らかにした.シナプスにおけるArcの存在量は,AMPA型グルタミン酸受容体のシナプス膜の表面における発現量と負の相関を示していた.さらに,Arcの不活性なシナプスへの集積の分子機構として,カルモジュリンと結合していない不活性型のCa2+/カルモジュリン依存性キナーゼIIβとの相互作用を同定した.これらの結果より,Arcは不活性型Ca2+/カルモジュリン依存性キナーゼIIβを介して不活性なシナプスに局在し,AMPA型グルタミン酸受容体のエンドサイトーシスを行っていることが示唆された.今回,明らかにされた不活性なシナプスに特異的なグルタミン酸受容体の制御機構は,長期的なシナプス可塑性の分子機構のひとつとして新しいフレームワークとなりうるものである.
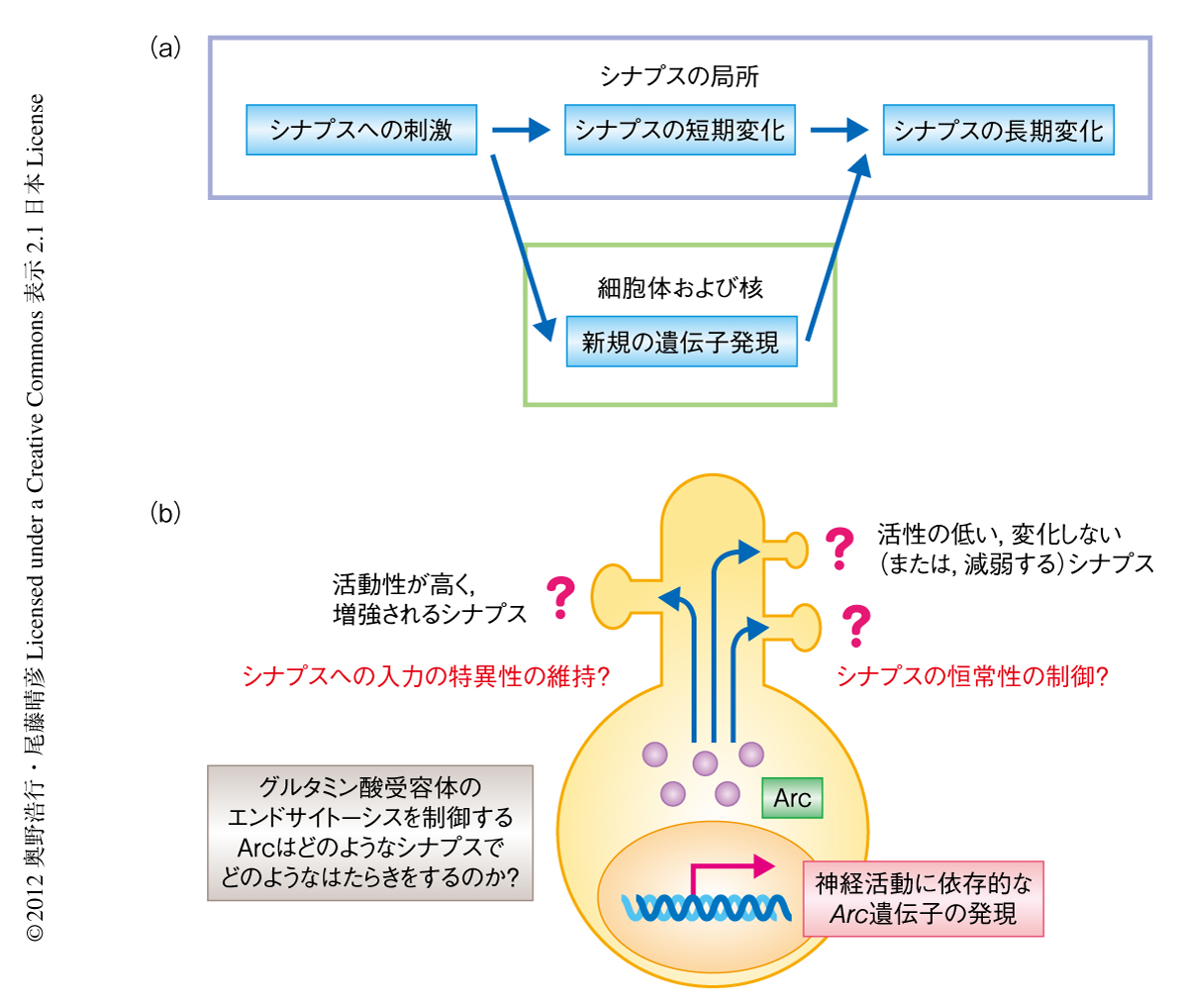
脳神経系における神経活動に依存的な遺伝子発現は,発達期において神経回路の形成に,また,成体においても長期的なシナプス可塑性や神経回路の再編成に必須である(図1a).なかでも,神経活動に依存的に発現する前初期遺伝子のひとつArc遺伝子(別名Arg3.1遺伝子)は1,2),その発現が大脳新皮質や海馬において感覚情報の処理や記憶の形成にかかわる神経活動と高い相関を示し3,4),また,そのノックアウトマウスにおいてシナプスの可塑性や長期記憶の形成に広範な障害のみられることから5,6),現在,多くの研究者の注目をあつめている.その遺伝子産物Arcは後シナプスに局在するタンパク質であり,AMPA型グルタミン酸受容体のエンドサイトーシスを促進するはたらきのあることや,シナプスの長期抑圧(long-term depression:LTD)やシナプスの恒常性に関与していることなどが報告されているが7,8),一方で,シナプスの長期増強(long-term potentiation:LTP)やスパインの形態制御にかかわるという報告もあり5,9),シナプスにおけるArcの機能についての統一的な見解は得られていない.この問題を解決するためには,神経活動に依存的に細胞体において生合成されたArcがどのようにしてシナプスへと運ばれ集積するのか,また,Arcはいかにして修飾すべきシナプスを選択しているのか,などの分子機構の理解が不可欠である(図1b).
この研究において,筆者らは,さまざまな方法を駆使してシナプスにおけるArcの動態を調べることにより,Arcのシナプスへの集積のルールを明らかにした.また,Arcのシナプスへの集積における分子機構を同定し,さらに,個々のシナプスにおいてArcがグルタミン酸受容体のエンドサイトーシスにかかわることを示した.
Arcはニューロンにおいておもに樹状突起に存在し,とくに,後シナプス肥厚部に集積している.Arcのアミノ酸配列からはシナプスへの局在にかかわる明らかなドメイン構造は認められない.このため,Arcのシナプスへの局在はほかのシナプスタンパク質との相互作用により制御されていると考え,酵母ツーハイブリッド法によりArcと結合するタンパク質を探索した.その結果,候補となるタンパク質のひとつとして,後シナプス肥厚部において発現の高いリン酸化酵素Ca2+/カルモジュリン依存性キナーゼIIβがみつかった.免疫共沈降法や精製した組換えタンパク質を用いた実験により,ArcとCa2+/カルモジュリン依存性キナーゼIIβとは実際に結合することが確かめられた.興味深いことに,Ca2+あるいはカルモジュリンが存在しない条件ではArcとCa2+/カルモジュリン依存性キナーゼIIβとは強い結合を示したが,Ca2+とカルモジュリンの両方が存在した場合にはArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合は著しく減弱した.これらの結果から,ArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合はCa2+/カルモジュリン依存性キナーゼIIβの活性化の状態により制御されている可能性が示唆された.
興奮性シナプスにおいてグルタミン酸が放出されると後シナプスにCa2+が流入し,カルモジュリンと結合してCa2+/カルモジュリン依存性キナーゼIIβを活性化する.もし,ArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合がCa2+およびカルモジュリンにより制御されているのであれば,Arcのシナプスにおける局在はシナプスの活動により変化する可能性がある.この可能性を調べるため,海馬初代培養ニューロンを用いてシナプスの活動を阻害剤などにより操作し,Arcのシナプスにおける局在の変化を解析した.海馬初代培養ニューロンにBDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)やシナプス伝達を促進する薬剤bicucullineを投与すると,ニューロンが活性化されArcは一過的に発現誘導される.この発現誘導されたArcは,ニューロンの自発的な神経活動を制限しない場合にはおもに樹状突起の幹部と一部のスパイン(棘部のシナプス)に存在した.ところが,薬理的に神経活動を遮断した場合にはArcはスパインに顕著な集積を示した.また,単一のシナプス前終末からの神経伝達物質の放出を阻害すると,その阻害されたシナプスにおいて特異的にArcの後シナプスへの集積の上昇がみられた.同様の結果は,GFP-Arc融合タンパク質を用いた生細胞イメージングによっても再現された.これらの実験結果から,神経活動により発現誘導されたArcは,そののちのシナプスの活動の履歴に応じ不活性なシナプスに選択的に集積するという性質が明らかになった(図2a).
ArcにはAMPA型グルタミン酸受容体のエンドサイトーシスを促進するはらたきがある7).そこで,まずBDNFによる刺激によりArcを発現誘導させ,つづいて神経活動の遮断により不活性なシナプスにArcを集積させた際に,AMPA型グルタミン酸受容体のサブユニットGluA1のシナプス膜の表面における発現量がどのように変化するかを調べた.その結果,Arcの集積量の多いシナプスではGluA1の発現量は低く,逆に,Arcの量の少ないシナプスにおいてはGluA1の量は高いという負の相関が認められた.また,刺激によるGluA1のシナプス膜の表面における発現量の変化を調べたところ,BDNFの刺激によりGluA1の発現は一過的に上昇したが,そののちの神経活動の遮断によりGluA1の発現量はBDNFの刺激前のレベルにまで低下することが明らかになった.これらの結果は,BDNFにより発現誘導されたArcはそののちの神経活動の遮断により不活性なシナプスに集積することで,BDNFの刺激により増加したGluA1のシナプス膜の表面における発現量をもどすはたらきのあることを示唆していた(図2b).
Arcと不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの結合は,実際にArcのシナプスへの局在に関与しているのだろうか? 培養ニューロンにおいてCa2+/カルモジュリン依存性キナーゼIIβをRNAi法によりノックダウンしたとき,Arcのシナプスにおける局在にどのように影響するかについて検討した.対照となる培養ニューロンではこれまでの実験と同様にBDNFによる刺激ののちの神経活動の遮断によりArcのシナプスにおける集積がみられたが,Ca2+/カルモジュリン依存性キナーゼIIβをノックダウンした培養ニューロンではArcのシナプスにおける集積は顕著に減弱していた.また,RNAiに対する抵抗変異をもつCa2+/カルモジュリン依存性キナーゼIIβを発現させることにより,この効果は相殺された.これらのことから,Arcの不活性なシナプスへの局在はCa2+/カルモジュリン依存性キナーゼIIβにより制御されていることが示された.
さらに,培養ニューロンにおいてみられたこの現象が個体の脳においても起こるかどうか検討するため,マウスの大脳視覚野におけるArcのシナプスへの局在を野生型マウスとCa2+/カルモジュリン依存性キナーゼIIβノックアウトマウスとで比較した.このin vivoでの実験においてはArcのシナプスにおける局在を感度よく定量するため,Arc遺伝子のプロモーターの制御のもとGFP-Arc融合タンパク質の発現するトランスジェニックマウスを用いた.また,個体差の影響を排除するため,マウス視覚野の半球独立性を生かした同一の動物における比較を行った.実験では,暗所で飼育したマウスに光刺激をあたえてArcを両側の視覚野に発現誘導したのち,片眼への薬剤の注入により一方の半球の視覚野のみで神経活動を抑制した.このようなマウスにおいて左右の視覚野におけるGFP-Arc融合タンパク質のシナプスでの局在量を比較したところ,野生型マウスにおいては光刺激により発現誘導されたGFP-Arc融合タンパク質の後シナプス肥厚部への集積の量は神経活動が低下したほうの半球において有意に多かったが,Ca2+/カルモジュリン依存性キナーゼIIβノックアウトマウスにおいては左右の半球の差は認められなかった.これらの実験結果から,不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用によるArcの不活性なシナプスへの選択的な集積は,培養ニューロンにおいても個体の脳においても起こることが示された(図2b).
ここまでの結果より,Arcは不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用により活動の少ないシナプスに集積することが示されたが,Arcのシナプスへの集積とシナプスの可塑性とのあいだにはどのような関係があるのだろうか? この問いに答えるため,高頻度の電気刺激により長期増強様の変化をシナプスにひき起こした際のArcのシナプスへの集積を生細胞イメージング法により調べた.培養ニューロンの形成する神経回路に高頻度の電気刺激をあたえると一部のスパインにおいて容積の増大がみられる.この構造的な変化はシナプスの伝達効率の増加と正に相関することが知られており,長期増強のよい指標となる.そこで,ニューロンに発現させたRFPによりスパインの構造変化を,また,Arc遺伝子のプロモーターの制御のもとにあるGFP-Arc融合タンパク質によりArcの細胞における動態を観察した.高頻度の電気刺激により容積の増大したスパインの多くは,そののち長時間(3時間以上)にわたり容積の増大状態を持続していたが,このとき,スパインにおけるGFP-Arc融合タンパク質の濃度をスパインごとに計測したところ,その増加率は容積の増大を示したスパインに比べ容積の増大を示さないスパインにおいて大きかった.すなわち,長期増強様の変化により誘導されたArcは,長期増強がひき起こされたシナプスではなく,むしろ変化の少ないシナプスに選択的に集積することが示唆された.
今回,樹状突起における局所的なシナプスの活動の履歴がArcの動態を決定していることが明らかになった.筆者らは,これらの結果より,長期的なシナプス可塑性の分子機構として,“逆シナプスタギング”という新たなフレームワークを提唱した.これまで,シナプスへの刺激により発現誘導された可塑性に関連するタンパク質は,活性の高いシナプスに形成された指標(シナプスタグ)を目印に,それらのシナプスに選択的に集積して可塑性の固定化を担う,という“シナプスタギング”モデルが提唱されており,実際に,このモデルをサポートする実験結果が数多く得られている10,11).一方,この研究で示された,Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用によるArcの不活性なシナプスへの集積およびグルタミン酸受容体のエンドサイトーシスの制御は,このモデルとは相補的な“逆シナプスタギング”とよぶべき機構であり,おそらく,可塑的なシナプスの周囲に存在する非可塑的なシナプスの可塑性を抑える役割を担っているものと考えられる.長期的なシナプス可塑性の維持期においては,シナプスタギング機構と逆シナプスタギング機構の両者が存在することにより,強化されるべきシナプスと強化されないシナプスとの対比を安定かつ厳密に保っているのであろう.今回の発見は,これまで謎であった,細胞体で新規に生合成されたタンパク質がいかにしてシナプスの選択性をもつのかという問いにひとつの解をあたえ,今後の樹状突起でのシナプスの修飾および長期記憶の形成における分子機構の解明に大きく貢献するものと期待される.
略歴:1995年 東京大学大学院医学系研究科 修了,同年より同 助手(現 助教).2000年から2003年 米国Johns Hopkins大学School of Medicineポスドク研究員.
研究テーマ:神経活動に依存的に発現する前初期遺伝子の機能について,分子・細胞・回路・個体の階層をつなぐ研究をめざしています.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 准教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2012 奥野浩行・尾藤晴彦 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生化学分野)
email:奥野浩行,尾藤晴彦
DOI: 10.7875/first.author.2012.061
Inverse synaptic tagging of inactive synapses via dynamic interaction of Arc/Arg3.1 with CaMKIIβ.
Hiroyuki Okuno, Kaori Akashi, Yuichiro Ishii, Nan Yagishita-Kyo, Kanzo Suzuki, Mio Nonaka, Takashi Kawashima, Hajime Fujii, Sayaka Takemoto-Kimura, Manabu Abe, Rie Natsume, Shoaib Chowdhury, Kenji Sakimura, Paul F. Worley, Haruhiko Bito
Cell, 149, 886-898 (2012)
要 約
ニューロンに強いシナプスへの刺激をくわえると,すみやかかつ一過的に遺伝子発現がひき起こされる.このような神経活動に依存的な遺伝子発現は神経回路の形成やシナプスの可塑性,さらに,長期記憶の形成などに必須であることが知られている.神経活動に依存的に発現する前初期遺伝子にコードされるArcは,AMPA型グルタミン酸受容体のエンドサイトーシスにかかわり長期的なシナプス可塑性に重要な役割をはたしている.しかしながら,このArcがどのようにシナプスに対する選択性をもつのかについては長らく不明であった.今回,筆者らは,シナプスの活動とシナプスにおけるArcの動態との関係を解析し,Arcは活動の少ない不活性なシナプスに多く集積することを明らかにした.シナプスにおけるArcの存在量は,AMPA型グルタミン酸受容体のシナプス膜の表面における発現量と負の相関を示していた.さらに,Arcの不活性なシナプスへの集積の分子機構として,カルモジュリンと結合していない不活性型のCa2+/カルモジュリン依存性キナーゼIIβとの相互作用を同定した.これらの結果より,Arcは不活性型Ca2+/カルモジュリン依存性キナーゼIIβを介して不活性なシナプスに局在し,AMPA型グルタミン酸受容体のエンドサイトーシスを行っていることが示唆された.今回,明らかにされた不活性なシナプスに特異的なグルタミン酸受容体の制御機構は,長期的なシナプス可塑性の分子機構のひとつとして新しいフレームワークとなりうるものである.
はじめに
脳神経系における神経活動に依存的な遺伝子発現は,発達期において神経回路の形成に,また,成体においても長期的なシナプス可塑性や神経回路の再編成に必須である(図1a).なかでも,神経活動に依存的に発現する前初期遺伝子のひとつArc遺伝子(別名Arg3.1遺伝子)は1,2),その発現が大脳新皮質や海馬において感覚情報の処理や記憶の形成にかかわる神経活動と高い相関を示し3,4),また,そのノックアウトマウスにおいてシナプスの可塑性や長期記憶の形成に広範な障害のみられることから5,6),現在,多くの研究者の注目をあつめている.その遺伝子産物Arcは後シナプスに局在するタンパク質であり,AMPA型グルタミン酸受容体のエンドサイトーシスを促進するはたらきのあることや,シナプスの長期抑圧(long-term depression:LTD)やシナプスの恒常性に関与していることなどが報告されているが7,8),一方で,シナプスの長期増強(long-term potentiation:LTP)やスパインの形態制御にかかわるという報告もあり5,9),シナプスにおけるArcの機能についての統一的な見解は得られていない.この問題を解決するためには,神経活動に依存的に細胞体において生合成されたArcがどのようにしてシナプスへと運ばれ集積するのか,また,Arcはいかにして修飾すべきシナプスを選択しているのか,などの分子機構の理解が不可欠である(図1b).
この研究において,筆者らは,さまざまな方法を駆使してシナプスにおけるArcの動態を調べることにより,Arcのシナプスへの集積のルールを明らかにした.また,Arcのシナプスへの集積における分子機構を同定し,さらに,個々のシナプスにおいてArcがグルタミン酸受容体のエンドサイトーシスにかかわることを示した.
1.Arcは不活性型Ca2+/カルモジュリン依存性キナーゼIIβと選択的に結合する
Arcはニューロンにおいておもに樹状突起に存在し,とくに,後シナプス肥厚部に集積している.Arcのアミノ酸配列からはシナプスへの局在にかかわる明らかなドメイン構造は認められない.このため,Arcのシナプスへの局在はほかのシナプスタンパク質との相互作用により制御されていると考え,酵母ツーハイブリッド法によりArcと結合するタンパク質を探索した.その結果,候補となるタンパク質のひとつとして,後シナプス肥厚部において発現の高いリン酸化酵素Ca2+/カルモジュリン依存性キナーゼIIβがみつかった.免疫共沈降法や精製した組換えタンパク質を用いた実験により,ArcとCa2+/カルモジュリン依存性キナーゼIIβとは実際に結合することが確かめられた.興味深いことに,Ca2+あるいはカルモジュリンが存在しない条件ではArcとCa2+/カルモジュリン依存性キナーゼIIβとは強い結合を示したが,Ca2+とカルモジュリンの両方が存在した場合にはArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合は著しく減弱した.これらの結果から,ArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合はCa2+/カルモジュリン依存性キナーゼIIβの活性化の状態により制御されている可能性が示唆された.
2.ニューロンの樹状突起においてArcは不活性なシナプスに集積する
興奮性シナプスにおいてグルタミン酸が放出されると後シナプスにCa2+が流入し,カルモジュリンと結合してCa2+/カルモジュリン依存性キナーゼIIβを活性化する.もし,ArcとCa2+/カルモジュリン依存性キナーゼIIβとの結合がCa2+およびカルモジュリンにより制御されているのであれば,Arcのシナプスにおける局在はシナプスの活動により変化する可能性がある.この可能性を調べるため,海馬初代培養ニューロンを用いてシナプスの活動を阻害剤などにより操作し,Arcのシナプスにおける局在の変化を解析した.海馬初代培養ニューロンにBDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)やシナプス伝達を促進する薬剤bicucullineを投与すると,ニューロンが活性化されArcは一過的に発現誘導される.この発現誘導されたArcは,ニューロンの自発的な神経活動を制限しない場合にはおもに樹状突起の幹部と一部のスパイン(棘部のシナプス)に存在した.ところが,薬理的に神経活動を遮断した場合にはArcはスパインに顕著な集積を示した.また,単一のシナプス前終末からの神経伝達物質の放出を阻害すると,その阻害されたシナプスにおいて特異的にArcの後シナプスへの集積の上昇がみられた.同様の結果は,GFP-Arc融合タンパク質を用いた生細胞イメージングによっても再現された.これらの実験結果から,神経活動により発現誘導されたArcは,そののちのシナプスの活動の履歴に応じ不活性なシナプスに選択的に集積するという性質が明らかになった(図2a).
3.Arcのシナプスへの集積量とAMPA型グルタミン酸受容体の発現量は負の相関を示す
ArcにはAMPA型グルタミン酸受容体のエンドサイトーシスを促進するはらたきがある7).そこで,まずBDNFによる刺激によりArcを発現誘導させ,つづいて神経活動の遮断により不活性なシナプスにArcを集積させた際に,AMPA型グルタミン酸受容体のサブユニットGluA1のシナプス膜の表面における発現量がどのように変化するかを調べた.その結果,Arcの集積量の多いシナプスではGluA1の発現量は低く,逆に,Arcの量の少ないシナプスにおいてはGluA1の量は高いという負の相関が認められた.また,刺激によるGluA1のシナプス膜の表面における発現量の変化を調べたところ,BDNFの刺激によりGluA1の発現は一過的に上昇したが,そののちの神経活動の遮断によりGluA1の発現量はBDNFの刺激前のレベルにまで低下することが明らかになった.これらの結果は,BDNFにより発現誘導されたArcはそののちの神経活動の遮断により不活性なシナプスに集積することで,BDNFの刺激により増加したGluA1のシナプス膜の表面における発現量をもどすはたらきのあることを示唆していた(図2b).
4.Arcのシナプスにおける局在は不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用により制御される
Arcと不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの結合は,実際にArcのシナプスへの局在に関与しているのだろうか? 培養ニューロンにおいてCa2+/カルモジュリン依存性キナーゼIIβをRNAi法によりノックダウンしたとき,Arcのシナプスにおける局在にどのように影響するかについて検討した.対照となる培養ニューロンではこれまでの実験と同様にBDNFによる刺激ののちの神経活動の遮断によりArcのシナプスにおける集積がみられたが,Ca2+/カルモジュリン依存性キナーゼIIβをノックダウンした培養ニューロンではArcのシナプスにおける集積は顕著に減弱していた.また,RNAiに対する抵抗変異をもつCa2+/カルモジュリン依存性キナーゼIIβを発現させることにより,この効果は相殺された.これらのことから,Arcの不活性なシナプスへの局在はCa2+/カルモジュリン依存性キナーゼIIβにより制御されていることが示された.
さらに,培養ニューロンにおいてみられたこの現象が個体の脳においても起こるかどうか検討するため,マウスの大脳視覚野におけるArcのシナプスへの局在を野生型マウスとCa2+/カルモジュリン依存性キナーゼIIβノックアウトマウスとで比較した.このin vivoでの実験においてはArcのシナプスにおける局在を感度よく定量するため,Arc遺伝子のプロモーターの制御のもとGFP-Arc融合タンパク質の発現するトランスジェニックマウスを用いた.また,個体差の影響を排除するため,マウス視覚野の半球独立性を生かした同一の動物における比較を行った.実験では,暗所で飼育したマウスに光刺激をあたえてArcを両側の視覚野に発現誘導したのち,片眼への薬剤の注入により一方の半球の視覚野のみで神経活動を抑制した.このようなマウスにおいて左右の視覚野におけるGFP-Arc融合タンパク質のシナプスでの局在量を比較したところ,野生型マウスにおいては光刺激により発現誘導されたGFP-Arc融合タンパク質の後シナプス肥厚部への集積の量は神経活動が低下したほうの半球において有意に多かったが,Ca2+/カルモジュリン依存性キナーゼIIβノックアウトマウスにおいては左右の半球の差は認められなかった.これらの実験結果から,不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用によるArcの不活性なシナプスへの選択的な集積は,培養ニューロンにおいても個体の脳においても起こることが示された(図2b).
5.Arcは可塑的なシナプスより非可塑的なシナプスに多く集積する
ここまでの結果より,Arcは不活性型Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用により活動の少ないシナプスに集積することが示されたが,Arcのシナプスへの集積とシナプスの可塑性とのあいだにはどのような関係があるのだろうか? この問いに答えるため,高頻度の電気刺激により長期増強様の変化をシナプスにひき起こした際のArcのシナプスへの集積を生細胞イメージング法により調べた.培養ニューロンの形成する神経回路に高頻度の電気刺激をあたえると一部のスパインにおいて容積の増大がみられる.この構造的な変化はシナプスの伝達効率の増加と正に相関することが知られており,長期増強のよい指標となる.そこで,ニューロンに発現させたRFPによりスパインの構造変化を,また,Arc遺伝子のプロモーターの制御のもとにあるGFP-Arc融合タンパク質によりArcの細胞における動態を観察した.高頻度の電気刺激により容積の増大したスパインの多くは,そののち長時間(3時間以上)にわたり容積の増大状態を持続していたが,このとき,スパインにおけるGFP-Arc融合タンパク質の濃度をスパインごとに計測したところ,その増加率は容積の増大を示したスパインに比べ容積の増大を示さないスパインにおいて大きかった.すなわち,長期増強様の変化により誘導されたArcは,長期増強がひき起こされたシナプスではなく,むしろ変化の少ないシナプスに選択的に集積することが示唆された.
おわりに
今回,樹状突起における局所的なシナプスの活動の履歴がArcの動態を決定していることが明らかになった.筆者らは,これらの結果より,長期的なシナプス可塑性の分子機構として,“逆シナプスタギング”という新たなフレームワークを提唱した.これまで,シナプスへの刺激により発現誘導された可塑性に関連するタンパク質は,活性の高いシナプスに形成された指標(シナプスタグ)を目印に,それらのシナプスに選択的に集積して可塑性の固定化を担う,という“シナプスタギング”モデルが提唱されており,実際に,このモデルをサポートする実験結果が数多く得られている10,11).一方,この研究で示された,Ca2+/カルモジュリン依存性キナーゼIIβとの相互作用によるArcの不活性なシナプスへの集積およびグルタミン酸受容体のエンドサイトーシスの制御は,このモデルとは相補的な“逆シナプスタギング”とよぶべき機構であり,おそらく,可塑的なシナプスの周囲に存在する非可塑的なシナプスの可塑性を抑える役割を担っているものと考えられる.長期的なシナプス可塑性の維持期においては,シナプスタギング機構と逆シナプスタギング機構の両者が存在することにより,強化されるべきシナプスと強化されないシナプスとの対比を安定かつ厳密に保っているのであろう.今回の発見は,これまで謎であった,細胞体で新規に生合成されたタンパク質がいかにしてシナプスの選択性をもつのかという問いにひとつの解をあたえ,今後の樹状突起でのシナプスの修飾および長期記憶の形成における分子機構の解明に大きく貢献するものと期待される.
文 献
- Link, W., Konietzko, U., Kauselmann, G. et al.: Somatodendritic expression of an immediate early gene is regulated by synaptic activity. Proc. Natl. Acad. Sci. USA, 92, 5734-5738 (1995)[PubMed]
- Lyford, G. L., Yamagata, K., Kaufmann, W. E. et al.: Arc, a growth factor and activity-regulated gene, encodes a novel cytoskeleton-associated protein that is enriched in neuronal dendrites. Neuron, 14, 433-445 (1995)[PubMed]
- Guzowski, J. F., McNaughton, B. L., Barnes, C. A. et al.: Environment-specific expression of the immediate-early gene Arc in hippocampal neuronal ensembles. Nat. Neurosci., 2, 1120-1124 (1999)[PubMed]
- Kawashima, T., Okuno, H., Nonaka, M. et al.: Synaptic activity-responsive element in the Arc/Arg3.1 promoter essential for synapse-to-nucleus signaling in activated neurons. Proc. Natl. Acad. Sci. USA, 106, 316-321 (2009)[PubMed]
- Plath, N., Ohana, O., Dammermann, B. et al.: Arc/Arg3.1 is essential for the consolidation of synaptic plasticity and memories. Neuron, 52, 437-444 (2006)[PubMed]
- McCurry, C. L., Shepherd, J. D., Tropea, D. et al.: Loss of Arc renders the visual cortex impervious to the effects of sensory experience or deprivation. Nat. Neurosci., 13, 450-457 (2010)[PubMed]
- Chowdhury, S., Shepherd, J.D., Okuno, H. et al.: Arc/Arg3.1 interacts with the endocytic machinery to regulate AMPA receptor trafficking. Neuron, 52, 445-459 (2006)[PubMed]
- Shepherd, J. D., Rumbaugh, G., Wu, J. et al.: Arc/Arg3.1 mediates homeostatic synaptic scaling of AMPA receptors. Neuron, 52, 475-484 (2006)[PubMed]
- Messaoudi, E., Kanhema, T., Soule, J. et al.: Sustained Arc/Arg3.1 synthesis controls long-term potentiation consolidation through regulation of local actin polymerization in the dentate gyrus in vivo. J. Neurosci., 27, 10445-10455 (2007)[PubMed]
- Frey, U. & Morris, R.G.: Synaptic tagging and long-term potentiation. Nature, 385, 533-536 (1997)[PubMed]
- Redondo, R. L., Okuno, H., Spooner, P. A. et al.: Synaptic tagging and capture: differential role of distinct calcium/calmodulin kinases in protein synthesis-dependent long-term potentiation. J. Neurosci., 30, 4981-4989 (2010)[PubMed]
著者プロフィール
略歴:1995年 東京大学大学院医学系研究科 修了,同年より同 助手(現 助教).2000年から2003年 米国Johns Hopkins大学School of Medicineポスドク研究員.
研究テーマ:神経活動に依存的に発現する前初期遺伝子の機能について,分子・細胞・回路・個体の階層をつなぐ研究をめざしています.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 准教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp
© 2012 奥野浩行・尾藤晴彦 Licensed under CC 表示 2.1 日本