細胞表層のダイニンと非対称な細胞膜の伸長が細胞の均等な分裂を保障する
清光 智美
(米国Whitehead Institute for Biomedical Research)
email:清光智美
DOI: 10.7875/first.author.2013.100
Cortical dynein and asymmetric membrane elongation coordinately position the spindle in anaphase.
Tomomi Kiyomitsu, Iain M. Cheeseman
Cell, 154, 391-402 (2013)
細胞分裂期における紡錘体の配置は細胞の分裂面の位置を規定するため,細胞分裂の対称性あるいは非対称性を決める重要な役割をもつ.細胞が対称分裂するためには,分裂期後期において紡錘体が細胞の中央に正確に配置されなければならないが,その分子機構は理解されていなかった.筆者らは,対称分裂するヒト細胞において,紡錘体の細胞の中央への配置を制御する2つの概念的に異なる分子機構を発見した.まず,紡錘体の配置のかたよりは細胞表層のダイニンに依存的な牽引力によって“紡錘体を動かす”ことにより修正された.また,予想外なことに,紡錘体の配置のかたよりは紡錘体の近傍の細胞膜が非対称に伸長し“細胞の境界を拡張する”ことによっても修正された.この非対称な細胞膜の伸長は分裂期後期の後半においてみられ,染色体から派生するRan-GTPシグナルに依存的に細胞表層のAnillinが減少することにより誘導された.筆者らは,これら2つの分子機構が協調的にはたらくことにより対称分裂が達成されると考えた.
細胞は分裂によりその数を増やす.その際,染色体に存在する遺伝情報は分配装置である紡錘体によりつねに均等に娘細胞に分配される1).一方,紡錘体から派生するシグナルは細胞の分裂面の位置を規定するため,紡錘体の配置は娘細胞の大きさおよび細胞内物質の分配比を規定し,細胞分裂の対称性あるいは非対称性を決める役割も担う2).多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.両者の適切な進行は正常な組織の形成に必須であるため,それらの制御機構を理解することは細胞分裂のみならず,個体の発生やがんの理解においても重要である.対称分裂あるいは非対称分裂の違いにかかわらず,多くの細胞において,紡錘体の配置は微小管結合モータータンパク質であるダイニンが細胞表層において紡錘体極から延びた星状体微小管を牽引する力により制御される2).そのため,細胞表層におけるダイニンの局在の制御を理解することがきわめて重要となる.
筆者らのグループおよびほかのグループは,対称分裂するHeLa細胞において,ダイニンはGαi-LGN-NuMA複合体と相互作用することにより細胞表層へ局在すること,また,これらのダイニン複合体は星状体微小管を牽引し,紡錘体の振動や軸の方向の規定に必須であることを明らかにしてきた3,4).しかしながら,ダイニンの上流のタンパク質であるLGNの発現を抑制した細胞においては,分裂期中期において紡錘体の軸の方向が異常になるにもかかわらず娘細胞のサイズはほぼ均等であった3)(新着論文レビュー でも掲載).これらの結果は,LGNに非依存的ななんらかのしくみが分裂期後期に存在し,細胞サイズの対称性を制御する可能性を示唆した.今回,筆者らは,分裂期後期においてLGNに非依存的にNuMAおよびダイニンが細胞表層に局在することを明らかにし,その責任タンパク質として4.1タンパク質の同定に成功した.LGNおよび4.1タンパク質の発現を抑制した細胞では分裂期後期においてダイニンは細胞表層へ局在できず,大小異なるサイズの娘細胞が観察された.さらに筆者らは,分裂期後期においてダイニンに依存的な紡錘体の牽引のほかにも,非対称な細胞膜の伸長による細胞の境界の拡張が紡錘体の細胞の中央への配置に機能することを発見した.筆者らは,細胞表層のダイニンが対称分裂に必要であることをはじめて実証するとともに,ダイニンによる牽引力と細胞膜の伸長とが協調的に制御されることにより細胞分裂の対称性が保障される,という新しい概念を提唱した.
これまで,ダイニンはGαi-LGN-NuMA複合体により分裂期に細胞表層へ局在することが示されてきた3,4).しかしながら,NuMAおよびダイニンはLGNあるいはGαiの発現を抑制した細胞においても分裂期後期の細胞表層に局在した.筆者らは,NuMAのC末端側の領域が分裂期後期における細胞表層への局在の責任部位であることを示し,そのNuMA断片に結合するタンパク質として4.1Gタンパク質および4.1Rタンパク質を同定した.実際に,LGNと4.1Gタンパク質および4.1Rタンパク質の発現を同時に抑制すると,ダイニンおよびNuMAは分裂期後期の細胞表層に局在しなくなった.また,このダイニンおよびNuMAの局在の欠損は,siRNAに耐性の4.1Gタンパク質の発現や,4.1タンパク質に保存されたC末端ドメインを細胞膜に人工的に局在させることで抑制されたことから,4.1タンパク質はC末端ドメインを介し分裂期後期にNuMAおよびダイニンを細胞表層に局在させることが示唆された.
HeLa細胞を含む大半の培養細胞は対称分裂し,それ自体の細胞のコピーを増やす.LGNあるいは4.1タンパク質のどちらか一方をノックダウンしたHeLa細胞ではほとんどの細胞がほぼ均等なサイズに分裂したが,両者の発現を同時に抑制すると10%以上の細胞においてきわめて不均等な細胞分裂が観察された.この非対称分裂もsiRNAに耐性のLGNや4.1Gタンパク質の全長,あるいは,細胞膜に局在する4.1タンパク質に保存されたC末端ドメインの断片を発現することにより抑制されたことから,細胞表層のダイニンが対称分裂に必要であることが示唆された.興味深いことに,サイズの異なる娘細胞は異なる細胞周期の速度を示したほか,小さい細胞の一部は細胞死を起こした.これは,哺乳類の細胞の性質が細胞サイズに依存することを示したはじめての例であり,哺乳類の細胞は酵母の細胞とは異なり,生存に必要な細胞サイズに閾値が存在することも示唆した.
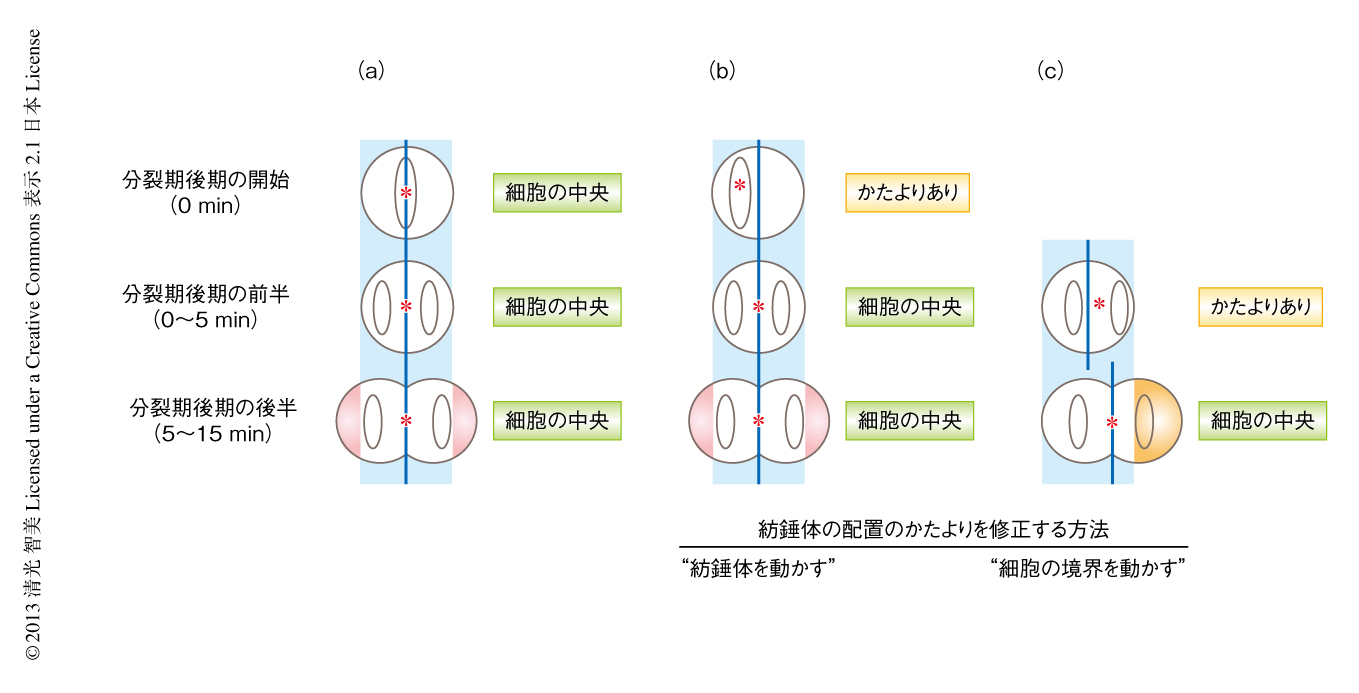
筆者らは,分裂期中期においては紡錘体の配置のかたよりに応じダイニンが紡錘体から遠い側の細胞表層に非対称に局在すること,また,その非対称に局在するダイニンが紡錘体の配置のかたよりを修正することを示してきた3).しかしながら,細胞のかたちが劇的に変化し紡錘体が伸長する分裂期後期においては,異なる紡錘体の配置の分子機構が存在する可能性もある.いかに細胞表層のダイニンが分裂期後期において紡錘体の細胞の中央への配置に機能するのかを理解する目的で,染色体,ダイニン,および,細胞表層のアクチンをそれぞれ蛍光タンパク質との融合タンパク質により可視化し,ダイニンの局在と紡錘体の配置との関連を生細胞において詳細に検討した.分裂期後期の開始の時点においてすでに紡錘体の中心が細胞の中央に配置されている場合には,細胞膜は左右対称に伸長した(図1a).分裂期後期の開始の時点において紡錘体の配置がかたよっていた場合,細胞のかたちの変化しない分裂期後期の前半(分裂期後期の開始から5分ほどのあいだ)では,分裂期中期と同様に,紡錘体の配置のかたよりに応じダイニンは非対称に局在し,紡錘体を細胞の中央の方向へと牽引することにより紡錘体の配置のかたよりを修正した(図1b).このしくみにより,約75%の細胞では分裂期後期の開始から5分以内に紡錘体は細胞の中央へと配置され,これらの細胞では,そののち,紡錘体極の付近の細胞膜が左右対称に伸長し,細胞質分裂までのあいだ紡錘体は細胞の中央に維持された.驚いたことに,残りの25%の細胞では紡錘体に近い側の細胞膜のみが非対称に伸長し,細胞の境界を非対称に拡張することにより紡錘体の配置のかたよりが修正されるという現象が観察された(図1c).筆者らの知るかぎり,対称分裂する細胞においてこのような非対称な細胞膜の伸長が観察されたのはこれがはじめてである.また,がん化したHeLa細胞のほかにも,不死化細胞株であるRpe1細胞において同様な現象が観察された.
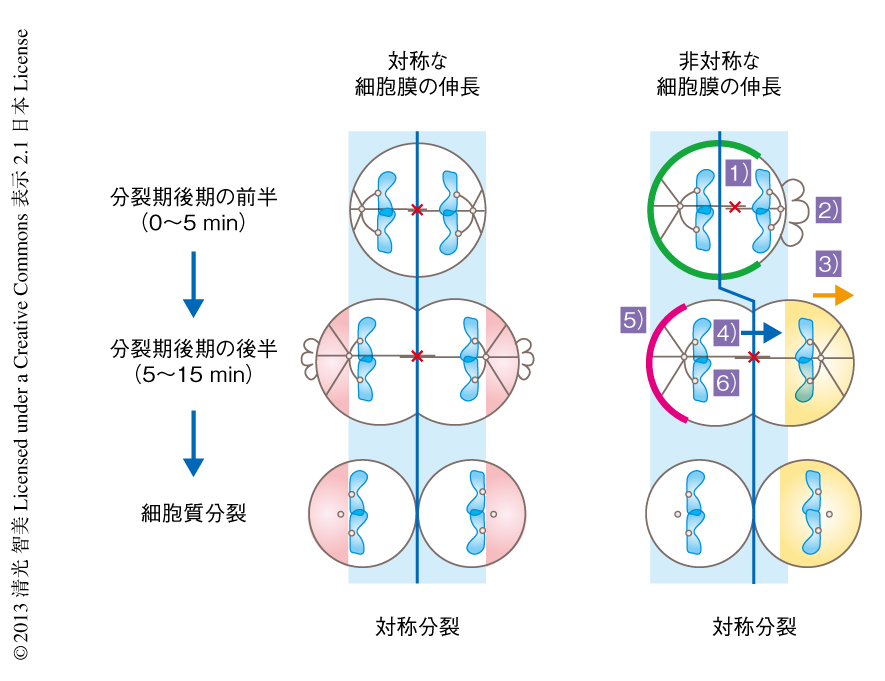
非対称な細胞膜の伸長におけるダイニンの役割を理解する目的で,対照となる細胞と,LGNと4.1タンパク質を同時にsiRNAによりノックダウンした細胞とを比較した.対照となる細胞ではダイニンは非対称に伸長する細胞膜とは逆側の細胞表層に局在し,紡錘体を牽引するために紡錘体が細胞の中央に配置されることがわかった(図2).一方,LGNと4.1タンパク質を同時にsiRNAによりノックダウンした細胞では,非対称な細胞膜の伸長にともない紡錘体が伸長の方向にかたより,その結果,大小異なるサイズの娘細胞が形成された.これらの結果は,非対称な細胞膜の伸長は紡錘体の配置のズレを修正するバックアップ装置として機能するものの,ダイニンと協調してはじめて中央への紡錘体の配置に機能することを示唆した.
それでは,細胞膜はどのような分子機構により紡錘体の位置情報を感知し,対称あるいは非対称に伸長するのだろうか? 細胞質分裂の際,細胞のかたちは細胞膜とアクチンとを連結するタンパク質の制御や,細胞膜を裏打ちするアクチン骨格の収縮により制御されている5).そこで,それらに関与するAnillinおよびミオシンの局在に注目した.その結果,紡錘体が中央に配置され細胞膜が左右対称に伸長する細胞においては,Anillinおよびミオシンは紡錘体極に近い細胞表層の両側で減少したが,非対称な細胞膜の伸長の際には紡錘体の近傍の細胞表層のみでAnillinおよびミオシンが非対称に減少していることが見い出された(図2).微小管の重合阻害剤のノコダゾールを添加し紡錘体を破壊した条件においても,染色体の近傍の細胞表層からAnillinおよびミオシンは減少したことから,染色体から派生したシグナルによりこれらの表層タンパク質が制御されていることが示唆された.分裂期中期の染色体からはRan-GTPの濃度勾配が形成されている6).このRan-GTPの濃度勾配は分裂期後期にも存在するため,Ran-GTPの濃度勾配を破壊するtsBN2温度感受性変異株7) を用いてRan-GTPの関与を検討した.すると,Anillinの局在は許容温度では染色体の近傍の細胞表層で減少したが,制限温度でRan-GTPの濃度勾配が破壊された条件では染色体の近傍の細胞表層にも局在した.さらに,分裂期後期を模倣するため,ノコダゾールを添加したのちCDKの阻害剤であるFlavopiridolをくわえた条件において細胞膜が伸長するかどうかを検討したところ,Anillinが減少した箇所から細胞膜の伸長が観察された.このような細胞膜の伸長は,制限温度においてtsBN2温度感受性変異株ではみられなかった.Anillinは分裂期後期において活性化したミオシンと結合することが報告されている.したがって,染色体から派生するRan-GTPシグナルがAnillinの局在の制御を介しミオシンの非対称な局在を誘導し,ミオシンにより内側に収縮する部分と,ミオシンがないため外側に弛緩する部分とが形成されることにより,非対称な細胞膜の伸長が誘導されると考えた(図2).
ほとんどすべての培養細胞やがん細胞株は対称に分裂する.また,多細胞生物の発生の過程においても細胞のコピーを増やすため対称分裂は必要不可欠である.近年,細胞の多様性を生み出す非対称分裂が精力的に研究されその分子機構がしだいに明らかにされてきたが,細胞がいかに均等なサイズの娘細胞に対称分裂するかという基本機構は明らかにされていなかった.筆者らの研究から,対称分裂する細胞は少なくとも2つのしくみをもち細胞サイズの対称性を維持していることが明らかになった.これまで,紡錘体の配置の研究はおもにダイニンなど微小管の牽引力を生み出すタンパク質に集中して行われてきたが2),今後は同時に,ミオシンなど細胞膜の伸長を制御するタンパク質にも注目して研究する必要がある.これら2つの分子機構はサイズの異なる細胞や非対称分裂する細胞においては異なる制御をうける可能性が高い.今後はまず,対称分裂する細胞においていかに紡錘体や染色体の位置情報が細胞表層へと伝えられ,ダイニンやミオシンなどモータータンパク質の局在の制御につながるのか,それらの分子機構を正確に理解したい.そののち,それらの分子機構を軸に,対称分裂から非対称分裂への変換機構,異なるサイズの細胞での分裂の制御機構の理解をめざしたいと考えている.
略歴:2008年 京都大学大学院生命科学研究科 修了,同年 同 博士研究員,2010年 米国Whitehead Institute for Biomedical Research博士研究員を経て,2013年より名古屋大学大学院理学研究科 助教.
研究テーマ:対称分裂において紡錘体の配置を制御するシステムの理解.
抱負:また予想外な発見をしたい.
© 2013 清光 智美 Licensed under CC 表示 2.1 日本
(米国Whitehead Institute for Biomedical Research)
email:清光智美
DOI: 10.7875/first.author.2013.100
Cortical dynein and asymmetric membrane elongation coordinately position the spindle in anaphase.
Tomomi Kiyomitsu, Iain M. Cheeseman
Cell, 154, 391-402 (2013)
要 約
細胞分裂期における紡錘体の配置は細胞の分裂面の位置を規定するため,細胞分裂の対称性あるいは非対称性を決める重要な役割をもつ.細胞が対称分裂するためには,分裂期後期において紡錘体が細胞の中央に正確に配置されなければならないが,その分子機構は理解されていなかった.筆者らは,対称分裂するヒト細胞において,紡錘体の細胞の中央への配置を制御する2つの概念的に異なる分子機構を発見した.まず,紡錘体の配置のかたよりは細胞表層のダイニンに依存的な牽引力によって“紡錘体を動かす”ことにより修正された.また,予想外なことに,紡錘体の配置のかたよりは紡錘体の近傍の細胞膜が非対称に伸長し“細胞の境界を拡張する”ことによっても修正された.この非対称な細胞膜の伸長は分裂期後期の後半においてみられ,染色体から派生するRan-GTPシグナルに依存的に細胞表層のAnillinが減少することにより誘導された.筆者らは,これら2つの分子機構が協調的にはたらくことにより対称分裂が達成されると考えた.
はじめに
細胞は分裂によりその数を増やす.その際,染色体に存在する遺伝情報は分配装置である紡錘体によりつねに均等に娘細胞に分配される1).一方,紡錘体から派生するシグナルは細胞の分裂面の位置を規定するため,紡錘体の配置は娘細胞の大きさおよび細胞内物質の分配比を規定し,細胞分裂の対称性あるいは非対称性を決める役割も担う2).多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.両者の適切な進行は正常な組織の形成に必須であるため,それらの制御機構を理解することは細胞分裂のみならず,個体の発生やがんの理解においても重要である.対称分裂あるいは非対称分裂の違いにかかわらず,多くの細胞において,紡錘体の配置は微小管結合モータータンパク質であるダイニンが細胞表層において紡錘体極から延びた星状体微小管を牽引する力により制御される2).そのため,細胞表層におけるダイニンの局在の制御を理解することがきわめて重要となる.
筆者らのグループおよびほかのグループは,対称分裂するHeLa細胞において,ダイニンはGαi-LGN-NuMA複合体と相互作用することにより細胞表層へ局在すること,また,これらのダイニン複合体は星状体微小管を牽引し,紡錘体の振動や軸の方向の規定に必須であることを明らかにしてきた3,4).しかしながら,ダイニンの上流のタンパク質であるLGNの発現を抑制した細胞においては,分裂期中期において紡錘体の軸の方向が異常になるにもかかわらず娘細胞のサイズはほぼ均等であった3)(新着論文レビュー でも掲載).これらの結果は,LGNに非依存的ななんらかのしくみが分裂期後期に存在し,細胞サイズの対称性を制御する可能性を示唆した.今回,筆者らは,分裂期後期においてLGNに非依存的にNuMAおよびダイニンが細胞表層に局在することを明らかにし,その責任タンパク質として4.1タンパク質の同定に成功した.LGNおよび4.1タンパク質の発現を抑制した細胞では分裂期後期においてダイニンは細胞表層へ局在できず,大小異なるサイズの娘細胞が観察された.さらに筆者らは,分裂期後期においてダイニンに依存的な紡錘体の牽引のほかにも,非対称な細胞膜の伸長による細胞の境界の拡張が紡錘体の細胞の中央への配置に機能することを発見した.筆者らは,細胞表層のダイニンが対称分裂に必要であることをはじめて実証するとともに,ダイニンによる牽引力と細胞膜の伸長とが協調的に制御されることにより細胞分裂の対称性が保障される,という新しい概念を提唱した.
1.分裂期後期においてダイニンは4.1タンパク質-NuMA経路を介し細胞表層へ局在する
これまで,ダイニンはGαi-LGN-NuMA複合体により分裂期に細胞表層へ局在することが示されてきた3,4).しかしながら,NuMAおよびダイニンはLGNあるいはGαiの発現を抑制した細胞においても分裂期後期の細胞表層に局在した.筆者らは,NuMAのC末端側の領域が分裂期後期における細胞表層への局在の責任部位であることを示し,そのNuMA断片に結合するタンパク質として4.1Gタンパク質および4.1Rタンパク質を同定した.実際に,LGNと4.1Gタンパク質および4.1Rタンパク質の発現を同時に抑制すると,ダイニンおよびNuMAは分裂期後期の細胞表層に局在しなくなった.また,このダイニンおよびNuMAの局在の欠損は,siRNAに耐性の4.1Gタンパク質の発現や,4.1タンパク質に保存されたC末端ドメインを細胞膜に人工的に局在させることで抑制されたことから,4.1タンパク質はC末端ドメインを介し分裂期後期にNuMAおよびダイニンを細胞表層に局在させることが示唆された.
2.細胞表層のダイニンは対称分裂に必要である
HeLa細胞を含む大半の培養細胞は対称分裂し,それ自体の細胞のコピーを増やす.LGNあるいは4.1タンパク質のどちらか一方をノックダウンしたHeLa細胞ではほとんどの細胞がほぼ均等なサイズに分裂したが,両者の発現を同時に抑制すると10%以上の細胞においてきわめて不均等な細胞分裂が観察された.この非対称分裂もsiRNAに耐性のLGNや4.1Gタンパク質の全長,あるいは,細胞膜に局在する4.1タンパク質に保存されたC末端ドメインの断片を発現することにより抑制されたことから,細胞表層のダイニンが対称分裂に必要であることが示唆された.興味深いことに,サイズの異なる娘細胞は異なる細胞周期の速度を示したほか,小さい細胞の一部は細胞死を起こした.これは,哺乳類の細胞の性質が細胞サイズに依存することを示したはじめての例であり,哺乳類の細胞は酵母の細胞とは異なり,生存に必要な細胞サイズに閾値が存在することも示唆した.
3.分裂期後期の後半における紡錘体の配置のかたよりは非対称な細胞膜の伸長により修正される
筆者らは,分裂期中期においては紡錘体の配置のかたよりに応じダイニンが紡錘体から遠い側の細胞表層に非対称に局在すること,また,その非対称に局在するダイニンが紡錘体の配置のかたよりを修正することを示してきた3).しかしながら,細胞のかたちが劇的に変化し紡錘体が伸長する分裂期後期においては,異なる紡錘体の配置の分子機構が存在する可能性もある.いかに細胞表層のダイニンが分裂期後期において紡錘体の細胞の中央への配置に機能するのかを理解する目的で,染色体,ダイニン,および,細胞表層のアクチンをそれぞれ蛍光タンパク質との融合タンパク質により可視化し,ダイニンの局在と紡錘体の配置との関連を生細胞において詳細に検討した.分裂期後期の開始の時点においてすでに紡錘体の中心が細胞の中央に配置されている場合には,細胞膜は左右対称に伸長した(図1a).分裂期後期の開始の時点において紡錘体の配置がかたよっていた場合,細胞のかたちの変化しない分裂期後期の前半(分裂期後期の開始から5分ほどのあいだ)では,分裂期中期と同様に,紡錘体の配置のかたよりに応じダイニンは非対称に局在し,紡錘体を細胞の中央の方向へと牽引することにより紡錘体の配置のかたよりを修正した(図1b).このしくみにより,約75%の細胞では分裂期後期の開始から5分以内に紡錘体は細胞の中央へと配置され,これらの細胞では,そののち,紡錘体極の付近の細胞膜が左右対称に伸長し,細胞質分裂までのあいだ紡錘体は細胞の中央に維持された.驚いたことに,残りの25%の細胞では紡錘体に近い側の細胞膜のみが非対称に伸長し,細胞の境界を非対称に拡張することにより紡錘体の配置のかたよりが修正されるという現象が観察された(図1c).筆者らの知るかぎり,対称分裂する細胞においてこのような非対称な細胞膜の伸長が観察されたのはこれがはじめてである.また,がん化したHeLa細胞のほかにも,不死化細胞株であるRpe1細胞において同様な現象が観察された.
非対称な細胞膜の伸長におけるダイニンの役割を理解する目的で,対照となる細胞と,LGNと4.1タンパク質を同時にsiRNAによりノックダウンした細胞とを比較した.対照となる細胞ではダイニンは非対称に伸長する細胞膜とは逆側の細胞表層に局在し,紡錘体を牽引するために紡錘体が細胞の中央に配置されることがわかった(図2).一方,LGNと4.1タンパク質を同時にsiRNAによりノックダウンした細胞では,非対称な細胞膜の伸長にともない紡錘体が伸長の方向にかたより,その結果,大小異なるサイズの娘細胞が形成された.これらの結果は,非対称な細胞膜の伸長は紡錘体の配置のズレを修正するバックアップ装置として機能するものの,ダイニンと協調してはじめて中央への紡錘体の配置に機能することを示唆した.
4.染色体から派生するRan-GTPシグナルが非対称な細胞膜の伸長に必要である
それでは,細胞膜はどのような分子機構により紡錘体の位置情報を感知し,対称あるいは非対称に伸長するのだろうか? 細胞質分裂の際,細胞のかたちは細胞膜とアクチンとを連結するタンパク質の制御や,細胞膜を裏打ちするアクチン骨格の収縮により制御されている5).そこで,それらに関与するAnillinおよびミオシンの局在に注目した.その結果,紡錘体が中央に配置され細胞膜が左右対称に伸長する細胞においては,Anillinおよびミオシンは紡錘体極に近い細胞表層の両側で減少したが,非対称な細胞膜の伸長の際には紡錘体の近傍の細胞表層のみでAnillinおよびミオシンが非対称に減少していることが見い出された(図2).微小管の重合阻害剤のノコダゾールを添加し紡錘体を破壊した条件においても,染色体の近傍の細胞表層からAnillinおよびミオシンは減少したことから,染色体から派生したシグナルによりこれらの表層タンパク質が制御されていることが示唆された.分裂期中期の染色体からはRan-GTPの濃度勾配が形成されている6).このRan-GTPの濃度勾配は分裂期後期にも存在するため,Ran-GTPの濃度勾配を破壊するtsBN2温度感受性変異株7) を用いてRan-GTPの関与を検討した.すると,Anillinの局在は許容温度では染色体の近傍の細胞表層で減少したが,制限温度でRan-GTPの濃度勾配が破壊された条件では染色体の近傍の細胞表層にも局在した.さらに,分裂期後期を模倣するため,ノコダゾールを添加したのちCDKの阻害剤であるFlavopiridolをくわえた条件において細胞膜が伸長するかどうかを検討したところ,Anillinが減少した箇所から細胞膜の伸長が観察された.このような細胞膜の伸長は,制限温度においてtsBN2温度感受性変異株ではみられなかった.Anillinは分裂期後期において活性化したミオシンと結合することが報告されている.したがって,染色体から派生するRan-GTPシグナルがAnillinの局在の制御を介しミオシンの非対称な局在を誘導し,ミオシンにより内側に収縮する部分と,ミオシンがないため外側に弛緩する部分とが形成されることにより,非対称な細胞膜の伸長が誘導されると考えた(図2).
おわりに
ほとんどすべての培養細胞やがん細胞株は対称に分裂する.また,多細胞生物の発生の過程においても細胞のコピーを増やすため対称分裂は必要不可欠である.近年,細胞の多様性を生み出す非対称分裂が精力的に研究されその分子機構がしだいに明らかにされてきたが,細胞がいかに均等なサイズの娘細胞に対称分裂するかという基本機構は明らかにされていなかった.筆者らの研究から,対称分裂する細胞は少なくとも2つのしくみをもち細胞サイズの対称性を維持していることが明らかになった.これまで,紡錘体の配置の研究はおもにダイニンなど微小管の牽引力を生み出すタンパク質に集中して行われてきたが2),今後は同時に,ミオシンなど細胞膜の伸長を制御するタンパク質にも注目して研究する必要がある.これら2つの分子機構はサイズの異なる細胞や非対称分裂する細胞においては異なる制御をうける可能性が高い.今後はまず,対称分裂する細胞においていかに紡錘体や染色体の位置情報が細胞表層へと伝えられ,ダイニンやミオシンなどモータータンパク質の局在の制御につながるのか,それらの分子機構を正確に理解したい.そののち,それらの分子機構を軸に,対称分裂から非対称分裂への変換機構,異なるサイズの細胞での分裂の制御機構の理解をめざしたいと考えている.
文 献
- Cheeseman, I. M. & Desai, A.: Molecular architecture of the kinetochore-microtubule interface. Nat. Rev. Mol. Cell Biol., 9, 33-46 (2008)[PubMed]
- McNally, F. J.: Mechanisms of spindle positioning. J. Cell Biol., 200, 131-140 (2013)[PubMed]
- Kiyomitsu, T. & Cheeseman, I. M.: Chromosome- and spindle-pole-derived signals generate an intrinsic code for spindle position and orientation. Nat. Cell Biol., 14, 311-317 (2012)[PubMed] [新着論文レビュー]
- Kotak, S., Busso, C. & Gonczy, P.: Cortical dynein is critical for proper spindle positioning in human cells. J. Cell Biol., 199, 97-110 (2012)[PubMed]
- Salbreux, G., Charras, G. & Paluch, E.: Actin cortex mechanics and cellular morphogenesis. Trends Cell Biol., 22, 536-545 (2012)[PubMed]
- Kalab, P., Pralle, A., Isacoff, E. Y. et al.: Analysis of a RanGTP-regulated gradient in mitotic somatic cells. Nature, 440, 697-701 (2006)[PubMed]
- Nishitani, H., Ohtsubo, M., Yamashita, K. et al.: Loss of RCC1, a nuclear DNA-binding protein, uncouples the completion of DNA replication from the activation of cdc2 protein kinase and mitosis. EMBO J., 10, 1555-1564 (1991)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院生命科学研究科 修了,同年 同 博士研究員,2010年 米国Whitehead Institute for Biomedical Research博士研究員を経て,2013年より名古屋大学大学院理学研究科 助教.
研究テーマ:対称分裂において紡錘体の配置を制御するシステムの理解.
抱負:また予想外な発見をしたい.
© 2013 清光 智美 Licensed under CC 表示 2.1 日本