分裂期における紡錘体の配置および軸の方向を規定する2つの細胞内法則
清光 智美
(米国Whitehead Institute for Biomedical Research)
email:清光智美
DOI: 10.7875/first.author.2012.040
Chromosome- and spindle-pole-derived signals generate an intrinsic code for spindle position and orientation.
Tomomi Kiyomitsu, Iain M. Cheeseman
Nature Cell Biology, 14, 311-317 (2012)
多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.この2つの細胞分裂の様式の選択は分裂期における紡錘体の配置および軸の方向に大きく依存するため,その制御機構を理解することは細胞分裂のみならず発生,分化,組織の維持の理解にもきわめて重要である.近年,非対称分裂において紡錘体の軸の方向を規定する発生シグナルおよび細胞外シグナルが同定され注目を集めているが,細胞がいかに細胞内における紡錘体の配置および軸の方向を認識し制御するのか,その制御機構は十分には理解されていない.分裂の様式の違いにかかわらず,多くの細胞において紡錘体の配置および軸の方向は,モータータンパク質であるダイニンが細胞皮質において紡錘体極から伸びた星状体微小管を牽引する力により制御される.したがって,細胞皮質におけるダイニンの局在の制御を理解することがきわめて重要となる.筆者らは,対称分裂するヒトの培養細胞において細胞皮質におけるダイニンの局在を制御する2つの細胞内シグナルとその責任タンパク質の同定に成功した.まず,紡錘体極から派生するPlk1のシグナルがダイニンとその上流タンパク質であるLGNとの結合を解離させることにより,細胞皮質におけるダイニンの局在を負に制御することを見い出した.このPlk1のシグナルは紡錘体が中央からずれた際に細胞皮質におけるダイニンの非対称な局在を誘導し,細胞の中央の方向へと牽引する非対称な力を生み出すため,紡錘体の細胞の中央への配置に貢献した.また,細胞の中央に整列した染色体から派生するRanGTPの濃度勾配のシグナルがダイニンの上流タンパク質LGNを染色体の近傍の細胞皮質から排除することも見い出した.このRanGTPの濃度勾配のシグナルはダイニンを細胞の側面の細胞皮質のみに限定して局在させることにより,紡錘体の軸を染色体の軸と垂直な一定の方向に維持した.筆者らは,これら紡錘体極および染色体から派生する2つの細胞内シグナルが,紡錘体の配置および軸の方向を規定する細胞内での法則をつくり出していると考えた.
細胞分裂はひとつの細胞から2つの独立な娘細胞を生み出す過程である.その過程では,微小管から構成される紡錘体が遺伝情報をもつ染色体を娘細胞に均等に分配することが肝要である1).一方,紡錘体の配置および軸の方向は,細胞分裂面および分裂軸の決定にも深く関与するため,紡錘体は染色体の分配のみならず,細胞内物質の分配,娘細胞の大きさと配置も規定しうる2).多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.この両者のバランスと制御が正しく維持されることが,組織の形成と維持に必須である.紡錘体の配置および軸の方向は,細胞分裂の対称性あるいは非対称性に深く関与するため,その制御機構を理解することは細胞分裂のみならず発生,分化,組織の維持の理解にも重要である.対称分裂と非対称分裂の違いにかかわらず,多くの細胞において紡錘体の配置および軸の方向はモータータンパク質であるダイニンが細胞皮質(cell cortex)において紡錘体極から伸びた星状体微小管を牽引する力により制御されている2).そのため,細胞皮質におけるダイニンの局在の制御を理解することはきわめて重要である.近年,とくに非対称分裂において,紡錘体の軸方向の制御に重要な発生シグナルおよび細胞外シグナルが同定されてきたが,ダイニンの局在を制御する細胞内シグナルについては十分に理解されていなかった.今回,筆者らは,対称分裂するヒトの培養細胞において,細胞皮質におけるダイニンの局在を制御する2つの細胞内シグナルおよびその責任タンパク質を同定することに成功した.
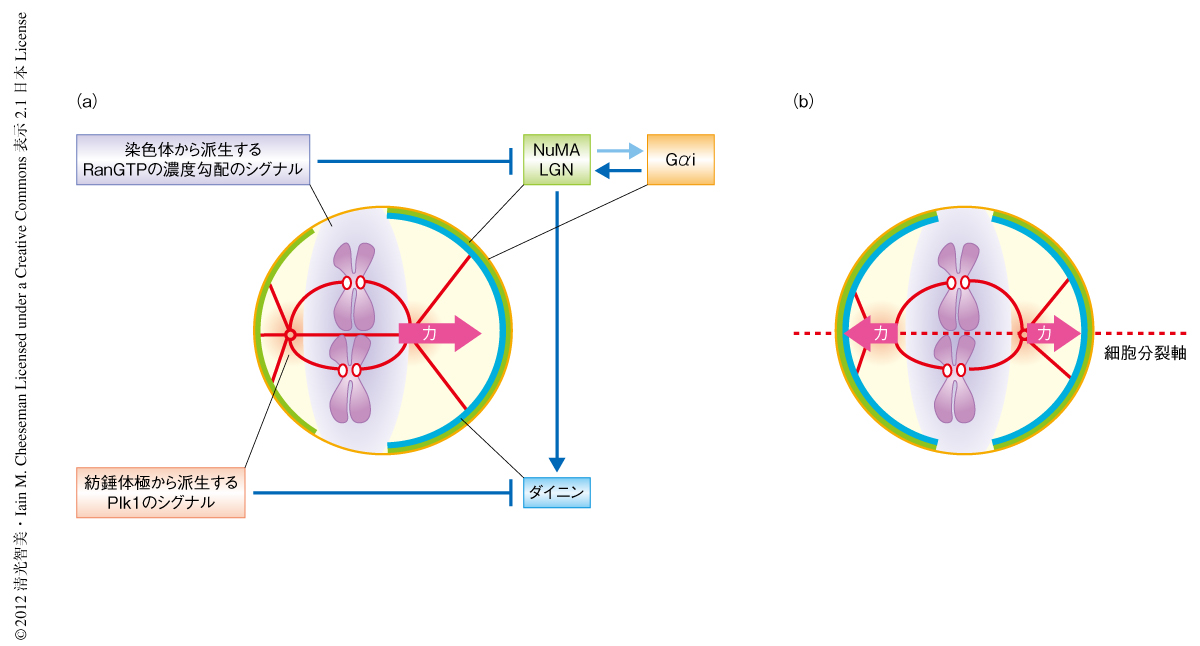
対称分裂により等しい大きさの2つの娘細胞に分裂するためには,紡錘体は細胞の中央に配置されなければならない.紡錘体の配置はダイニンが細胞皮質において紡錘体極から伸びた星状体微小管を牽引することより制御されていると考えられているため2),紡錘体を細胞の中央に配置するためには紡錘体の位置情報が正しく認識され,そのかたよりに応じ細胞皮質の牽引力が調整されなければならない.しかし,そのような紡錘体の配置の認識および補正の分子機構は理解されていなかった.そこで,その分子機構を理解する目的で,対称分裂するヒトの培養細胞であるHeLa細胞において,紡錘体が中央からずれた際に細胞皮質におけるダイニンおよびその上流タンパク質と考えられているLGNの局在を観察した.おもしろいことに,LGNは両方の側面の細胞皮質にほぼ対称に局在したが,ダイニンは紡錘体に近い細胞皮質から減少し,紡錘体から離れた細胞皮質に集積するという非対称な局在パターンを示した(図1a).そののちの紡錘体の動態を生細胞観察により追跡すると,紡錘体はダイニンの集積している細胞皮質の方向へと引き寄せられ,紡錘体が細胞皮質に接近しすぎるとふたたび細胞皮質におけるダイニンの局在が減少し,逆の側面の細胞皮質に集積した.このように,紡錘体は非対称に局在するダイニンにより細胞の中央の方向へと引き寄せられ,振動をくり返すうちにしだいに細胞の中央へと配置された(図1b).紡錘体の振動とダイニンの局在の変化との関連を調べると,細胞皮質におけるダイニンの局在は紡錘体極と細胞皮質とのあいだの距離に依存して制御されていることがわかった.これらの結果は,紡錘体極から派生するなんらかのシグナルが紡錘体の位置情報を細胞皮質へと伝え,ダイニンの局在を負に制御していることを示唆していた.では,紡錘体極から派生するシグナルは何なのだろうか?
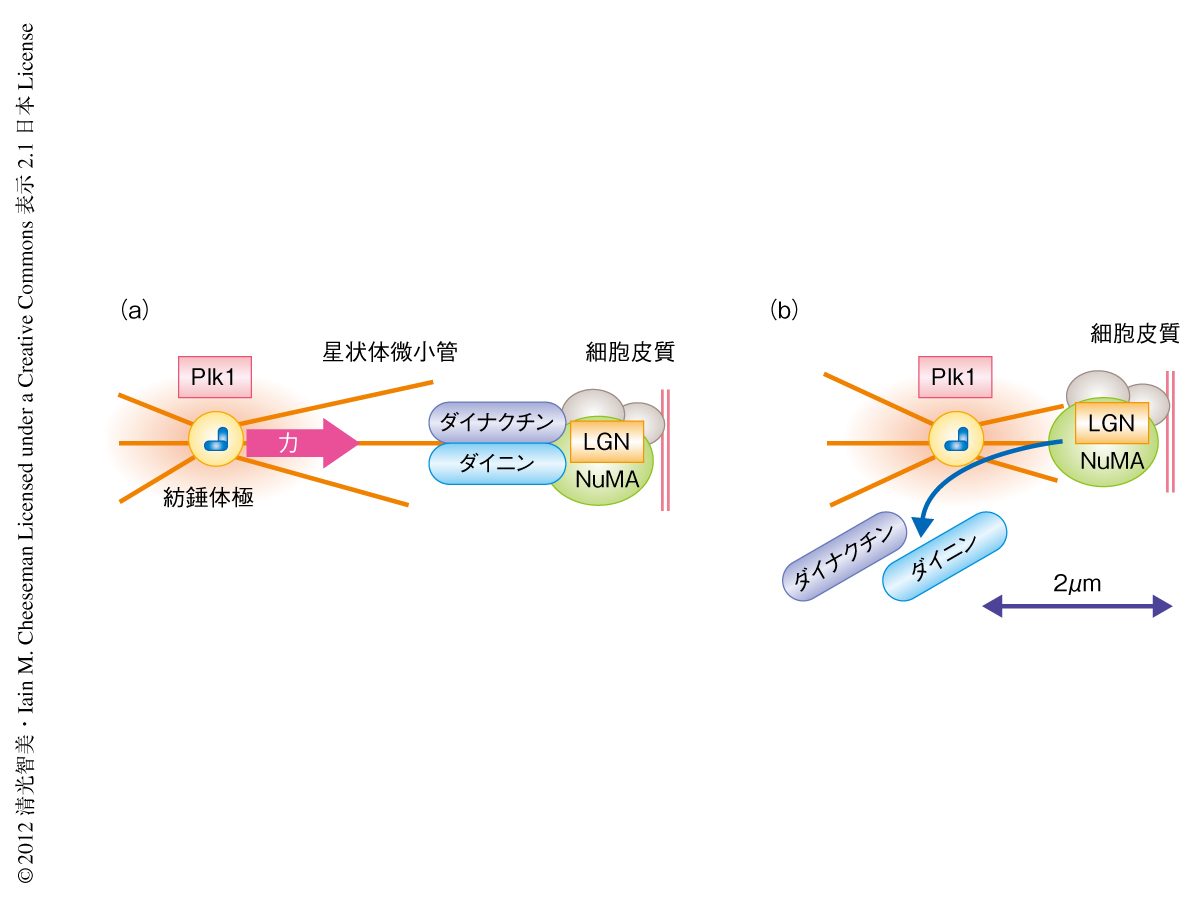
紡錘体極にはさまざまなキナーゼが集積している.近年,キナーゼは拡散により濃度勾配を形成し,距離に依存的に基質をリン酸化することが示唆されている3).筆者らは,紡錘体極に集積する多機能キナーゼであるPlk1に注目して研究を進めた.興味深いことに,Plk1の阻害剤であるBI2536を細胞にくわえると,紡錘体極の付近の細胞皮質においてもダイニンの局在が観察された.また,Plk1を強制的に細胞皮質に局在させると,細胞皮質におけるダイニンの局在は著しく減少した.不活性型Plk1を細胞皮質に局在させてもダイニンは影響をうけず,また,ダイニンの上流タンパク質であるLGNはPlk1により影響をうけなかったことから,Plk1はLGNの下流においてキナーゼ活性に依存的にダイニンの局在を負に制御すると考えられた.また,GFP-LGN融合タンパク質の免疫沈降,また,質量分析の結果から,LGNはNuMA,ダイニン,ダイナクチン(ダイニン結合タンパク質)と複合体を形成することがわかった.重要なことに,これらのタンパク質複合体に精製したPlk1を混合すると,NuMAは依然としてLGNと結合しているものの,ダイニンおよびダイナクチンはLGNから解離した.これらの結果は,紡錘体極に局在するPlk1がダイニンおよびダイナクチンと,NuMAおよびLGNとの結合を解離させることにより,ダイニンおよびダイナクチンの細胞皮質における局在を減少させることを示唆した(図2).
通常,HeLa細胞の紡錘体の軸の方向はXY平面上でランダムに配向する.しかし筆者らは,いったん軸の方向が規定されると,その方向は細胞分裂期をつうじて一定に維持されることを見い出した.紡錘体の軸の方向を維持するためには,牽引力の源であるダイニンは軸方向にそった細胞皮質の側面のみに限定的に局在し,力の軸の方向を一定に保つ必要がある.実際,ダイニンおよびその上流タンパク質であるLGNは細胞皮質の側面のみに限定的に局在する.しかし,どのような分子機構によりダイニンおよびLGNが側面のみに限定して局在するのかは理解されていなかった.染色体の軸はつねに紡錘体の軸と垂直に形成され,その染色体の付近の細胞皮質ではLGNの局在がつねに減少することから,染色体から派生するシグナルがLGNの細胞皮質における局在を負に制御するのではないかと仮定した.おもしろいことに,微小管の重合阻害剤であるノコダゾールを添加して染色体の整列および配置を壊した際のLGNの局在パターンを観察すると,LGNは染色体の近傍の細胞皮質から局所的に排除され,その制御には距離に依存的な関係のあることがわかった.これらの結果は,染色体に由来するなんらかシグナルが細胞皮質におけるLGNの局在を負に制御していることを示唆した.では,その染色体から派生するシグナルは何なのだろうか?
染色体から派生するシグナルの候補としてRanGTPの濃度勾配を検討した.RanはRas様GTPaseのひとつであり,GEF(guanine nucleaotide exchange factor,グアニンヌクレオチド交換因子)であるRCC1によりGDP結合型からGTP結合型へと変換される.RanGTPはImportinに結合し,核局在化シグナル配列を含むカーゴタンパク質をImportinから解離させることで,核輸送や紡錘体の形成などに機能することが報告されている4).RCC1は細胞周期をとおして染色体に結合するため,細胞分裂期においても染色体を中心にRanGTPの濃度勾配が形成される.通常,LGNは染色体の近傍の細胞皮質には局在できないが,ドミナントネガティブ型のRan変異タンパク質の過剰発現やRCC1遺伝子に変異をもつ温度感受性tsBN2細胞株を用いてRanGTPの濃度勾配を破壊すると,LGNは染色体の付近の細胞皮質にも局在した.また,ドミナントネガティブ型Ran変異タンパク質を過剰に発現した細胞では,紡錘体の軸の方向は一定に維持されなかった.以上の結果から,RanGTPの濃度勾配が染色体から派生するLGNの局在を制御するシグナルであり,対称分裂する細胞においてRanGTPの濃度勾配は紡錘体の軸の方向の規定あるいは維持に必要であると結論した.
RanGTPの濃度勾配はどのような分子機構によりLGNを細胞皮質から排除するのだろうか? LGNはC末端側で細胞皮質にあるGαiと,N末端側でNuMAと相互作用する5).また,NuMAは核局在化シグナル配列を含みRanGTPの標的タンパク質であることが報告されている6).興味深いことに,LGNのC末端の断片は細胞皮質の全体に局在し染色体の配置の影響をうけなかったが,このLGNのC末端の断片に核局在化シグナル配列を含むNuMAのC末端の断片を結合させると,このNuMA-LGN融合タンパク質は全長のLGNと同様に染色体の配置の影響をうけた.また,この染色体の配置の感受性はNuMAのC末端の断片に含まれる核局在化シグナル配列に依存的であった.これらの結果は,NuMAの核局在化シグナル配列がRanGTPの濃度勾配によるNuMAおよびLGNの細胞皮質からの解離に少なくとも一部は関与していることを示唆した.RanGTPの濃度勾配の詳細な作用機構を理解することは今後の重要な課題である.
対称分裂は非対称分裂と同様に発生および組織の形成に必須である.これまで,非対称分裂に必須な発生シグナルおよび細胞外シグナルについては精力的に研究されてきたが,対称分裂に機能する細胞内シグナルは理解されていなかった.筆者らは,紡錘体極から派生するPlk1のシグナルおよび染色体から派生するRanGTPの濃度勾配のシグナルが,それぞれ,紡錘体および染色体の位置情報を細胞皮質に伝え,細胞皮質におけるダイニンの局在を制御することで,紡錘体の配置および軸の方向を制御することを見い出した(図1).今後は,Plk1およびRanGTPの濃度勾配のそれぞれの下流で起こる生化学反応,および,これら対称分裂の細胞内シグナルが非対称分裂細胞またサイズの大きな細胞において発生シグナルあるいは細胞外シグナルとどのように協調して機能するのか,それらの分子機構を理解したい.
略歴:2008年 京都大学大学院生命科学研究科 修了,同年 同 博士研究員を経て,2010年より米国Whitehead Institute for Biomedical Research博士研究員.
© 2012 清光 智美 Licensed under CC 表示 2.1 日本
(米国Whitehead Institute for Biomedical Research)
email:清光智美
DOI: 10.7875/first.author.2012.040
Chromosome- and spindle-pole-derived signals generate an intrinsic code for spindle position and orientation.
Tomomi Kiyomitsu, Iain M. Cheeseman
Nature Cell Biology, 14, 311-317 (2012)
要 約
多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.この2つの細胞分裂の様式の選択は分裂期における紡錘体の配置および軸の方向に大きく依存するため,その制御機構を理解することは細胞分裂のみならず発生,分化,組織の維持の理解にもきわめて重要である.近年,非対称分裂において紡錘体の軸の方向を規定する発生シグナルおよび細胞外シグナルが同定され注目を集めているが,細胞がいかに細胞内における紡錘体の配置および軸の方向を認識し制御するのか,その制御機構は十分には理解されていない.分裂の様式の違いにかかわらず,多くの細胞において紡錘体の配置および軸の方向は,モータータンパク質であるダイニンが細胞皮質において紡錘体極から伸びた星状体微小管を牽引する力により制御される.したがって,細胞皮質におけるダイニンの局在の制御を理解することがきわめて重要となる.筆者らは,対称分裂するヒトの培養細胞において細胞皮質におけるダイニンの局在を制御する2つの細胞内シグナルとその責任タンパク質の同定に成功した.まず,紡錘体極から派生するPlk1のシグナルがダイニンとその上流タンパク質であるLGNとの結合を解離させることにより,細胞皮質におけるダイニンの局在を負に制御することを見い出した.このPlk1のシグナルは紡錘体が中央からずれた際に細胞皮質におけるダイニンの非対称な局在を誘導し,細胞の中央の方向へと牽引する非対称な力を生み出すため,紡錘体の細胞の中央への配置に貢献した.また,細胞の中央に整列した染色体から派生するRanGTPの濃度勾配のシグナルがダイニンの上流タンパク質LGNを染色体の近傍の細胞皮質から排除することも見い出した.このRanGTPの濃度勾配のシグナルはダイニンを細胞の側面の細胞皮質のみに限定して局在させることにより,紡錘体の軸を染色体の軸と垂直な一定の方向に維持した.筆者らは,これら紡錘体極および染色体から派生する2つの細胞内シグナルが,紡錘体の配置および軸の方向を規定する細胞内での法則をつくり出していると考えた.
はじめに
細胞分裂はひとつの細胞から2つの独立な娘細胞を生み出す過程である.その過程では,微小管から構成される紡錘体が遺伝情報をもつ染色体を娘細胞に均等に分配することが肝要である1).一方,紡錘体の配置および軸の方向は,細胞分裂面および分裂軸の決定にも深く関与するため,紡錘体は染色体の分配のみならず,細胞内物質の分配,娘細胞の大きさと配置も規定しうる2).多細胞生物は対称分裂により同じ細胞を増やし,非対称分裂により細胞の多様性を生み出す.この両者のバランスと制御が正しく維持されることが,組織の形成と維持に必須である.紡錘体の配置および軸の方向は,細胞分裂の対称性あるいは非対称性に深く関与するため,その制御機構を理解することは細胞分裂のみならず発生,分化,組織の維持の理解にも重要である.対称分裂と非対称分裂の違いにかかわらず,多くの細胞において紡錘体の配置および軸の方向はモータータンパク質であるダイニンが細胞皮質(cell cortex)において紡錘体極から伸びた星状体微小管を牽引する力により制御されている2).そのため,細胞皮質におけるダイニンの局在の制御を理解することはきわめて重要である.近年,とくに非対称分裂において,紡錘体の軸方向の制御に重要な発生シグナルおよび細胞外シグナルが同定されてきたが,ダイニンの局在を制御する細胞内シグナルについては十分に理解されていなかった.今回,筆者らは,対称分裂するヒトの培養細胞において,細胞皮質におけるダイニンの局在を制御する2つの細胞内シグナルおよびその責任タンパク質を同定することに成功した.
1.ダイニンは紡錘体の配置のかたよりに応じ細胞皮質に非対称に局在し非対称な力を生み出す
対称分裂により等しい大きさの2つの娘細胞に分裂するためには,紡錘体は細胞の中央に配置されなければならない.紡錘体の配置はダイニンが細胞皮質において紡錘体極から伸びた星状体微小管を牽引することより制御されていると考えられているため2),紡錘体を細胞の中央に配置するためには紡錘体の位置情報が正しく認識され,そのかたよりに応じ細胞皮質の牽引力が調整されなければならない.しかし,そのような紡錘体の配置の認識および補正の分子機構は理解されていなかった.そこで,その分子機構を理解する目的で,対称分裂するヒトの培養細胞であるHeLa細胞において,紡錘体が中央からずれた際に細胞皮質におけるダイニンおよびその上流タンパク質と考えられているLGNの局在を観察した.おもしろいことに,LGNは両方の側面の細胞皮質にほぼ対称に局在したが,ダイニンは紡錘体に近い細胞皮質から減少し,紡錘体から離れた細胞皮質に集積するという非対称な局在パターンを示した(図1a).そののちの紡錘体の動態を生細胞観察により追跡すると,紡錘体はダイニンの集積している細胞皮質の方向へと引き寄せられ,紡錘体が細胞皮質に接近しすぎるとふたたび細胞皮質におけるダイニンの局在が減少し,逆の側面の細胞皮質に集積した.このように,紡錘体は非対称に局在するダイニンにより細胞の中央の方向へと引き寄せられ,振動をくり返すうちにしだいに細胞の中央へと配置された(図1b).紡錘体の振動とダイニンの局在の変化との関連を調べると,細胞皮質におけるダイニンの局在は紡錘体極と細胞皮質とのあいだの距離に依存して制御されていることがわかった.これらの結果は,紡錘体極から派生するなんらかのシグナルが紡錘体の位置情報を細胞皮質へと伝え,ダイニンの局在を負に制御していることを示唆していた.では,紡錘体極から派生するシグナルは何なのだろうか?
2.紡錘体極から派生するPlk1のシグナルが細胞皮質におけるダイニンの局在を負に制御する
紡錘体極にはさまざまなキナーゼが集積している.近年,キナーゼは拡散により濃度勾配を形成し,距離に依存的に基質をリン酸化することが示唆されている3).筆者らは,紡錘体極に集積する多機能キナーゼであるPlk1に注目して研究を進めた.興味深いことに,Plk1の阻害剤であるBI2536を細胞にくわえると,紡錘体極の付近の細胞皮質においてもダイニンの局在が観察された.また,Plk1を強制的に細胞皮質に局在させると,細胞皮質におけるダイニンの局在は著しく減少した.不活性型Plk1を細胞皮質に局在させてもダイニンは影響をうけず,また,ダイニンの上流タンパク質であるLGNはPlk1により影響をうけなかったことから,Plk1はLGNの下流においてキナーゼ活性に依存的にダイニンの局在を負に制御すると考えられた.また,GFP-LGN融合タンパク質の免疫沈降,また,質量分析の結果から,LGNはNuMA,ダイニン,ダイナクチン(ダイニン結合タンパク質)と複合体を形成することがわかった.重要なことに,これらのタンパク質複合体に精製したPlk1を混合すると,NuMAは依然としてLGNと結合しているものの,ダイニンおよびダイナクチンはLGNから解離した.これらの結果は,紡錘体極に局在するPlk1がダイニンおよびダイナクチンと,NuMAおよびLGNとの結合を解離させることにより,ダイニンおよびダイナクチンの細胞皮質における局在を減少させることを示唆した(図2).
3.染色体から派生するRanGTPの濃度勾配のシグナルが細胞皮質からLGNを排除する
通常,HeLa細胞の紡錘体の軸の方向はXY平面上でランダムに配向する.しかし筆者らは,いったん軸の方向が規定されると,その方向は細胞分裂期をつうじて一定に維持されることを見い出した.紡錘体の軸の方向を維持するためには,牽引力の源であるダイニンは軸方向にそった細胞皮質の側面のみに限定的に局在し,力の軸の方向を一定に保つ必要がある.実際,ダイニンおよびその上流タンパク質であるLGNは細胞皮質の側面のみに限定的に局在する.しかし,どのような分子機構によりダイニンおよびLGNが側面のみに限定して局在するのかは理解されていなかった.染色体の軸はつねに紡錘体の軸と垂直に形成され,その染色体の付近の細胞皮質ではLGNの局在がつねに減少することから,染色体から派生するシグナルがLGNの細胞皮質における局在を負に制御するのではないかと仮定した.おもしろいことに,微小管の重合阻害剤であるノコダゾールを添加して染色体の整列および配置を壊した際のLGNの局在パターンを観察すると,LGNは染色体の近傍の細胞皮質から局所的に排除され,その制御には距離に依存的な関係のあることがわかった.これらの結果は,染色体に由来するなんらかシグナルが細胞皮質におけるLGNの局在を負に制御していることを示唆した.では,その染色体から派生するシグナルは何なのだろうか?
4.RanGTPの濃度勾配はLGNを細胞皮質から解離させる
染色体から派生するシグナルの候補としてRanGTPの濃度勾配を検討した.RanはRas様GTPaseのひとつであり,GEF(guanine nucleaotide exchange factor,グアニンヌクレオチド交換因子)であるRCC1によりGDP結合型からGTP結合型へと変換される.RanGTPはImportinに結合し,核局在化シグナル配列を含むカーゴタンパク質をImportinから解離させることで,核輸送や紡錘体の形成などに機能することが報告されている4).RCC1は細胞周期をとおして染色体に結合するため,細胞分裂期においても染色体を中心にRanGTPの濃度勾配が形成される.通常,LGNは染色体の近傍の細胞皮質には局在できないが,ドミナントネガティブ型のRan変異タンパク質の過剰発現やRCC1遺伝子に変異をもつ温度感受性tsBN2細胞株を用いてRanGTPの濃度勾配を破壊すると,LGNは染色体の付近の細胞皮質にも局在した.また,ドミナントネガティブ型Ran変異タンパク質を過剰に発現した細胞では,紡錘体の軸の方向は一定に維持されなかった.以上の結果から,RanGTPの濃度勾配が染色体から派生するLGNの局在を制御するシグナルであり,対称分裂する細胞においてRanGTPの濃度勾配は紡錘体の軸の方向の規定あるいは維持に必要であると結論した.
5.NuMAのもつ核局在化シグナル配列はLGNの細胞皮質からの解離に関与する
RanGTPの濃度勾配はどのような分子機構によりLGNを細胞皮質から排除するのだろうか? LGNはC末端側で細胞皮質にあるGαiと,N末端側でNuMAと相互作用する5).また,NuMAは核局在化シグナル配列を含みRanGTPの標的タンパク質であることが報告されている6).興味深いことに,LGNのC末端の断片は細胞皮質の全体に局在し染色体の配置の影響をうけなかったが,このLGNのC末端の断片に核局在化シグナル配列を含むNuMAのC末端の断片を結合させると,このNuMA-LGN融合タンパク質は全長のLGNと同様に染色体の配置の影響をうけた.また,この染色体の配置の感受性はNuMAのC末端の断片に含まれる核局在化シグナル配列に依存的であった.これらの結果は,NuMAの核局在化シグナル配列がRanGTPの濃度勾配によるNuMAおよびLGNの細胞皮質からの解離に少なくとも一部は関与していることを示唆した.RanGTPの濃度勾配の詳細な作用機構を理解することは今後の重要な課題である.
おわりに
対称分裂は非対称分裂と同様に発生および組織の形成に必須である.これまで,非対称分裂に必須な発生シグナルおよび細胞外シグナルについては精力的に研究されてきたが,対称分裂に機能する細胞内シグナルは理解されていなかった.筆者らは,紡錘体極から派生するPlk1のシグナルおよび染色体から派生するRanGTPの濃度勾配のシグナルが,それぞれ,紡錘体および染色体の位置情報を細胞皮質に伝え,細胞皮質におけるダイニンの局在を制御することで,紡錘体の配置および軸の方向を制御することを見い出した(図1).今後は,Plk1およびRanGTPの濃度勾配のそれぞれの下流で起こる生化学反応,および,これら対称分裂の細胞内シグナルが非対称分裂細胞またサイズの大きな細胞において発生シグナルあるいは細胞外シグナルとどのように協調して機能するのか,それらの分子機構を理解したい.
文 献
- Cheeseman, I. M. & Desai, A.: Molecular architecture of the kinetochore-microtubule interface. Nat. Rev. Mol. Cell Biol., 9, 33-46 (2008)[PubMed]
- Siller, K. H. & Doe, C. Q.: Spindle orientation during asymmetric cell division. Nat. Cell Biol., 11, 365-374 (2009)[PubMed]
- Wang, E., Ballister, E. R. & Lampson, M. A.: Aurora B dynamics at centromeres create a diffusion-based phosphorylation gradient. J. Cell Biol., 194, 539-549 (2011)[PubMed]
- Kalab, P. & Heald, R.: The RanGTP gradient: a GPS for the mitotic spindle. J. Cell Sci., 121, 1577-1586 (2008)[PubMed]
- Du, Q. & Macara, I. G.: Mammalian Pins is a conformational switch that links NuMA to heterotrimeric G proteins. Cell, 119, 503-516 (2004)[PubMed]
- Nachury, M. V., Maresca, T. J., Salmon, W. C. et al.: Importinβ is a mitotic target of the small GTPase Ran in spindle assembly. Cell, 104, 95-106 (2001)[PubMed]
著者プロフィール
略歴:2008年 京都大学大学院生命科学研究科 修了,同年 同 博士研究員を経て,2010年より米国Whitehead Institute for Biomedical Research博士研究員.
© 2012 清光 智美 Licensed under CC 表示 2.1 日本