リンパ球に特異的なアクチン脱キャッピングタンパク質RltprはCD28を介するT細胞の活性化と制御性T細胞の分化に必須である
横須賀 忠1・斉藤 隆1・Bernard Malissen 2
(1理化学研究所統合生命医科学研究センター 免疫シグナル研究グループ,2フランスAix Marseille大学Centre d'Immunologie de Marseille-Luminy)
email:横須賀 忠,斉藤 隆
DOI: 10.7875/first.author.2013.089
The lymphoid lineage-specific actin-uncapping protein Rltpr is essential for costimulation via CD28 and the development of regulatory T cells.
Yinming Liang, Margot Cucchetti, Romain Roncagalli, Tadashi Yokosuka, Aurélie Malzac, Elodie Bertosio, Jean Imbert, Isaac J. Nijman, Miloslav Suchanek, Takashi Saito, Christoph Wülfing, Bernard Malissen, Marie Malissen
Nature Immunology, 14, 858-866 (2013)
T細胞が活性化しエフェクター機能を発揮するためには,T細胞受容体からの刺激と同時に,補助刺激受容体であるCD28からのシグナルが必須である.突然変異誘発スクリーニングにより,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprは,CD28からの補助刺激シグナルを介したT細胞の活性化と制御性T細胞の分化に必須であることが明らかになった.CD28とリガンドとの結合により,野生型および変異型のRltprはT細胞と抗原提示細胞とのあいだに形成されるT細胞の活性化のための構造である“免疫シナプス”に集合し,CD28とともにクラスターを形成した.しかし,変異型RltprをもつT細胞ではCD28の下流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθ-Carma1複合体とCD28との共役が障害され,これがRltpr変異マウスにおけるT細胞の活性化の低下の原因と考えられた.Rltprは多機能タンパク質として,補助刺激受容体からのシグナルとアクチンの重合とを同時に制御する新たなカテゴリーのシグナル伝達タンパク質であった.
体内に侵入した病原体や異物は,まず樹状細胞やマクロファージなどの抗原提示細胞により貪食され,抗原として提示される.T細胞は抗原提示細胞により提示された抗原をT細胞受容体を介して認識し,T細胞は活性化および分裂しエフェクター細胞へと分化する.胸腺においては,T細胞が異物のみを認識し自己を攻撃しないよう,適切な抗原特異性をもつT細胞受容体が選択される過程,いわゆる“自己と非自己”の教育が行われる.この胸腺選択ではT細胞受容体からのシグナルの強弱が決定因子であり,T細胞受容体シグナルの軽微な破綻が自己免疫疾患やアレルギーをひき起こすと考えられている1,2).アルキル化剤であるN-エチル-N-ニトロソ尿素により誘発した突然変異スクリーニングによりみつかった,T細胞受容体の下流に位置する膜型アダプタータンパク質LATにおいて136番目のThrがPheに変異したマウスでは,CD4陽性T細胞の異常な活性化と増殖,2型ヘルパー細胞への分化誘導の促進,それら活性化したT細胞の組織への浸潤とT細胞に誘導されたB細胞の異常な活性化が起こる1).
一方,T細胞が十分なエフェクター機能を獲得するためには,T細胞受容体からのシグナルにくわえて,補助刺激受容体やサイトカイン受容体からのシグナルが必須である.とくに,正の補助刺激受容体であるCD28は細胞の増殖やサイトカインの産生などT細胞の基本的な機能のため必須であり,制御性T細胞への分化にも寄与している.CD28の下流のシグナル伝達系はT細胞受容体からのシグナル伝達系と共通するところも多いため詳細は不明であったが,近年の筆者らによる分子イメージング法を用いた研究から,CD28はNF-κB経路の上流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθおよび足場タンパク質Carma1とともにシグナル伝達のための複合体を形成し,NF-κB経路を介しT細胞を活性化させることがわかってきた3-5).
T細胞が抗原提示細胞から情報をうけとる際に,この2つの細胞は強固に接着し,その接着面には神経系のニューロンと似たシナプス構造を形成することが知られており“免疫シナプス”とよばれている6).免疫シナプスは中心部より,T細胞受容体が凝集した中心部超分子クラスター(central-supramolecular activation cluster:c-SMAC),T細胞受容体をとりかこむ接着分子からなる周辺部超分子クラスター(peripheral-SMAC:p-SMAC),接着面からはじきだされた背の高い膜型脱リン酸化酵素からなる遠位部超分子クラスター(distal-SMAC:d-SMAC)からなる,直径が約10~20μmの同心円の構造をとる.これまで,筆者らは,免疫シナプスがさらに小さなT細胞受容体とシグナル伝達タンパク質の集合体である“T細胞受容体ミクロクラスター”から構成され,ミクロクラスターがT細胞の活性化のユニットとしてはたらくことを明らかにしてきた7,8).今回の研究では,CD28-プロテインキナーゼCθ-Carma1複合体からなるNF-κB経路における活性中心の形成において必須である,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprを突然変異誘発スクリーングにより発見し,そのT細胞の活性化の制御機構を明らかにした.
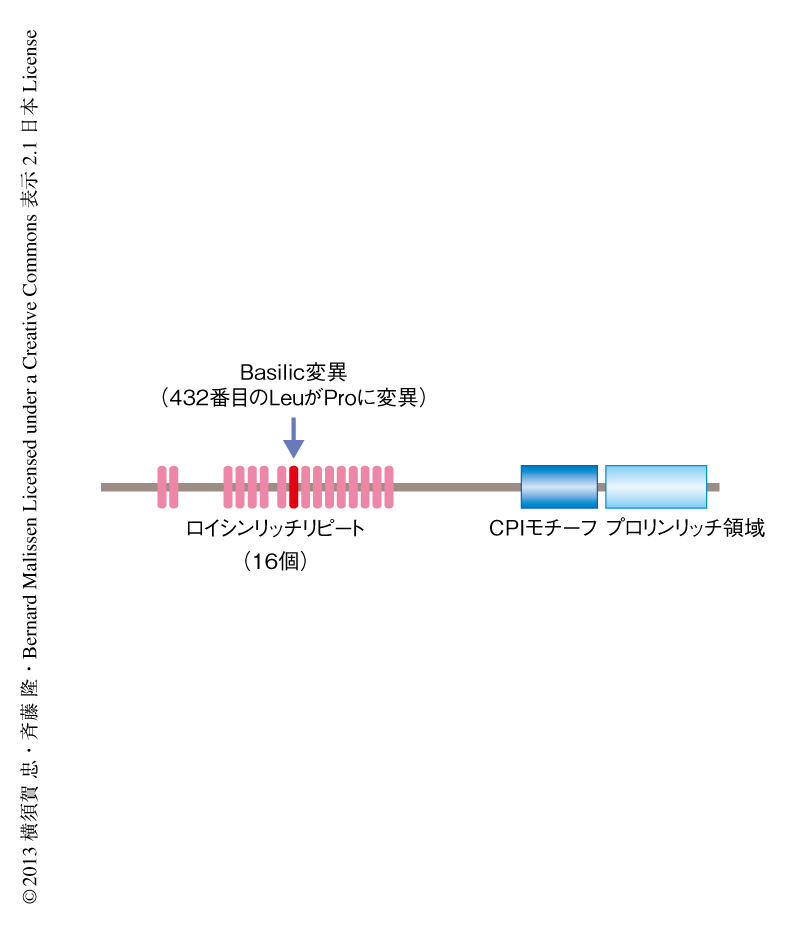
136番目のThrがPheに変異したLATを発現するマウスにおいてみられるCD4陽性T細胞の異常な活性化はなぜ起こるのか,その責任タンパク質を同定するため,このLAT変異ホモ接合体マウスをもとに,ふたたびN-エチル-N-ニトロソ尿素により誘発した突然変異スクリーニングを行ったところ,表現型が正常化した個体としてBasilic変異をもつLAT変異ホモ接合体マウスの単離に成功した.高解像度のハプロタイプマッピングより,Basilic変異は第8染色体に存在する16 Mbにあることがわかり,次世代シークエンサーによる塩基配列の決定により判明した30個の遺伝子多型のうち,3個の遺伝子多型が3個のタンパク質に相当し,最終的に求める変異はリンパ球に特異的なアクチン脱キャッピングタンパク質Rltpr(Lrrc16cとしても知られる)に存在する432番目のLeuのProへの置換であることがわかった.Rltpr遺伝子は39個のエクソンからなり,Rltprは1397のアミノ酸残基からなる150 kDaのタンパク質で16個のロイシンリッチリピート,CPIモチーフ,プロリンリッチ領域から構成され,マウスのパラログLrrc16aおよびLrrc16bとともにLRRCファミリーを構成する9)(図1).CPIモチーフがキャッピングタンパク質と結合しこれをアクチンフィラメントの先端からはずすことから,LRRCファミリーはアクチンフィラメントの伸長を誘導するタンパク質と考えられていた.Basilic変異は8番目のロイシンリッチリピートに存在し,Basilic変異をもつRltprの発現は野生型の半分ほどに低下していたが,Basilic変異をもつRltprとキャッピングタンパク質との結合は正常であった.Rltprの発現は成熟したマウスの胸腺および脾臓において高く,骨髄,脳,精巣ではほとんど発現のなかったことから,リンパ球,とくに,T細胞に特異的なアクチン脱キャッピングタンパク質と考えられた.胸腺細胞のなかでもCD69陰性CD4陽性CD8陽性細胞においてもっとも発現が高く,CD69陽性CD4陽性CD8陽性細胞,CD4陽性細胞またはCD8陽性細胞へとより分化が進むにつれその発現は低下したが,末梢のT細胞においても中等度に維持されていた.
これまでの研究から,LAT変異ホモ接合体マウスとCD28のリガンドであるCD80およびCD86を欠損したマウスとを交配すると,LAT変異ホモ接合体マウスにおいてみられたCD4陽性T細胞およびB細胞の活性化の消失することがわかっていた10).そこで,LATには変異をもたないBasilic変異Rltprを発現したマウスとCD28欠損マウスのT細胞を詳細に比較することにした.どちらも野生型のマウスに比べ胸腺細胞の数はやや多く,また,胸腺細胞の分化,正の選択および負の選択は正常であった.Basilic変異Rltprを発現したマウスの胸腺および末梢のT細胞におけるCD28の発現は野生型マウスと同じであったが,抗CD3抗体および抗CD28抗体の刺激による細胞増殖および細胞分裂,また,サイトカインの産生はCD28欠損マウスと同じ程度に低かった.Basilic変異Rltprを発現したT細胞における反応性の低下は,抗原特異的なT細胞受容体のトランスジェニックマウスと交配し特異的な抗原ペプチドと抗原提示細胞を用いた実験系においてもみられ,野生型のT細胞をCD80 CD86二重欠損マウスの抗原提示細胞により刺激した場合と同じであったが,外部からのインターロイキン2の添加により野生型T細胞と同じ程度にまで回復した.一方,抗CD3抗体の刺激によるT細胞受容体の下流に位置するシグナル伝達タンパク質のチロシンリン酸化や,Ca2+の細胞内での動態,T細胞受容体の刺激により生じるCD28の細胞内チロシンモチーフのリン酸化は正常であったことから,Basilic変異はT細胞受容体ではなく,CD28に限定したシグナル伝達の減弱を示すと考えられた.それを裏づけるように,CD28欠損マウスと同様に,Basilic変異Rltprを発現したマウスの胸腺において分化誘導された制御性T細胞の割合は20%まで低下していた.Basilic変異Rltprを発現したマウスに新たに作製したRltpr欠損マウスを交配したマウスでも同様の表現型を示したことから,これらの表現型は突然変異の誘発によるほかのタンパク質の異常ではなく,Basilic変異によるものと考えられた.
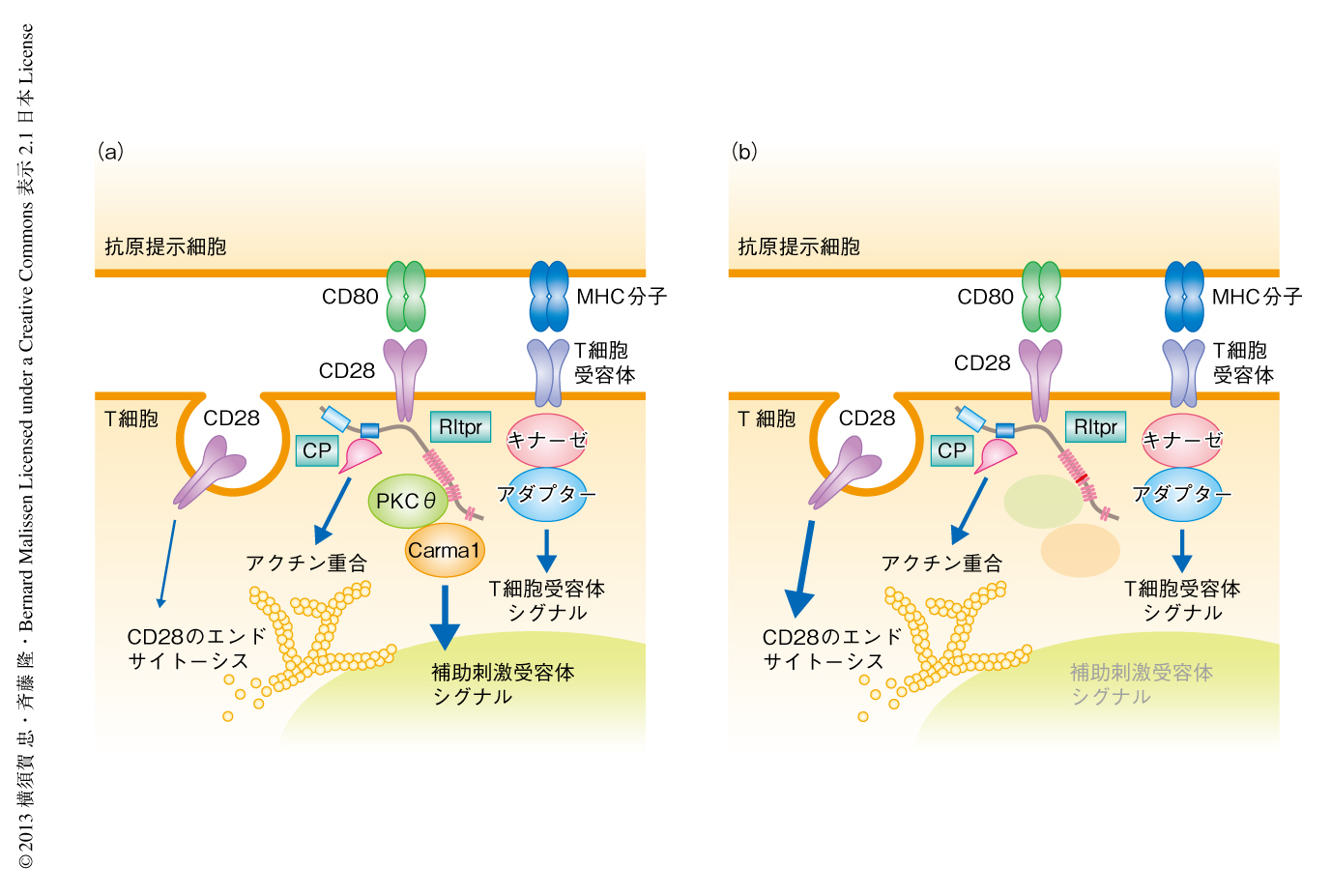
Basilic変異がCD28シグナルをどのように減弱させているのか,そのシグナル伝達経路をより詳細に解析するため,抗原の提示が可能なガラス平面人工脂質二重膜を用いて,RltprおよびBasilic変異Rltprを発現したCD4陽性T細胞においてCD28およびその下流に位置するシグナル伝達タンパク質の分子イメージング解析を行った.ガラス平面人工脂質二重膜では,カバーガラスのうえの人工脂質膜においてもT細胞受容体のリガンドとなるMHC(主要組織抗原複合体分子)やCD80が流動性を保持しているため,疑似の抗原提示細胞膜としてT細胞を刺激することが可能で,細胞どうしの接着の系よりも詳細な観察ができる.まず,野生型のT細胞およびBasilic変異Rltprを発現したT細胞にEGFPにより標識したCD28を導入し観察したが,野生型T細胞とBasilic変異Rltprを発現したT細胞とのあいだに差はなく,リガンドであるCD80との結合に依存してCD28はクラスター(CD28ミクロクラスター)を形成し接着面の中心部へと移動して中心部超分子クラスターとして凝集した.T細胞受容体およびCD28ミクロクラスターの移動の速度やアクチンの重合にも差はなかった.一方,Rltprを観察したところ,野生型のRltprはCD28とCD80との結合に依存してCD28ミクロクラスターに集合し,やがて,CD28とともに接着面の中心部へと移動して,CD28,プロテインキナーゼCθ,Carma1からなるNF-κB経路の活性中心複合体として凝集した.Basilic変異をもつRltprも,野生型Rltprと同じ挙動を示した.しかしながら,Basilic変異をもつRltprを発現したT細胞では,CD28とCD80との結合により本来は中心部超分子クラスターへの凝集のみられるプロテインキナーゼCθ-Carma1複合体が完全に消失していたことから,Basilic変異はCD28それ自体ではなく,CD28の下流に位置するNF-κB経路の活性中心複合体の形成に異常をきたしていることがわかった.また,T細胞と抗原提示細胞とを接着させてシグナル伝達タンパク質の細胞内での局在パターンを網羅的に解析したところ11),野生型のRltprは早期に接着面の中心部にクラスターを形成しCD28と同様な結果を示したが,Basilic変異をもつRltprではクラスターの形成はやや遅延し凝集も一過性であった.また,野生型Rltprの細胞内での局在パターンは,T細胞受容体の下流においてT細胞受容体とアクチンの重合とを結びつけるアダプタータンパク質であるNckやCIN85の局在パターンと似ており,CPIモチーフを介したアクチン重合の制御と受容体とのインターナリゼーションに関与することも示唆された.実際,抗CD28抗体を用いたCD28のインターナリゼーションはBasilic変異をもつRltprの発現により増強された.Rltprは,CD28-プロテインキナーゼCθ-Carma1複合体の形成というシグナル伝達系における機能と,CD28のインターナリゼーションに関与するアクチン重合の制御とを同時にになう,新たなカテゴリーの多機能シグナル伝達タンパク質であることが明らかになった(図2).
T細胞が増殖しエフェクター細胞となるには,T細胞受容体からのシグナルのほかに補助刺激受容体からのシグナルが必須であり,とくにCD28シグナルはT細胞の活性化および増殖,サイトカインの産生を強力に誘導する.ゆえに,CD28とリガンドとの結合を阻害する生物学的な製剤はリウマチ,ループス腎炎,I型糖尿病,脳脊髄炎,臓器移植後の拒絶反応などの症状を軽減させることが実験的に証明されており,一部では臨床応用もはじまっているが,CD28の下流におけるシグナル伝達経路はいまだ不明瞭な部分も多い.今回,突然変異を誘発したマウスのスクリーニングからみつかったBasilic変異をとおし,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprが,T細胞受容体やCD28の発現あるいは挙動ではなく,CD28と,NF-κBの下流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθとCarma1との機能的な活性中心の形成に関与することが明らかにされた.キャッピングタンパク質と結合しアクチン重合を促進するというLRRCファミリータンパク質の本来の機能がCD28からのシグナルに直接に影響しているかどうかは依然として不明であるが,T細胞のもつ接着分子であり補助刺激受容体としてもはたらくCD2もアダプタータンパク質CIN85を介しキャッピングタンパク質と結合することから,アクチンがT細胞の補助刺激受容体の挙動やそこからのシグナル伝達を制御する因子である可能性が考えられる.Rltprは,乾癬の患者の皮膚においてその遺伝子の発現が低下していたり12),強直性脊椎炎患者のゲノム解析において遺伝子多型がみつかっていたりと13),疾患との関連性も指摘されている.この研究が,T細胞が引き金となる自己免疫疾患,あるいは,乾癬や強直性脊椎炎などの直接的な治療につながることを期待している.
略歴:2001年 千葉大学大学院医学研究院博士課程 修了,2002年 同 助手,2004年 理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター)研究員を経て,2007年より同 上級研究員.2011年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:T細胞受容体からのシグナル伝達のイメージング解析.
斉藤 隆(Takashi Saito)
理化学研究所統合生命医科学研究センター グループディレクター.
研究室URL:http://web.rcai.riken.jp/en/labo/signaling/index.html
Bernard Malissen
フランスAix Marseille大学Group Leader.
© 2013 横須賀 忠・斉藤 隆・Bernard Malissen Licensed under CC 表示 2.1 日本
(1理化学研究所統合生命医科学研究センター 免疫シグナル研究グループ,2フランスAix Marseille大学Centre d'Immunologie de Marseille-Luminy)
email:横須賀 忠,斉藤 隆
DOI: 10.7875/first.author.2013.089
The lymphoid lineage-specific actin-uncapping protein Rltpr is essential for costimulation via CD28 and the development of regulatory T cells.
Yinming Liang, Margot Cucchetti, Romain Roncagalli, Tadashi Yokosuka, Aurélie Malzac, Elodie Bertosio, Jean Imbert, Isaac J. Nijman, Miloslav Suchanek, Takashi Saito, Christoph Wülfing, Bernard Malissen, Marie Malissen
Nature Immunology, 14, 858-866 (2013)
要 約
T細胞が活性化しエフェクター機能を発揮するためには,T細胞受容体からの刺激と同時に,補助刺激受容体であるCD28からのシグナルが必須である.突然変異誘発スクリーニングにより,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprは,CD28からの補助刺激シグナルを介したT細胞の活性化と制御性T細胞の分化に必須であることが明らかになった.CD28とリガンドとの結合により,野生型および変異型のRltprはT細胞と抗原提示細胞とのあいだに形成されるT細胞の活性化のための構造である“免疫シナプス”に集合し,CD28とともにクラスターを形成した.しかし,変異型RltprをもつT細胞ではCD28の下流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθ-Carma1複合体とCD28との共役が障害され,これがRltpr変異マウスにおけるT細胞の活性化の低下の原因と考えられた.Rltprは多機能タンパク質として,補助刺激受容体からのシグナルとアクチンの重合とを同時に制御する新たなカテゴリーのシグナル伝達タンパク質であった.
はじめに
体内に侵入した病原体や異物は,まず樹状細胞やマクロファージなどの抗原提示細胞により貪食され,抗原として提示される.T細胞は抗原提示細胞により提示された抗原をT細胞受容体を介して認識し,T細胞は活性化および分裂しエフェクター細胞へと分化する.胸腺においては,T細胞が異物のみを認識し自己を攻撃しないよう,適切な抗原特異性をもつT細胞受容体が選択される過程,いわゆる“自己と非自己”の教育が行われる.この胸腺選択ではT細胞受容体からのシグナルの強弱が決定因子であり,T細胞受容体シグナルの軽微な破綻が自己免疫疾患やアレルギーをひき起こすと考えられている1,2).アルキル化剤であるN-エチル-N-ニトロソ尿素により誘発した突然変異スクリーニングによりみつかった,T細胞受容体の下流に位置する膜型アダプタータンパク質LATにおいて136番目のThrがPheに変異したマウスでは,CD4陽性T細胞の異常な活性化と増殖,2型ヘルパー細胞への分化誘導の促進,それら活性化したT細胞の組織への浸潤とT細胞に誘導されたB細胞の異常な活性化が起こる1).
一方,T細胞が十分なエフェクター機能を獲得するためには,T細胞受容体からのシグナルにくわえて,補助刺激受容体やサイトカイン受容体からのシグナルが必須である.とくに,正の補助刺激受容体であるCD28は細胞の増殖やサイトカインの産生などT細胞の基本的な機能のため必須であり,制御性T細胞への分化にも寄与している.CD28の下流のシグナル伝達系はT細胞受容体からのシグナル伝達系と共通するところも多いため詳細は不明であったが,近年の筆者らによる分子イメージング法を用いた研究から,CD28はNF-κB経路の上流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθおよび足場タンパク質Carma1とともにシグナル伝達のための複合体を形成し,NF-κB経路を介しT細胞を活性化させることがわかってきた3-5).
T細胞が抗原提示細胞から情報をうけとる際に,この2つの細胞は強固に接着し,その接着面には神経系のニューロンと似たシナプス構造を形成することが知られており“免疫シナプス”とよばれている6).免疫シナプスは中心部より,T細胞受容体が凝集した中心部超分子クラスター(central-supramolecular activation cluster:c-SMAC),T細胞受容体をとりかこむ接着分子からなる周辺部超分子クラスター(peripheral-SMAC:p-SMAC),接着面からはじきだされた背の高い膜型脱リン酸化酵素からなる遠位部超分子クラスター(distal-SMAC:d-SMAC)からなる,直径が約10~20μmの同心円の構造をとる.これまで,筆者らは,免疫シナプスがさらに小さなT細胞受容体とシグナル伝達タンパク質の集合体である“T細胞受容体ミクロクラスター”から構成され,ミクロクラスターがT細胞の活性化のユニットとしてはたらくことを明らかにしてきた7,8).今回の研究では,CD28-プロテインキナーゼCθ-Carma1複合体からなるNF-κB経路における活性中心の形成において必須である,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprを突然変異誘発スクリーングにより発見し,そのT細胞の活性化の制御機構を明らかにした.
1.突然変異誘発スクリーニングから発見されたBasilic変異
136番目のThrがPheに変異したLATを発現するマウスにおいてみられるCD4陽性T細胞の異常な活性化はなぜ起こるのか,その責任タンパク質を同定するため,このLAT変異ホモ接合体マウスをもとに,ふたたびN-エチル-N-ニトロソ尿素により誘発した突然変異スクリーニングを行ったところ,表現型が正常化した個体としてBasilic変異をもつLAT変異ホモ接合体マウスの単離に成功した.高解像度のハプロタイプマッピングより,Basilic変異は第8染色体に存在する16 Mbにあることがわかり,次世代シークエンサーによる塩基配列の決定により判明した30個の遺伝子多型のうち,3個の遺伝子多型が3個のタンパク質に相当し,最終的に求める変異はリンパ球に特異的なアクチン脱キャッピングタンパク質Rltpr(Lrrc16cとしても知られる)に存在する432番目のLeuのProへの置換であることがわかった.Rltpr遺伝子は39個のエクソンからなり,Rltprは1397のアミノ酸残基からなる150 kDaのタンパク質で16個のロイシンリッチリピート,CPIモチーフ,プロリンリッチ領域から構成され,マウスのパラログLrrc16aおよびLrrc16bとともにLRRCファミリーを構成する9)(図1).CPIモチーフがキャッピングタンパク質と結合しこれをアクチンフィラメントの先端からはずすことから,LRRCファミリーはアクチンフィラメントの伸長を誘導するタンパク質と考えられていた.Basilic変異は8番目のロイシンリッチリピートに存在し,Basilic変異をもつRltprの発現は野生型の半分ほどに低下していたが,Basilic変異をもつRltprとキャッピングタンパク質との結合は正常であった.Rltprの発現は成熟したマウスの胸腺および脾臓において高く,骨髄,脳,精巣ではほとんど発現のなかったことから,リンパ球,とくに,T細胞に特異的なアクチン脱キャッピングタンパク質と考えられた.胸腺細胞のなかでもCD69陰性CD4陽性CD8陽性細胞においてもっとも発現が高く,CD69陽性CD4陽性CD8陽性細胞,CD4陽性細胞またはCD8陽性細胞へとより分化が進むにつれその発現は低下したが,末梢のT細胞においても中等度に維持されていた.
2.Basilic変異マウスはCD28欠損マウスと酷似した表現型を示す
これまでの研究から,LAT変異ホモ接合体マウスとCD28のリガンドであるCD80およびCD86を欠損したマウスとを交配すると,LAT変異ホモ接合体マウスにおいてみられたCD4陽性T細胞およびB細胞の活性化の消失することがわかっていた10).そこで,LATには変異をもたないBasilic変異Rltprを発現したマウスとCD28欠損マウスのT細胞を詳細に比較することにした.どちらも野生型のマウスに比べ胸腺細胞の数はやや多く,また,胸腺細胞の分化,正の選択および負の選択は正常であった.Basilic変異Rltprを発現したマウスの胸腺および末梢のT細胞におけるCD28の発現は野生型マウスと同じであったが,抗CD3抗体および抗CD28抗体の刺激による細胞増殖および細胞分裂,また,サイトカインの産生はCD28欠損マウスと同じ程度に低かった.Basilic変異Rltprを発現したT細胞における反応性の低下は,抗原特異的なT細胞受容体のトランスジェニックマウスと交配し特異的な抗原ペプチドと抗原提示細胞を用いた実験系においてもみられ,野生型のT細胞をCD80 CD86二重欠損マウスの抗原提示細胞により刺激した場合と同じであったが,外部からのインターロイキン2の添加により野生型T細胞と同じ程度にまで回復した.一方,抗CD3抗体の刺激によるT細胞受容体の下流に位置するシグナル伝達タンパク質のチロシンリン酸化や,Ca2+の細胞内での動態,T細胞受容体の刺激により生じるCD28の細胞内チロシンモチーフのリン酸化は正常であったことから,Basilic変異はT細胞受容体ではなく,CD28に限定したシグナル伝達の減弱を示すと考えられた.それを裏づけるように,CD28欠損マウスと同様に,Basilic変異Rltprを発現したマウスの胸腺において分化誘導された制御性T細胞の割合は20%まで低下していた.Basilic変異Rltprを発現したマウスに新たに作製したRltpr欠損マウスを交配したマウスでも同様の表現型を示したことから,これらの表現型は突然変異の誘発によるほかのタンパク質の異常ではなく,Basilic変異によるものと考えられた.
3.RltprはCD28とCD80との結合が誘導するCD28-プロテインキナーゼCθ-Carma1複合体の形成に必須である
Basilic変異がCD28シグナルをどのように減弱させているのか,そのシグナル伝達経路をより詳細に解析するため,抗原の提示が可能なガラス平面人工脂質二重膜を用いて,RltprおよびBasilic変異Rltprを発現したCD4陽性T細胞においてCD28およびその下流に位置するシグナル伝達タンパク質の分子イメージング解析を行った.ガラス平面人工脂質二重膜では,カバーガラスのうえの人工脂質膜においてもT細胞受容体のリガンドとなるMHC(主要組織抗原複合体分子)やCD80が流動性を保持しているため,疑似の抗原提示細胞膜としてT細胞を刺激することが可能で,細胞どうしの接着の系よりも詳細な観察ができる.まず,野生型のT細胞およびBasilic変異Rltprを発現したT細胞にEGFPにより標識したCD28を導入し観察したが,野生型T細胞とBasilic変異Rltprを発現したT細胞とのあいだに差はなく,リガンドであるCD80との結合に依存してCD28はクラスター(CD28ミクロクラスター)を形成し接着面の中心部へと移動して中心部超分子クラスターとして凝集した.T細胞受容体およびCD28ミクロクラスターの移動の速度やアクチンの重合にも差はなかった.一方,Rltprを観察したところ,野生型のRltprはCD28とCD80との結合に依存してCD28ミクロクラスターに集合し,やがて,CD28とともに接着面の中心部へと移動して,CD28,プロテインキナーゼCθ,Carma1からなるNF-κB経路の活性中心複合体として凝集した.Basilic変異をもつRltprも,野生型Rltprと同じ挙動を示した.しかしながら,Basilic変異をもつRltprを発現したT細胞では,CD28とCD80との結合により本来は中心部超分子クラスターへの凝集のみられるプロテインキナーゼCθ-Carma1複合体が完全に消失していたことから,Basilic変異はCD28それ自体ではなく,CD28の下流に位置するNF-κB経路の活性中心複合体の形成に異常をきたしていることがわかった.また,T細胞と抗原提示細胞とを接着させてシグナル伝達タンパク質の細胞内での局在パターンを網羅的に解析したところ11),野生型のRltprは早期に接着面の中心部にクラスターを形成しCD28と同様な結果を示したが,Basilic変異をもつRltprではクラスターの形成はやや遅延し凝集も一過性であった.また,野生型Rltprの細胞内での局在パターンは,T細胞受容体の下流においてT細胞受容体とアクチンの重合とを結びつけるアダプタータンパク質であるNckやCIN85の局在パターンと似ており,CPIモチーフを介したアクチン重合の制御と受容体とのインターナリゼーションに関与することも示唆された.実際,抗CD28抗体を用いたCD28のインターナリゼーションはBasilic変異をもつRltprの発現により増強された.Rltprは,CD28-プロテインキナーゼCθ-Carma1複合体の形成というシグナル伝達系における機能と,CD28のインターナリゼーションに関与するアクチン重合の制御とを同時にになう,新たなカテゴリーの多機能シグナル伝達タンパク質であることが明らかになった(図2).
おわりに
T細胞が増殖しエフェクター細胞となるには,T細胞受容体からのシグナルのほかに補助刺激受容体からのシグナルが必須であり,とくにCD28シグナルはT細胞の活性化および増殖,サイトカインの産生を強力に誘導する.ゆえに,CD28とリガンドとの結合を阻害する生物学的な製剤はリウマチ,ループス腎炎,I型糖尿病,脳脊髄炎,臓器移植後の拒絶反応などの症状を軽減させることが実験的に証明されており,一部では臨床応用もはじまっているが,CD28の下流におけるシグナル伝達経路はいまだ不明瞭な部分も多い.今回,突然変異を誘発したマウスのスクリーニングからみつかったBasilic変異をとおし,リンパ球に特異的なアクチン脱キャッピングタンパク質Rltprが,T細胞受容体やCD28の発現あるいは挙動ではなく,CD28と,NF-κBの下流に位置するシグナル伝達タンパク質であるプロテインキナーゼCθとCarma1との機能的な活性中心の形成に関与することが明らかにされた.キャッピングタンパク質と結合しアクチン重合を促進するというLRRCファミリータンパク質の本来の機能がCD28からのシグナルに直接に影響しているかどうかは依然として不明であるが,T細胞のもつ接着分子であり補助刺激受容体としてもはたらくCD2もアダプタータンパク質CIN85を介しキャッピングタンパク質と結合することから,アクチンがT細胞の補助刺激受容体の挙動やそこからのシグナル伝達を制御する因子である可能性が考えられる.Rltprは,乾癬の患者の皮膚においてその遺伝子の発現が低下していたり12),強直性脊椎炎患者のゲノム解析において遺伝子多型がみつかっていたりと13),疾患との関連性も指摘されている.この研究が,T細胞が引き金となる自己免疫疾患,あるいは,乾癬や強直性脊椎炎などの直接的な治療につながることを期待している.
文 献
- Aguado, E., Richelme, S., Nunez-Cruz, S. et al.: Induction of T helper type 2 immunity by a point mutation in the LAT adaptor. Science, 296, 2036-2040 (2002)[PubMed]
- Sakaguchi, N., Takahashi, T., Hata, H. et al.: Altered thymic T-cell selection due to a mutation of the ZAP-70 gene causes autoimmune arthritis in mice. Nature, 426, 454-460 (2003)[PubMed]
- Yokosuka, T., Kobayashi, W., Sakata-Sogawa, K. et al.: Spatiotemporal regulation of T cell costimulation by TCR-CD28 microclusters and protein kinase Cθ translocation. Immunity, 29, 589-601 (2008)[PubMed]
- Yokosuka, T., Kobayashi, W., Takamatsu, M. et al.: Spatiotemporal basis of CTLA-4 costimulatory molecule-mediated negative regulation of T cell activation. Immunity, 33, 326-339 (2010)[PubMed] [新着論文レビュー]
- Kong, K. F., Yokosuka, T., Canonigo-Balancio, A. J. et al.: A motif in the V3 domain of the kinase PKC-θ determines its localization in the immunological synapse and functions in T cells via association with CD28. Nat. Immunol., 12, 1105-1112 (2011)[PubMed]
- Dustin, M. L. & Depoil, D.: New insights into the T cell synapse from single molecule techniques. Nat. Rev. Immunol., 11, 672-684 (2011)[PubMed]
- Yokosuka, T., Sakata-Sogawa, K., Kobayashi, W. et al.: Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol., 6, 1253-1262 (2005)[PubMed]
- Yokosuka, T. & Saito, T.: The immunological synapse, TCR microclusters, and T cell activation. Curr. Top. Microbiol. Immunol., 340, 81-107 (2010)[PubMed]
- Hernandez-Valladares, M., Kim, T., Kannan, B. et al.: Structural characterization of a capping protein interaction motif defines a family of actin filament regulators. Nat. Struct. Mol. Biol., 17, 497-503 (2010)[PubMed]
- Chevrier, S., Genton, C., Malissen, B. et al.: Dominant role of CD80-CD86 over CD40 and ICOSL in the massive polyclonal B cell activation mediated by LATY136F CD4+ T Cells. Front. Immunol., 3, 27 (2012)[PubMed]
- Singleton, K. L., Roybal, K. T., Sun, Y. et al.: Spatiotemporal patterning during T cell activation is highly diverse. Sci. Signal., 2, ra15 (2009)[PubMed]
- Matsuzaka, Y., Okamoto, K., Mabuchi, T. et al.: Identification, expression analysis and polymorphism of a novel RLTPR gene encoding a RGD motif, tropomodulin domain and proline/leucine-rich regions. Gene, 343, 291-304 (2004)[PubMed]
- Pointon, J. J., Harvey, D., Karaderi, T. et al.: The chromosome 16q region associated with ankylosing spondylitis includes the candidate gene tumour necrosis factor receptor type 1-associated death domain (TRADD). Ann. Rheum. Dis., 69, 1243-1246 (2010)[PubMed]
著者プロフィール
略歴:2001年 千葉大学大学院医学研究院博士課程 修了,2002年 同 助手,2004年 理化学研究所免疫・アレルギー科学総合研究センター(現 統合生命医科学研究センター)研究員を経て,2007年より同 上級研究員.2011年より科学技術振興機構さきがけ 研究員 兼任.
研究テーマ:T細胞受容体からのシグナル伝達のイメージング解析.
斉藤 隆(Takashi Saito)
理化学研究所統合生命医科学研究センター グループディレクター.
研究室URL:http://web.rcai.riken.jp/en/labo/signaling/index.html
Bernard Malissen
フランスAix Marseille大学Group Leader.
© 2013 横須賀 忠・斉藤 隆・Bernard Malissen Licensed under CC 表示 2.1 日本