T細胞の活性化に対する補助刺激受容体CTLA-4による時空間的な制御機構の解明
横須賀 忠・斉藤 隆
(理化学研究所免疫・アレルギー科学総合研究センター 免疫シグナル研究グループ)
email:横須賀 忠,斉藤 隆
DOI: 10.7875/first.author.2010.037
Spatiotemporal basis of CTLA-4 costimulatory molecule-mediated negative regulation of T cell activation.
Tadashi Yokosuka, Wakana Kobayashi, Masako Takamatsu, Kumiko Sakata-Sogawa, Hu Zeng, Akiko Hashimoto-Tane, Hideo Yagita, Makio Tokunaga, Takashi Saito
Immunity, 33, 326-339 (2010)
T細胞の活性化はT細胞受容体と補助刺激受容体からのシグナルによって制御されている.なかでも,正の補助刺激受容体CD28と負の補助刺激受容体CTLA-4はリガンドを共有しており,両者のバランスはT細胞の活性化に強く影響する.筆者らの研究により,T細胞と抗原提示細胞との接着面に形成される免疫シナプスの中心部において,CTLA-4がミクロクラスターを形成してCD28の凝集を阻害していることが明らかになった.その結果,CD28の下流ではたらくプロテインキナーゼCθと足場タンパク質CARMA1の細胞膜へのリクルートが阻害され,T細胞のサイトカイン産生は著しく低下した.また,CTLA-4のミクロクラスターの形成とCD28シグナルへの阻害の効果はCTLA-4の細胞外領域の大きさとリガンドとの結合に依存していた.さらに,CTLA-4によるT細胞活性化の抑制機構は抑制性T細胞の不応答の要因であることも明らとなった.これらの結果から,CTLA-4はミクロクラスターを形成し,免疫シナプスにおいて時間的かつ空間的にCD28シグナルを阻害することで,T細胞の活性化を制御しているものと考えられた.
ウイルスや花粉などの異物は,体内に侵入したのち,まず,樹状細胞やマクロファージなどの抗原提示細胞によって取り込まれ抗原として提示される.T細胞はT細胞受容体(T cell receptor:TCR)を介して抗原提示細胞上の抗原情報を認識し,自ら活性化して分裂したりエフェクター細胞へと分化したりする.この情報交換の際,T細胞は抗原提示細胞と強固に接着し,その接着面に“免疫シナプス”を形成する1,2).免疫シナプスは細胞表面のさまざまな受容体や細胞内シグナル伝達タンパク質が同心円状に規則正しく配列する直径約10~20μmの構造体であり,中心部より,T細胞受容体からなる中心部超分子クラスター(central-supramolecular activation cluster:c-SMAC),接着分子からなる周辺部超分子クラスター(peripheral-supramolecular activation cluster:p-SMAC),膜型ホスファターゼからなる遠位部超分子クラスター(distal-supramolecular activation cluster:d-SMAC)の三重構造を呈している.これまで筆者らは,免疫シナプスが形成されるよりまえにT細胞受容体を核とするシグナル伝達タンパク質の集合体“T細胞受容体ミクロクラスター”が形成されこれがT細胞活性化のユニットとして機能していること,また,免疫シナプスもT細胞受容体ミクロクラスターの集まりであることを明らかにしてきた3,4).
T細胞がヘルパーT細胞やキラーT細胞などのエフェクター機能を獲得するには,T細胞受容体シグナルにくわえて,補助刺激受容体やサイトカイン受容体,ケモカイン受容体からの刺激が必須であると考えられている.補助刺激受容体にはCD28やICOSなどの正の補助刺激受容体とCTLA-4やPD-1などの負の補助刺激受容体があり,これら受容体からのシグナルのバランスによってT細胞の活性化が制御されている5).なかでも,CD28は強力な正の補助刺激受容体として機能し,T細胞の増殖,抗アポトーシス作用,サイトカイン産生を促進させる.筆者らは,T細胞の活性化を担うシグナロソームという視点から,CD28もT細胞受容体と同様にミクロクラスターを形成すること,特殊なキナーゼであるプロテインキナーゼCθ(PKCθ)をT細胞受容体-CD28ミクロクラスターおよび中心部超分子クラスターへリクルートすることでT細胞活性化の増強に寄与していることを明らかにした6-8)(図1).
一方,最初の負の補助刺激受容体として発見されたCTLA-4は,リガンドであるCD80およびCD86をCD28と共有し,その親和性がCD28の数十倍と高いためCD28のリガンドとの結合およびCD28シグナルを強力に阻害する.また,CTLA-4ノックアウトマウスは全身性の自己免疫疾患を呈し生後2ヶ月で死亡することからも,生体において強力な免疫抑制機能をもつものと考えられている9),さらに近年,制御性T細胞の免疫制御機序においてCTLA-4の重要性が明らかとなった10).これらのことから,CTLA-4阻害抗体や可溶化CTLA-4を用いた臨床応用がすでにはじまっておりその重要性は増しているが,シグナル伝達など詳細な抑制機構はまだ解明されていない.
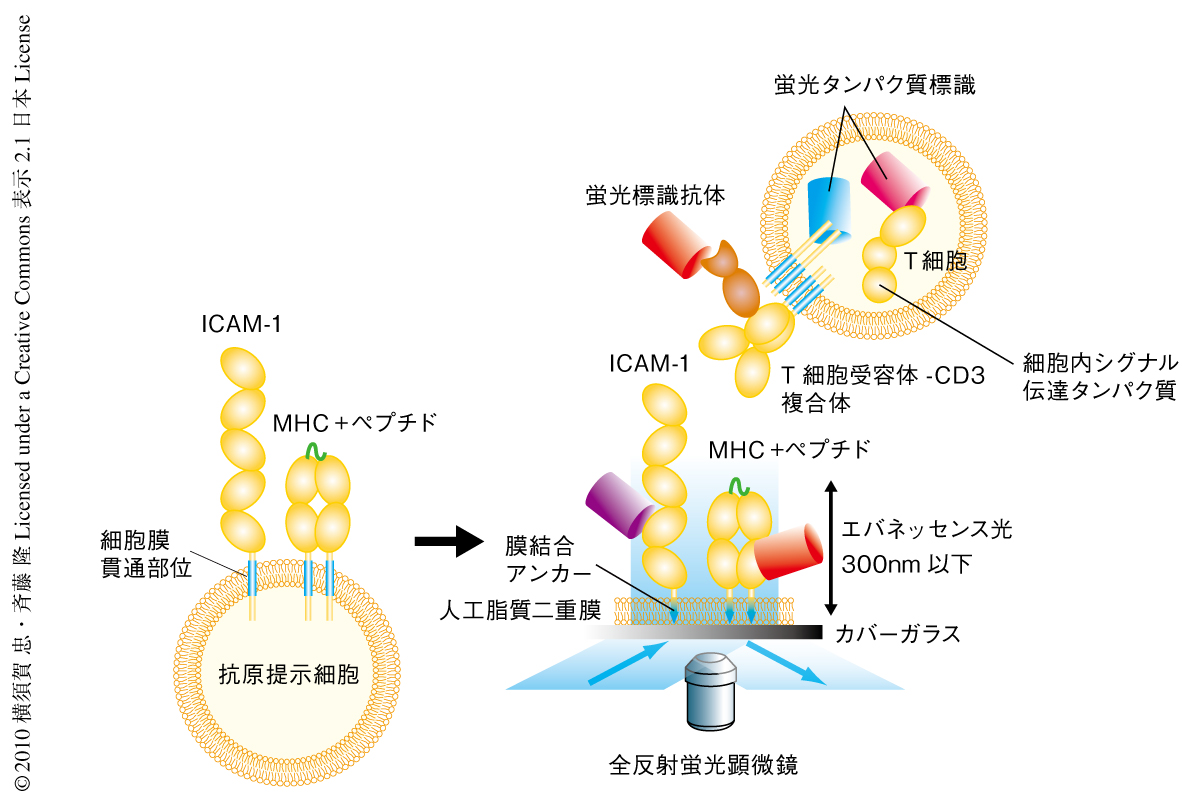
T細胞と抗原提示細胞との接着面には凹凸があり,顕微鏡観察には不向きである.筆者らは,ガラス平面上に人工脂質二重膜(プレイナーメンブレン)を作製し,抗原提示細胞が発現しているMHC(major histocompatibility complex,主要組織適合抗原複合体),接着分子ICAM-1,CD80を可動性を保ちながら導入し,疑似の抗原提示細胞にみたてた.その上にT細胞をのせ,接着面で起こる現象を1分子レベルでの解析が可能な高感度全反射蛍光顕微鏡や11),共焦点レーザー顕微鏡を用いて観察した.T細胞受容体,CD28やCTLA-4,シグナル伝達タンパク質など,観察対象のタンパク質はGFPなどの蛍光タンパク質を付加したり蛍光標識抗体で染色したりすることで可視化した(図2).
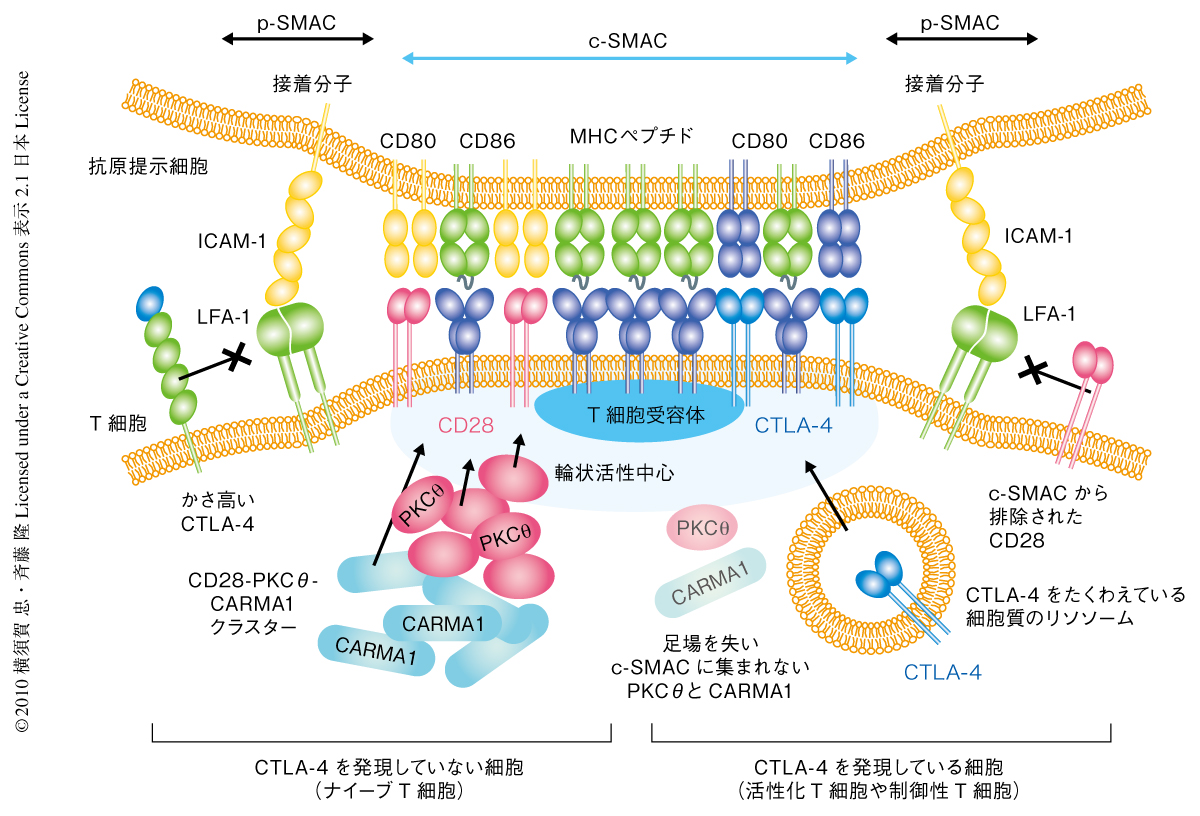
T細胞は人工脂質二重膜との接着ののち膜上を伸びるように広がる.接着直後から接着面にはT細胞受容体-CD28ミクロクラスターがつぎつぎと形成され,T細胞が最大限に伸長したのち,その収縮とともに中央へと移動をはじめ,中心部超分子クラスターを形成した.CD28-CD80結合の存在下で,CD28はT細胞受容体-CD28ミクロクラスターを形成し特異的にプロテインキナーゼCθをリクルートするが,中心部超分子クラスターに凝集したのちはプロテインキナーゼCθとともにT細胞受容体とは独立した輪状の活性中心を形成した.CTLA-4は活性化T細胞で発現し細胞内の分泌型リソソームに蓄えられているが,T細胞と人工脂質二重膜との接着にともない1~2分のうちにリソソームからその接着面に出現してCTLA-4ミクロクラスターを形成し,ただちにT細胞受容体-CD28ミクロクラスターへと移動した.中心部超分子クラスターが形成されるとCTLA-4は中心部超分子クラスターの輪状活性中心を占拠し,CD28を周辺部超分子クラスターの外側へと排除した(図3).CTLA-4によるCD28ミクロクラスター凝集の阻害はCTLA-4の発現が高くリガンドであるCD80およびCD86の発現が低いときに顕著であった.
これまでの筆者らの研究から,T細胞受容体の近傍のシグナル伝達タンパク質は一過性にT細胞受容体ミクロクラスターに局在することが明らかとなっていた3).一方,CD28ミクロクラスターはプロテインキナーゼCθをリクルートし中心部超分子クラスターで輪状活性中心を形成することから,中心部超分子クラスターはT細胞シグナルのなかでもおもにNF-κB経路を担っているものと示唆された.人工脂質二重膜を用いた実験で,NF-κB経路の中核をなす足場タンパク質CARMA1もCD28-CD80結合に依存してプロテインキナーゼCθと同じ中心部超分子クラスターの輪状活性中心に集まることがわかった.さらに,CTLA-4ミクロクラスターはCD28の中心部超分子クラスターへの凝集を阻害すると同時に,プロテインキナーゼCθとCARMA1の輪状活性中心でのクラスター形成をも阻害した.NF-κB経路の活性化にひきつづいて起こるインターロイキン2の産生も,CTLA-4の中心部超分子クラスターへの局在とプロテインキナーゼCθおよびCARMA1のクラスター形成の阻害とともに低下したことから,CTLA-4はT細胞受容体の近傍のシグナル伝達経路よりもNF-κB経路の阻害に強くはたらいているものと考えられた.
CTLA-4とCD80とはホモ2量体を形成し,どちらも2価の結合能をもっている.これまでの結晶解析からはこれを裏づけするようなCTLA-4とCD80との格子状構造モデルが提唱されていた12,13).しかし,人工脂質二重膜を用いた実験では,単量体であるCD86をリガンドとした場合でもホモ2量体を形成できない変異型CTLA-4を用いた場合でも,リガンドとの結合に依存的にCTLA-4ミクロクラスターが形成された.また,CTLA-4の細胞内領域を欠損した変異型CTLA-4でも変わりはなく,CTLA-4下流のシグナル伝達はCTLA-4のミクロクラスターの形成には関与していなかった.一方,免疫グロブリンドメインを継ぎ足して細胞外領域を大きくした変異型CTLA-4を用いた場合,リガンド依存的にクラスターの形成はするものの,T細胞受容体-CD28ミクロクラスターおよび中心部超分子クラスターには共局在できず,T細胞抑制の効果も著しく低下した.これらのことから,CTLA-4のミクロクラスター形成とT細胞活性化の制御はCTLA-4どうしの相互作用ではなく,リガンドとの結合力および細胞外領域の大きさに起因することが明らかになった.
CTLA-4はナイーブT細胞ではなく,いちど活性化したT細胞に発現し,合目的に過度のT細胞の活性化およびそれにつづく免疫応答を制御するはたらきがある.一方,制御性T細胞においては恒常的に発現しており,制御性T細胞のヘルパーT細胞への活性抑制機能を担っているものと考えられている10).また,制御性T細胞はin vitroでの2次抗原刺激に対する不応答が知られており,この不応答はインターロイキン2の添加により回復する14).制御性T細胞におけるCTLA-4ミクロクラスターの形成を調べたところ,活性化T細胞と同様に,CTLA-4は中心部超分子クラスターに集まり,CD28ミクロクラスターとプロテインキナーゼCθの中心部超分子クラスターへのリクルートを阻害し,制御性T細胞の細胞増殖を抑制していることがわかった.CTLA-4ノックアウトマウスでは制御性T細胞の不応答の一部が回復し,また,活性化T細胞と同様に,CTLA-4の細胞外領域の大きさがその制御機構に重要であることがわかった.
T細胞の補助刺激受容体は,それ単独では機能しないが,T細胞の活性化や増殖を制御したり,活性化したのちのT細胞の運命決定を行ったり,T細胞の活性化を修飾する重要なタンパク質である.これらのシグナル伝達機構はこれまでの単純な生化学的な解析からはよくわかっていなかったが,筆者らは,補助刺激受容体を“ミクロクラスター”という視点でとらえ,複雑な補助刺激受容体のシグナル伝達系の解明への可能性を示唆した.
CTLA-4は最初に発見されたT細胞抑制性の補助刺激受容体として早くから臨床応用がなされてきた15).可溶化CTLA-4はリガンドであるCD80およびCD86と強力に結合しCD28の活性化シグナルを阻害する.リウマチ,ループス腎炎,I型糖尿病,脳脊髄炎,臓器移植のマウス実験モデルでも症状軽減の効果が認められ,2006年から欧州ではリウマチ患者に対する臨床応用がはじまっている.また,CTLA-4阻害抗体もCTLA-4の機能を抑え免疫系を賦活化させることから,イピリムマブ(ipilimumab)として悪性メラノーマなどのがん治療に用いられている.しかし,免疫系のランダムな活性化による2次的な自己免疫疾患の発症や,CTLA-4を恒常的に発現している制御性T細胞を逆に刺激してしまうなど,阻害抗体の使用による弊害も生じている.
今回の研究から,T細胞の活性化がT細胞受容体と補助刺激受容体からなる正と負のミクロクラスターのバランスによって制御されていることが明らかとなった.T細胞シグナル伝達経路の分子機構の詳細な解析はより選択的な免疫抑制剤や免疫賦活剤の開発への可能性を示しており,安全で効果的な免疫治療の進歩につながるものと期待される.
略歴:1993年 千葉大学医学部 卒業,同年より2002年まで同 呼吸器外科学教室にて臨床に従事,2001年 千葉大学大学院医学研究院博士課程 修了,2002年 同 助手(斉藤 隆研究室),2004年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2007年より同 上級研究員.
研究テーマ:T細胞受容体シグナル伝達系のイメージング解析.
斉藤 隆(Takashi Saito)
理化学研究所免疫・アレルギー科学総合研究センター 副センター長・グループディレクター.大阪大学免疫フロンティア研究センター 招聘教授.
研究室URL:http://web.rcai.riken.jp/en/labo/signaling/index.html
© 2010 横須賀 忠・斉藤 隆 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫シグナル研究グループ)
email:横須賀 忠,斉藤 隆
DOI: 10.7875/first.author.2010.037
Spatiotemporal basis of CTLA-4 costimulatory molecule-mediated negative regulation of T cell activation.
Tadashi Yokosuka, Wakana Kobayashi, Masako Takamatsu, Kumiko Sakata-Sogawa, Hu Zeng, Akiko Hashimoto-Tane, Hideo Yagita, Makio Tokunaga, Takashi Saito
Immunity, 33, 326-339 (2010)
この論文に出現する遺伝子・タンパク質のUniprot ID
CTLA-4(P09793), T細胞受容体, CD28(P31041), プロテインキナーゼCθ(Q02111), CARMA1(Q8CIS0), サイトカイン, T cell receptor, TCR, サイトカイン受容体, ケモカイン受容体, ICOS(Q9Y6W8), PD-1(Q15116), シグナロソーム, PKCθ(Q02111), CD80(Q00609), CD86(P42082), MHC, major histocompatibility complex, 主要組織適合抗原複合体, ICAM-1(P13597), NF-κB, インターロイキン2(P04351), LFA-1
要 約
T細胞の活性化はT細胞受容体と補助刺激受容体からのシグナルによって制御されている.なかでも,正の補助刺激受容体CD28と負の補助刺激受容体CTLA-4はリガンドを共有しており,両者のバランスはT細胞の活性化に強く影響する.筆者らの研究により,T細胞と抗原提示細胞との接着面に形成される免疫シナプスの中心部において,CTLA-4がミクロクラスターを形成してCD28の凝集を阻害していることが明らかになった.その結果,CD28の下流ではたらくプロテインキナーゼCθと足場タンパク質CARMA1の細胞膜へのリクルートが阻害され,T細胞のサイトカイン産生は著しく低下した.また,CTLA-4のミクロクラスターの形成とCD28シグナルへの阻害の効果はCTLA-4の細胞外領域の大きさとリガンドとの結合に依存していた.さらに,CTLA-4によるT細胞活性化の抑制機構は抑制性T細胞の不応答の要因であることも明らとなった.これらの結果から,CTLA-4はミクロクラスターを形成し,免疫シナプスにおいて時間的かつ空間的にCD28シグナルを阻害することで,T細胞の活性化を制御しているものと考えられた.
はじめに
ウイルスや花粉などの異物は,体内に侵入したのち,まず,樹状細胞やマクロファージなどの抗原提示細胞によって取り込まれ抗原として提示される.T細胞はT細胞受容体(T cell receptor:TCR)を介して抗原提示細胞上の抗原情報を認識し,自ら活性化して分裂したりエフェクター細胞へと分化したりする.この情報交換の際,T細胞は抗原提示細胞と強固に接着し,その接着面に“免疫シナプス”を形成する1,2).免疫シナプスは細胞表面のさまざまな受容体や細胞内シグナル伝達タンパク質が同心円状に規則正しく配列する直径約10~20μmの構造体であり,中心部より,T細胞受容体からなる中心部超分子クラスター(central-supramolecular activation cluster:c-SMAC),接着分子からなる周辺部超分子クラスター(peripheral-supramolecular activation cluster:p-SMAC),膜型ホスファターゼからなる遠位部超分子クラスター(distal-supramolecular activation cluster:d-SMAC)の三重構造を呈している.これまで筆者らは,免疫シナプスが形成されるよりまえにT細胞受容体を核とするシグナル伝達タンパク質の集合体“T細胞受容体ミクロクラスター”が形成されこれがT細胞活性化のユニットとして機能していること,また,免疫シナプスもT細胞受容体ミクロクラスターの集まりであることを明らかにしてきた3,4).
T細胞がヘルパーT細胞やキラーT細胞などのエフェクター機能を獲得するには,T細胞受容体シグナルにくわえて,補助刺激受容体やサイトカイン受容体,ケモカイン受容体からの刺激が必須であると考えられている.補助刺激受容体にはCD28やICOSなどの正の補助刺激受容体とCTLA-4やPD-1などの負の補助刺激受容体があり,これら受容体からのシグナルのバランスによってT細胞の活性化が制御されている5).なかでも,CD28は強力な正の補助刺激受容体として機能し,T細胞の増殖,抗アポトーシス作用,サイトカイン産生を促進させる.筆者らは,T細胞の活性化を担うシグナロソームという視点から,CD28もT細胞受容体と同様にミクロクラスターを形成すること,特殊なキナーゼであるプロテインキナーゼCθ(PKCθ)をT細胞受容体-CD28ミクロクラスターおよび中心部超分子クラスターへリクルートすることでT細胞活性化の増強に寄与していることを明らかにした6-8)(図1).
一方,最初の負の補助刺激受容体として発見されたCTLA-4は,リガンドであるCD80およびCD86をCD28と共有し,その親和性がCD28の数十倍と高いためCD28のリガンドとの結合およびCD28シグナルを強力に阻害する.また,CTLA-4ノックアウトマウスは全身性の自己免疫疾患を呈し生後2ヶ月で死亡することからも,生体において強力な免疫抑制機能をもつものと考えられている9),さらに近年,制御性T細胞の免疫制御機序においてCTLA-4の重要性が明らかとなった10).これらのことから,CTLA-4阻害抗体や可溶化CTLA-4を用いた臨床応用がすでにはじまっておりその重要性は増しているが,シグナル伝達など詳細な抑制機構はまだ解明されていない.
1.プレイナーメンブレン法の確立とCTLA-4ミクロクラスターの可視化
T細胞と抗原提示細胞との接着面には凹凸があり,顕微鏡観察には不向きである.筆者らは,ガラス平面上に人工脂質二重膜(プレイナーメンブレン)を作製し,抗原提示細胞が発現しているMHC(major histocompatibility complex,主要組織適合抗原複合体),接着分子ICAM-1,CD80を可動性を保ちながら導入し,疑似の抗原提示細胞にみたてた.その上にT細胞をのせ,接着面で起こる現象を1分子レベルでの解析が可能な高感度全反射蛍光顕微鏡や11),共焦点レーザー顕微鏡を用いて観察した.T細胞受容体,CD28やCTLA-4,シグナル伝達タンパク質など,観察対象のタンパク質はGFPなどの蛍光タンパク質を付加したり蛍光標識抗体で染色したりすることで可視化した(図2).
2.CTLA-4とCD28との競合はT細胞受容体ミクロクラスターおよび中心部超分子クラスターで起こっている
T細胞は人工脂質二重膜との接着ののち膜上を伸びるように広がる.接着直後から接着面にはT細胞受容体-CD28ミクロクラスターがつぎつぎと形成され,T細胞が最大限に伸長したのち,その収縮とともに中央へと移動をはじめ,中心部超分子クラスターを形成した.CD28-CD80結合の存在下で,CD28はT細胞受容体-CD28ミクロクラスターを形成し特異的にプロテインキナーゼCθをリクルートするが,中心部超分子クラスターに凝集したのちはプロテインキナーゼCθとともにT細胞受容体とは独立した輪状の活性中心を形成した.CTLA-4は活性化T細胞で発現し細胞内の分泌型リソソームに蓄えられているが,T細胞と人工脂質二重膜との接着にともない1~2分のうちにリソソームからその接着面に出現してCTLA-4ミクロクラスターを形成し,ただちにT細胞受容体-CD28ミクロクラスターへと移動した.中心部超分子クラスターが形成されるとCTLA-4は中心部超分子クラスターの輪状活性中心を占拠し,CD28を周辺部超分子クラスターの外側へと排除した(図3).CTLA-4によるCD28ミクロクラスター凝集の阻害はCTLA-4の発現が高くリガンドであるCD80およびCD86の発現が低いときに顕著であった.
3.CTLA-4ミクロクラスターはT細胞シグナルのNF-κB経路を抑制する
これまでの筆者らの研究から,T細胞受容体の近傍のシグナル伝達タンパク質は一過性にT細胞受容体ミクロクラスターに局在することが明らかとなっていた3).一方,CD28ミクロクラスターはプロテインキナーゼCθをリクルートし中心部超分子クラスターで輪状活性中心を形成することから,中心部超分子クラスターはT細胞シグナルのなかでもおもにNF-κB経路を担っているものと示唆された.人工脂質二重膜を用いた実験で,NF-κB経路の中核をなす足場タンパク質CARMA1もCD28-CD80結合に依存してプロテインキナーゼCθと同じ中心部超分子クラスターの輪状活性中心に集まることがわかった.さらに,CTLA-4ミクロクラスターはCD28の中心部超分子クラスターへの凝集を阻害すると同時に,プロテインキナーゼCθとCARMA1の輪状活性中心でのクラスター形成をも阻害した.NF-κB経路の活性化にひきつづいて起こるインターロイキン2の産生も,CTLA-4の中心部超分子クラスターへの局在とプロテインキナーゼCθおよびCARMA1のクラスター形成の阻害とともに低下したことから,CTLA-4はT細胞受容体の近傍のシグナル伝達経路よりもNF-κB経路の阻害に強くはたらいているものと考えられた.
4.CTLA-4のリガンド結合と細胞外領域の大きさとがCTLA-4の局在を決定する
CTLA-4とCD80とはホモ2量体を形成し,どちらも2価の結合能をもっている.これまでの結晶解析からはこれを裏づけするようなCTLA-4とCD80との格子状構造モデルが提唱されていた12,13).しかし,人工脂質二重膜を用いた実験では,単量体であるCD86をリガンドとした場合でもホモ2量体を形成できない変異型CTLA-4を用いた場合でも,リガンドとの結合に依存的にCTLA-4ミクロクラスターが形成された.また,CTLA-4の細胞内領域を欠損した変異型CTLA-4でも変わりはなく,CTLA-4下流のシグナル伝達はCTLA-4のミクロクラスターの形成には関与していなかった.一方,免疫グロブリンドメインを継ぎ足して細胞外領域を大きくした変異型CTLA-4を用いた場合,リガンド依存的にクラスターの形成はするものの,T細胞受容体-CD28ミクロクラスターおよび中心部超分子クラスターには共局在できず,T細胞抑制の効果も著しく低下した.これらのことから,CTLA-4のミクロクラスター形成とT細胞活性化の制御はCTLA-4どうしの相互作用ではなく,リガンドとの結合力および細胞外領域の大きさに起因することが明らかになった.
5.CTLA-4ミクロクラスターは制御性T細胞のin vitro不応答の要因となる
CTLA-4はナイーブT細胞ではなく,いちど活性化したT細胞に発現し,合目的に過度のT細胞の活性化およびそれにつづく免疫応答を制御するはたらきがある.一方,制御性T細胞においては恒常的に発現しており,制御性T細胞のヘルパーT細胞への活性抑制機能を担っているものと考えられている10).また,制御性T細胞はin vitroでの2次抗原刺激に対する不応答が知られており,この不応答はインターロイキン2の添加により回復する14).制御性T細胞におけるCTLA-4ミクロクラスターの形成を調べたところ,活性化T細胞と同様に,CTLA-4は中心部超分子クラスターに集まり,CD28ミクロクラスターとプロテインキナーゼCθの中心部超分子クラスターへのリクルートを阻害し,制御性T細胞の細胞増殖を抑制していることがわかった.CTLA-4ノックアウトマウスでは制御性T細胞の不応答の一部が回復し,また,活性化T細胞と同様に,CTLA-4の細胞外領域の大きさがその制御機構に重要であることがわかった.
おわりに
T細胞の補助刺激受容体は,それ単独では機能しないが,T細胞の活性化や増殖を制御したり,活性化したのちのT細胞の運命決定を行ったり,T細胞の活性化を修飾する重要なタンパク質である.これらのシグナル伝達機構はこれまでの単純な生化学的な解析からはよくわかっていなかったが,筆者らは,補助刺激受容体を“ミクロクラスター”という視点でとらえ,複雑な補助刺激受容体のシグナル伝達系の解明への可能性を示唆した.
CTLA-4は最初に発見されたT細胞抑制性の補助刺激受容体として早くから臨床応用がなされてきた15).可溶化CTLA-4はリガンドであるCD80およびCD86と強力に結合しCD28の活性化シグナルを阻害する.リウマチ,ループス腎炎,I型糖尿病,脳脊髄炎,臓器移植のマウス実験モデルでも症状軽減の効果が認められ,2006年から欧州ではリウマチ患者に対する臨床応用がはじまっている.また,CTLA-4阻害抗体もCTLA-4の機能を抑え免疫系を賦活化させることから,イピリムマブ(ipilimumab)として悪性メラノーマなどのがん治療に用いられている.しかし,免疫系のランダムな活性化による2次的な自己免疫疾患の発症や,CTLA-4を恒常的に発現している制御性T細胞を逆に刺激してしまうなど,阻害抗体の使用による弊害も生じている.
今回の研究から,T細胞の活性化がT細胞受容体と補助刺激受容体からなる正と負のミクロクラスターのバランスによって制御されていることが明らかとなった.T細胞シグナル伝達経路の分子機構の詳細な解析はより選択的な免疫抑制剤や免疫賦活剤の開発への可能性を示しており,安全で効果的な免疫治療の進歩につながるものと期待される.
文 献
- Monks, C. R., Freiberg, B. A., Kupfer, H. et al.: Three-dimensional segregation of supramolecular activation clusters in T cells. Nature, 395, 82-86 (1998)[PubMed]
- Grakoui, A., Bromley, S. K., Sumen, C. et al.: The immunological synapse: a molecular machine controlling T cell activation. Science, 285, 221-227 (1999)[PubMed]
- Yokosuka, T., Sakata-Sogawa, K., Kobayashi, W. et al.: Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol., 6, 1253-1262 (2005)[PubMed]
- Saito, T. & Yokosuka, T.: Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr. Opin. Immunol., 18, 305-313 (2006)[PubMed]
- Greenwald, R. J., Freeman, G. J. & Sharpe, A. H.: The B7 family revisited. Annu. Rev. Immunol., 23, 515-548 (2005)[PubMed]
- Yokosuka, T., Kobayashi, W., Sakata-Sogawa, K. et al.: Spatiotemporal regulation of T cell costimulation by TCR-CD28 microclusters and protein kinase Cθ translocation. Immunity, 29, 589-601 (2008)[PubMed]
- Yokosuka, T. & Saito, T.: Dynamic regulation of T-cell costimulation through TCR-CD28 microclusters. Immunol. Rev., 229, 27-40 (2009)[PubMed]
- Yokosuka, T. & Saito, T.: The immunological synapse, TCR microclusters, and T cell activation. Curr. Top. Microbiol. Immunol., 340, 81-107 (2010)[PubMed]
- Waterhouse, P., Penninger, J. M., Timms, E. et al.: Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4. Science, 270, 985-988 (1995)[PubMed]
- Wing, K., Onishi, Y., Prieto-Martin, P. et al.: CTLA-4 control over Foxp3+ regulatory T cell function. Science, 322, 271-275 (2008)[PubMed]
- Tokunaga, M., Imamoto, N. & Sakata-Sogawa, K.: Highly inclined thin illumination enables clear single-molecule imaging in cells. Nat. Methods, 5, 159-161 (2008)[PubMed]
- Stamper, C. C., Zhang, Y., Tobin, J. F. et al.: Crystal structure of the B7-1/CTLA-4 complex that inhibits human immune responses. Nature, 410, 608-611 (2001)[PubMed]
- Schwartz, J. C., Zhang, X., Fedorov, A. A. et al.: Structural basis for co-stimulation by the human CTLA-4/B7-2 complex. Nature, 410, 604-608 (2001)[PubMed]
- Sakaguchi, S., Yamaguchi, T., Nomura, T. et al.: Regulatory T cells and immune tolerance. Cell, 133, 775-787 (2008)[PubMed]
- Linsley, P. S. & Nadler, S. G.: The clinical utility of inhibiting CD28-mediated costimulation. Immunol. Rev., 229, 307-321 (2009)[PubMed]
著者プロフィール
略歴:1993年 千葉大学医学部 卒業,同年より2002年まで同 呼吸器外科学教室にて臨床に従事,2001年 千葉大学大学院医学研究院博士課程 修了,2002年 同 助手(斉藤 隆研究室),2004年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2007年より同 上級研究員.
研究テーマ:T細胞受容体シグナル伝達系のイメージング解析.
斉藤 隆(Takashi Saito)
理化学研究所免疫・アレルギー科学総合研究センター 副センター長・グループディレクター.大阪大学免疫フロンティア研究センター 招聘教授.
研究室URL:http://web.rcai.riken.jp/en/labo/signaling/index.html
© 2010 横須賀 忠・斉藤 隆 Licensed under CC 表示 2.1 日本