SelA十量体とtRNASecとの複合体のX線結晶構造解析によりセレノシステイン合成の分子機構を解明した
伊藤弓弦1・横山茂之2
(1東京大学分子細胞生物学研究所 細胞形態研究分野,2理化学研究所 横山構造生物学研究室)
email:伊藤弓弦,横山茂之
DOI: 10.7875/first.author.2013.054
Decameric SelA•tRNASec ring structure reveals mechanism of bacterial selenocysteine formation.
Yuzuru Itoh, Markus J. Bröcker, Shun-ichi Sekine, Gifty Hammond, Shiro Suetsugu, Dieter Söll, Shigeyuki Yokoyama
Science, 340, 75-78 (2013)
微量必須元素セレンを含むアミノ酸であるセレノシステインは21番目のアミノ酸とよばれ,mRNAに直接にコードされ翻訳の過程でタンパク質に取り込まれる.セレノシステインは専用のtRNAであるtRNASecに結合したセリンから合成されるが,ヒトを含めた真核生物および古細菌のグループと真正細菌のグループとでは,その合成機構は異なっている.これまで,ヒトにおけるセレノシステインの合成についてはその詳細が明らかにされているが,真正細菌においては不明のままであった.筆者らは,真正細菌においてセレノシステインを合成する酵素SelAとtRNASecとの複合体のX線結晶構造解析により,10個のSelAからなる星形の超巨大複合体の形成を明らかにした.また,セリンを結合した1つのtRNASecに対しSelAの4個のサブユニットがはたらいており,SelAが十量体を形成することがセレノシステインの合成に必要不可欠であることもつきとめた.
タンパク質を構成するアミノ酸のうち,mRNAに直接にコードされているものは22種類である.20種類の標準アミノ酸にくわえ,セレノシステイン(Sec)とピロリジン(Pyl)がそれぞれ21番目,22番目のアミノ酸とよばれている.ピロリジンはきわめてかぎられた古細菌および真正細菌にのみ存在するのに対し,Secはヒトを含めた真核生物,古細菌,真正細菌に広く存在する.Secはシステインのもつ硫黄がセレンに置き換わったアミノ酸であり,おもに酸化還元酵素の触媒活性部位を形成し,ヒトでは25種類のセレン含有タンパク質(セレノタンパク質)が知られている1).必須微量元素であるセレンは体内ではSecとして機能しており,セレノタンパク質はセレンの高い反応性を利用して抗酸化作用など重要な機能を発揮している.
SecはmRNAのUGAコドンにコードされており,SecのtRNA(tRNASec)はUGAに相補的なアンチコドンUCAをもつ.通常のtRNAの場合,対応するアミノアシルtRNA合成酵素により直接にアミノ酸が結合されてリボソームへと輸送されるが,tRNASecの場合は,まず,セリンのアミノアシルtRNA合成酵素がtRNASecとSerとを結合してSer-tRNASecを合成し2),つづいて,tRNASecにおいてSerがSecへと変換される.この変換機構は,ヒトを含めた真核生物および古細菌のグループ(ヒト型)と,真正細菌のグループ(真正細菌型)とではまったく異なっている.ヒト型では,リン酸化酵素PSTKがSerをリン酸化し3),SepSecSがリン酸化セリンをSecへと変換する4).一方,真正細菌では,1つの酵素SelAが1段階でSerをSecへと変換する5).筆者らのグループによる成果などにより,ヒト型のSec合成の分子機構の全容は明らかになっていたが6,7),真正細菌型の研究は巨大タンパク質を形成するSelAのX線結晶構造解析が技術的に困難であったため大きく遅れており,その解明が求められていた.
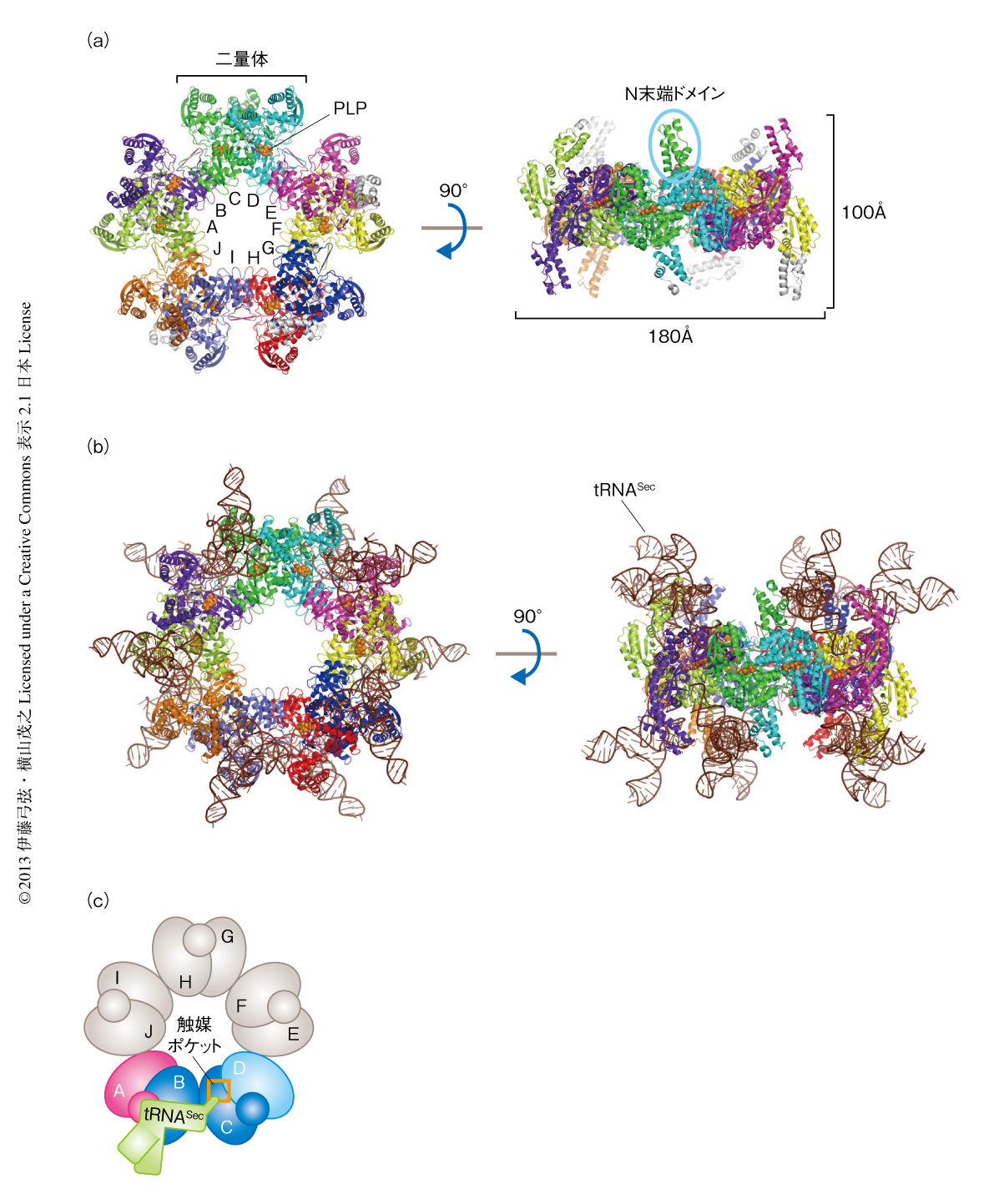
真正細菌の1種Aquifex aeolicusに由来するSelAを結晶化し結晶構造を決定した.SelAは,2個のサブユニットからなる二量体が5個,星形に配列してホモ十量体を形成していることがわかった(図1a).SelA十量体の総分子量は500,000をこえ,すべてのサブユニットは互いに同じ構造であったため,正五角形型の対称性をもっていた.おのおののサブユニットはN末端ドメイン,コアドメイン,C末端ドメインからなり,コアドメインとC末端ドメインとが星型を形成し,可動性のN末端ドメインは星型の平面から上下に突き出ていた(図1a).SelA二量体はコアドメインを介した比較的弱い相互作用により五量体化しており,相互作用面に点変異を導入することにより十量体を形成しない変異体を作製することができた.触媒ポケットは二量体を形成する境界面に存在し,補酵素であるピリドキサール5’-リン酸を結合していた.ピリドキサール5’-リン酸はアミノ酸の代謝を担う酵素など多数の酵素の活性を担っている.
SelAとtRNASecとが結合した状態の結晶構造も決定した(図1b).SelA十量体に10個のtRNASecが結合しており,総分子量は800,000に達した.これはリボソーム30Sサブユニットに匹敵する大きさであった.1つのtRNASecに注目すると,SelAの4つのサブユニット(サブユニットA~サブユニットD)にまたがって結合していることがわかった(図1c).サブユニットAのN末端ドメインがtRNASecのDアームと,サブユニットBがtRNASecのアクセプアームのステムと,サブユニットCがアクセプターアームの末端と,それぞれ相互作用していた.アミノ酸を結合するtRNASecの3’末端はサブユニットCとサブユニットDの境界面に存在する触媒ポケットにいたると考えられた(図1c).
N末端を欠くSelA変異体はtRNASecと結合できなかったのに対し,十量体を形成しないSelA変異体(N末端ドメインは欠いていない)はtRNASecとの結合能を保持していたため,N末端ドメインがtRNASecとの結合を担うことが明らかになった.どちらの変異体もin vitroおよびin vivoにおいて活性を失っていたため,SelAの活性にはtRNASecとの結合能だけでなく,十量体化も必須であることがわかった.
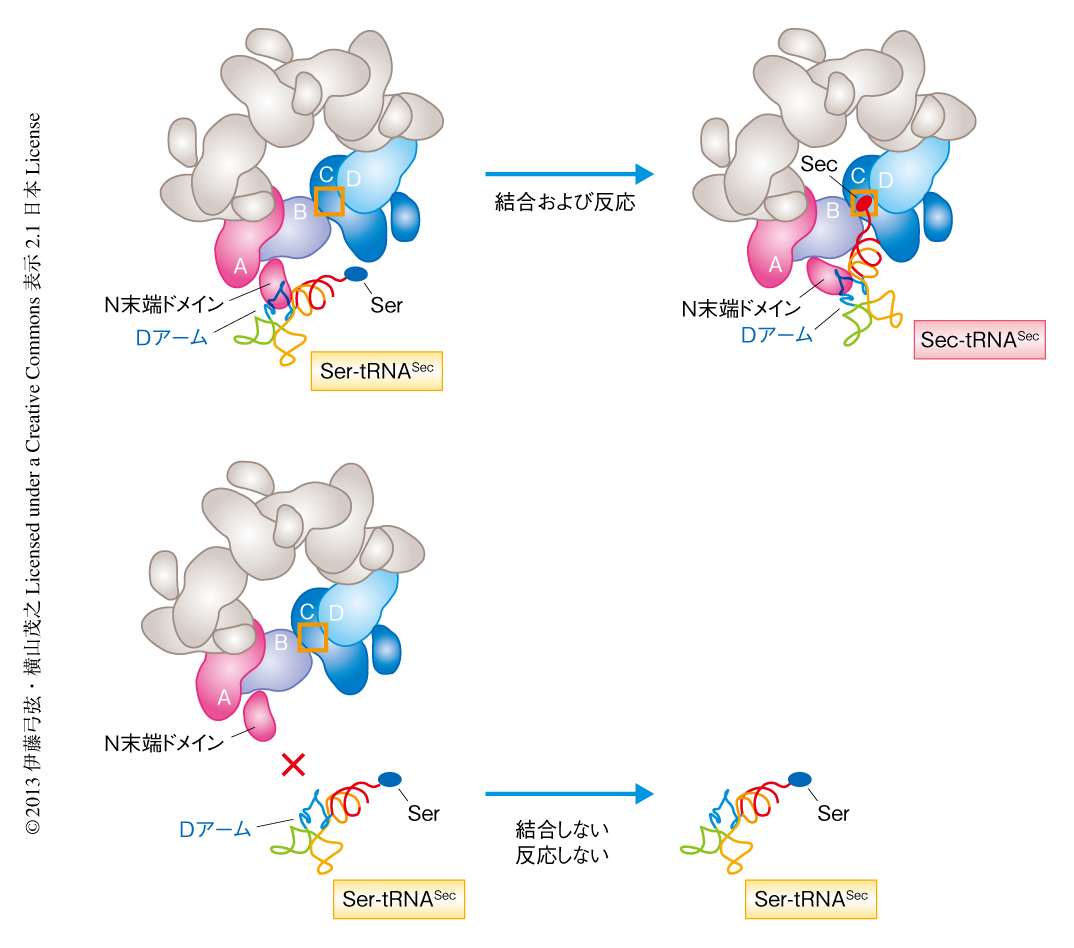
SerからSecへの変換においては,tRNASecを正確に識別することが重要である.Serを結合したSerのtRNA(Ser-tRNASer)にSelAがはたらくと,SerのコドンにSecを導入することになってしまう.また,細胞においてSer-tRNASecはSer-tRNASerに比べはるかに少ないことから,SelAはtRNASecに対するきわめて高い特異性をもつ必要がある.tRNASecのDアームはほかのtRNAに比べステムが長くループが短いという特徴をもつ8).SelAとtRNASecとの複合体の結晶構造から,SelAのN末端ドメインがtRNASecのDアームと特異的に相互作用することにより,tRNASecを正確に識別していることがわかった(図2).
ピリドキサール5’-リン酸をもつ酵素のほとんどは二量体または四量体として機能する.SelAが十量体を形成する必要性を詳細に調べたところ,SelA十量体のなかで,となりあう2つのSelA二量体に含まれる4個のサブユニットが,1つのSer-tRNASecに対し協力して4つの異なる作業を担っていることがわかった.具体的には,1)サブユニットAがSer-tRNASecを識別し,2)サブユニットAとサブユニットBがSer-tRNASecを固定,3)サブユニットCがSer-tRNASecの先端をつかまえ,4)サブユニットCとサブユニットDがSer-tRNASecの先端にあるSerをSecへと変換する,という連続した作業により,SelA十量体は1段階でSerをSecに変換している.また,サブユニットはすべて同じ構造であるため,となりのSer-tRNASecに対してはサブユニットC~サブユニットFの4個のサブユニットが4つの作業を担い,サブユニットCに着目すると,このとき1)と2)の作業を担当する.このように,おのおののサブユニットは4つの作業をすべて担うことができるが,これらのサブユニットをそれぞれのSer-tRNASecに対し機能させるためには二量体の配置が重要であり,これを実現するため,真正細菌では巨大な正五角形型の構造をとっていることがわかった.さらに,5つのSelA二量体を環状に配置することにより,全体では1)~4)の作業が10カ所で可能になった.もし,SelA二量体を直線状に配置した場合には両端にむだが生じるため非効率的であろう.このように,SelA十量体が環状の構造をとることの重要性も判明した.
セレノタンパク質はヒトの生存や健康の維持に必須であり,その研究はたいへん重要である.しかし現状では,Secをタンパク質に自在に取り込むことはできないため,セレノタンパク質の人工的な合成は困難である.今回,ヒト型につづき,真正細菌型のSec合成機構も解明できた.今後,セレノタンパク質の人工的な合成法の開発に大きく貢献し,タンパク質へのセレンの自在な導入により,天然の酵素をうわまわる能力をもつ人工酵素の創生や,セレンの欠乏を原因とする疾患の研究などに役立つことが期待できる.
古細菌と真正細菌の多くは,基本的な20種類のアミノ酸のうちいくつかについても,Secの合成のようにtRNAにおいてほかのアミノ酸を経由して合成している9).これは原始生物の名残とされ,初期の生物は少ない種類のアミノ酸からタンパク質を合成していたが,進化の過程において新しいアミノ酸を獲得していったものと考えられている.タンパク質を構成するアミノ酸の配列はDNAの遺伝子に規定されているため,新規のアミノ酸の獲得には遺伝暗号とその翻訳系の進化が必要である.Secの翻訳系はもっとも歴史の浅い未熟なものであるため,Secの合成から翻訳までの分子機構を詳細に調べ,完成されたアミノ酸の翻訳系と比較することは,原始の生物が遺伝暗号を進化させながら現在の姿にいたった経緯をひもとく手がかりになると期待できる.
略歴:2010年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:タンパク質および核酸のX線結晶構造解析.
抱負:生体において重要な巨大複合体の構造解析をめざす.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
© 2013 伊藤弓弦・横山茂之 Licensed under CC 表示 2.1 日本
(1東京大学分子細胞生物学研究所 細胞形態研究分野,2理化学研究所 横山構造生物学研究室)
email:伊藤弓弦,横山茂之
DOI: 10.7875/first.author.2013.054
Decameric SelA•tRNASec ring structure reveals mechanism of bacterial selenocysteine formation.
Yuzuru Itoh, Markus J. Bröcker, Shun-ichi Sekine, Gifty Hammond, Shiro Suetsugu, Dieter Söll, Shigeyuki Yokoyama
Science, 340, 75-78 (2013)
要 約
微量必須元素セレンを含むアミノ酸であるセレノシステインは21番目のアミノ酸とよばれ,mRNAに直接にコードされ翻訳の過程でタンパク質に取り込まれる.セレノシステインは専用のtRNAであるtRNASecに結合したセリンから合成されるが,ヒトを含めた真核生物および古細菌のグループと真正細菌のグループとでは,その合成機構は異なっている.これまで,ヒトにおけるセレノシステインの合成についてはその詳細が明らかにされているが,真正細菌においては不明のままであった.筆者らは,真正細菌においてセレノシステインを合成する酵素SelAとtRNASecとの複合体のX線結晶構造解析により,10個のSelAからなる星形の超巨大複合体の形成を明らかにした.また,セリンを結合した1つのtRNASecに対しSelAの4個のサブユニットがはたらいており,SelAが十量体を形成することがセレノシステインの合成に必要不可欠であることもつきとめた.
はじめに
タンパク質を構成するアミノ酸のうち,mRNAに直接にコードされているものは22種類である.20種類の標準アミノ酸にくわえ,セレノシステイン(Sec)とピロリジン(Pyl)がそれぞれ21番目,22番目のアミノ酸とよばれている.ピロリジンはきわめてかぎられた古細菌および真正細菌にのみ存在するのに対し,Secはヒトを含めた真核生物,古細菌,真正細菌に広く存在する.Secはシステインのもつ硫黄がセレンに置き換わったアミノ酸であり,おもに酸化還元酵素の触媒活性部位を形成し,ヒトでは25種類のセレン含有タンパク質(セレノタンパク質)が知られている1).必須微量元素であるセレンは体内ではSecとして機能しており,セレノタンパク質はセレンの高い反応性を利用して抗酸化作用など重要な機能を発揮している.
SecはmRNAのUGAコドンにコードされており,SecのtRNA(tRNASec)はUGAに相補的なアンチコドンUCAをもつ.通常のtRNAの場合,対応するアミノアシルtRNA合成酵素により直接にアミノ酸が結合されてリボソームへと輸送されるが,tRNASecの場合は,まず,セリンのアミノアシルtRNA合成酵素がtRNASecとSerとを結合してSer-tRNASecを合成し2),つづいて,tRNASecにおいてSerがSecへと変換される.この変換機構は,ヒトを含めた真核生物および古細菌のグループ(ヒト型)と,真正細菌のグループ(真正細菌型)とではまったく異なっている.ヒト型では,リン酸化酵素PSTKがSerをリン酸化し3),SepSecSがリン酸化セリンをSecへと変換する4).一方,真正細菌では,1つの酵素SelAが1段階でSerをSecへと変換する5).筆者らのグループによる成果などにより,ヒト型のSec合成の分子機構の全容は明らかになっていたが6,7),真正細菌型の研究は巨大タンパク質を形成するSelAのX線結晶構造解析が技術的に困難であったため大きく遅れており,その解明が求められていた.
1.SelAはホモ十量体を形成している
真正細菌の1種Aquifex aeolicusに由来するSelAを結晶化し結晶構造を決定した.SelAは,2個のサブユニットからなる二量体が5個,星形に配列してホモ十量体を形成していることがわかった(図1a).SelA十量体の総分子量は500,000をこえ,すべてのサブユニットは互いに同じ構造であったため,正五角形型の対称性をもっていた.おのおののサブユニットはN末端ドメイン,コアドメイン,C末端ドメインからなり,コアドメインとC末端ドメインとが星型を形成し,可動性のN末端ドメインは星型の平面から上下に突き出ていた(図1a).SelA二量体はコアドメインを介した比較的弱い相互作用により五量体化しており,相互作用面に点変異を導入することにより十量体を形成しない変異体を作製することができた.触媒ポケットは二量体を形成する境界面に存在し,補酵素であるピリドキサール5’-リン酸を結合していた.ピリドキサール5’-リン酸はアミノ酸の代謝を担う酵素など多数の酵素の活性を担っている.
2.SelA十量体に10個のtRNASecが結合する
SelAとtRNASecとが結合した状態の結晶構造も決定した(図1b).SelA十量体に10個のtRNASecが結合しており,総分子量は800,000に達した.これはリボソーム30Sサブユニットに匹敵する大きさであった.1つのtRNASecに注目すると,SelAの4つのサブユニット(サブユニットA~サブユニットD)にまたがって結合していることがわかった(図1c).サブユニットAのN末端ドメインがtRNASecのDアームと,サブユニットBがtRNASecのアクセプアームのステムと,サブユニットCがアクセプターアームの末端と,それぞれ相互作用していた.アミノ酸を結合するtRNASecの3’末端はサブユニットCとサブユニットDの境界面に存在する触媒ポケットにいたると考えられた(図1c).
N末端を欠くSelA変異体はtRNASecと結合できなかったのに対し,十量体を形成しないSelA変異体(N末端ドメインは欠いていない)はtRNASecとの結合能を保持していたため,N末端ドメインがtRNASecとの結合を担うことが明らかになった.どちらの変異体もin vitroおよびin vivoにおいて活性を失っていたため,SelAの活性にはtRNASecとの結合能だけでなく,十量体化も必須であることがわかった.
3.tRNASecとtRNASerとを識別する分子機構
SerからSecへの変換においては,tRNASecを正確に識別することが重要である.Serを結合したSerのtRNA(Ser-tRNASer)にSelAがはたらくと,SerのコドンにSecを導入することになってしまう.また,細胞においてSer-tRNASecはSer-tRNASerに比べはるかに少ないことから,SelAはtRNASecに対するきわめて高い特異性をもつ必要がある.tRNASecのDアームはほかのtRNAに比べステムが長くループが短いという特徴をもつ8).SelAとtRNASecとの複合体の結晶構造から,SelAのN末端ドメインがtRNASecのDアームと特異的に相互作用することにより,tRNASecを正確に識別していることがわかった(図2).
4.SelAが十量体を形成する必要性
ピリドキサール5’-リン酸をもつ酵素のほとんどは二量体または四量体として機能する.SelAが十量体を形成する必要性を詳細に調べたところ,SelA十量体のなかで,となりあう2つのSelA二量体に含まれる4個のサブユニットが,1つのSer-tRNASecに対し協力して4つの異なる作業を担っていることがわかった.具体的には,1)サブユニットAがSer-tRNASecを識別し,2)サブユニットAとサブユニットBがSer-tRNASecを固定,3)サブユニットCがSer-tRNASecの先端をつかまえ,4)サブユニットCとサブユニットDがSer-tRNASecの先端にあるSerをSecへと変換する,という連続した作業により,SelA十量体は1段階でSerをSecに変換している.また,サブユニットはすべて同じ構造であるため,となりのSer-tRNASecに対してはサブユニットC~サブユニットFの4個のサブユニットが4つの作業を担い,サブユニットCに着目すると,このとき1)と2)の作業を担当する.このように,おのおののサブユニットは4つの作業をすべて担うことができるが,これらのサブユニットをそれぞれのSer-tRNASecに対し機能させるためには二量体の配置が重要であり,これを実現するため,真正細菌では巨大な正五角形型の構造をとっていることがわかった.さらに,5つのSelA二量体を環状に配置することにより,全体では1)~4)の作業が10カ所で可能になった.もし,SelA二量体を直線状に配置した場合には両端にむだが生じるため非効率的であろう.このように,SelA十量体が環状の構造をとることの重要性も判明した.
おわりに
セレノタンパク質はヒトの生存や健康の維持に必須であり,その研究はたいへん重要である.しかし現状では,Secをタンパク質に自在に取り込むことはできないため,セレノタンパク質の人工的な合成は困難である.今回,ヒト型につづき,真正細菌型のSec合成機構も解明できた.今後,セレノタンパク質の人工的な合成法の開発に大きく貢献し,タンパク質へのセレンの自在な導入により,天然の酵素をうわまわる能力をもつ人工酵素の創生や,セレンの欠乏を原因とする疾患の研究などに役立つことが期待できる.
古細菌と真正細菌の多くは,基本的な20種類のアミノ酸のうちいくつかについても,Secの合成のようにtRNAにおいてほかのアミノ酸を経由して合成している9).これは原始生物の名残とされ,初期の生物は少ない種類のアミノ酸からタンパク質を合成していたが,進化の過程において新しいアミノ酸を獲得していったものと考えられている.タンパク質を構成するアミノ酸の配列はDNAの遺伝子に規定されているため,新規のアミノ酸の獲得には遺伝暗号とその翻訳系の進化が必要である.Secの翻訳系はもっとも歴史の浅い未熟なものであるため,Secの合成から翻訳までの分子機構を詳細に調べ,完成されたアミノ酸の翻訳系と比較することは,原始の生物が遺伝暗号を進化させながら現在の姿にいたった経緯をひもとく手がかりになると期待できる.
文 献
- Kryukov, G. V., Castellano, S., Novoselov, S. V. et al.: Characterization of mammalian selenoproteomes. Science, 300, 1439-1443 (2003)[PubMed]
- Leinfelder, W., Zehelein, E., Mandrand-Berthelot, M. A. et al.: Gene for a novel tRNA species that accepts L-serine and cotranslationally inserts selenocysteine. Nature, 331, 723-725 (1988)[PubMed]
- Carlson, B. A., Xu, X. M., Kryukov, G. V. et al.: Identification and characterization of phosphoseryl-tRNA[Ser]Sec kinase. Proc. Natl. Acad. Sci. USA, 101, 12848-12853 (2004)[PubMed]
- Yuan, J., Palioura, S., Salazar, J. C. et al.: RNA-dependent conversion of phosphoserine forms selenocysteine in eukaryotes and archaea. Proc. Natl. Acad. Sci. USA, 103, 18923-18927 (2006)[PubMed]
- Forchhammer, K. & Bock, A.: Selenocysteine synthase from Escherichia coli. Analysis of the reaction sequence. J. Biol. Chem., 266, 6324-6328 (1991)[PubMed]
- Chiba, S., Itoh, Y., Sekine, S. et al.: Structural basis for the major role of O-phosphoseryl-tRNA kinase in the UGA-specific encoding of selenocysteine. Mol. Cell, 39, 410-420 (2010)[PubMed] [新着論文レビュー]
- Palioura, S., Sherrer, R. L., Steitz, T. A. et al.: The human SepSecS-tRNASec complex reveals the mechanism of selenocysteine formation. Science, 325, 321-325 (2009)[PubMed]
- Itoh, Y., Chiba, S., Sekine, S. et al.: Crystal structure of human selenocysteine tRNA. Nucleic Acids Res., 37, 6259-6268 (2009)[PubMed]
- Sheppard, K., Yuan, J., Hohn, M. J. et al.: From one amino acid to another: tRNA-dependent amino acid biosynthesis. Nucleic Acids Res., 36, 1813-1825 (2008)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:タンパク質および核酸のX線結晶構造解析.
抱負:生体において重要な巨大複合体の構造解析をめざす.
横山 茂之(Shigeyuki Yokoyama)
理化学研究所 上席研究員.
© 2013 伊藤弓弦・横山茂之 Licensed under CC 表示 2.1 日本