ユビキチン様タンパク質Atg12-Atg5結合体はAtg3の活性中心の再編成をひき起こしその酵素活性を上昇させる
中戸川万智子・中戸川 仁・大隅良典
(東京工業大学 フロンティア研究機構)
email:中戸川万智子
DOI: 10.7875/first.author.2013.040
Atg12-Atg5 conjugate enhances E2 activity of Atg3 by rearranging its catalytic site.
Machiko Sakoh-Nakatogawa, Kazuaki Matoba, Eri Asai, Hiromi Kirisako, Junko Ishii, Nobuo N Noda, Fuyuhiko Inagaki, Hitoshi Nakatogawa, Yoshinori Ohsumi
Nature Structural & Molecular Biology, 20, 433-439 (2013)
オートファジーには2つのユビキチン様タンパク質Atg8およびAtg12が必須である.いずれもユビキチンと同様の結合反応をへて,それぞれ,ホスファチジルエタノールアミンおよびAtg5と結合する.これまで,Atg12-Atg5結合体がAtg8結合反応のE2酵素であるAtg3と直接に相互作用し,Atg8のAtg3からホスファチジルエタノールアミンへの転移を促進するE3酵素としてはたらくことが示されていたが,その分子機構は明らかではなかった.この論文において,筆者らは,構造情報をもとにした生化学的な解析により,Atg12-Atg5結合体の非存在下ではAtg3の活性中心は通常のE2酵素の活性中心とは異なる不活性型の構造をとりやすいこと,Atg12-Atg5結合体が相互作用するとAtg3の活性中心に構造変化がひき起こされ活性型になることを示した.Atg12-Atg5結合体はユビキチンに対する典型的なE3酵素とはまったく異なる様式でAtg8の転移を促進することが明らかになった.
オートファジーは真核生物に広く保存されたバルク分解系である.オートファジーが誘導されると細胞質に扁平な膜構造体が現われ,分解標的を包み込みながら伸長し,これが閉じることでオートファゴソームとよばれる二重膜構造が形成される.完成したオートファゴソームは外膜が液胞またはリソソームと融合し内膜ごと中身が分解される.オートファジーは栄養飢餓のときには細胞質の構成成分を無差別に分解するが,異常なオルガネラや凝集性タンパク質,細胞に侵入した細菌などの選択的な分解も担う.オートファジーの破綻が神経変性疾患や肝疾患,糖尿病などの重篤な疾患の発症につながる可能性が示されつつある.
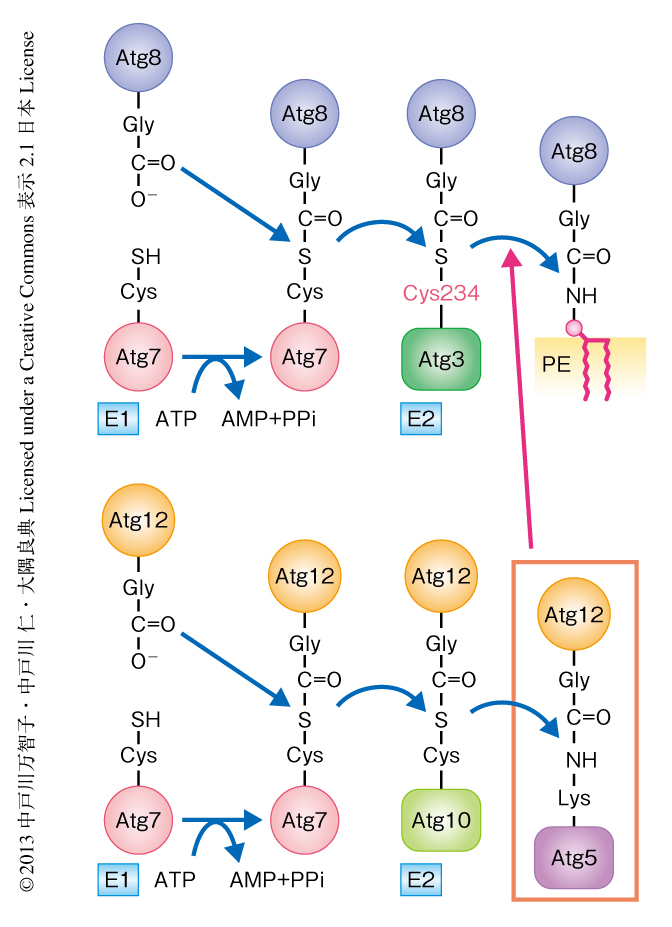
オートファゴソームの形成は2つのユビキチン様タンパク質Atg8およびAtg12を必要とする.これらはAtg7を共通のE1酵素とし,Atg3とAtg10をそれぞれに特異的なE2酵素として,ユビキチンと同様の結合反応の基質になる(図1).ただし,Atg8の標的はタンパク質ではなく脂質分子ホスファチジルエタノールアミンである.Atg12は最終的にAtg5と結合体を形成するが,このAtg12-Atg5結合体はAtg8結合反応のE3酵素として機能する1).ユビキチン様タンパク質結合体がほかのユビキチン様タンパク質の結合反応を促進するというユニークな系である.しかしながら,Atg12-Atg5結合体の立体構造は典型的なE3酵素とは大きく異なっており2),これまで詳細な解析が行われてきたユビキチンやユビキチン様タンパク質の例からは,Atg12-Atg5結合体がどのようにしてE3酵素として機能するのかまったく予想できなかった.
筆者らは,分子内ジスルフィド結合の形成を指標にしてAtg3の活性中心のCysとほかのアミノ酸残基とのあいだの近接度を調べる方法を確立し,Atg12-Atg5結合体が相互作用することにより,Atg3の活性中心のCysの側鎖の向きが活性に重要なほかの残基のほうへと大きく変化することを示した.さらに,変異解析により,Atg12-Atg5結合体の非存在下においてAtg3の活性がどのように抑制されているのか,その構造的な基盤も明らかにした.以上の結果から,Atg12-Atg5結合体によるAtg3の活性化機構のモデルを提唱した.
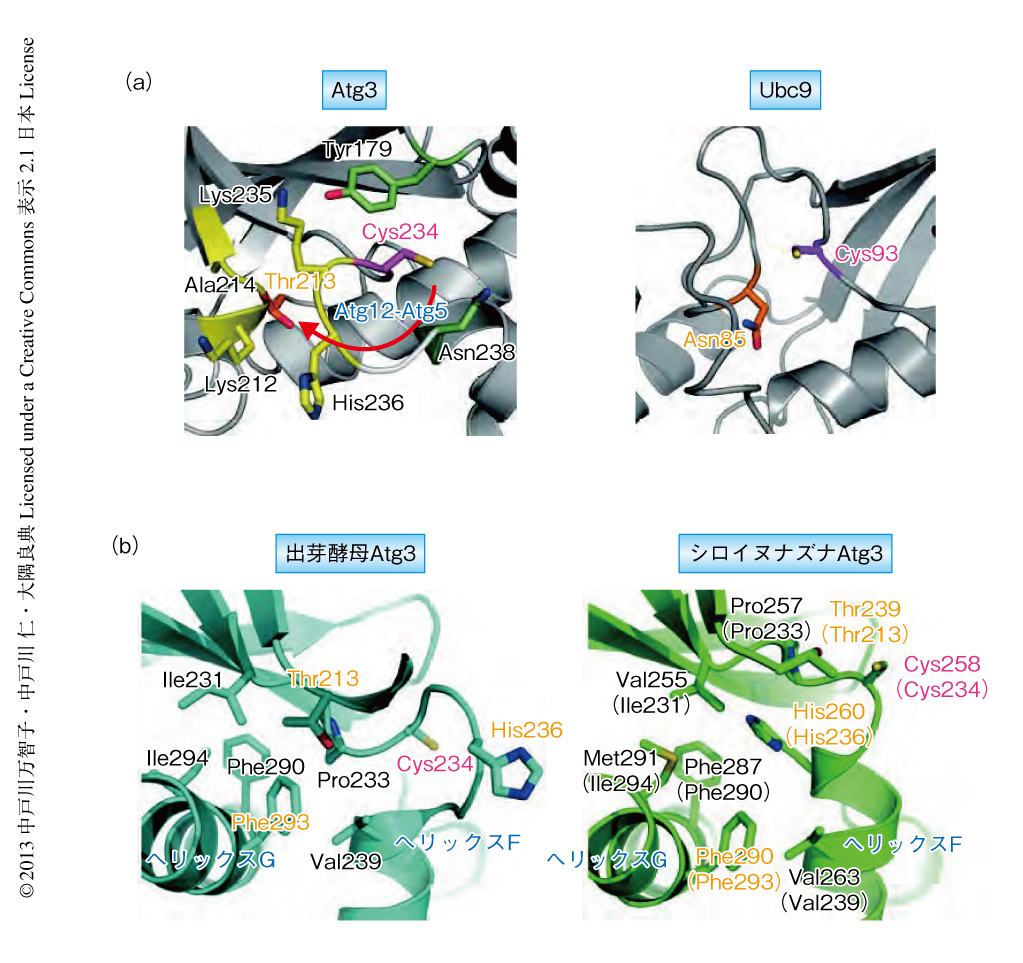
出芽酵母Atg3の結晶構造はすでに解かれており,そのE2コアドメインの全体構造はほかのE2酵素とよく似ていることが明らかになった3).しかしながら,活性中心の構造はほかのE2酵素と比較していくつかの点で異なっていた(図2a).ユビキチンのE2酵素から標的タンパク質への転移反応に重要であり,すべてのE2酵素に保存されているAsnの位置に,Atg3ではThrが配置されている.このThr213をほかのアミノ酸残基に置換した変異体を発現させた出芽酵母株ではオートファジー活性は著しく減少したことから,Thr213はAtg3の活性に必須であることが示された.さらに,Atg8の結合反応のin vitro再構成系を用いることで,Thr213の点変異体ではAtg8-Atg3チオエステル中間体の形成(図1)は正常であるものの,つぎのステップであるAtg8のAtg3からホスファチジルエタノールアミンへの転移に異常の生じることが明らかになった.これらの結果から,Atg3のThr213はほかのE2酵素におけるAsnに相当する役割をはたしていると考えられた.
しかしながら,Thr213が典型的なE2酵素におけるAsnと同じ様式でAtg8の転移反応に関与すると考えると,典型的なE2酵素では活性中心のCysの側鎖はAsnに近接しているのに対し,Atg3では活性中心のCys234の側鎖はThr213とはまったく異なる方向をむいており,Atg3がこのままの構造で活性を示すとは考えにくかった(図2a).そこで,Atg12-Atg5結合体によりAtg3に構造変化がひき起こされる可能性を,つぎに示す方法により検証した.Thr213やその付近にあるアミノ酸残基をCysに置換し,Atg12-Atg5結合体によりCys234が導入したCysの方向をむくような構造変化がAtg3に起こった場合には,それらのCysのあいだにジスルフィド結合が形成されるのではないかと考えた.Cysを導入したAtg3変異体を精製し,Atg12-Atg5結合体の存在下または非存在下において分子内ジスルフィド結合の形成を調べた.その結果,Lys212,Thr213,あるいは,Lys235をCysに置換した変異体において,Atg12-Atg5結合体に依存的にCys234とのジスルフィド結合が形成された(図2a).一方,結晶構造においてCys234と近接するTyr179をCysに置換すると,Atg12-Atg5結合体の非存在下においてCys234とCys179とのあいだにジスルフィド結合が効率よく形成された(図2a).これらの結果から,Atg12-Atg5結合体はAtg3のCys234がTyr179からThr213の方向をむくような構造変化をひき起こすことが示唆された.
これまで,Atg8-ホスファチジルエタノールアミンの形成は高いpH条件でより効率よく進行することが示されていた4).さらに今回,異なるpH条件におけるAtg8-Atg3中間体の形成について調べたところ,その形成効率はpHが変わってもほとんど変化しないことが明らかになった.ホスファチジルエタノールアミンの親水性頭部のプロトン化状態は調べたpHの範囲ではほぼ変化しないことから,これらの結果は,高いpHではAtg3のE2酵素活性が上昇しAtg8の転移反応が促進されることを示唆していた.また,Cys234とThr213の位置に導入したCysとのあいだのジスルフィド結合の形成についてpHの影響を調べた結果,高いpHにおいてはAtg12-Atg5結合体の非存在下でもそれらCysのあいだにジスルフィド結合の形成されることがわかった.以上の結果から,Atg3の活性中心におけるCys234の配向(分子内ジスルフィド結合の形成)とそのE2酵素活性とのあいだには相関のあること,したがって,Atg12-Atg5結合体によりひき起こされる構造変化はAtg3のE2酵素活性の上昇をもたらすことが示唆された.
出芽酵母Atg3の結晶構造において,Cys234を含むループはE2コアドメインの一部であるヘリックスGとPhe293を介し相互作用している(図2b).ここまでの結果から,この結晶構造は不活性型のAtg3を示していると考えられたため,この相互作用は不活性型の構造の維持に寄与していると予想された.Phe293をSerに置換した変異体を作製しin vitroにおける活性を調べた結果,その活性は野生型Atg3に比べ高いことが明らかになった.さらに,野生型Atg3を用いたAtg8-ホスファチジルエタノールアミンの形成反応はAtg12-Atg5結合体の添加により促進されたのに対し,Phe293をSerに置換した変異体ではそのような促進はみられなかった.すなわち,Phe293をSerに置換した変異体は構成的に活性化した変異体であることが示唆された.一方,Phe293をSerに置換した変異体においてAtg8-Atg3中間体の形成効率は野生型Atg3と変わらなかったため,この変異はAtg8のAtg3からホスファチジルエタノールアミンへの転移を促進すると考えられた.さらに,Phe293をSerに置換した変異体の活性中心の構造を調べるため,この変異体にThr213をCysに置換する点変異を導入しCys234とのジスルフィド結合の形成について調べた.その結果,Phe293をSerに置換した変異体ではAtg12-Atg5結合体の非存在下においても分子内ジスルフィド結合が形成された.つまり,Phe293をSerに置換した変異により,Atg3の活性中心はCys234がThr213の方向をむいた構造をとりやすくなっており,このことがこの変異体の活性上昇の原因になっていると考えられた.
この論文の共著者のグループは,最近,シロイヌナズナAtg3の結晶構造を明らかにした5)(新着論文レビュー でも掲載).興味深いことに,シロイヌナズナAtg3の全体構造は出芽酵母Atg3の構造とよく似ていたにもかかわらず,活性中心のCys234に相当するCys258は,Thr213に相当するThr239と非常に近接していた(図2b).シロイヌナズナにおいてもAtg12-Atg5結合体がAtg8-ホスファチジルエタノールアミンの形成を促進することが示されているため6),シロイヌナズナAtg3においてこのような結晶構造が得られたのは,高いpH条件(pH 8.0)において得られた結晶を解析したことに起因すると考えられた(出芽酵母Atg3の構造解析に用いられた結晶は,pH 5.8で得られたものである).実際に,シロイヌナズナAtg3のThr239の位置にCysを導入した変異体をpHを変えてインキュベーションしたところ,pH 7.0ではみられなかった分子内ジスルフィド結合の形成がpH 8.0において効率よく起こった.つまり,構造解析で示されたシロイヌナズナAtg3の活性中心の構造は,Atg3がAtg12-Atg5結合体により活性化された状態に相当すると考えられた.
シロイヌナズナAtg3の活性中心では,Cys258を含むループにつづくヘリックスFが出芽酵母Atg3のヘリックスFより1巻き多いことでHis260が構造の内部にむけて配向し,ヘリックスGのPhe293に相当するPhe290を含むいくつかの残基により形成される疎水的な環境におさまっている(図2b).一方,His260に相当する出芽酵母Atg3のHis236は,結晶構造においてヘリックスGとは反対側をむいていた.His236の重要性を調べるため,これをほかのアミノ酸残基に置換した変異体を作製した.その結果,そのような変異体ではAtg8のホスファチジルエタノールアミンへの転移のステップが進行せず,さらに,Atg12-Atg5結合体による構造変化も起こらなくなった.これらの結果から,His236はAtg12-Atg5結合体による構造変化,あるいは,活性型の構造維持に重要であることが示唆された.
以上の結果をまとめて,Atg12-Atg5結合体によるAtg3の活性化機構のモデルを提唱した(図3).Atg12-Atg5結合体の非存在下では,Atg3のCys234を含むループがヘリックスGと相互作用することによりCys234はThr213とは逆に配向し,不活性型の構造をとっている.Atg12-Atg5結合体が相互作用するとAtg3に構造変化がひき起こされ,Cys234がThr213に近接することにより,Atg8のAtg3からホスファチジルエタノールアミンへの転移が促進される.
また,Atg12-Atg5結合体の非存在下でも高い活性を示す,Phe293をSerに置換した変異体をATG5遺伝子を欠損させた出芽酵母株で発現させると,野生型のAtg3を発現させた場合とは異なり,Atg8-ホスファチジルエタノールアミンは効率よく形成されるがオートファジーは進行しないことが示された.Atg12-Atg5結合体はAtg8結合反応のE3酵素として機能するだけでなく,Atg16と複合体を形成し,Atg8-ホスファチジルエタノールアミンの形成の場所を規定していると考えられている7).オートファジーが進行するにはAtg8-ホスファチジルエタノールアミンがAtg12-Atg5-Atg16複合体によりしかるべき場所において形成されることが必要なのだろう.ホスファチジルエタノールアミンは細胞に豊富に存在する脂質であるため,Atg12-Atg5-Atg16複合体が局在する場所においてもっとも効率よくAtg8-ホスファチジルエタノールアミンを形成させるために,Atg12-Atg5結合体がAtg3を活性化する機構が必要であると考えられた.
この論文では,E3酵素であるAtg12-Atg5結合体がE2酵素であるAtg3に構造変化をひき起こし,その活性を上昇させることを明らかにした.E3酵素がE2酵素に構造変化をひき起こすことを示したはじめての例である.Atg12-Atg5結合体は典型的なE3酵素とは構造的にまったく異なる.Atg12がユビキチン様タンパク質であるのにくわえ,Atg5にもユビキチン様フォールドが2つ存在する8).これら3つのユビキチン様フォールドがAtg3の構造変化においてどのように関与しているのかを含め,Atg12-Atg5結合体がAtg3とどのように相互作用し構造変化をひき起こすのかを明らかにするには,Atg12-Atg5結合体とAtg3との複合体の構造解析が必須である.
略歴:2005年 京都大学大学院理学研究科博士課程 修了,同年 名古屋大学大学院理学研究科 博士研究員を経て,2009年より東京工業大学フロンティア研究機構 博士研究員.
研究テーマ:オートファジーにおけるユビキチン様タンパク質結合系の役割.
関心事:Atgタンパク質の修飾による活性制御.
中戸川 仁(Hitoshi Nakatogawa)
東京工業大学フロンティア研究機構 特任准教授.
大隅 良典(Yoshinori Ohsumi)
東京工業大学フロンティア研究機構 特任教授.
研究室URL:http://www.ohsumilab.aro.iri.titech.ac.jp/
© 2013 中戸川万智子・中戸川 仁・大隅良典 Licensed under CC 表示 2.1 日本
(東京工業大学 フロンティア研究機構)
email:中戸川万智子
DOI: 10.7875/first.author.2013.040
Atg12-Atg5 conjugate enhances E2 activity of Atg3 by rearranging its catalytic site.
Machiko Sakoh-Nakatogawa, Kazuaki Matoba, Eri Asai, Hiromi Kirisako, Junko Ishii, Nobuo N Noda, Fuyuhiko Inagaki, Hitoshi Nakatogawa, Yoshinori Ohsumi
Nature Structural & Molecular Biology, 20, 433-439 (2013)
要 約
オートファジーには2つのユビキチン様タンパク質Atg8およびAtg12が必須である.いずれもユビキチンと同様の結合反応をへて,それぞれ,ホスファチジルエタノールアミンおよびAtg5と結合する.これまで,Atg12-Atg5結合体がAtg8結合反応のE2酵素であるAtg3と直接に相互作用し,Atg8のAtg3からホスファチジルエタノールアミンへの転移を促進するE3酵素としてはたらくことが示されていたが,その分子機構は明らかではなかった.この論文において,筆者らは,構造情報をもとにした生化学的な解析により,Atg12-Atg5結合体の非存在下ではAtg3の活性中心は通常のE2酵素の活性中心とは異なる不活性型の構造をとりやすいこと,Atg12-Atg5結合体が相互作用するとAtg3の活性中心に構造変化がひき起こされ活性型になることを示した.Atg12-Atg5結合体はユビキチンに対する典型的なE3酵素とはまったく異なる様式でAtg8の転移を促進することが明らかになった.
はじめに
オートファジーは真核生物に広く保存されたバルク分解系である.オートファジーが誘導されると細胞質に扁平な膜構造体が現われ,分解標的を包み込みながら伸長し,これが閉じることでオートファゴソームとよばれる二重膜構造が形成される.完成したオートファゴソームは外膜が液胞またはリソソームと融合し内膜ごと中身が分解される.オートファジーは栄養飢餓のときには細胞質の構成成分を無差別に分解するが,異常なオルガネラや凝集性タンパク質,細胞に侵入した細菌などの選択的な分解も担う.オートファジーの破綻が神経変性疾患や肝疾患,糖尿病などの重篤な疾患の発症につながる可能性が示されつつある.
オートファゴソームの形成は2つのユビキチン様タンパク質Atg8およびAtg12を必要とする.これらはAtg7を共通のE1酵素とし,Atg3とAtg10をそれぞれに特異的なE2酵素として,ユビキチンと同様の結合反応の基質になる(図1).ただし,Atg8の標的はタンパク質ではなく脂質分子ホスファチジルエタノールアミンである.Atg12は最終的にAtg5と結合体を形成するが,このAtg12-Atg5結合体はAtg8結合反応のE3酵素として機能する1).ユビキチン様タンパク質結合体がほかのユビキチン様タンパク質の結合反応を促進するというユニークな系である.しかしながら,Atg12-Atg5結合体の立体構造は典型的なE3酵素とは大きく異なっており2),これまで詳細な解析が行われてきたユビキチンやユビキチン様タンパク質の例からは,Atg12-Atg5結合体がどのようにしてE3酵素として機能するのかまったく予想できなかった.
筆者らは,分子内ジスルフィド結合の形成を指標にしてAtg3の活性中心のCysとほかのアミノ酸残基とのあいだの近接度を調べる方法を確立し,Atg12-Atg5結合体が相互作用することにより,Atg3の活性中心のCysの側鎖の向きが活性に重要なほかの残基のほうへと大きく変化することを示した.さらに,変異解析により,Atg12-Atg5結合体の非存在下においてAtg3の活性がどのように抑制されているのか,その構造的な基盤も明らかにした.以上の結果から,Atg12-Atg5結合体によるAtg3の活性化機構のモデルを提唱した.
1.Atg3の酵素活性におけるThr213の重要性
出芽酵母Atg3の結晶構造はすでに解かれており,そのE2コアドメインの全体構造はほかのE2酵素とよく似ていることが明らかになった3).しかしながら,活性中心の構造はほかのE2酵素と比較していくつかの点で異なっていた(図2a).ユビキチンのE2酵素から標的タンパク質への転移反応に重要であり,すべてのE2酵素に保存されているAsnの位置に,Atg3ではThrが配置されている.このThr213をほかのアミノ酸残基に置換した変異体を発現させた出芽酵母株ではオートファジー活性は著しく減少したことから,Thr213はAtg3の活性に必須であることが示された.さらに,Atg8の結合反応のin vitro再構成系を用いることで,Thr213の点変異体ではAtg8-Atg3チオエステル中間体の形成(図1)は正常であるものの,つぎのステップであるAtg8のAtg3からホスファチジルエタノールアミンへの転移に異常の生じることが明らかになった.これらの結果から,Atg3のThr213はほかのE2酵素におけるAsnに相当する役割をはたしていると考えられた.
2.Atg12-Atg5結合体はAtg3の活性中心に構造変化をひき起こす
しかしながら,Thr213が典型的なE2酵素におけるAsnと同じ様式でAtg8の転移反応に関与すると考えると,典型的なE2酵素では活性中心のCysの側鎖はAsnに近接しているのに対し,Atg3では活性中心のCys234の側鎖はThr213とはまったく異なる方向をむいており,Atg3がこのままの構造で活性を示すとは考えにくかった(図2a).そこで,Atg12-Atg5結合体によりAtg3に構造変化がひき起こされる可能性を,つぎに示す方法により検証した.Thr213やその付近にあるアミノ酸残基をCysに置換し,Atg12-Atg5結合体によりCys234が導入したCysの方向をむくような構造変化がAtg3に起こった場合には,それらのCysのあいだにジスルフィド結合が形成されるのではないかと考えた.Cysを導入したAtg3変異体を精製し,Atg12-Atg5結合体の存在下または非存在下において分子内ジスルフィド結合の形成を調べた.その結果,Lys212,Thr213,あるいは,Lys235をCysに置換した変異体において,Atg12-Atg5結合体に依存的にCys234とのジスルフィド結合が形成された(図2a).一方,結晶構造においてCys234と近接するTyr179をCysに置換すると,Atg12-Atg5結合体の非存在下においてCys234とCys179とのあいだにジスルフィド結合が効率よく形成された(図2a).これらの結果から,Atg12-Atg5結合体はAtg3のCys234がTyr179からThr213の方向をむくような構造変化をひき起こすことが示唆された.
3.Atg3の構造変化と活性との関連
これまで,Atg8-ホスファチジルエタノールアミンの形成は高いpH条件でより効率よく進行することが示されていた4).さらに今回,異なるpH条件におけるAtg8-Atg3中間体の形成について調べたところ,その形成効率はpHが変わってもほとんど変化しないことが明らかになった.ホスファチジルエタノールアミンの親水性頭部のプロトン化状態は調べたpHの範囲ではほぼ変化しないことから,これらの結果は,高いpHではAtg3のE2酵素活性が上昇しAtg8の転移反応が促進されることを示唆していた.また,Cys234とThr213の位置に導入したCysとのあいだのジスルフィド結合の形成についてpHの影響を調べた結果,高いpHにおいてはAtg12-Atg5結合体の非存在下でもそれらCysのあいだにジスルフィド結合の形成されることがわかった.以上の結果から,Atg3の活性中心におけるCys234の配向(分子内ジスルフィド結合の形成)とそのE2酵素活性とのあいだには相関のあること,したがって,Atg12-Atg5結合体によりひき起こされる構造変化はAtg3のE2酵素活性の上昇をもたらすことが示唆された.
4.Atg3の活性抑制に関する構造基盤
出芽酵母Atg3の結晶構造において,Cys234を含むループはE2コアドメインの一部であるヘリックスGとPhe293を介し相互作用している(図2b).ここまでの結果から,この結晶構造は不活性型のAtg3を示していると考えられたため,この相互作用は不活性型の構造の維持に寄与していると予想された.Phe293をSerに置換した変異体を作製しin vitroにおける活性を調べた結果,その活性は野生型Atg3に比べ高いことが明らかになった.さらに,野生型Atg3を用いたAtg8-ホスファチジルエタノールアミンの形成反応はAtg12-Atg5結合体の添加により促進されたのに対し,Phe293をSerに置換した変異体ではそのような促進はみられなかった.すなわち,Phe293をSerに置換した変異体は構成的に活性化した変異体であることが示唆された.一方,Phe293をSerに置換した変異体においてAtg8-Atg3中間体の形成効率は野生型Atg3と変わらなかったため,この変異はAtg8のAtg3からホスファチジルエタノールアミンへの転移を促進すると考えられた.さらに,Phe293をSerに置換した変異体の活性中心の構造を調べるため,この変異体にThr213をCysに置換する点変異を導入しCys234とのジスルフィド結合の形成について調べた.その結果,Phe293をSerに置換した変異体ではAtg12-Atg5結合体の非存在下においても分子内ジスルフィド結合が形成された.つまり,Phe293をSerに置換した変異により,Atg3の活性中心はCys234がThr213の方向をむいた構造をとりやすくなっており,このことがこの変異体の活性上昇の原因になっていると考えられた.
5.Atg3の活性型の構造
この論文の共著者のグループは,最近,シロイヌナズナAtg3の結晶構造を明らかにした5)(新着論文レビュー でも掲載).興味深いことに,シロイヌナズナAtg3の全体構造は出芽酵母Atg3の構造とよく似ていたにもかかわらず,活性中心のCys234に相当するCys258は,Thr213に相当するThr239と非常に近接していた(図2b).シロイヌナズナにおいてもAtg12-Atg5結合体がAtg8-ホスファチジルエタノールアミンの形成を促進することが示されているため6),シロイヌナズナAtg3においてこのような結晶構造が得られたのは,高いpH条件(pH 8.0)において得られた結晶を解析したことに起因すると考えられた(出芽酵母Atg3の構造解析に用いられた結晶は,pH 5.8で得られたものである).実際に,シロイヌナズナAtg3のThr239の位置にCysを導入した変異体をpHを変えてインキュベーションしたところ,pH 7.0ではみられなかった分子内ジスルフィド結合の形成がpH 8.0において効率よく起こった.つまり,構造解析で示されたシロイヌナズナAtg3の活性中心の構造は,Atg3がAtg12-Atg5結合体により活性化された状態に相当すると考えられた.
シロイヌナズナAtg3の活性中心では,Cys258を含むループにつづくヘリックスFが出芽酵母Atg3のヘリックスFより1巻き多いことでHis260が構造の内部にむけて配向し,ヘリックスGのPhe293に相当するPhe290を含むいくつかの残基により形成される疎水的な環境におさまっている(図2b).一方,His260に相当する出芽酵母Atg3のHis236は,結晶構造においてヘリックスGとは反対側をむいていた.His236の重要性を調べるため,これをほかのアミノ酸残基に置換した変異体を作製した.その結果,そのような変異体ではAtg8のホスファチジルエタノールアミンへの転移のステップが進行せず,さらに,Atg12-Atg5結合体による構造変化も起こらなくなった.これらの結果から,His236はAtg12-Atg5結合体による構造変化,あるいは,活性型の構造維持に重要であることが示唆された.
6.Atg12-Atg5結合体によるAtg3の活性化機構
以上の結果をまとめて,Atg12-Atg5結合体によるAtg3の活性化機構のモデルを提唱した(図3).Atg12-Atg5結合体の非存在下では,Atg3のCys234を含むループがヘリックスGと相互作用することによりCys234はThr213とは逆に配向し,不活性型の構造をとっている.Atg12-Atg5結合体が相互作用するとAtg3に構造変化がひき起こされ,Cys234がThr213に近接することにより,Atg8のAtg3からホスファチジルエタノールアミンへの転移が促進される.
また,Atg12-Atg5結合体の非存在下でも高い活性を示す,Phe293をSerに置換した変異体をATG5遺伝子を欠損させた出芽酵母株で発現させると,野生型のAtg3を発現させた場合とは異なり,Atg8-ホスファチジルエタノールアミンは効率よく形成されるがオートファジーは進行しないことが示された.Atg12-Atg5結合体はAtg8結合反応のE3酵素として機能するだけでなく,Atg16と複合体を形成し,Atg8-ホスファチジルエタノールアミンの形成の場所を規定していると考えられている7).オートファジーが進行するにはAtg8-ホスファチジルエタノールアミンがAtg12-Atg5-Atg16複合体によりしかるべき場所において形成されることが必要なのだろう.ホスファチジルエタノールアミンは細胞に豊富に存在する脂質であるため,Atg12-Atg5-Atg16複合体が局在する場所においてもっとも効率よくAtg8-ホスファチジルエタノールアミンを形成させるために,Atg12-Atg5結合体がAtg3を活性化する機構が必要であると考えられた.
おわりに
この論文では,E3酵素であるAtg12-Atg5結合体がE2酵素であるAtg3に構造変化をひき起こし,その活性を上昇させることを明らかにした.E3酵素がE2酵素に構造変化をひき起こすことを示したはじめての例である.Atg12-Atg5結合体は典型的なE3酵素とは構造的にまったく異なる.Atg12がユビキチン様タンパク質であるのにくわえ,Atg5にもユビキチン様フォールドが2つ存在する8).これら3つのユビキチン様フォールドがAtg3の構造変化においてどのように関与しているのかを含め,Atg12-Atg5結合体がAtg3とどのように相互作用し構造変化をひき起こすのかを明らかにするには,Atg12-Atg5結合体とAtg3との複合体の構造解析が必須である.
文 献
- Hanada, T., Noda, N. N., Satomi, Y. et al.: The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy. J. Biol. Chem., 282, 37298-37302 (2007)[PubMed]
- Noda, N. N., Fujioka, Y., Hanada, T. et al.: Structure of the Atg12-Atg5 conjugate reveals a platform for stimulating Atg8-PE conjugation. EMBO Rep., 14, 206-211 (2013)[PubMed]
- Yamada, Y., Suzuki, N. N., Hanada, T. et al.: The crystal structure of Atg3, an autophagy-related ubiquitin carrier protein (E2) enzyme that mediates Atg8 lipidation. J. Biol. Chem., 282, 8036-8043 (2007)[PubMed]
- Oh-oka, K., Nakatogawa, H. & Ohsumi, Y.: Physiological pH and acidic phospholipids contribute to substrate specificity in lipidation of Atg8. J. Biol. Chem., 283, 21847-21852 (2008)[PubMed]
- Yamaguchi, M., Matoba, K., Sawada, R. et al.: Noncanonical recognition and UBL loading of distinct E2s by autophagy-essential Atg7. Nat. Struct. Mol. Biol., 19, 1250-1256 (2012)[PubMed] [新着論文レビュー]
- Fujioka, Y., Noda, N. N., Fujii, K. et al.: In vitro reconstitution of plant ATG8 and ATG12 conjugation systems essential for autophagy. J. Biol. Chem., 283, 1912-1928 (2008)[PubMed]
- Fujita, N., Itoh, T., Omori, H. et al.: The Atg16L complex specifies the site of LC3 lipidation for membrane biogenesis in autophagy. Mol. Biol. Cell, 19, 2092-2100 (2008)[PubMed]
- Matsushita, M., Suzuki, N. N., Obara, K. et al.: Structure of Atg5-Atg16, a complex essential for autophagy. J. Biol. Chem., 282, 6763-6772 (2006)[PubMed]
著者プロフィール
略歴:2005年 京都大学大学院理学研究科博士課程 修了,同年 名古屋大学大学院理学研究科 博士研究員を経て,2009年より東京工業大学フロンティア研究機構 博士研究員.
研究テーマ:オートファジーにおけるユビキチン様タンパク質結合系の役割.
関心事:Atgタンパク質の修飾による活性制御.
中戸川 仁(Hitoshi Nakatogawa)
東京工業大学フロンティア研究機構 特任准教授.
大隅 良典(Yoshinori Ohsumi)
東京工業大学フロンティア研究機構 特任教授.
研究室URL:http://www.ohsumilab.aro.iri.titech.ac.jp/
© 2013 中戸川万智子・中戸川 仁・大隅良典 Licensed under CC 表示 2.1 日本