Tet1は減数分裂関連遺伝子の転写制御をつうじて減数分裂を制御している
山口新平・Yi Zhang
(米国Harvard Medical School,Boston Children’s Hospital)
email:山口新平
DOI: 10.7875/first.author.2012.149
Tet1 controls meiosis by regulating meiotic gene expression.
Shinpei Yamaguchi, Kwonho Hong, Rui Liu, Li Shen, Azusa Inoue, Dinh Diep, Kun Zhang, Yi Zhang
Nature, 492, 443-447 (2012)
減数分裂は半数体の配偶子をつくるうえで必須の生殖細胞に特異的な細胞分裂の様式である.マウスの始原生殖細胞では,減数分裂の開始にさきんじてゲノム全体におけるDNA脱メチル化などエピジェネティックな修飾の変化が大規模に起こっている.しかし,減数分裂に関連する遺伝子のエピジェネティックな発現制御機構はほとんど知られていない.この研究では,DNA脱メチル化関連酵素Tet1が卵細胞において減数分裂の制御に重要な役割をはたしていることを示した.Tet1ノックアウトマウスでは出生前の胎仔の卵巣において卵細胞の数が顕著に減少し,その妊性も著しく低下していた.Tet1ノックアウトマウスの卵細胞は相同染色体の対合とDNA二本鎖切断修復に異常を示した.Tet1ノックアウトマウスの生殖細胞ではゲノム全体におけるDNAメチル化レベルに大きな変化はみられなかったが,複数の減数分裂に関連する遺伝子の周辺領域においてDNA脱メチル化が阻害されており,それらの発現も顕著に低下していた.この研究は,雌の生殖細胞においてTet1による減数分裂に関連する遺伝子の発現制御機構を明らかにした.
生殖細胞は受精をとおし次世代に遺伝情報を伝えることのできる唯一の細胞である.マウスの場合,減数分裂はレチノイン酸など細胞の外からのシグナルに生殖細胞が応答するかたちで誘導される.しかし,生殖細胞において減数分裂に関連する遺伝子の発現制御機構についてはほとんどわかっていなかった1).
マウスの始原生殖細胞では減数分裂のまえに,ゲノムインプリンティングの消去や不活性X染色体の再活性化,ヒストン修飾パターンの変化など,ゲノム全体にわたるエピジェネティックな修飾がリプログラミングされる2).このようなリプログラミングは始原生殖細胞と受精卵でのみみられるが,その分子機構についてはほとんどわかっていない.とくに,移動期の始原生殖細胞においてDNAのシトシン残基のメチル化(5-メチルシトシン)が消失するDNAの脱メチル化に関しては,この現象がなんらかの酵素に依存する能動的な脱メチル化なのか,DNA複製に依存する受動的な脱メチル化なのかすら確実な証拠は示されていない.
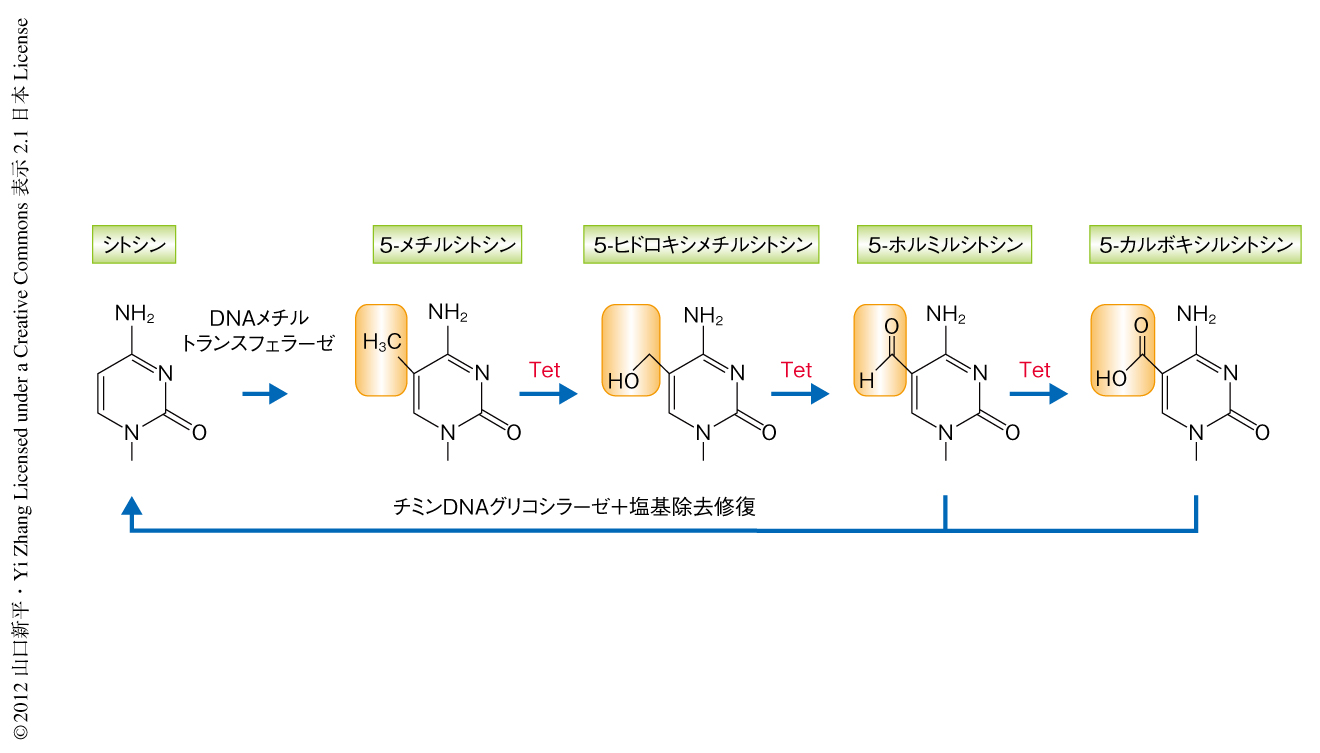
DNA脱メチル化関連酵素Tetは5-メチルシトシンに特異的に反応し,5-ヒドロキシルメチルシトシン,5-ホルミルシトシン,5-カルボキシルシトシンへと酸化させる活性をもつ3-5).5-ホルミルシトシンおよび5-カルボキシルシトシンはチミンDNAグリコシラーゼと塩基除去修復機構を介してシトシンへと変換されうることから,Tetは能動的なDNA脱メチル化反応の第1段階としてはたらいていることが示唆されていた6)(図1).筆者らは,生殖細胞において高く発現するTet1のノックアウトマウスを作製し,生殖細胞におけるDNA脱メチル化の分子機構と生理的な意義を解析した.
生殖細胞の発生過程においてTet1遺伝子,Tet2遺伝子,Tet3遺伝子の発現パターンを定量的PCR法により確認した.Tet2遺伝子とTet3遺伝子は始原生殖細胞の周辺にある体細胞でも発現していたのに対し,Tet1遺伝子は胎生10日から胎生13日まで始原生殖細胞において特異的に高く発現していた.そこで,Tet1の生殖細胞における機能を明らかにするため,遺伝子トラップ法によりTet1ノックアウトマウスを作製した.Tet1遺伝子の欠失はサザンハイブリダイゼーション法,定量的PCR法,および,抗Tet1抗体を用いたウェスタンブロッティング法,免疫染色法により確認した.重要なことに,始原生殖細胞において免疫染色法により検出される5-ヒドロキシルメチルシトシンがTet1ノックアウトマウスでは消失していた.以上のことから,Tet1ノックアウトマウスではTet1の発現およびその機能の失われていることが確認された.
まず,このTet1ノックアウトマウスにおける妊性について検証した.交配の結果は妊性ありといういっけん失望させるものであったが,Tet1ホモノックアウトマウスはつねに少数の仔しか出産しないことがわかった.この結果は,ほかのグループよる報告と矛盾しないものであった7).妊性の低下は雄よりも雌においてより顕著であったことから,雌の形質にしぼり解析を継続した.Tet1ノックアウトマウスの卵巣を解析したところ,成熟卵の数が有意に減少していることがわかった.ホルモン刺激により過排卵を誘導すると,野生型マウスでは平均19個の卵が回収できたのに対し,Tet1ノックアウトマウスではわずか4個の卵しか回収できなかった.胚発生期の卵巣を解析したところ,胎生16日まで卵細胞の数に大きな差は認められなかったのに対し,胎生18日以降のTet1ノックアウトマウスの卵細胞の数は野生型マウスの約30%まで減少していた.また,胎生16日および胎生18日のTet1ノックアウトマウスの卵巣では切断型カスパーゼ3により検出されたアポトーシスによる細胞死の有意な増加が認められた.以上のことから,Tet1ノックアウトマウスにおける卵細胞の数の減少は胚発生の後期での細胞死の増加によることが示唆された.
この胎生16日~胎生18日の卵細胞は減数分裂前期にあたることから,Tet1ノックアウトマウスの卵細胞では減数分裂の進行に異常が生じていると考えた.減数分裂前期はレプトテン期,ザイゴテン期,パキテン期,ディプロテン期の4つのサブステージをへる過程で,相同染色体の対合とDNA二本鎖切断修復が起こる.Tet1ノックアウトマウスにおける減数分裂の進行を詳細に解析したところ,胎生16日から胎生18日までパキテン期の卵細胞がつねに少数しか認められなかった.さらなる解析の結果,パキテン期のTet1ノックアウトマウスにはシナプトネマ複合体において相同染色体どうしを結びつけるセントラルエレメントが形成されず,約40%の卵細胞において対合不全の一価染色体の出現が認められた.また,残る60%の卵細胞においてもDNA二本鎖切断修復に異常がみられた.通常,パキテン期にはDNA二本鎖切断修復は完了しているが,Tet1ノックアウトマウスの卵細胞ではパキテン期だけではなくディプロテン期においても修復されていないDNA二本鎖切断が有意に増加していた.以上のことから,Tet1ノックアウトマウスにおいて胚発生の後期に起こる卵細胞のアポトーシスは減数分裂の進行の異常が原因であると考えられた.
すでに筆者らは,Tet1はES細胞においてDNA脱メチル化をつうじ転写制御に機能しうることを示していた8).そこで,生殖細胞におけるTet1の転写への影響を明らかにするため,胎生13日の雌の始原生殖細胞における全転写産物の塩基配列を解読した.この時期は,減数分裂に関連する遺伝子の発現が開始され,体細胞分裂から減数分裂へと切り替わる時期にあたる.Tet1ノックアウトマウスの始原生殖細胞では野生型マウスの始原生殖細胞と比べ1010個の遺伝子において顕著な発現の変化が認められ,そのほとんど(899遺伝子)は発現の低下を示した.重要なことに,この899個の遺伝子にはSycp1遺伝子,Sycp3遺伝子,Stra8遺伝子,Prdm9遺伝子,Mael遺伝子など多数の減数分裂に関連する遺伝子が含まれていた.遺伝子オントロジー解析によりこの899個の遺伝子には細胞周期や減数分裂に関連する多数の遺伝子が含まれていることがわかった.これらの減数分裂に関連する遺伝子の発現低下は定量的PCR法でも確認された.Tet1がこれらの遺伝子の発現を直接に制御している可能性を検証するため,抗Tet1抗体を用いてクロマチン免疫沈降実験を行ったところ,Tet1はSycp1遺伝子,Sycp3遺伝子,Mael遺伝子のプロモーター領域に直接に結合していることが明らかになった.以上の結果から,Tet1は始原生殖細胞において減数分裂に関連する遺伝子を含む多数の遺伝子の発現を直接に制御していることが示唆された.
Tet1による転写制御の分子機構を明らかにするため,胎生13日のTet1ノックアウトマウスの始原生殖細胞において,全ゲノムに対するバイサルファイトシークエンシング法を用いてDNAメチル化を網羅的に解析した.その結果,Tet1ノックアウトマウスの始原生殖細胞では野生型マウスに比べ,遺伝子領域を含むゲノム全体においてDNAメチル化レベルの上昇が検出された.しかしながら,そのDNAメチル化レベルは体細胞に比べると依然として非常に低く,ゲノム全体におけるDNA脱メチル化へのTet1の寄与は限定的であると結論づけられた.
そこで,野生型マウスと比べTet1ノックアウトマウスの始原生殖細胞においてDNAメチル化レベルが統計的な有意性をもって変化していた4337箇所の領域を同定したところ,その近傍には5247個の遺伝子が存在した.この結果を,さきに述べた全転写産物の塩基配列の解読による遺伝子発現解析の結果と比較したところ,発現の変化が検出された1010個の遺伝子のうち255個の遺伝子は,このDNAメチル化レベルの変化していた領域の近傍に位置した.遺伝子オントロジー解析によりこの255個の遺伝子には細胞周期や生殖巣の発生に関連する多数の遺伝子が含まれていることがわかった.
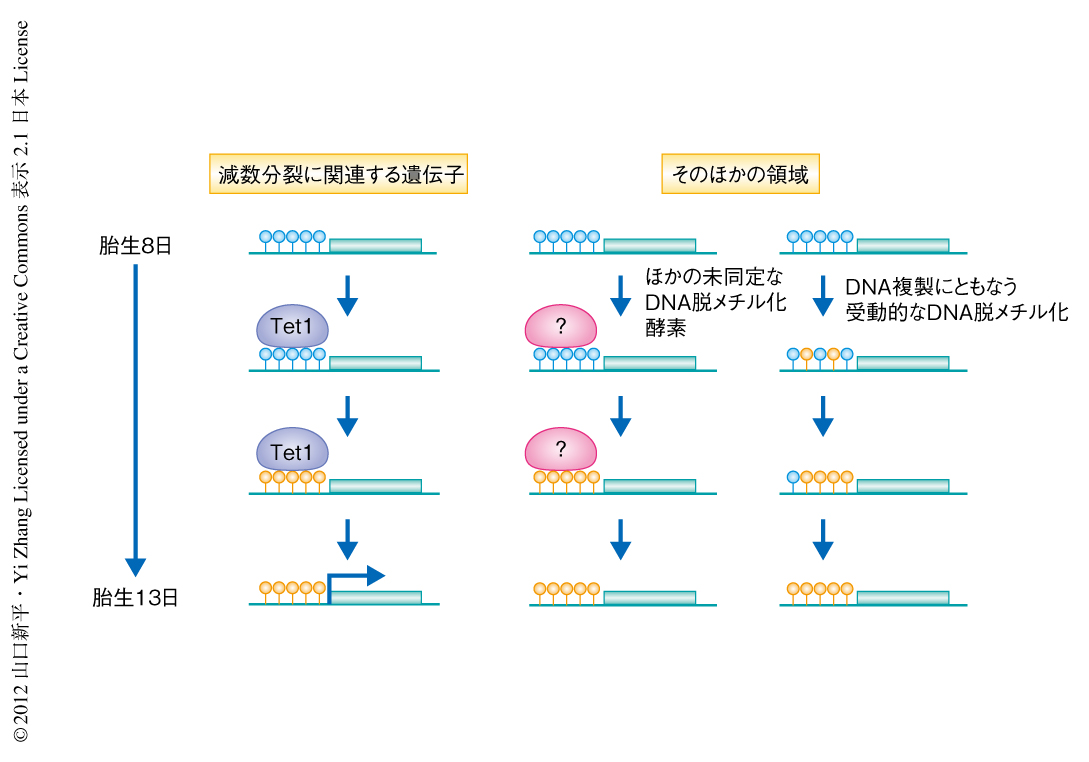
最後に,減数分裂に関連する遺伝子について通常のバイサルファイトシークエンシング法によりDNAメチル化を詳細に解析した.Tet1ノックアウトマウスの始原生殖細胞ではSycp1遺伝子,Sycp3遺伝子,Mael遺伝子など減数分裂に関連する遺伝子のプロモーター領域においてDNAメチル化レベルの上昇が認められた.以上のことから,Tet1はゲノム全体におけるDNA脱メチル化ではなく,部位特異的なDNA脱メチル化に機能していることが示唆された(図2).
筆者らは,Tet1は減数分裂に関連する遺伝子の転写活性化に機能し,少なくともその一部は,能動的なDNA脱メチル化により制御されていることを示した.Tet1ノックアウトマウスにおいて認められた妊性低下の原因は,胚発生の後期の卵細胞が減数分裂の過程で異常を示し,チェックポイント機構をつうじアポトーシスにいたったためと考えられた.筆者らは,これらの減数分裂の異常はTet1の下流遺伝子の発現低下にともなう二次的なものだと考えている.実際,Prdm9遺伝子,Stra8遺伝子,Sycp1遺伝子,Sycp3遺伝子など多くのTet1下流遺伝子の欠損は,Tet1の欠損と同様に,減数分裂に異常をきたし生殖細胞の減少につながることがわかっている1).
研究を開始したときに期待したTet1の機能はゲノム全体におけるDNA脱メチル化への寄与であったが,得られた結果は部位特異的なDNA脱メチル化に機能するという予想外のものであった.減数分裂において必要とされる遺伝子は,Tet1による選択的なDNA脱メチル化をつうじてエピジェネティックな修飾を制御し,転写活性化を確実にしているものと考えられる.では,Tet1はどのようにしてこれらのターゲット遺伝子を識別しているのか? Tet1によらない大部分のゲノム領域におけるDNA脱メチル化はどのような分子機構により制御されているのか? これらの重要な疑問に答える今後のさらなる解析が待たれる.
略歴:2010年 京都大学大学院医学研究科 修了,同年 京都大学再生医科学研究所 研究員,2011年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:生殖細胞の発生,幹細胞.
関心事:ああ生殖細胞.どうしてあなたは生殖細胞なの?
Yi Zhang
米国Harvard Medical SchoolにてProfessor.
研究室URL:http://labs.idi.harvard.edu/zhang/lab.htm
© 2012 山口新平・Yi Zhang Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Boston Children’s Hospital)
email:山口新平
DOI: 10.7875/first.author.2012.149
Tet1 controls meiosis by regulating meiotic gene expression.
Shinpei Yamaguchi, Kwonho Hong, Rui Liu, Li Shen, Azusa Inoue, Dinh Diep, Kun Zhang, Yi Zhang
Nature, 492, 443-447 (2012)
要 約
減数分裂は半数体の配偶子をつくるうえで必須の生殖細胞に特異的な細胞分裂の様式である.マウスの始原生殖細胞では,減数分裂の開始にさきんじてゲノム全体におけるDNA脱メチル化などエピジェネティックな修飾の変化が大規模に起こっている.しかし,減数分裂に関連する遺伝子のエピジェネティックな発現制御機構はほとんど知られていない.この研究では,DNA脱メチル化関連酵素Tet1が卵細胞において減数分裂の制御に重要な役割をはたしていることを示した.Tet1ノックアウトマウスでは出生前の胎仔の卵巣において卵細胞の数が顕著に減少し,その妊性も著しく低下していた.Tet1ノックアウトマウスの卵細胞は相同染色体の対合とDNA二本鎖切断修復に異常を示した.Tet1ノックアウトマウスの生殖細胞ではゲノム全体におけるDNAメチル化レベルに大きな変化はみられなかったが,複数の減数分裂に関連する遺伝子の周辺領域においてDNA脱メチル化が阻害されており,それらの発現も顕著に低下していた.この研究は,雌の生殖細胞においてTet1による減数分裂に関連する遺伝子の発現制御機構を明らかにした.
はじめに
生殖細胞は受精をとおし次世代に遺伝情報を伝えることのできる唯一の細胞である.マウスの場合,減数分裂はレチノイン酸など細胞の外からのシグナルに生殖細胞が応答するかたちで誘導される.しかし,生殖細胞において減数分裂に関連する遺伝子の発現制御機構についてはほとんどわかっていなかった1).
マウスの始原生殖細胞では減数分裂のまえに,ゲノムインプリンティングの消去や不活性X染色体の再活性化,ヒストン修飾パターンの変化など,ゲノム全体にわたるエピジェネティックな修飾がリプログラミングされる2).このようなリプログラミングは始原生殖細胞と受精卵でのみみられるが,その分子機構についてはほとんどわかっていない.とくに,移動期の始原生殖細胞においてDNAのシトシン残基のメチル化(5-メチルシトシン)が消失するDNAの脱メチル化に関しては,この現象がなんらかの酵素に依存する能動的な脱メチル化なのか,DNA複製に依存する受動的な脱メチル化なのかすら確実な証拠は示されていない.
DNA脱メチル化関連酵素Tetは5-メチルシトシンに特異的に反応し,5-ヒドロキシルメチルシトシン,5-ホルミルシトシン,5-カルボキシルシトシンへと酸化させる活性をもつ3-5).5-ホルミルシトシンおよび5-カルボキシルシトシンはチミンDNAグリコシラーゼと塩基除去修復機構を介してシトシンへと変換されうることから,Tetは能動的なDNA脱メチル化反応の第1段階としてはたらいていることが示唆されていた6)(図1).筆者らは,生殖細胞において高く発現するTet1のノックアウトマウスを作製し,生殖細胞におけるDNA脱メチル化の分子機構と生理的な意義を解析した.
1.Tet1ノックアウトマウスの作製
生殖細胞の発生過程においてTet1遺伝子,Tet2遺伝子,Tet3遺伝子の発現パターンを定量的PCR法により確認した.Tet2遺伝子とTet3遺伝子は始原生殖細胞の周辺にある体細胞でも発現していたのに対し,Tet1遺伝子は胎生10日から胎生13日まで始原生殖細胞において特異的に高く発現していた.そこで,Tet1の生殖細胞における機能を明らかにするため,遺伝子トラップ法によりTet1ノックアウトマウスを作製した.Tet1遺伝子の欠失はサザンハイブリダイゼーション法,定量的PCR法,および,抗Tet1抗体を用いたウェスタンブロッティング法,免疫染色法により確認した.重要なことに,始原生殖細胞において免疫染色法により検出される5-ヒドロキシルメチルシトシンがTet1ノックアウトマウスでは消失していた.以上のことから,Tet1ノックアウトマウスではTet1の発現およびその機能の失われていることが確認された.
2.Tet1ノックアウトマウスは卵細胞の減少による妊性の低下を示す
まず,このTet1ノックアウトマウスにおける妊性について検証した.交配の結果は妊性ありといういっけん失望させるものであったが,Tet1ホモノックアウトマウスはつねに少数の仔しか出産しないことがわかった.この結果は,ほかのグループよる報告と矛盾しないものであった7).妊性の低下は雄よりも雌においてより顕著であったことから,雌の形質にしぼり解析を継続した.Tet1ノックアウトマウスの卵巣を解析したところ,成熟卵の数が有意に減少していることがわかった.ホルモン刺激により過排卵を誘導すると,野生型マウスでは平均19個の卵が回収できたのに対し,Tet1ノックアウトマウスではわずか4個の卵しか回収できなかった.胚発生期の卵巣を解析したところ,胎生16日まで卵細胞の数に大きな差は認められなかったのに対し,胎生18日以降のTet1ノックアウトマウスの卵細胞の数は野生型マウスの約30%まで減少していた.また,胎生16日および胎生18日のTet1ノックアウトマウスの卵巣では切断型カスパーゼ3により検出されたアポトーシスによる細胞死の有意な増加が認められた.以上のことから,Tet1ノックアウトマウスにおける卵細胞の数の減少は胚発生の後期での細胞死の増加によることが示唆された.
3.Tet1ノックアウトマウスの卵細胞は相同染色体の対合およびDNA二本鎖切断修復の異常を示す
この胎生16日~胎生18日の卵細胞は減数分裂前期にあたることから,Tet1ノックアウトマウスの卵細胞では減数分裂の進行に異常が生じていると考えた.減数分裂前期はレプトテン期,ザイゴテン期,パキテン期,ディプロテン期の4つのサブステージをへる過程で,相同染色体の対合とDNA二本鎖切断修復が起こる.Tet1ノックアウトマウスにおける減数分裂の進行を詳細に解析したところ,胎生16日から胎生18日までパキテン期の卵細胞がつねに少数しか認められなかった.さらなる解析の結果,パキテン期のTet1ノックアウトマウスにはシナプトネマ複合体において相同染色体どうしを結びつけるセントラルエレメントが形成されず,約40%の卵細胞において対合不全の一価染色体の出現が認められた.また,残る60%の卵細胞においてもDNA二本鎖切断修復に異常がみられた.通常,パキテン期にはDNA二本鎖切断修復は完了しているが,Tet1ノックアウトマウスの卵細胞ではパキテン期だけではなくディプロテン期においても修復されていないDNA二本鎖切断が有意に増加していた.以上のことから,Tet1ノックアウトマウスにおいて胚発生の後期に起こる卵細胞のアポトーシスは減数分裂の進行の異常が原因であると考えられた.
4.Tet1は減数分裂に関連する遺伝子の転写を活性化する
すでに筆者らは,Tet1はES細胞においてDNA脱メチル化をつうじ転写制御に機能しうることを示していた8).そこで,生殖細胞におけるTet1の転写への影響を明らかにするため,胎生13日の雌の始原生殖細胞における全転写産物の塩基配列を解読した.この時期は,減数分裂に関連する遺伝子の発現が開始され,体細胞分裂から減数分裂へと切り替わる時期にあたる.Tet1ノックアウトマウスの始原生殖細胞では野生型マウスの始原生殖細胞と比べ1010個の遺伝子において顕著な発現の変化が認められ,そのほとんど(899遺伝子)は発現の低下を示した.重要なことに,この899個の遺伝子にはSycp1遺伝子,Sycp3遺伝子,Stra8遺伝子,Prdm9遺伝子,Mael遺伝子など多数の減数分裂に関連する遺伝子が含まれていた.遺伝子オントロジー解析によりこの899個の遺伝子には細胞周期や減数分裂に関連する多数の遺伝子が含まれていることがわかった.これらの減数分裂に関連する遺伝子の発現低下は定量的PCR法でも確認された.Tet1がこれらの遺伝子の発現を直接に制御している可能性を検証するため,抗Tet1抗体を用いてクロマチン免疫沈降実験を行ったところ,Tet1はSycp1遺伝子,Sycp3遺伝子,Mael遺伝子のプロモーター領域に直接に結合していることが明らかになった.以上の結果から,Tet1は始原生殖細胞において減数分裂に関連する遺伝子を含む多数の遺伝子の発現を直接に制御していることが示唆された.
5.Tet1は部位特異的なDNA脱メチル化に機能している
Tet1による転写制御の分子機構を明らかにするため,胎生13日のTet1ノックアウトマウスの始原生殖細胞において,全ゲノムに対するバイサルファイトシークエンシング法を用いてDNAメチル化を網羅的に解析した.その結果,Tet1ノックアウトマウスの始原生殖細胞では野生型マウスに比べ,遺伝子領域を含むゲノム全体においてDNAメチル化レベルの上昇が検出された.しかしながら,そのDNAメチル化レベルは体細胞に比べると依然として非常に低く,ゲノム全体におけるDNA脱メチル化へのTet1の寄与は限定的であると結論づけられた.
そこで,野生型マウスと比べTet1ノックアウトマウスの始原生殖細胞においてDNAメチル化レベルが統計的な有意性をもって変化していた4337箇所の領域を同定したところ,その近傍には5247個の遺伝子が存在した.この結果を,さきに述べた全転写産物の塩基配列の解読による遺伝子発現解析の結果と比較したところ,発現の変化が検出された1010個の遺伝子のうち255個の遺伝子は,このDNAメチル化レベルの変化していた領域の近傍に位置した.遺伝子オントロジー解析によりこの255個の遺伝子には細胞周期や生殖巣の発生に関連する多数の遺伝子が含まれていることがわかった.
最後に,減数分裂に関連する遺伝子について通常のバイサルファイトシークエンシング法によりDNAメチル化を詳細に解析した.Tet1ノックアウトマウスの始原生殖細胞ではSycp1遺伝子,Sycp3遺伝子,Mael遺伝子など減数分裂に関連する遺伝子のプロモーター領域においてDNAメチル化レベルの上昇が認められた.以上のことから,Tet1はゲノム全体におけるDNA脱メチル化ではなく,部位特異的なDNA脱メチル化に機能していることが示唆された(図2).
おわりに
筆者らは,Tet1は減数分裂に関連する遺伝子の転写活性化に機能し,少なくともその一部は,能動的なDNA脱メチル化により制御されていることを示した.Tet1ノックアウトマウスにおいて認められた妊性低下の原因は,胚発生の後期の卵細胞が減数分裂の過程で異常を示し,チェックポイント機構をつうじアポトーシスにいたったためと考えられた.筆者らは,これらの減数分裂の異常はTet1の下流遺伝子の発現低下にともなう二次的なものだと考えている.実際,Prdm9遺伝子,Stra8遺伝子,Sycp1遺伝子,Sycp3遺伝子など多くのTet1下流遺伝子の欠損は,Tet1の欠損と同様に,減数分裂に異常をきたし生殖細胞の減少につながることがわかっている1).
研究を開始したときに期待したTet1の機能はゲノム全体におけるDNA脱メチル化への寄与であったが,得られた結果は部位特異的なDNA脱メチル化に機能するという予想外のものであった.減数分裂において必要とされる遺伝子は,Tet1による選択的なDNA脱メチル化をつうじてエピジェネティックな修飾を制御し,転写活性化を確実にしているものと考えられる.では,Tet1はどのようにしてこれらのターゲット遺伝子を識別しているのか? Tet1によらない大部分のゲノム領域におけるDNA脱メチル化はどのような分子機構により制御されているのか? これらの重要な疑問に答える今後のさらなる解析が待たれる.
文 献
- Handel, M. A. & Schimenti, J. C.: Genetics of mammalian meiosis: regulation, dynamics and impact on fertility. Nat. Rev. Genet., 11, 124-136 (2010)[PubMed]
- Saitou, M., Kagiwada, S. & Kurimoto, K.: Epigenetic reprogramming in mouse pre-implantation development and primordial germ cells. Development, 139, 15-31 (2012)[PubMed]
- Tahiliani, M., Koh, K. P., Shen, Y. et al.: Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science, 324, 930-935 (2009)[PubMed]
- Ito, S., D’Alessio, A. C., Taranova, O. V. et al.: Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification. Nature, 466, 1129-1133 (2010)[PubMed] [新着論文レビュー]
- Ito, S., Shen, L., Dai, Q. et al.: Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science, 333, 1300-1303 (2011)[PubMed]
- He, Y. F., Li, B. Z., Li, Z. et al.: Tet-mediated formation of 5-carboxylcytosine and its excision by TDG in mammalian DNA. Science, 333, 1303-1307 (2011)[PubMed]
- Dawlaty, M. M., Ganz, K., Powell, B. E. et al.: Tet1 is dispensable for maintaining pluripotency and its loss is compatible with embryonic and postnatal development. Cell Stem Cell, 9, 166-175 (2011)[PubMed]
- Wu, H., D’Alessio, A. C., Ito, S. et al.: Dual functions of Tet1 in transcriptional regulation in mouse embryonic stem cells. Nature, 473, 389-393 (2011)[PubMed]
著者プロフィール
略歴:2010年 京都大学大学院医学研究科 修了,同年 京都大学再生医科学研究所 研究員,2011年 米国North Carolina大学Chapel Hill校 研究員を経て,2012年より米国Harvard Medical School研究員.
研究テーマ:生殖細胞の発生,幹細胞.
関心事:ああ生殖細胞.どうしてあなたは生殖細胞なの?
Yi Zhang
米国Harvard Medical SchoolにてProfessor.
研究室URL:http://labs.idi.harvard.edu/zhang/lab.htm
© 2012 山口新平・Yi Zhang Licensed under CC 表示 2.1 日本