キノール依存型一酸化窒素還元酵素の結晶構造からみた呼吸酵素の分子進化
松本悠史・當舎武彦・城 宜嗣
(理化学研究所放射光科学総合研究センター 城生体金属科学研究室)
email:城 宜嗣
DOI: 10.7875/first.author.2012.022
Crystal structure of quinol-dependent nitric oxide reductase from Geobacillus stearothermophilus.
Yushi Matsumoto, Takehiko Tosha, Andrei V. Pisliakov, Tomoya Hino, Hiroshi Sugimoto, Shingo Nagano, Yuji Sugita, Yoshitsugu Shiro
Nature Structural & Molecular Biology, 19, 238-245 (2012)
現在の地球上の生物の多くは酸素分子を利用した好気呼吸によりエネルギーを得ている.好気呼吸では呼吸鎖末端酸化酵素が酸素分子の還元と共役してプロトンを細胞の内側から外側へと能動輸送することにより,ATP合成酵素を効率よく機能させている.アミノ酸配列の相同性から,嫌気呼吸にみられる一酸化窒素還元酵素は呼吸鎖末端酸化酵素の祖先蛋白質であると考えられているが,一酸化窒素還元酵素はプロトンポンプとしての機能をもたない.つまり,呼吸酵素は一酸化窒素還元酵素から呼吸鎖末端酸化酵素への進化の過程においてプロトンポンプ機能を獲得したといえる.筆者らは,呼吸酵素の分子進化に関し理解を深めるため,呼吸酵素のなかで最後まで立体構造が未解明であったキノール依存型一酸化窒素還元酵素の構造解析に挑戦し,好熱菌に由来する酵素の結晶構造を2.5Å分解能で決定した.通説では一酸化窒素還元酵素の触媒反応に必要なプロトンは細胞の外側から供給されるとされているが,キノール依存型一酸化窒素還元酵素には対応するプロトンの輸送経路を確認できなかった.その代わり,活性部位と細胞の内側とをつなぐ親水性の水チャネルが発見され,これがプロトンの輸送経路として機能するという予想外の結果が得られた.興味深いことに,このキノール依存型一酸化窒素還元酵素に特有の水チャネルは,好気呼吸酵素である呼吸鎖末端酸化酵素が分子進化のすえ獲得したプロトンポンプ経路の一部に対応していた.このように,キノール依存型一酸化窒素還元酵素の結晶構造は一酸化窒素還元酵素が分子進化の過程でどのようにプロトンポンプ機能を得るにいたったのか,その解明にせまる大きな手がかりをあたえるものであった.
一酸化窒素還元酵素は細菌の細胞膜に存在する金属酵素で,一酸化窒素(NO)を還元し亜酸化窒素(N2O)を生成する(2NO + 2H+ + 2e- → N2O + H2O).一酸化窒素還元酵素はおもに,硝酸を段階的に還元し窒素分子を生成する,脱窒反応とよばれる嫌気呼吸を行う細菌にみられる.このような細菌は脱窒反応によりATPを合成しており嫌気条件において生育できる.注目すべきことに,一酸化窒素還元酵素は好気呼吸の根幹を担う呼吸鎖末端酸化酵素の主要サブユニットと20%程度のアミノ酸配列の相同性を示す.このことから,一酸化窒素還元酵素と呼吸鎖末端酸化酵素とは進化的に関連が深いと考えられてきた1).呼吸鎖末端酸化酵素は酸素分子の還元反応(O2 + 4H+ + 4e- → 2H2O)により生じるエネルギーを利用して細胞内のプロトンを細胞外へと汲み出すプロトンポンプ機能をもち,その結果として生じる細胞膜のあいだのプロトン濃度勾配がATP合成酵素を効率よく稼働させる.この呼吸の本質ともいえる呼吸鎖末端酸化酵素の機能は一酸化窒素還元酵素にはないものである.地球上の酸素濃度が劇的に上昇したのは光合成細菌が出現した約30億年前のことである.それ以前に存在していた原始生物は酸素分子ではなく窒素化合物や硫黄化合物を利用して呼吸を行っていたことを考慮すると,嫌気呼吸酵素である一酸化窒素還元酵素が好気呼吸酵素である呼吸鎖末端酸化酵素に進化することで生物は地球環境に適応しさらなる進化をとげたという筋書きが予想される.つまり,一酸化窒素還元酵素から呼吸鎖末端酸化酵素への機能変換のしくみを理解することは生物進化の理解につながる.
呼吸酵素の分子進化に関する研究においてはアミノ酸配列の系統解析がおもな手法として用いられてきた2).しかし,よりくわしい分子進化の理解のためには機能を直接に反映する立体構造にもとづいた議論が必要不可欠である.系統解析により,呼吸酵素は,好気条件において機能する種々の呼吸鎖末端酸化酵素,低酸素環境においてはたらくcbb3型の呼吸鎖末端酸化酵素,および,シトクロムcを電子供与体とするシトクロムc依存型一酸化窒素還元酵素とキノールを電子供与体とするキノール依存型一酸化窒素還元酵素の2種類からなる一酸化窒素還元酵素,に分類される.これらの呼吸酵素のうち,好気条件においてはたらく種々の呼吸鎖末端酸化酵素の立体構造が決定されており3,4),2010年には,cbb3型呼吸鎖末端酸化酵素の立体構造が報告され5),ついで,筆者らの研究室において,シトクロムc依存型一酸化窒素還元酵素の結晶構造が解明された6)(新着論文レビュー でも掲載).つまり,残るキノール依存型一酸化窒素還元酵素の立体構造が決定されれば,呼吸酵素の分子進化を立体構造にもとづきより詳細に検討できるものと期待されていた.
構造解析に適した試料を得るため,熱安定性にすぐれる好熱菌Geobacillus stearothermophilusに由来するキノール依存型一酸化窒素還元酵素の遺伝子をクローニングし,大腸菌において過剰に発現させた.種々の界面活性剤の存在下において結晶化の条件を検討したところ,2.5Å分解能でキノール依存型一酸化窒素還元酵素の結晶構造を決定することができた(PDB ID:3AYF).キノール依存型一酸化窒素還元酵素は14本の膜貫通αヘリックスと細胞外に突き出た親水性ドメインからなる構造をしていた.2つのサブユニットからなるシトクロムc依存型一酸化窒素還元酵素と比較すると,サブユニット構造をもたないキノール依存型一酸化窒素還元酵素は膜貫通ヘリックスを1本多くもっており,このヘリックスはシトクロムc依存型一酸化窒素還元酵素の2つのサブユニットをつなぐように配置されていた.また,シトクロムc依存型一酸化窒素還元酵素とは異なりキノール依存型一酸化窒素還元酵素は細胞外の親水性領域にヘムcをもたないにもかかわらず,その立体構造はシトクロムc依存型一酸化窒素還元酵素と同様にシトクロムc型の構造であった.キノール依存型一酸化窒素還元酵素においてヘムcの結合部位に対応する部位には疎水性のアミノ酸残基がクラスターを形成しており,疎水分子であるヘムcがなくてもシトクロムc型の構造を維持しているものと推察できた.
NO還元反応はヘム(ヘムb3)とその近傍に存在する非ヘム鉄からなる複核中心で起こる.今回,明らかにされたキノール依存型一酸化窒素還元酵素の結晶構造では活性部位の非ヘム鉄が亜鉛に置き換わっていた.元素分析の結果から,大腸菌で発現させたキノール依存型一酸化窒素還元酵素は活性部位に非ヘム鉄含むものと亜鉛を含むものとが混在しており,精製および結晶化をへて亜鉛が結合したキノール依存型一酸化窒素還元酵素のみが単結晶として得られることがわかった.
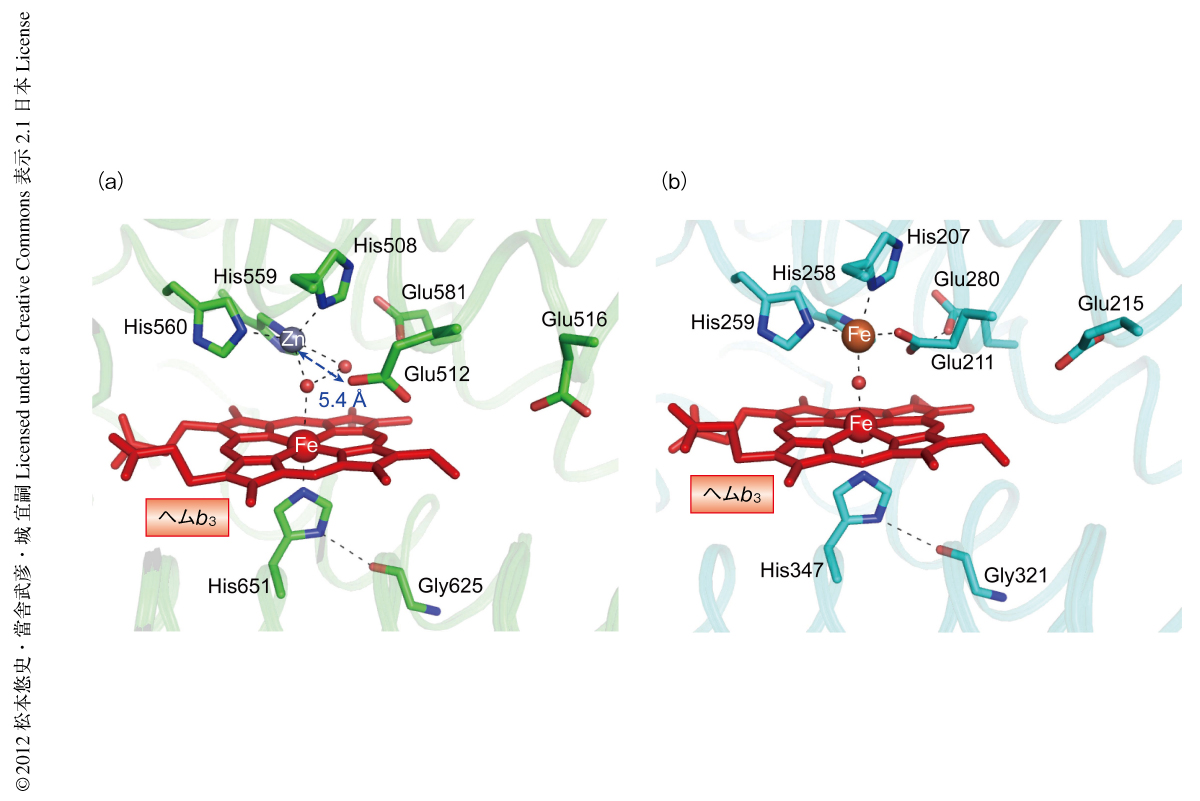
キノール依存型一酸化窒素還元酵素とシトクロムc依存型一酸化窒素還元酵素の活性部位の立体構造を比較したところ,亜鉛と非ヘム鉄の違いはあるものの,非ヘム金属に配位している3つのHis残基の配置はよく一致していた(図1).一方,シトクロムc依存型一酸化窒素還元酵素においては非ヘム鉄の配位子であったGlu残基が,キノール依存型一酸化窒素還元酵素においては亜鉛から遠ざかっており非ヘム金属に配位しないという違いがみられた.現時点では,このGlu残基の配向の違いが非ヘム金属の違いによるのか,あるいは,キノール依存型一酸化窒素還元酵素とシトクロムc依存型一酸化窒素還元酵素との違いによるのか定かではない.しかし,今回,得られたキノール依存型一酸化窒素還元酵素の結晶構造を用いた分子動力学計算から,活性部位のGlu残基は非ヘム金属へ配位したり解離したり,周辺の条件により柔軟に構造を変化できることが示された.筆者らは,このGlu残基の構造変化がNO還元反応に重要なのではないかと考えている.
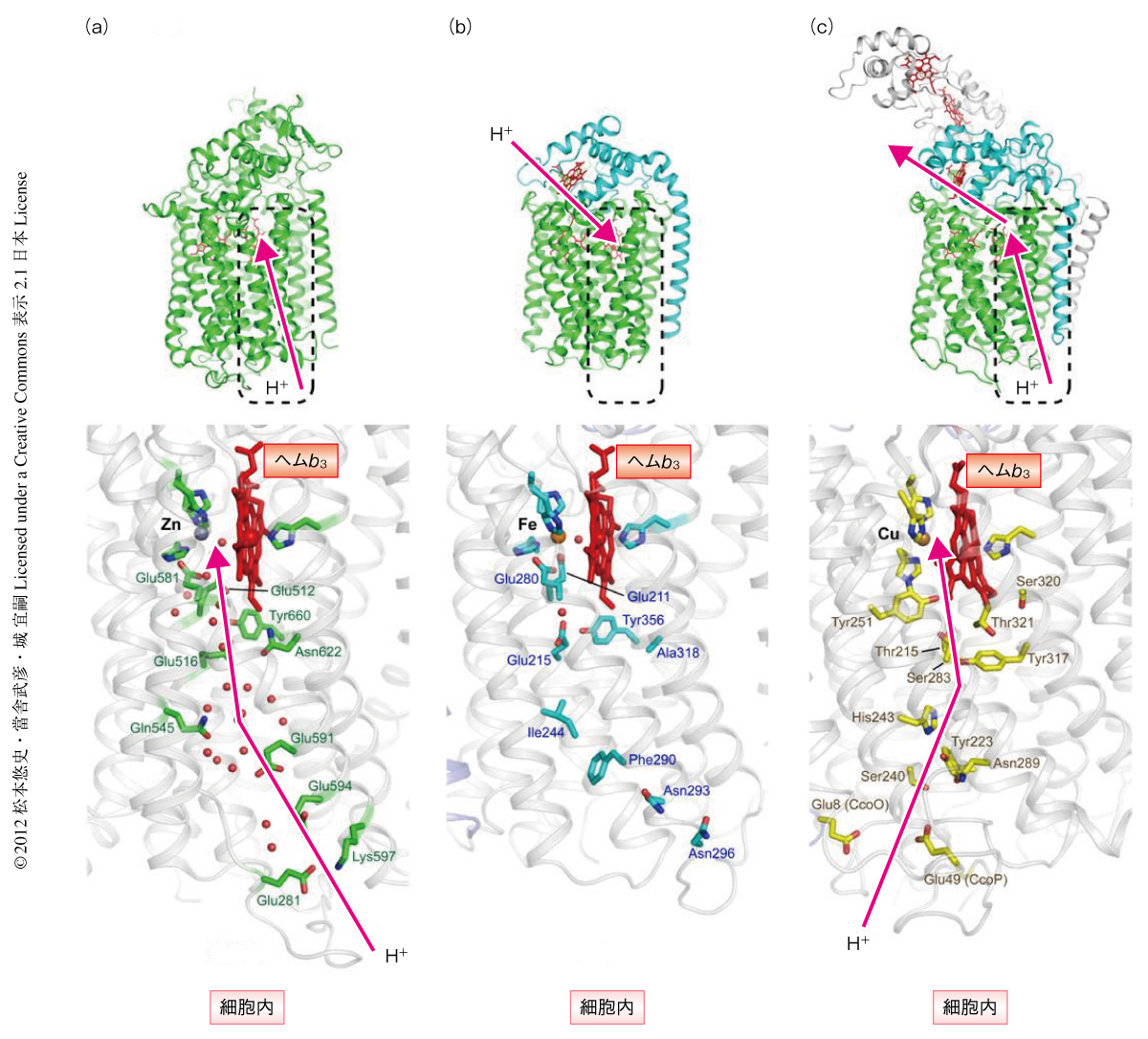
NO還元反応の起こる複核中心は膜貫通領域に埋まっており,反応に必要なプロトンは細胞膜の内側あるいは外側から供給される必要がある.多くの研究がなされてきたシトクロムc依存型一酸化窒素還元酵素ではプロトンは細胞の外側から供給されることが示されている7).実際に,シトクロムc依存型一酸化窒素還元酵素の結晶構造では活性部位のGlu残基から細胞外へとつづくプロトン輸送経路が観測された6).しかし,キノール依存型一酸化窒素還元酵素の結晶構造には細胞外と活性部位とをつなぐプロトン輸送経路を見い出すことはできなかった.代わりに,活性部位のGlu残基から細胞の内側へと延びる水分子を大量に含んだチャネル(水チャネル)が観測され,これがプロトン輸送経路として機能していることが予想された(図2).実際に,水チャネルを構成するアミノ酸残基の変異体を用いた実験や分子動力学計算の結果,水チャネルがキノール依存型一酸化窒素還元酵素におけるプロトン輸送経路としてはたらくことが示唆された.この水チャネルを形成する親水性のアミノ酸残基はシトクロムc依存型一酸化窒素還元酵素にはみられずキノール依存型一酸化窒素還元酵素においてよく保存されていることから,水チャネルがキノール依存型一酸化窒素還元酵素に特異的であることを強調したい.
キノール類似体の存在下においてキノール依存型一酸化窒素還元酵素を結晶化させることで,電子供与体であるキノール結合部位を決定できた(PDB ID:3AYG).その結果,キノールは膜貫通領域の細胞外側における近傍に結合し,キノール依存型一酸化窒素還元酵素に特徴的なアミノ酸残基との相互作用により認識されていることがわかった.また,キノール結合部位は電子伝達の担い手であるヘムbから3.8Åの距離に位置しており,キノールからの電子はヘムbにわたされ複核中心へとうけわたされることが示された.
また,ヘムbとヘムb3とを架橋するようにヘムのプロピオン酸のあいだにCa2+がみられた.Ca2+はシトクロムc依存型一酸化窒素還元酵素の同じ位置にもみられ配位構造もよく一致していた6).Ca2+に配位しているアミノ酸残基を変異させると,Ca2+含量の低下とともに酵素活性の著しい減少がみられ,Ca2+が一酸化窒素還元酵素の酵素機能に必須であることが示された.興味深いことに,Ca2+は低酸素濃度において機能するcbb3型呼吸鎖末端酸化酵素においても同じ位置に存在する5).しかし,好気条件においてはたらくほかの呼吸鎖末端酸化酵素ではCa2+は存在せず,その代わり,対応する位置に正電荷を持つArg残基が配置されている3,4).呼吸酵素におけるCa2+やArg残基の正電荷の役割として,ヘムのあいだでの電子伝達に関与していることが推測されている.
1994年に,一酸化窒素還元酵素が呼吸鎖末端酸化酵素と進化的な類縁関係にあると提案されてから1),長きにわたりアミノ酸配列の系統解析をもとに呼吸酵素の分子進化が論じられてきた2).キノール依存型一酸化窒素還元酵素の結晶構造が解明されたことで,系統解析により区別されるすべてのタイプの呼吸酵素の立体構造がでそろったことになる.つまり,呼吸酵素が地球環境の変化にあわせてそれ自体の構造および機能を変化させてきたその道筋を,立体構造を基盤に追跡することが可能になったといえる.
一酸化窒素還元酵素と呼吸鎖末端酸化酵素の親水性ドメインの立体構造を比較すると,2種類の一酸化窒素還元酵素およびcbb3型呼吸鎖末端酸化酵素がシトクロムc型の構造をもち,そのほかの呼吸鎖末端酸化酵素は銅タンパク質型の構造をもつことがわかった.また,さきに述べたように,一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素のみが2つのヘムのプロピオン酸のあいだにCa2+をもつことも,親水性ドメインの構造を指標とした呼吸酵素のグループ分けと同じ結果をあたえた.このような結果は従来のアミノ酸配列を利用した系統解析からも推測されており,複数の事象が一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素は進化において関連の深いことを示唆していた.
一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素とが進化上の近縁種であることが示唆されたが,一酸化窒素還元酵素からcbb3型呼吸鎖末端酸化酵素への分子進化を考えると,呼吸酵素はNO還元からO2還元へと触媒反応を変換するとともに,プロトンポンプ機能を獲得するという劇的な機能変換が起こっている.過去のプロトンポンプに関する研究から,呼吸鎖末端酸化酵素において細胞内のプロトンは活性部位である複核中心を経由して細胞外へと汲み出されるという経路(Kチャネル)が提案されている5)(図2).一酸化窒素還元酵素はプロトンポンプ機能をもたないことが示されており,シトクロムc依存型一酸化窒素還元酵素の結晶構造はこの通説を支持するものであった.今回,明らかにされたキノール依存型一酸化窒素還元酵素の結晶構造においても,細胞の内側と外側とをつなぐプロトンポンプ経路は確認できなかった.しかし,たいへん興味深いことに,キノール依存型一酸化窒素還元酵素で発見された水チャネルの位置はcbb3型呼吸鎖末端酸化酵素におけるKチャネルとよく対応していた(図2).キノール依存型一酸化窒素還元酵素の水チャネルはプロトンを細胞内から活性部位へと輸送する機能をもっており,いわば,プロトンポンプの“試作品”のような機能をもっているといえた.このことは,呼吸酵素がどのようにしてプロトンポンプ機能を獲得するにいたったのか考えるうえで重要な手がかりになるだろう.
キノール依存型一酸化窒素還元酵素の結晶構造が決定されたことで呼吸酵素の立体構造が勢ぞろいし,立体構造を基盤とした分子進化に関する議論が可能になった.とくに,キノール依存型一酸化窒素還元酵素において細胞内側から活性部位へとつづく水チャネルが発見され,呼吸酵素におけるプロトンポンプ機能の獲得機構に関する新たな知見を得た意義は大きい.今後,結晶構造から得られた情報をもとに,さまざまな実験手法や解析手段を駆使することで呼吸酵素の分子進化のさらなる理解につながっていくであろう.呼吸酵素の分子進化に関する研究は,いま,新たな幕開けをむかえようとしている.
また,筆者らは,呼吸酵素の分子進化という点に着目して一酸化窒素還元酵素に関する研究を展開してきたが,シトクロムc依存型一酸化窒素還元酵素およびキノール依存型一酸化窒素還元酵素と2つの一酸化窒素還元酵素の立体構造が明らかになったことは多方面の分野への貢献が期待できる.たとえば,一酸化窒素還元酵素は脱窒細菌だけではなくいくつかの病原細菌にもみられ,マクロファージなど哺乳類の免疫系が産生するNOを分解することで病原細菌の生存に必須である8).このことは,一酸化窒素還元酵素の阻害剤が薬剤として有効な可能性を示唆しており,その立体構造を利用した薬剤の分子設計に期待がかかる.また,一酸化窒素還元酵素の触媒反応はN-N結合の形成やN-O結合の開裂といった基礎化学にとって興味深い要素を含んでいる.これまでに明らかにされた休止状態の立体構造にくわえて,配位子結合型などの構造解析を進めることで一酸化窒素還元酵素により行われる化学反応の詳細が明らかになるであろう.さらに,一酸化窒素還元酵素の反応生成物であるN2Oはオゾン層破壊物質であるとともに強力な温室効果ガスであり9),環境科学の観点からも一酸化窒素還元酵素は注目をあつめている.地球上でのN2Oの生成量の約70%が微生物による窒素酸化物の分解,つまりは,一酸化窒素還元酵素のはたらきに由来しており,この酵素が行う触媒反応の詳細を理解することは今後の地球環境を考えていくうえでも重要な課題である.このように,一酸化窒素還元酵素の立体構造が解明されたことは呼吸酵素の分子進化の解明に一石を投じただけでなく,さまざまな分野における研究の進展に役立つものであると信じている.
九州大学生体防御医学研究所 研究員.
當舎 武彦(Takehiko Tosha)
理化学研究所放射光科学総合研究センター 研究員.
城 宜嗣(Yoshitsugu Shiro)
略歴:1985年 京都大学大学院工学研究科 修了,1987年 理化学研究所 研究員を経て,2000年より同 主任研究員.
研究テーマ:金属酵素・金属タンパク質の構造生物化学.
抱負:生体内の微量金属のセンシング・輸送などを,タンパク質構造を基盤に分子レベルで理解したい.金属酵素の分子機構の化学的な理解を深めたい.
研究室URL:http://www.riken.jp/biometal/index.htm
© 2012 松本悠史・當舎武彦・城 宜嗣 Licensed under CC 表示 2.1 日本
(理化学研究所放射光科学総合研究センター 城生体金属科学研究室)
email:城 宜嗣
DOI: 10.7875/first.author.2012.022
Crystal structure of quinol-dependent nitric oxide reductase from Geobacillus stearothermophilus.
Yushi Matsumoto, Takehiko Tosha, Andrei V. Pisliakov, Tomoya Hino, Hiroshi Sugimoto, Shingo Nagano, Yuji Sugita, Yoshitsugu Shiro
Nature Structural & Molecular Biology, 19, 238-245 (2012)
要 約
現在の地球上の生物の多くは酸素分子を利用した好気呼吸によりエネルギーを得ている.好気呼吸では呼吸鎖末端酸化酵素が酸素分子の還元と共役してプロトンを細胞の内側から外側へと能動輸送することにより,ATP合成酵素を効率よく機能させている.アミノ酸配列の相同性から,嫌気呼吸にみられる一酸化窒素還元酵素は呼吸鎖末端酸化酵素の祖先蛋白質であると考えられているが,一酸化窒素還元酵素はプロトンポンプとしての機能をもたない.つまり,呼吸酵素は一酸化窒素還元酵素から呼吸鎖末端酸化酵素への進化の過程においてプロトンポンプ機能を獲得したといえる.筆者らは,呼吸酵素の分子進化に関し理解を深めるため,呼吸酵素のなかで最後まで立体構造が未解明であったキノール依存型一酸化窒素還元酵素の構造解析に挑戦し,好熱菌に由来する酵素の結晶構造を2.5Å分解能で決定した.通説では一酸化窒素還元酵素の触媒反応に必要なプロトンは細胞の外側から供給されるとされているが,キノール依存型一酸化窒素還元酵素には対応するプロトンの輸送経路を確認できなかった.その代わり,活性部位と細胞の内側とをつなぐ親水性の水チャネルが発見され,これがプロトンの輸送経路として機能するという予想外の結果が得られた.興味深いことに,このキノール依存型一酸化窒素還元酵素に特有の水チャネルは,好気呼吸酵素である呼吸鎖末端酸化酵素が分子進化のすえ獲得したプロトンポンプ経路の一部に対応していた.このように,キノール依存型一酸化窒素還元酵素の結晶構造は一酸化窒素還元酵素が分子進化の過程でどのようにプロトンポンプ機能を得るにいたったのか,その解明にせまる大きな手がかりをあたえるものであった.
はじめに
一酸化窒素還元酵素は細菌の細胞膜に存在する金属酵素で,一酸化窒素(NO)を還元し亜酸化窒素(N2O)を生成する(2NO + 2H+ + 2e- → N2O + H2O).一酸化窒素還元酵素はおもに,硝酸を段階的に還元し窒素分子を生成する,脱窒反応とよばれる嫌気呼吸を行う細菌にみられる.このような細菌は脱窒反応によりATPを合成しており嫌気条件において生育できる.注目すべきことに,一酸化窒素還元酵素は好気呼吸の根幹を担う呼吸鎖末端酸化酵素の主要サブユニットと20%程度のアミノ酸配列の相同性を示す.このことから,一酸化窒素還元酵素と呼吸鎖末端酸化酵素とは進化的に関連が深いと考えられてきた1).呼吸鎖末端酸化酵素は酸素分子の還元反応(O2 + 4H+ + 4e- → 2H2O)により生じるエネルギーを利用して細胞内のプロトンを細胞外へと汲み出すプロトンポンプ機能をもち,その結果として生じる細胞膜のあいだのプロトン濃度勾配がATP合成酵素を効率よく稼働させる.この呼吸の本質ともいえる呼吸鎖末端酸化酵素の機能は一酸化窒素還元酵素にはないものである.地球上の酸素濃度が劇的に上昇したのは光合成細菌が出現した約30億年前のことである.それ以前に存在していた原始生物は酸素分子ではなく窒素化合物や硫黄化合物を利用して呼吸を行っていたことを考慮すると,嫌気呼吸酵素である一酸化窒素還元酵素が好気呼吸酵素である呼吸鎖末端酸化酵素に進化することで生物は地球環境に適応しさらなる進化をとげたという筋書きが予想される.つまり,一酸化窒素還元酵素から呼吸鎖末端酸化酵素への機能変換のしくみを理解することは生物進化の理解につながる.
呼吸酵素の分子進化に関する研究においてはアミノ酸配列の系統解析がおもな手法として用いられてきた2).しかし,よりくわしい分子進化の理解のためには機能を直接に反映する立体構造にもとづいた議論が必要不可欠である.系統解析により,呼吸酵素は,好気条件において機能する種々の呼吸鎖末端酸化酵素,低酸素環境においてはたらくcbb3型の呼吸鎖末端酸化酵素,および,シトクロムcを電子供与体とするシトクロムc依存型一酸化窒素還元酵素とキノールを電子供与体とするキノール依存型一酸化窒素還元酵素の2種類からなる一酸化窒素還元酵素,に分類される.これらの呼吸酵素のうち,好気条件においてはたらく種々の呼吸鎖末端酸化酵素の立体構造が決定されており3,4),2010年には,cbb3型呼吸鎖末端酸化酵素の立体構造が報告され5),ついで,筆者らの研究室において,シトクロムc依存型一酸化窒素還元酵素の結晶構造が解明された6)(新着論文レビュー でも掲載).つまり,残るキノール依存型一酸化窒素還元酵素の立体構造が決定されれば,呼吸酵素の分子進化を立体構造にもとづきより詳細に検討できるものと期待されていた.
1.キノール依存型一酸化窒素還元酵素の全体構造
構造解析に適した試料を得るため,熱安定性にすぐれる好熱菌Geobacillus stearothermophilusに由来するキノール依存型一酸化窒素還元酵素の遺伝子をクローニングし,大腸菌において過剰に発現させた.種々の界面活性剤の存在下において結晶化の条件を検討したところ,2.5Å分解能でキノール依存型一酸化窒素還元酵素の結晶構造を決定することができた(PDB ID:3AYF).キノール依存型一酸化窒素還元酵素は14本の膜貫通αヘリックスと細胞外に突き出た親水性ドメインからなる構造をしていた.2つのサブユニットからなるシトクロムc依存型一酸化窒素還元酵素と比較すると,サブユニット構造をもたないキノール依存型一酸化窒素還元酵素は膜貫通ヘリックスを1本多くもっており,このヘリックスはシトクロムc依存型一酸化窒素還元酵素の2つのサブユニットをつなぐように配置されていた.また,シトクロムc依存型一酸化窒素還元酵素とは異なりキノール依存型一酸化窒素還元酵素は細胞外の親水性領域にヘムcをもたないにもかかわらず,その立体構造はシトクロムc依存型一酸化窒素還元酵素と同様にシトクロムc型の構造であった.キノール依存型一酸化窒素還元酵素においてヘムcの結合部位に対応する部位には疎水性のアミノ酸残基がクラスターを形成しており,疎水分子であるヘムcがなくてもシトクロムc型の構造を維持しているものと推察できた.
2.活性部位の構造
NO還元反応はヘム(ヘムb3)とその近傍に存在する非ヘム鉄からなる複核中心で起こる.今回,明らかにされたキノール依存型一酸化窒素還元酵素の結晶構造では活性部位の非ヘム鉄が亜鉛に置き換わっていた.元素分析の結果から,大腸菌で発現させたキノール依存型一酸化窒素還元酵素は活性部位に非ヘム鉄含むものと亜鉛を含むものとが混在しており,精製および結晶化をへて亜鉛が結合したキノール依存型一酸化窒素還元酵素のみが単結晶として得られることがわかった.
キノール依存型一酸化窒素還元酵素とシトクロムc依存型一酸化窒素還元酵素の活性部位の立体構造を比較したところ,亜鉛と非ヘム鉄の違いはあるものの,非ヘム金属に配位している3つのHis残基の配置はよく一致していた(図1).一方,シトクロムc依存型一酸化窒素還元酵素においては非ヘム鉄の配位子であったGlu残基が,キノール依存型一酸化窒素還元酵素においては亜鉛から遠ざかっており非ヘム金属に配位しないという違いがみられた.現時点では,このGlu残基の配向の違いが非ヘム金属の違いによるのか,あるいは,キノール依存型一酸化窒素還元酵素とシトクロムc依存型一酸化窒素還元酵素との違いによるのか定かではない.しかし,今回,得られたキノール依存型一酸化窒素還元酵素の結晶構造を用いた分子動力学計算から,活性部位のGlu残基は非ヘム金属へ配位したり解離したり,周辺の条件により柔軟に構造を変化できることが示された.筆者らは,このGlu残基の構造変化がNO還元反応に重要なのではないかと考えている.
3.プロトン輸送経路
NO還元反応の起こる複核中心は膜貫通領域に埋まっており,反応に必要なプロトンは細胞膜の内側あるいは外側から供給される必要がある.多くの研究がなされてきたシトクロムc依存型一酸化窒素還元酵素ではプロトンは細胞の外側から供給されることが示されている7).実際に,シトクロムc依存型一酸化窒素還元酵素の結晶構造では活性部位のGlu残基から細胞外へとつづくプロトン輸送経路が観測された6).しかし,キノール依存型一酸化窒素還元酵素の結晶構造には細胞外と活性部位とをつなぐプロトン輸送経路を見い出すことはできなかった.代わりに,活性部位のGlu残基から細胞の内側へと延びる水分子を大量に含んだチャネル(水チャネル)が観測され,これがプロトン輸送経路として機能していることが予想された(図2).実際に,水チャネルを構成するアミノ酸残基の変異体を用いた実験や分子動力学計算の結果,水チャネルがキノール依存型一酸化窒素還元酵素におけるプロトン輸送経路としてはたらくことが示唆された.この水チャネルを形成する親水性のアミノ酸残基はシトクロムc依存型一酸化窒素還元酵素にはみられずキノール依存型一酸化窒素還元酵素においてよく保存されていることから,水チャネルがキノール依存型一酸化窒素還元酵素に特異的であることを強調したい.
4.電子伝達
キノール類似体の存在下においてキノール依存型一酸化窒素還元酵素を結晶化させることで,電子供与体であるキノール結合部位を決定できた(PDB ID:3AYG).その結果,キノールは膜貫通領域の細胞外側における近傍に結合し,キノール依存型一酸化窒素還元酵素に特徴的なアミノ酸残基との相互作用により認識されていることがわかった.また,キノール結合部位は電子伝達の担い手であるヘムbから3.8Åの距離に位置しており,キノールからの電子はヘムbにわたされ複核中心へとうけわたされることが示された.
また,ヘムbとヘムb3とを架橋するようにヘムのプロピオン酸のあいだにCa2+がみられた.Ca2+はシトクロムc依存型一酸化窒素還元酵素の同じ位置にもみられ配位構造もよく一致していた6).Ca2+に配位しているアミノ酸残基を変異させると,Ca2+含量の低下とともに酵素活性の著しい減少がみられ,Ca2+が一酸化窒素還元酵素の酵素機能に必須であることが示された.興味深いことに,Ca2+は低酸素濃度において機能するcbb3型呼吸鎖末端酸化酵素においても同じ位置に存在する5).しかし,好気条件においてはたらくほかの呼吸鎖末端酸化酵素ではCa2+は存在せず,その代わり,対応する位置に正電荷を持つArg残基が配置されている3,4).呼吸酵素におけるCa2+やArg残基の正電荷の役割として,ヘムのあいだでの電子伝達に関与していることが推測されている.
5.呼吸酵素の分子進化
1994年に,一酸化窒素還元酵素が呼吸鎖末端酸化酵素と進化的な類縁関係にあると提案されてから1),長きにわたりアミノ酸配列の系統解析をもとに呼吸酵素の分子進化が論じられてきた2).キノール依存型一酸化窒素還元酵素の結晶構造が解明されたことで,系統解析により区別されるすべてのタイプの呼吸酵素の立体構造がでそろったことになる.つまり,呼吸酵素が地球環境の変化にあわせてそれ自体の構造および機能を変化させてきたその道筋を,立体構造を基盤に追跡することが可能になったといえる.
一酸化窒素還元酵素と呼吸鎖末端酸化酵素の親水性ドメインの立体構造を比較すると,2種類の一酸化窒素還元酵素およびcbb3型呼吸鎖末端酸化酵素がシトクロムc型の構造をもち,そのほかの呼吸鎖末端酸化酵素は銅タンパク質型の構造をもつことがわかった.また,さきに述べたように,一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素のみが2つのヘムのプロピオン酸のあいだにCa2+をもつことも,親水性ドメインの構造を指標とした呼吸酵素のグループ分けと同じ結果をあたえた.このような結果は従来のアミノ酸配列を利用した系統解析からも推測されており,複数の事象が一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素は進化において関連の深いことを示唆していた.
一酸化窒素還元酵素とcbb3型呼吸鎖末端酸化酵素とが進化上の近縁種であることが示唆されたが,一酸化窒素還元酵素からcbb3型呼吸鎖末端酸化酵素への分子進化を考えると,呼吸酵素はNO還元からO2還元へと触媒反応を変換するとともに,プロトンポンプ機能を獲得するという劇的な機能変換が起こっている.過去のプロトンポンプに関する研究から,呼吸鎖末端酸化酵素において細胞内のプロトンは活性部位である複核中心を経由して細胞外へと汲み出されるという経路(Kチャネル)が提案されている5)(図2).一酸化窒素還元酵素はプロトンポンプ機能をもたないことが示されており,シトクロムc依存型一酸化窒素還元酵素の結晶構造はこの通説を支持するものであった.今回,明らかにされたキノール依存型一酸化窒素還元酵素の結晶構造においても,細胞の内側と外側とをつなぐプロトンポンプ経路は確認できなかった.しかし,たいへん興味深いことに,キノール依存型一酸化窒素還元酵素で発見された水チャネルの位置はcbb3型呼吸鎖末端酸化酵素におけるKチャネルとよく対応していた(図2).キノール依存型一酸化窒素還元酵素の水チャネルはプロトンを細胞内から活性部位へと輸送する機能をもっており,いわば,プロトンポンプの“試作品”のような機能をもっているといえた.このことは,呼吸酵素がどのようにしてプロトンポンプ機能を獲得するにいたったのか考えるうえで重要な手がかりになるだろう.
おわりに
キノール依存型一酸化窒素還元酵素の結晶構造が決定されたことで呼吸酵素の立体構造が勢ぞろいし,立体構造を基盤とした分子進化に関する議論が可能になった.とくに,キノール依存型一酸化窒素還元酵素において細胞内側から活性部位へとつづく水チャネルが発見され,呼吸酵素におけるプロトンポンプ機能の獲得機構に関する新たな知見を得た意義は大きい.今後,結晶構造から得られた情報をもとに,さまざまな実験手法や解析手段を駆使することで呼吸酵素の分子進化のさらなる理解につながっていくであろう.呼吸酵素の分子進化に関する研究は,いま,新たな幕開けをむかえようとしている.
また,筆者らは,呼吸酵素の分子進化という点に着目して一酸化窒素還元酵素に関する研究を展開してきたが,シトクロムc依存型一酸化窒素還元酵素およびキノール依存型一酸化窒素還元酵素と2つの一酸化窒素還元酵素の立体構造が明らかになったことは多方面の分野への貢献が期待できる.たとえば,一酸化窒素還元酵素は脱窒細菌だけではなくいくつかの病原細菌にもみられ,マクロファージなど哺乳類の免疫系が産生するNOを分解することで病原細菌の生存に必須である8).このことは,一酸化窒素還元酵素の阻害剤が薬剤として有効な可能性を示唆しており,その立体構造を利用した薬剤の分子設計に期待がかかる.また,一酸化窒素還元酵素の触媒反応はN-N結合の形成やN-O結合の開裂といった基礎化学にとって興味深い要素を含んでいる.これまでに明らかにされた休止状態の立体構造にくわえて,配位子結合型などの構造解析を進めることで一酸化窒素還元酵素により行われる化学反応の詳細が明らかになるであろう.さらに,一酸化窒素還元酵素の反応生成物であるN2Oはオゾン層破壊物質であるとともに強力な温室効果ガスであり9),環境科学の観点からも一酸化窒素還元酵素は注目をあつめている.地球上でのN2Oの生成量の約70%が微生物による窒素酸化物の分解,つまりは,一酸化窒素還元酵素のはたらきに由来しており,この酵素が行う触媒反応の詳細を理解することは今後の地球環境を考えていくうえでも重要な課題である.このように,一酸化窒素還元酵素の立体構造が解明されたことは呼吸酵素の分子進化の解明に一石を投じただけでなく,さまざまな分野における研究の進展に役立つものであると信じている.
文 献
- Saraste, M. & Castresana, J.: Cytochrome oxidase evolved by tinkering with denitrification enzymes. FEBS Lett., 341, 1-4 (1994)[PubMed]
- Ducluzeau, A. L., van Lis, R., Duval, S. et al.: Was nitric oxide the first deep electron sink? Trends. Biochem. Sci., 34, 9-15 (2009)[PubMed]
- Tsukihara, T., Aoyama, H., Yamashita, E. et al.: The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8Å. Science, 272, 1136-1144 (1996)[PubMed]
- Soulimane, T., Buse, G., Bourenkov, G. P. et al.: Structure and mechanism of the aberrant ba3-cytochrome c oxidase from Thermus thermophilus. EMBO J., 19, 1766-1776 (2000)[PubMed]
- Buschmann, S., Warkentin, E., Xie, H. et al.: The structure of cbb3 cytochrome oxidase provides insights into proton pumping. Science, 329, 327-330 (2010)[PubMed]
- Hino, T., Matsumoto, Y., Nagano, S. et al.: Structural basis of biological N2O generation by bacterial nitric oxide reductase. Science, 330, 1666-1670 (2010)[PubMed] [新着論文レビュー]
- Reimann, J., Flock, U., Lepp, H. et al.: A pathway for protons in nitric oxide reductase from Paracoccus denitrificans. Biochim. Biophys. Acta, 1767, 362-373 (2007)[PubMed]
- Stevanin, T. M., Moir, J. W. & Read, R. C.: Nitric oxide detoxification systems enhance survival of Neisseria meningitidis in human macrophages and in nasopharyngeal mucosa. Infect. Immun., 73, 3322-3329 (2005)[PubMed]
- Ravishankara, A. R., Daniel, J. S. & Portmann, R. W.: Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. Science, 326, 123-125 (2009)[PubMed]
著者プロフィール
九州大学生体防御医学研究所 研究員.
當舎 武彦(Takehiko Tosha)
理化学研究所放射光科学総合研究センター 研究員.
城 宜嗣(Yoshitsugu Shiro)
略歴:1985年 京都大学大学院工学研究科 修了,1987年 理化学研究所 研究員を経て,2000年より同 主任研究員.
研究テーマ:金属酵素・金属タンパク質の構造生物化学.
抱負:生体内の微量金属のセンシング・輸送などを,タンパク質構造を基盤に分子レベルで理解したい.金属酵素の分子機構の化学的な理解を深めたい.
研究室URL:http://www.riken.jp/biometal/index.htm
© 2012 松本悠史・當舎武彦・城 宜嗣 Licensed under CC 表示 2.1 日本