生体で亜酸化窒素を生成する一酸化窒素還元酵素の立体構造
日野智也 1・城 宜嗣2
(1 ERATO岩田ヒト膜受容体構造プロジェクト 結晶創成グループ,2理化学研究所放射光科学総合研究センター 城生体金属科学研究室)
email:城 宜嗣
DOI: 10.7875/first.author.2010.070
Structural basis of biological N2O generation by bacterial nitric oxide reductase.
Tomoya Hino, Yushi Matsumoto, Shingo Nagano, Hiroshi Sugimoto, Yoshihiro Fukumori, Takeshi Murata, So Iwata, Yoshitsugu Shiro
Science, 330, 1666-1670(2010)
一酸化窒素還元酵素は一酸化窒素から主要な温室効果ガスのひとつである亜酸化窒素を生成する酵素である.この酵素は結晶化の困難な膜タンパク質であるが,今回,筆者らは,モノクローナル抗体Fabフラグメントとの共結晶化を行うことで緑膿菌に由来する一酸化窒素還元酵素の結晶構造を2.7Å分解能で解明することに成功した.その結晶構造から,ヘムb3とFeBとよばれる鉄原子からなる触媒活性中心の詳細な立体構造が判明し,さらに,一酸化窒素,電子,プロトンといった一酸化窒素の還元反応に必要な要素がタンパク質外部からタンパク質内部にある活性中心へと輸送される経路を議論することができた.その全体構造と活性部位の配置などが好気呼吸酵素であるシトクロム酸化酵素と類似していたことから,一酸化窒素還元酵素とシトクロム酸化酵素とが分子進化的に類縁であることが立体構造を基盤に確認できた.しかし,これら酵素の構造上の相違点もいくつか発見でき,たとえば,活性中心FeBの配位子および配位構造の違いからNOから酸素へと呼吸基質を変換していった呼吸酵素の分子進化に関する新たな知見を得ることができた.これらの研究の成果は生態系による亜酸化窒素の産生の機構を解明すると同時に,呼吸酵素がいかにして地球の環境変化に適応して分子進化してきたのかを知るうえで重要な構造基盤をあたえるものとなった.
一酸化窒素N2Oは二酸化炭素CO2の310倍もの温暖化効果をもち,オゾン層の破壊にも関与するため,今後の地球環境の維持という観点から非常に注目されている1).近年,大気中のN2O濃度は上昇をつづけており,京都議定書において排出規制がかけられるほどとなった.N2Oの排出源は化石燃料の燃焼や工業生産による副産物などさまざまにあるが,その約70%は微生物による窒素酸化物の代謝に由来している.多くの細菌は酸素の不足する嫌気状態になると酸素O2の代わりに硝酸塩NO3-を基質とした硝酸塩呼吸(嫌気呼吸の一種)を行う.なかでも,脱窒菌とよばれる細菌はNO3-から逐次,酸素原子を取り除く還元反応を行う金属酵素群により最終的には窒素N2を産生する呼吸を行う(NO3-→NO2-→NO→N2O→N2).この一連の反応は窒素固定により大気から地表に取り入れられた窒素原子をN2として再び大気へと放出する唯一の生物的な反応であるため,地球規模での窒素原子の循環(窒素サイクル)を維持するうえで非常に重要な役割を担っている.この脱窒反応過程のうち,NOをN2Oに変換する反応を担うのが一酸化窒素還元酵素である.この酵素の触媒する反応は,2分子のNOの窒素原子間を結合し(ON-NO),さらにそこから酸素原子を引き抜く反応(N-N-O)である.この反応は単純ではあるが化学結合の生成と開裂という化学反応の本質を含んでいる.環境科学だけでなく化学反応機構という基礎科学の立場からも一酸化窒素還元酵素の構造と機能との関連を解き明かすことは重要であった.
さらに注目すべきことに,嫌気呼吸酵素である一酸化窒素還元酵素のアミノ酸配列は好気呼吸(O2を使った呼吸)にかかわる酵素であるシトクロム酸化酵素の主要サブユニットと約20%という高い相同性を示している.この2つの酵素の1次構造の類似点から,一酸化窒素還元酵素はヘムと銅原子を含む最終酸化酵素のスーパーファミリーに属しており,好気呼吸は硝酸塩呼吸から進化したものか,あるいは,同一の起源から分化したものであると考えられている.呼吸という生物にとって基本的かつ重要な生理反応に関係する酵素の分子進化という観点からも一酸化窒素還元酵素の立体構造解明は待望されていた.
膜タンパク質の立体構造解析は非常に困難であり,結晶ができたとしてもなかなか構造解析が可能な分解能にまで達しないことがしばしばである.この一酸化窒素還元酵素も例外ではなかった.嫌気培養した緑膿菌(Pseudomonas aeruginosa)が天然に発現する一酸化窒素還元酵素を1週間かけて精製することにより,40リットルの培養液から平均60 mgと膜タンパク質としては大量かつ純度よく調製することは可能であった.精製法の検討を開始してから半年ほどではじめて結晶を得ることに成功したが,大型放射光施設SPring-8にてX線回折実験を行ったところ14Å分解能の弱いX線回折点しか得られなかった.そののち,精製法や結晶化の条件,界面活性剤の種類の検討などさまざまなくふうと努力を重ねたが,最大でも6Åまで分解能を向上させるのがやっとであった.
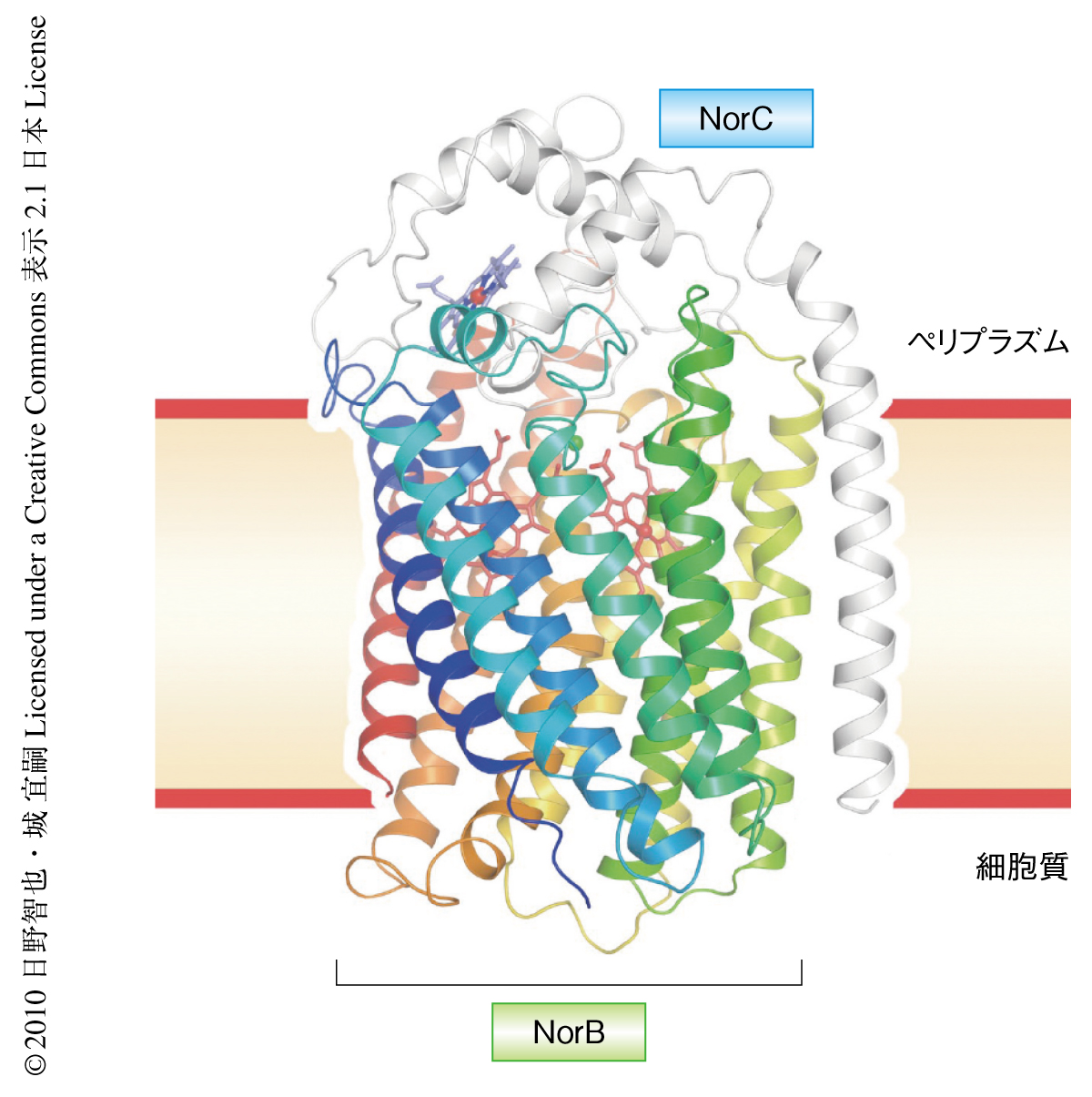
そこで,膜タンパク質の結晶構造解析でいくつか成功例のあった抗体を利用した結晶化法に取り組むことにした.当初は,膜タンパク質に対する抗体,とくに,結晶化に用いるための抗体はどのように作製すべきか,それにはどのような性質が必要なのかについてまったく指針がなかったが,マウスへの免疫や抗体のスクリーニングのときはできるかぎり一酸化窒素還元酵素が天然構造を保つよう2次元結晶を抗原として用いた.また,Biacoreによる表面プラズモン共鳴法を用いて一酸化窒素還元酵素に対する抗体の親和性を順位づけし,また,安定な複合体として精製可能かどうかをゲルろ過で確かめるなど,各種のスクリーニング法を組み合わせ,最終的に10個のモノクローナル抗体を得た.10クローンすべてについてFabフラグメント化を行い,一酸化窒素還元酵素との複合体を形成させたのち結晶化スクリーニングを行ったところ3クローンについて結晶が得られた.ただ,残念なことに,この時点で得られた結晶からはどれも10Å以上の低分解能のデータしか得られなかった.そこで,さらに界面活性剤の種類を検討した結果,ようやく2.4Å分解能までX線を反射する質のよい結晶の得られるようになり,ついには,2.7Å分解能で一酸化窒素還元酵素-Fab複合体の立体構造を決定することができた(図1,PDB ID:3O0R).
一酸化窒素還元酵素はNorBおよびNorCの2つのサブユニットからなり,合計で13本の膜貫通ヘリックスをもっていた.NorCにはヘムcが,NorBには2つのヘムbおよび非ヘム鉄FeBが存在していた.NO還元(N2O産生)の触媒反応中心はヘムb3とFeBからなる複核錯体であった.NorCがペリプラズム(グラム陰性細菌の細胞膜と外膜のあいだにある中間層)に存在するシトクロムc551から電子を受け取り,それをNorBの1分子のヘムbがリレーして複核活性中心に受け渡し,2分子のNOが2電子還元されてN2OとH2Oとを生成するものと考えられた.一酸化窒素還元酵素の全体構造とそれぞれの鉄イオンの存在位置,さらに,それらに配位しているすべてのHis残基の位置も,いままで報告されているすべてのシトクロム酸化酵素と一致していた.一酸化窒素還元酵素とシトクロム酸化酵素が共通の祖先をもつという,従来,アミノ酸配列の比較のみからの提案2,3) が正しかったことが立体構造から確かめられた.
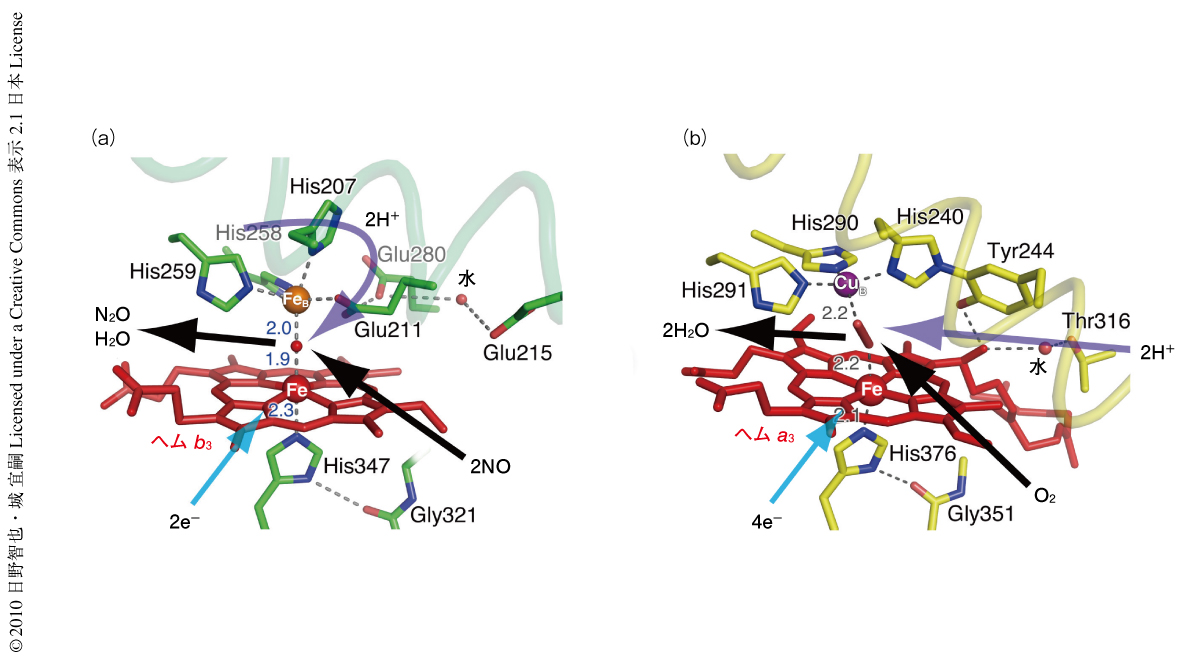
一酸化窒素還元酵素の触媒反応中心のヘムb3にはHis384が,FeBには3つのHis残基(His207,His258,His259)のイミダゾール基およびGlu211のカルボキシル基が配位していた(図2a).Glu211の配位は以前より予測されていたが4,5),今回,立体構造を決定することではじめて明確に証明することができた.さらに,これら4つのアミノ酸残基が形成する少しゆがんだ三角両錐型のFeBへの配位構造もはじめて明らかにできた.Glu211の近傍にはGlu280とGlu215の2つのカルボキシル基が存在し互いに相互作用していた.これら3つのGlu残基はほかの細菌の一酸化窒素還元酵素においても非常に高度に保存されており,この酵素の機能にとってきわめて重要であることが示されていた4,6).今回,これら3つのGlu残基の立体配置が明らかになったことにより,Glu211-Glu280-Glu215のネットワークが一酸化窒素還元酵素によるNO還元反応に必要とされる2つのプロトンを触媒反応中心へ供与する機能をもっていることが明らかになった.
この一酸化窒素還元酵素の触媒反応中心の構造をシトクロム酸化酵素と比較すると,シトクロム酸化酵素ではFeBは銅(CuB)に置き換わり,CuBは3つのHis残基が平面的に配位した四面体型の配位構造を形成している.一酸化窒素還元酵素で存在していたGlu残基はTyr残基に置き換わり,なおかつ,CuBに配位しているHis残基のひとつと共有結合している(図2b).このようなアミノ酸残基の置換とそれにともなう立体構造の変化が非ヘム金属の選択性(FeかCuか)を生み出し活性中心の反応性やプロトンの供給機構などを決めていることが明らかとなった.たとえば,モデル錯体を用いた実験から,非ヘム金属がFeの場合はCuの場合と比較してヘムb3の酸化還元電位が大きく低下することが明らかになっており7),このことが呼吸基質の変換へとつながったものと推定された.
生体において一酸化窒素還元酵素はペリプラズムに存在するシトクロムc551から電子を受容する.しかし,抗体が結合すると一酸化窒素還元酵素はシトクロムc551から電子を受容できなくなりNO還元活性を消失してしまった.このことは,抗体はシトクロムc551の結合する部位に結合しその結合を阻害することを示していた.立体構造をみると抗体はおもにNorCサブユニットと相互作用しているので,一酸化窒素還元酵素への電子供給の初段階はNorCサブユニットのもつヘムcの還元であることを示すことができた.また,ヘムcの鉄原子とNorBサブユニットのヘムbの距離,および,ヘムbとヘムb3の位置はシトクロム酸化酵素の金属中心のあいだの距離やヘムの配置と非常によく一致しており,一酸化窒素還元酵素もシトクロム酸化酵素と同様の電子伝達経路をもつことが示唆された8).一方,今回の結晶構造から活性中心から脂質膜へとつながる2つの疎水的なアミノ酸残基にかこまれたチャネルを見い出すことができ,そのひとつはシトクロム酸化酵素のO2輸送チャネルとほぼ一致する場所にあった9).NOは疎水的な分子であることから,このチャネルが分子進化的に保存された基質(O2あるいはNO)の導入経路であることが示唆された.
シトクロム酸化酵素による酸素呼吸の本質は,触媒反応中心における酸素の還元に共役して細胞膜の内から外へとプロトンをくみ出し,細胞膜のあいだにプロトンの濃度勾配をつくることである.すなわち,シトクロム酸化酵素は酸素還元反応に必要なプロトンと,同時に,膜を介したプロトンポンプ機能をもっている.どちらのプロトンも細胞内あるいはミトコンドリアのマトリックスから供給される.一方,一酸化窒素還元酵素はNO還元反応にプロトンを必要とするが,プロトンポンプ機能のないことは実験的に確かめられている10,11).一酸化窒素還元酵素の構造をみてみると,シトクロム酸化酵素とは大きく異なり,細胞の内側から活性中心へとつながる水素結合のネットワークはまったく存在せず,その部位には代わりに疎水的なアミノ酸残基が存在していた.この結果は,一酸化窒素還元酵素がプロトンポンプ機能をもっていないこと,触媒反応に用いるプロトンは細胞内からは供給されていないことを示していた.
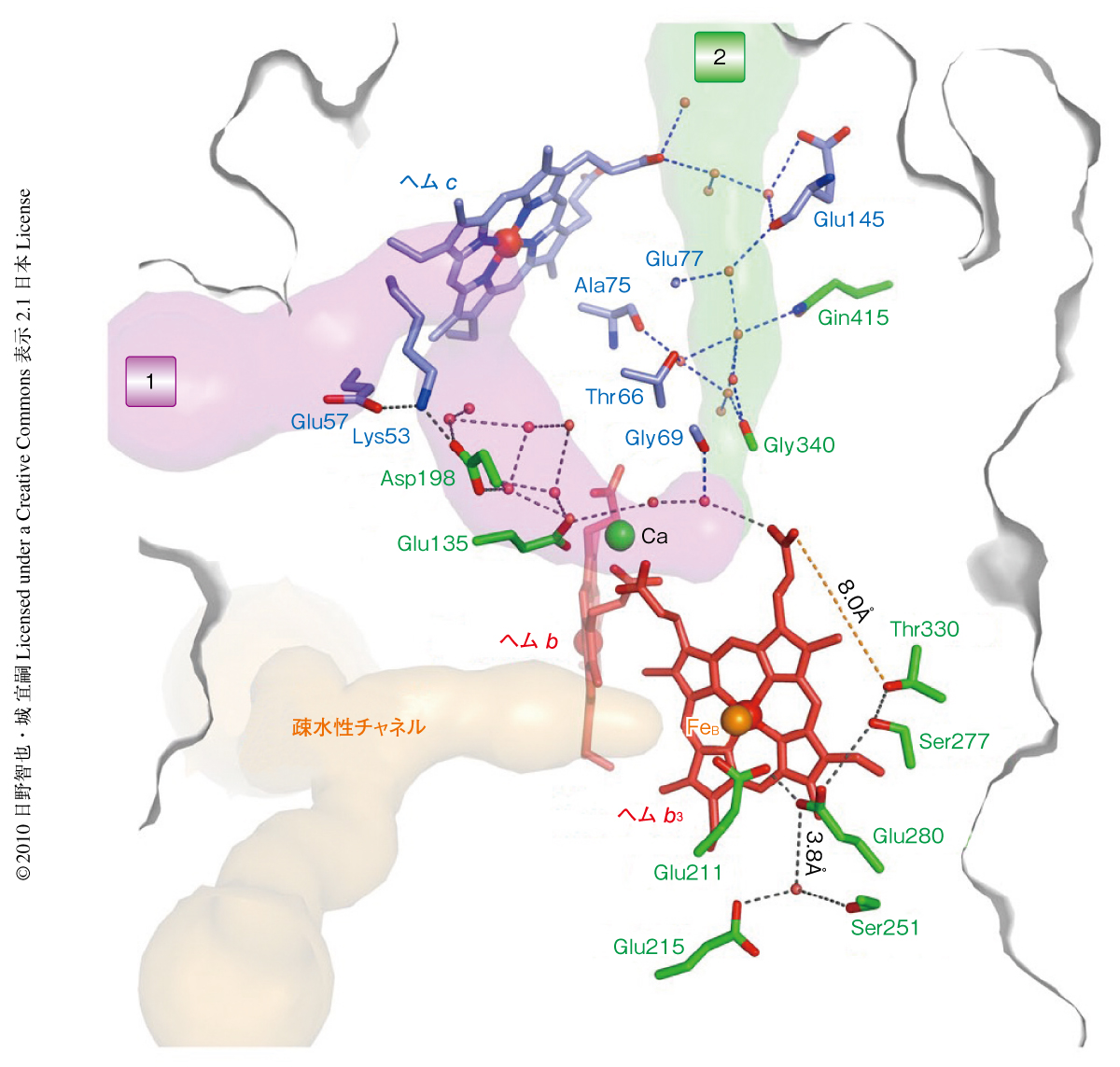
それでは,NO還元反応に必要なプロトンはどこからくるのであろうか? プロトン供給経路は,通常,プロトン化しうるアミノ酸残基の側鎖とタンパク質の内部に存在する水分子のつくりだす水素結合ネットワークにより形成される.今回の結晶構造を詳細に検討することにより,細胞の外側からNorBとNorCのサブユニット境界に存在する多くの水分子をへて活性中心近傍までつながる2つの水素結合ネットワークを見い出すことができた(図3).この経路は一部は不完全ではあるが,最終的にはさきに述べた活性中心近傍の3つのGlu残基(Glu211,Glu215,Glu280)につながっており,触媒反応中心へのプロトン供給経路として機能しているように思われる.今回の2.7Å分解能の結晶構造はあくまで静的な構造であり,プロトン輸送というダイナミックな反応を直接には観察できない.しかし,分子動力学計算などの手法によりタンパク質の内部でのプロトン輸送を“観察”するために重要な構造情報となることは間違いない.
以上,述べてきたように筆者らは,世界ではじめて一酸化窒素還元酵素の結晶構造を決定することができた.これにより,この酵素によるN2O生成の反応機構を解明するうえで重要な構造情報を得ることができた.しかし,実際にどのようにNO還元反応が進むのかを明らかにするためには,今回の休止状態の酵素の立体構造だけでなく,CO,NO,CN-,O2,N3-などの配位子結合型の構造が必須である.配位子がどのように触媒反応中心に結合しどのようなタンパク質の構造変化を誘起するのかを明らかにする必要がある.とくに,NO還元反応は1ミリ秒ときわめてすみやかに進行するため,2分子のNOが活性中心に結合した短寿命反応中間体の結晶構造解析は大きな挑戦である.
一酸化窒素還元酵素の結晶構造を解明したことで,嫌気呼吸(一酸化窒素還元酵素),微好気呼吸(cbb3型シトクロム酸化酵素),および,好気呼吸(ba3型シトクロム酸化酵素とaa3型シトクロム酸化酵素)にかかわる,いわゆる呼吸酵素ファミリーに属する3種類の酵素の構造がでそろった.これは,呼吸という生命維持に不可欠の生理反応が地球上に酸素濃度が低かった時代から現在にいたるまでどのように進化してきたのかを議論するための構造基盤が整ったことを意味している.これらの構造情報をもとに,構造生物学や生化学,分子生物学など,さまざまな解析手段を駆使することにより,生物が地球環境の変化に適応するためいかにして呼吸機能を進化させてきたのかを明らかにできるであろう.
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 協力研究員,および,同 基礎科学特別研究員を経て,2007年よりERATO岩田ヒト膜受容体構造プロジェクト 研究員.
研究テーマ:膜タンパク質全般の構造生物学.
抱負:一般に困難といわれる膜タンパク質の構造解析のなかでも,より困難な対象の構造解析に挑戦したい.
城 宜嗣(Yoshitsugu Shiro)
略歴:1985年 京都大学大学院工学研究科 修了,1987年 理化学研究所 研究員を経て,2000年より同 主任研究員.
研究テーマ:金属酵素・金属タンパク質の構造生物化学.
抱負:生体内の微量金属のセンシング・輸送などを,タンパク質構造を基盤に分子レベルで理解したい.金属酵素の分子機構の化学的な理解を深めたい.
© 2010 日野智也・城 宜嗣 Licensed under CC 表示 2.1 日本
(1 ERATO岩田ヒト膜受容体構造プロジェクト 結晶創成グループ,2理化学研究所放射光科学総合研究センター 城生体金属科学研究室)
email:城 宜嗣
DOI: 10.7875/first.author.2010.070
Structural basis of biological N2O generation by bacterial nitric oxide reductase.
Tomoya Hino, Yushi Matsumoto, Shingo Nagano, Hiroshi Sugimoto, Yoshihiro Fukumori, Takeshi Murata, So Iwata, Yoshitsugu Shiro
Science, 330, 1666-1670(2010)
要 約
一酸化窒素還元酵素は一酸化窒素から主要な温室効果ガスのひとつである亜酸化窒素を生成する酵素である.この酵素は結晶化の困難な膜タンパク質であるが,今回,筆者らは,モノクローナル抗体Fabフラグメントとの共結晶化を行うことで緑膿菌に由来する一酸化窒素還元酵素の結晶構造を2.7Å分解能で解明することに成功した.その結晶構造から,ヘムb3とFeBとよばれる鉄原子からなる触媒活性中心の詳細な立体構造が判明し,さらに,一酸化窒素,電子,プロトンといった一酸化窒素の還元反応に必要な要素がタンパク質外部からタンパク質内部にある活性中心へと輸送される経路を議論することができた.その全体構造と活性部位の配置などが好気呼吸酵素であるシトクロム酸化酵素と類似していたことから,一酸化窒素還元酵素とシトクロム酸化酵素とが分子進化的に類縁であることが立体構造を基盤に確認できた.しかし,これら酵素の構造上の相違点もいくつか発見でき,たとえば,活性中心FeBの配位子および配位構造の違いからNOから酸素へと呼吸基質を変換していった呼吸酵素の分子進化に関する新たな知見を得ることができた.これらの研究の成果は生態系による亜酸化窒素の産生の機構を解明すると同時に,呼吸酵素がいかにして地球の環境変化に適応して分子進化してきたのかを知るうえで重要な構造基盤をあたえるものとなった.
はじめに
一酸化窒素N2Oは二酸化炭素CO2の310倍もの温暖化効果をもち,オゾン層の破壊にも関与するため,今後の地球環境の維持という観点から非常に注目されている1).近年,大気中のN2O濃度は上昇をつづけており,京都議定書において排出規制がかけられるほどとなった.N2Oの排出源は化石燃料の燃焼や工業生産による副産物などさまざまにあるが,その約70%は微生物による窒素酸化物の代謝に由来している.多くの細菌は酸素の不足する嫌気状態になると酸素O2の代わりに硝酸塩NO3-を基質とした硝酸塩呼吸(嫌気呼吸の一種)を行う.なかでも,脱窒菌とよばれる細菌はNO3-から逐次,酸素原子を取り除く還元反応を行う金属酵素群により最終的には窒素N2を産生する呼吸を行う(NO3-→NO2-→NO→N2O→N2).この一連の反応は窒素固定により大気から地表に取り入れられた窒素原子をN2として再び大気へと放出する唯一の生物的な反応であるため,地球規模での窒素原子の循環(窒素サイクル)を維持するうえで非常に重要な役割を担っている.この脱窒反応過程のうち,NOをN2Oに変換する反応を担うのが一酸化窒素還元酵素である.この酵素の触媒する反応は,2分子のNOの窒素原子間を結合し(ON-NO),さらにそこから酸素原子を引き抜く反応(N-N-O)である.この反応は単純ではあるが化学結合の生成と開裂という化学反応の本質を含んでいる.環境科学だけでなく化学反応機構という基礎科学の立場からも一酸化窒素還元酵素の構造と機能との関連を解き明かすことは重要であった.
さらに注目すべきことに,嫌気呼吸酵素である一酸化窒素還元酵素のアミノ酸配列は好気呼吸(O2を使った呼吸)にかかわる酵素であるシトクロム酸化酵素の主要サブユニットと約20%という高い相同性を示している.この2つの酵素の1次構造の類似点から,一酸化窒素還元酵素はヘムと銅原子を含む最終酸化酵素のスーパーファミリーに属しており,好気呼吸は硝酸塩呼吸から進化したものか,あるいは,同一の起源から分化したものであると考えられている.呼吸という生物にとって基本的かつ重要な生理反応に関係する酵素の分子進化という観点からも一酸化窒素還元酵素の立体構造解明は待望されていた.
1.一酸化窒素還元酵素の結晶化と構造解析
膜タンパク質の立体構造解析は非常に困難であり,結晶ができたとしてもなかなか構造解析が可能な分解能にまで達しないことがしばしばである.この一酸化窒素還元酵素も例外ではなかった.嫌気培養した緑膿菌(Pseudomonas aeruginosa)が天然に発現する一酸化窒素還元酵素を1週間かけて精製することにより,40リットルの培養液から平均60 mgと膜タンパク質としては大量かつ純度よく調製することは可能であった.精製法の検討を開始してから半年ほどではじめて結晶を得ることに成功したが,大型放射光施設SPring-8にてX線回折実験を行ったところ14Å分解能の弱いX線回折点しか得られなかった.そののち,精製法や結晶化の条件,界面活性剤の種類の検討などさまざまなくふうと努力を重ねたが,最大でも6Åまで分解能を向上させるのがやっとであった.
そこで,膜タンパク質の結晶構造解析でいくつか成功例のあった抗体を利用した結晶化法に取り組むことにした.当初は,膜タンパク質に対する抗体,とくに,結晶化に用いるための抗体はどのように作製すべきか,それにはどのような性質が必要なのかについてまったく指針がなかったが,マウスへの免疫や抗体のスクリーニングのときはできるかぎり一酸化窒素還元酵素が天然構造を保つよう2次元結晶を抗原として用いた.また,Biacoreによる表面プラズモン共鳴法を用いて一酸化窒素還元酵素に対する抗体の親和性を順位づけし,また,安定な複合体として精製可能かどうかをゲルろ過で確かめるなど,各種のスクリーニング法を組み合わせ,最終的に10個のモノクローナル抗体を得た.10クローンすべてについてFabフラグメント化を行い,一酸化窒素還元酵素との複合体を形成させたのち結晶化スクリーニングを行ったところ3クローンについて結晶が得られた.ただ,残念なことに,この時点で得られた結晶からはどれも10Å以上の低分解能のデータしか得られなかった.そこで,さらに界面活性剤の種類を検討した結果,ようやく2.4Å分解能までX線を反射する質のよい結晶の得られるようになり,ついには,2.7Å分解能で一酸化窒素還元酵素-Fab複合体の立体構造を決定することができた(図1,PDB ID:3O0R).
2.一酸化窒素還元酵素の全体構造
一酸化窒素還元酵素はNorBおよびNorCの2つのサブユニットからなり,合計で13本の膜貫通ヘリックスをもっていた.NorCにはヘムcが,NorBには2つのヘムbおよび非ヘム鉄FeBが存在していた.NO還元(N2O産生)の触媒反応中心はヘムb3とFeBからなる複核錯体であった.NorCがペリプラズム(グラム陰性細菌の細胞膜と外膜のあいだにある中間層)に存在するシトクロムc551から電子を受け取り,それをNorBの1分子のヘムbがリレーして複核活性中心に受け渡し,2分子のNOが2電子還元されてN2OとH2Oとを生成するものと考えられた.一酸化窒素還元酵素の全体構造とそれぞれの鉄イオンの存在位置,さらに,それらに配位しているすべてのHis残基の位置も,いままで報告されているすべてのシトクロム酸化酵素と一致していた.一酸化窒素還元酵素とシトクロム酸化酵素が共通の祖先をもつという,従来,アミノ酸配列の比較のみからの提案2,3) が正しかったことが立体構造から確かめられた.
3.触媒反応中心の構造
一酸化窒素還元酵素の触媒反応中心のヘムb3にはHis384が,FeBには3つのHis残基(His207,His258,His259)のイミダゾール基およびGlu211のカルボキシル基が配位していた(図2a).Glu211の配位は以前より予測されていたが4,5),今回,立体構造を決定することではじめて明確に証明することができた.さらに,これら4つのアミノ酸残基が形成する少しゆがんだ三角両錐型のFeBへの配位構造もはじめて明らかにできた.Glu211の近傍にはGlu280とGlu215の2つのカルボキシル基が存在し互いに相互作用していた.これら3つのGlu残基はほかの細菌の一酸化窒素還元酵素においても非常に高度に保存されており,この酵素の機能にとってきわめて重要であることが示されていた4,6).今回,これら3つのGlu残基の立体配置が明らかになったことにより,Glu211-Glu280-Glu215のネットワークが一酸化窒素還元酵素によるNO還元反応に必要とされる2つのプロトンを触媒反応中心へ供与する機能をもっていることが明らかになった.
この一酸化窒素還元酵素の触媒反応中心の構造をシトクロム酸化酵素と比較すると,シトクロム酸化酵素ではFeBは銅(CuB)に置き換わり,CuBは3つのHis残基が平面的に配位した四面体型の配位構造を形成している.一酸化窒素還元酵素で存在していたGlu残基はTyr残基に置き換わり,なおかつ,CuBに配位しているHis残基のひとつと共有結合している(図2b).このようなアミノ酸残基の置換とそれにともなう立体構造の変化が非ヘム金属の選択性(FeかCuか)を生み出し活性中心の反応性やプロトンの供給機構などを決めていることが明らかとなった.たとえば,モデル錯体を用いた実験から,非ヘム金属がFeの場合はCuの場合と比較してヘムb3の酸化還元電位が大きく低下することが明らかになっており7),このことが呼吸基質の変換へとつながったものと推定された.
4.電子および一酸化窒素の輸送経路
生体において一酸化窒素還元酵素はペリプラズムに存在するシトクロムc551から電子を受容する.しかし,抗体が結合すると一酸化窒素還元酵素はシトクロムc551から電子を受容できなくなりNO還元活性を消失してしまった.このことは,抗体はシトクロムc551の結合する部位に結合しその結合を阻害することを示していた.立体構造をみると抗体はおもにNorCサブユニットと相互作用しているので,一酸化窒素還元酵素への電子供給の初段階はNorCサブユニットのもつヘムcの還元であることを示すことができた.また,ヘムcの鉄原子とNorBサブユニットのヘムbの距離,および,ヘムbとヘムb3の位置はシトクロム酸化酵素の金属中心のあいだの距離やヘムの配置と非常によく一致しており,一酸化窒素還元酵素もシトクロム酸化酵素と同様の電子伝達経路をもつことが示唆された8).一方,今回の結晶構造から活性中心から脂質膜へとつながる2つの疎水的なアミノ酸残基にかこまれたチャネルを見い出すことができ,そのひとつはシトクロム酸化酵素のO2輸送チャネルとほぼ一致する場所にあった9).NOは疎水的な分子であることから,このチャネルが分子進化的に保存された基質(O2あるいはNO)の導入経路であることが示唆された.
5.一酸化窒素還元酵素におけるプロトンチャネル
シトクロム酸化酵素による酸素呼吸の本質は,触媒反応中心における酸素の還元に共役して細胞膜の内から外へとプロトンをくみ出し,細胞膜のあいだにプロトンの濃度勾配をつくることである.すなわち,シトクロム酸化酵素は酸素還元反応に必要なプロトンと,同時に,膜を介したプロトンポンプ機能をもっている.どちらのプロトンも細胞内あるいはミトコンドリアのマトリックスから供給される.一方,一酸化窒素還元酵素はNO還元反応にプロトンを必要とするが,プロトンポンプ機能のないことは実験的に確かめられている10,11).一酸化窒素還元酵素の構造をみてみると,シトクロム酸化酵素とは大きく異なり,細胞の内側から活性中心へとつながる水素結合のネットワークはまったく存在せず,その部位には代わりに疎水的なアミノ酸残基が存在していた.この結果は,一酸化窒素還元酵素がプロトンポンプ機能をもっていないこと,触媒反応に用いるプロトンは細胞内からは供給されていないことを示していた.
それでは,NO還元反応に必要なプロトンはどこからくるのであろうか? プロトン供給経路は,通常,プロトン化しうるアミノ酸残基の側鎖とタンパク質の内部に存在する水分子のつくりだす水素結合ネットワークにより形成される.今回の結晶構造を詳細に検討することにより,細胞の外側からNorBとNorCのサブユニット境界に存在する多くの水分子をへて活性中心近傍までつながる2つの水素結合ネットワークを見い出すことができた(図3).この経路は一部は不完全ではあるが,最終的にはさきに述べた活性中心近傍の3つのGlu残基(Glu211,Glu215,Glu280)につながっており,触媒反応中心へのプロトン供給経路として機能しているように思われる.今回の2.7Å分解能の結晶構造はあくまで静的な構造であり,プロトン輸送というダイナミックな反応を直接には観察できない.しかし,分子動力学計算などの手法によりタンパク質の内部でのプロトン輸送を“観察”するために重要な構造情報となることは間違いない.
おわりに
以上,述べてきたように筆者らは,世界ではじめて一酸化窒素還元酵素の結晶構造を決定することができた.これにより,この酵素によるN2O生成の反応機構を解明するうえで重要な構造情報を得ることができた.しかし,実際にどのようにNO還元反応が進むのかを明らかにするためには,今回の休止状態の酵素の立体構造だけでなく,CO,NO,CN-,O2,N3-などの配位子結合型の構造が必須である.配位子がどのように触媒反応中心に結合しどのようなタンパク質の構造変化を誘起するのかを明らかにする必要がある.とくに,NO還元反応は1ミリ秒ときわめてすみやかに進行するため,2分子のNOが活性中心に結合した短寿命反応中間体の結晶構造解析は大きな挑戦である.
一酸化窒素還元酵素の結晶構造を解明したことで,嫌気呼吸(一酸化窒素還元酵素),微好気呼吸(cbb3型シトクロム酸化酵素),および,好気呼吸(ba3型シトクロム酸化酵素とaa3型シトクロム酸化酵素)にかかわる,いわゆる呼吸酵素ファミリーに属する3種類の酵素の構造がでそろった.これは,呼吸という生命維持に不可欠の生理反応が地球上に酸素濃度が低かった時代から現在にいたるまでどのように進化してきたのかを議論するための構造基盤が整ったことを意味している.これらの構造情報をもとに,構造生物学や生化学,分子生物学など,さまざまな解析手段を駆使することにより,生物が地球環境の変化に適応するためいかにして呼吸機能を進化させてきたのかを明らかにできるであろう.
文 献
- Ravishankara, A. R., Daniel, J. S., Portmann, R. W.: Nitrous oxide (N2O): the dominant ozone-depleting substance emitted in the 21st century. Science, 326, 123-125 (2009)[PubMed]
- Saraste, M., Castresana, J.: Cytochrome oxidase evolved by tinkering with denitrification enzymes. FEBS Lett., 341, 1-4 (1994)[PubMed]
- van der Oost, J., de Boor, A. P., de Gier, J. W. et al.: The heme-copper oxidase family consists of three distinct types of terminal oxidases and is related to nitric oxide reductase. FEMS Microbiol. Lett., 121, 1-9 (1994)[PubMed]
- Butland, G., Spiro, S., Watmough, N. J. et al.: Two conserved glutamates in bacterial nitric oxide reductase are essential for activity but not for assembly of the enzyme. J. Bacteriol., 183, 189-199 (2001)[PubMed]
- Reimann, J., Flock, U., Lepp, H. et al.: A pathway for protons in nitric oxide reductase from Paracoccus denitrificans. Biochim. Biophys. Acta, 1767, 362-373 (2007)[PubMed]
- Flock, U., Lachmann, P., Reimann, J. et al.: Exploring the terminal region of the proton pathway in the bacterial nitric oxide reductase. J. Inorg. Biochem., 103, 845-850 (2009)[PubMed]
- Lin, Y. W., Yeung, N., Gao, Y. G. et al.: Roles of glutamates and metal ions in a rationally designed nitric oxide reductase based on myoglobin. Proc. Natl. Acad. Sci. USA, 107, 8581-8586 (2010)[PubMed]
- Iwata, S., Ostermeier, C., Ludwig, B. et al.: Structure at 2.8Å resolution of cytochrome c oxidase from Paracoccus denitrificans. Nature, 376, 660-669 (1995)[PubMed]
- Buschmann, S., Warkentin, E., Xie, H. et al.: The structure of cbb3 cytochrome oxidase provides insights into the proton pumping. Science, 329, 327-330 (2010)[PubMed]
- Shapleigh, J. P., Payne, W. J.: Nitric oxide-dependent proton translocation in various denitrifiers. J. Bacteriol., 163, 837- 840 (1985)[PubMed]
- Bell, L. C., Richardson, D. J., Fergason, S. J.: Identification of nitric oxide reductase activity in Rhodobacter capsulatus: the electron transport pathway can either use or bypass both cytochrome c2 and the cytochrome bc1 complex. J. Gen. Microbiol., 138, 437-443 (1992)[PubMed]
著者プロフィール
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 協力研究員,および,同 基礎科学特別研究員を経て,2007年よりERATO岩田ヒト膜受容体構造プロジェクト 研究員.
研究テーマ:膜タンパク質全般の構造生物学.
抱負:一般に困難といわれる膜タンパク質の構造解析のなかでも,より困難な対象の構造解析に挑戦したい.
城 宜嗣(Yoshitsugu Shiro)
略歴:1985年 京都大学大学院工学研究科 修了,1987年 理化学研究所 研究員を経て,2000年より同 主任研究員.
研究テーマ:金属酵素・金属タンパク質の構造生物化学.
抱負:生体内の微量金属のセンシング・輸送などを,タンパク質構造を基盤に分子レベルで理解したい.金属酵素の分子機構の化学的な理解を深めたい.
© 2010 日野智也・城 宜嗣 Licensed under CC 表示 2.1 日本