F1-ATPaseにおける回転の角度に依存した触媒活性の制御機構
渡邉力也・野地博行
(東京大学大学院工学系研究科 応用化学専攻)
email:渡邉力也
DOI: 10.7875/first.author.2011.179
Mechanical modulation of catalytic power on F1-ATPase.
Rikiya Watanabe, Daichi Okuno, Shouichi Sakakihara, Katsuya Shimabukuro, Ryota Iino, Masasuke Yoshida, Hiroyuki Noji
Nature Chemical Biology, 8, 86–92 (2012)
われわれの細胞にはF1-ATPaseとよばれるタンパク質でできた回転分子モーターが存在し,生理的に重要な役割を担っている.F1-ATPaseでは化学反応と力学的な回転運動とが可逆的に共役しており,ATPの加水分解で得られるエネルギーを利用して反時計方向に回転するだけでなく,回転子を逆方向に強制的に回転させるとADPと無機リン酸からATPを合成することが知られている.この回転の方向に依存した可逆的な触媒活性を実現するため,F1-ATPaseは回転の角度に応じて構造を変化させ,反応速度および平衡状態を制御していることが示唆されている.しかし,従来の1分子観察法では,特定の回転角度における反応速度を計測することはできたが,それ以外の回転角度では測定はできなかったため,回転角度と触媒活性との関係を厳密に調べることができなかった.そこで,この研究では,磁気ピンセットによる1分子操作系を利用して,さまざまな回転角度におけるATP加水分解およびATP合成の反応速度定数および平衡定数を計測した.その結果,F1-ATPaseは可逆的な触媒活性の実現のため回転角度に依存して反応速度および化学平衡を合理的に制御していることが明らかになった.また,測定された回転角度と平衡定数の関係からATP加水分解のそれぞれの反応素過程で放出されるエネルギー量を算出したところ,基質の結合過程および生成物の解離過程が突出して大きく,つまりは,それらが主役となり回転運動が駆動されていることが判明した.
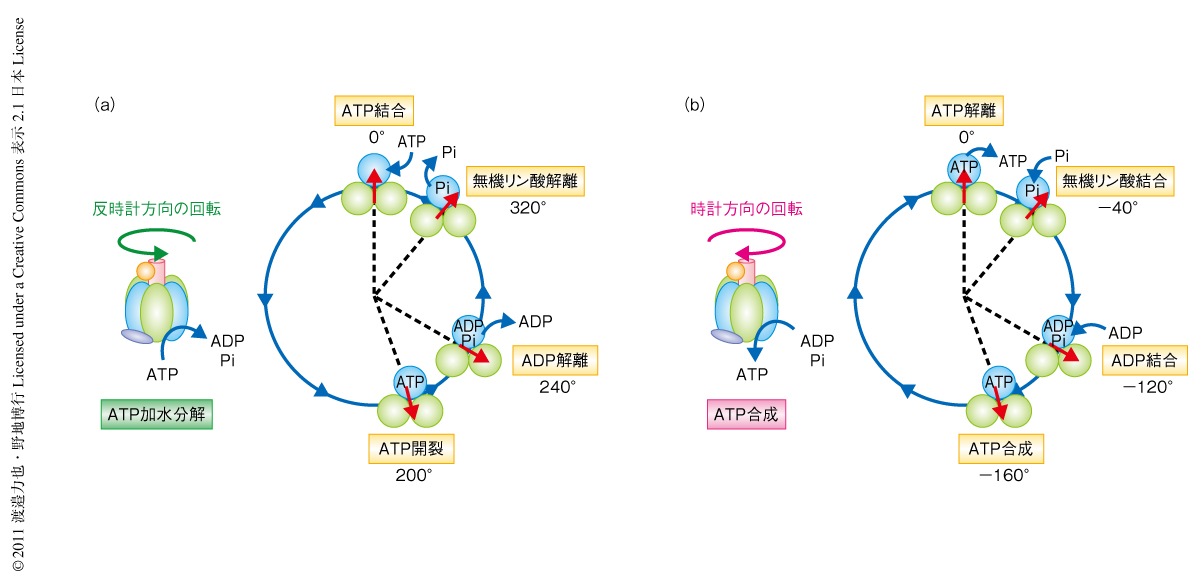
F1-ATPaseはタンパク質でできた世界最小の回転分子モーターであり,ATPを加水分解することで反時計方向に回転する1).その回転運動の解析から,回転子が1回転するあいだに3分子のATPが加水分解され,40 pN nmの回転トルクを発生することが知られている.これを1回転でのエネルギー収支に置き換えると,放出される運動エネルギー量とATPの加水分解により獲得される化学エネルギー量とはほぼ等価であり,つまり,F1-ATPaseは100%の変換効率で化学エネルギーを力学的な運動に変換しているといえる2).また,F1-ATPaseはATPの加水分解を駆動力として回転するだけでなく,回転子を逆方向へ強制的に回転させるとADPと無機リン酸からATPを合成することが知られており,つまり,F1-ATPaseは化学エネルギーを力学的な運動へと変換する過程において可逆化を実現している3,4)(図1a).これをエンジンなどの熱機関にたとえると,ガソリンを燃焼して車輪を回転させるだけでなく,車輪を回転させることで排気ガスからガソリンを合成していることと同じで,現在の技術では実現することのできないものである.
筆者らは,このすばらしいエネルギー変換機構(高効率かつ可逆)の作動原理を理解するため,まずATPを加水分解しているときの化学反応と力学的な運動との共役スキームを明らかにすることをめざした.近年,回転運動の1分子観察法によりATP加水分解のそれぞれの反応素過程(ATPの結合,ATPの加水分解,生成物であるADPと無機リン酸の解離)はそれぞれ異なる回転角度(反応角度)においてひき起こされることが明らかにされ,つまり,ATP加水分解の際の化学反応と力学的な運動との共役スキームが反応素過程の単位で完成した5-7)(図1a).現在ではつぎの課題として,ATP合成のときの共役スキーム,また,ATPの加水分解と合成との化学平衡の制御機構を解明することが求められている.しかし,従来の1分子観察法では合成反応の反応速度やその平衡定数を計測することは非常にむずかしい.そこで,近年,開発した1分子操作ののちの分子の応答から触媒反応の進行のようすを明らかにする実験系を利用し8),さまざまな回転角度におけるATPの結合と解離およびATPの加水分解と合成の反応速度定数と平衡定数を網羅的に計測することで,ATP合成の際の共役スキームや回転角度に依存した化学平衡の制御機構の解明を試みた.
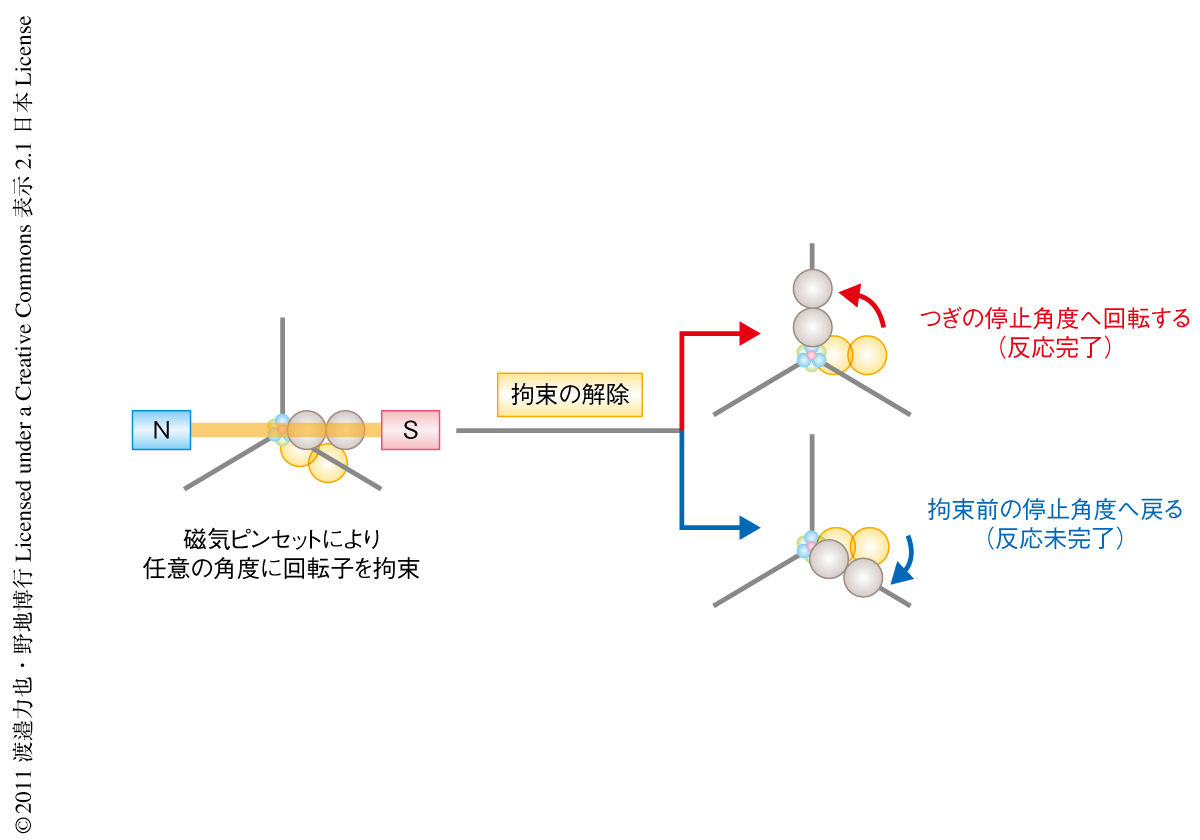
F1-ATPaseは化学反応と回転運動とが強固に共役しているため,溶液のATPの濃度を減らすとATP結合の反応中間体に起因した長時間の停止が観察され,また,ATPの加水分解が著しく遅い変異体を利用するとATP加水分解の反応中間体に起因した長時間の停止をともない回転するようすが観察される2,9).従来の1分子観察法では,この停止角度および停止時間の解析によりATP加水分解のそれぞれの反応素過程における反応角度および反応速度を同定してきた.しかし,この方法では停止角度の近傍(つまり,触媒部位が安定構造をとる回転角度)での反応速度を計測することはできたが,停止角度から大きく離れた回転角度(つまり,触媒部位が準安定構造をとる回転角度)での測定はできなかった.そこで,1分子操作ののちの分子の応答から触媒反応の進行のようすを明らかにする実験系を利用し,さまざまな回転角度における反応速度および平衡定数を計測した.具体的には,ATPの結合およびATPの加水分解の反応中間体に起因する長時間の停止中に,磁気ピンセットを利用してF1-ATPaseの回転子を任意の角度に強制的に拘束した.そして,拘束から解放した直後の挙動から,特定の触媒部位におけるATPの結合およびATPの加水分解の進行状況を識別した.拘束からの解放の直後に観察された挙動は,つぎの停止角度へ回転する(つまり,反応が完了する),あるいは,拘束前の停止角度へ戻る(つまり,反応が完了しない)の2つであった.
化学反応と回転運動との強固な共役関係から,“つぎの停止角度へ回転する”挙動は拘束からの解放の直前に反応が完了していたことを意味し,一方,“拘束前の停止角度へ戻る”挙動は反応が未完了であったことを意味していた(図2).つまりは,磁気ピンセットによる拘束から解放した直後のF1-ATPaseの挙動を観察し,2つの挙動の出現確率から反応の進行状況に関する情報を獲得することができたのである.
ATPの結合と解離およびATPの加水分解と合成の2つの計測において,“つぎの停止角度へ回転した”事例の出現確率(つまり,反応が完了した確率)は拘束時間および拘束角度に依存して増大し,ある一定の値で収束した.この結果は,それぞれの反応が化学平衡へいたるまでの経時変化を表わしており,また,その割合が一定の値に収束することから,ATPの結合と解離およびATPの加水分解と合成がともに可逆的であることが証明された.さらに,この経時変化を速度論的に解析することで,さまざまな拘束角度における反応速度定数および平衡定数を導出することができた.結果をみると,ATP加水分解の方向への反応(ATPの結合およびATPの加水分解)は反時計方向の回転にともない指数関数的に加速し,一方,それらの逆反応(ATPの解離およびATPの合成)は減速していた.また,単位角度あたりの平衡定数の変化率からそれぞれの反応素過程で放出されるエネルギー量を求めたところ,ATPの結合では20 pN nmと大きく回転トルクの50%以上をしめる一方,ATPの加水分解では5 pN nmと小さいことが判明した.筆者らの先行研究では,生成物である無機リン酸の解離で約20 pN nmのエネルギーが放出されることを確認しており6),つまりは,基質の結合と生成物の解離とを主としてF1-ATPaseの回転運動が駆動されていることが確認された.
ATPの解離定数はATP結合の反応角度(0度)では約10-8 Mと非常に小さいことが判明した.ATP合成の際の生体におけるATP濃度(数百μM)を考えると,ATP結合の反応角度では化学平衡はATP結合側に大きくかたよっている.これをATP合成の際の反応スキームに置き換えると,ATP結合の反応角度ではATPは解離できないことがわかった.また,ATPの解離定数が時計方向の回転にともない指数関数的に増大し,化学平衡がATP解離側にかたよることも明らかにされた.つまり,これらの実験結果をふまえると,F1-ATPaseはATPの結合角度から時計方向へ大きく回転した角度で実際にATPを解離するものと考えられた.一方,ATP加水分解の平衡定数はその反応角度(200度)において約1であり,つまりは,ATPの合成はATP加水分解の反応角度とほぼ同じ角度で行われるものと考えられた.これらの情報を統合すると,ATP加水分解の際の反応角度とその逆反応の反応角度とは必ずしも一致しておらず,ATP合成の際の化学-力学共役スキームはATP加水分解の際の共役スキームの裏返しではないことがわかった(図1).
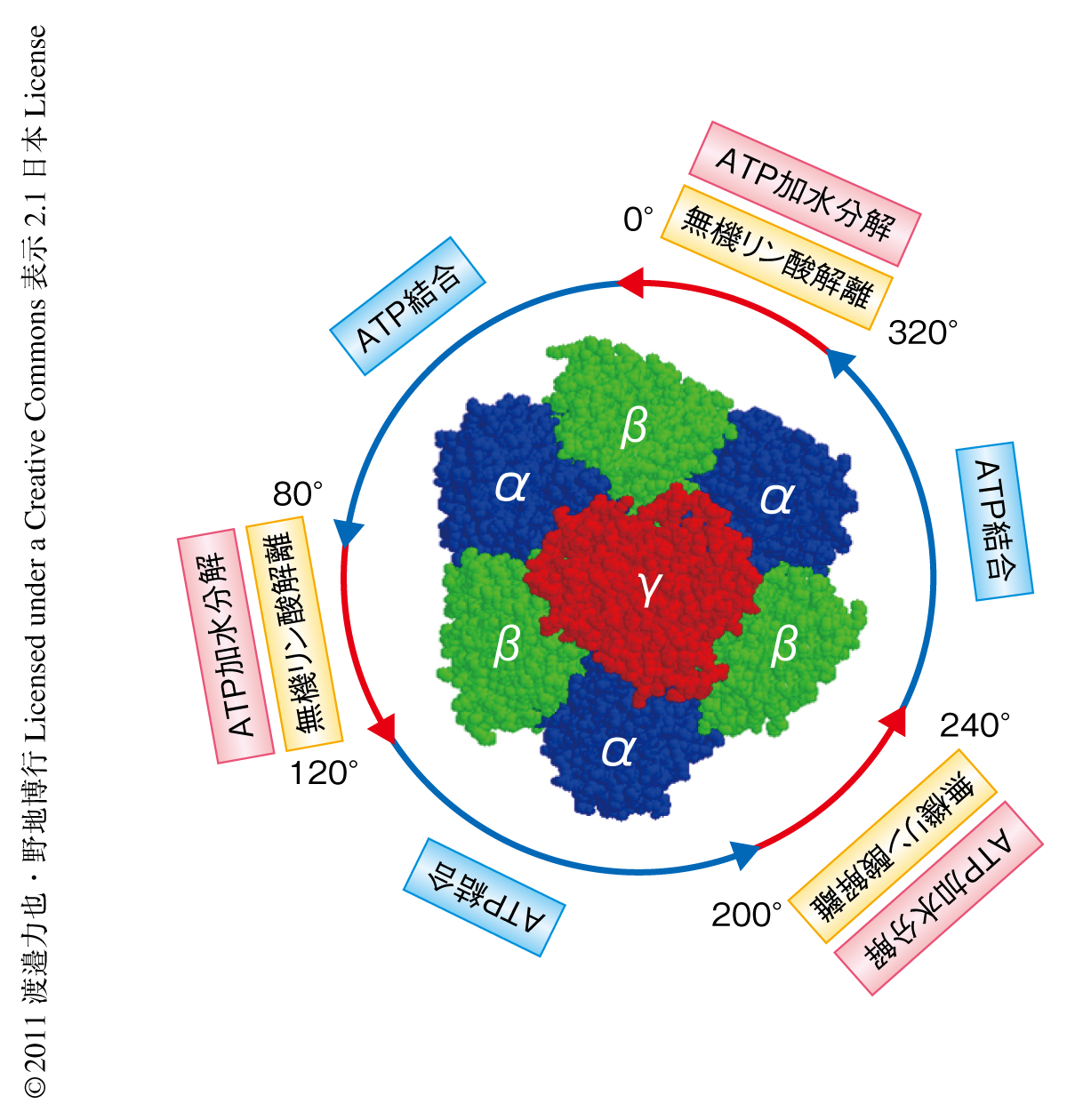
ATPの加水分解を構成する4つの反応素過程のうち,ATPの結合,および,無機リン酸の解離過程で大きな回転トルクの出力されることが明らかになった.また,ATP加水分解の際の化学-力学共役スキームでは,F1-ATPaseを構成する3つの触媒部位はATPの結合と無機リン酸の解離とのタイミングをずらし,一方,無機リン酸の解離とATPの加水分解とのタイミングを合わせていた.つまり,ATPの結合および無機リン酸の解離で得られる大きな回転トルクを特定の回転角度でいちどに出力するのではなく,360度にわたりほぼ一定の回転トルクを出力できるよう大きな回転トルクを生む反応と生まない反応とを組み合わせていることがわかった(図3).これは,ロータリーエンジンがガソリンの燃焼で得られる化学エネルギーを車輪の回転運動に変換する過程において高効率化を実現するために採用している機構と非常に似ており,つまり,F1-ATPaseは化学エネルギーを力学エネルギーに高効率で変換するための合理的なしくみをもちあわせていたのである.
また,反時計方向の回転にともないATPの分解方向の反応速度が加速し,また,その逆方向(時計方向)の回転にともないATPの合成方向の反応速度が加速することが明らかにされた.これは,F1-ATPaseが反時計方向に自律的に回転しているとき,その回転にしたがってATPの分解しやすい環境がじわじわと整っていることを意味し,一方,これを逆説的に考えると,F1-ATPaseの回転子を無理やり逆回転させると力学エネルギーが連続的に注入されて合成反応をしやすい環境が“じわじわ”と整うことを示唆していた.つまり,これらの回転方向に依存した触媒活性の制御により,化学エネルギーと力学エネルギーとの可逆的な変換がF1-ATPaseにおいて実現しているものと考えられた.
筆者らは,従来の1分子観察法では困難であった準安定構造の触媒活性の計測を,1分子操作による分子の応答の計測から可能にした.この研究により得られた新しい情報から,F1-ATPaseが回転の方向に依存して触媒活性を連続的に制御していることが明らかになった.このF1-ATPaseの作動原理は,生体において重要な役割を担う分子モーターがどのように化学エネルギーを利用して効率的に運動するのか,また,どのようにして化学エネルギーを可逆的に力学エネルギーに変換するのか,重要な手がかりをあたえてくれた.今後は,ほかの分子モーターにも同様の作動原理が保存されているのか検証したいと考えている.
略歴:2009年 大阪大学大学院工学研究科博士課程 修了,同年 大阪大学産業科学研究所 博士研究員を経て,2011年より東京大学大学院工学系研究科 助教.
研究テーマ:タンパク質でできた分子モーターの1分子生物物理学.
抱負:自転車で日本一周.
野地 博行(Hiroyuki Noji)
略歴:1997年 東京工業大学大学院総合理工学研究科博士課程 修了,2005年 大阪大学産業科学研究所 教授を経て,2010年より東京大学大学院工学系研究科 教授.
研究テーマ:1分子生物物理学.
抱負:羊蹄山からのスキー滑降.
研究室URL:http://www.nojilab.t.u-tokyo.ac.jp/
© 2011 渡邉力也・野地博行 Licensed under CC 表示 2.1 日本
(東京大学大学院工学系研究科 応用化学専攻)
email:渡邉力也
DOI: 10.7875/first.author.2011.179
Mechanical modulation of catalytic power on F1-ATPase.
Rikiya Watanabe, Daichi Okuno, Shouichi Sakakihara, Katsuya Shimabukuro, Ryota Iino, Masasuke Yoshida, Hiroyuki Noji
Nature Chemical Biology, 8, 86–92 (2012)
要 約
われわれの細胞にはF1-ATPaseとよばれるタンパク質でできた回転分子モーターが存在し,生理的に重要な役割を担っている.F1-ATPaseでは化学反応と力学的な回転運動とが可逆的に共役しており,ATPの加水分解で得られるエネルギーを利用して反時計方向に回転するだけでなく,回転子を逆方向に強制的に回転させるとADPと無機リン酸からATPを合成することが知られている.この回転の方向に依存した可逆的な触媒活性を実現するため,F1-ATPaseは回転の角度に応じて構造を変化させ,反応速度および平衡状態を制御していることが示唆されている.しかし,従来の1分子観察法では,特定の回転角度における反応速度を計測することはできたが,それ以外の回転角度では測定はできなかったため,回転角度と触媒活性との関係を厳密に調べることができなかった.そこで,この研究では,磁気ピンセットによる1分子操作系を利用して,さまざまな回転角度におけるATP加水分解およびATP合成の反応速度定数および平衡定数を計測した.その結果,F1-ATPaseは可逆的な触媒活性の実現のため回転角度に依存して反応速度および化学平衡を合理的に制御していることが明らかになった.また,測定された回転角度と平衡定数の関係からATP加水分解のそれぞれの反応素過程で放出されるエネルギー量を算出したところ,基質の結合過程および生成物の解離過程が突出して大きく,つまりは,それらが主役となり回転運動が駆動されていることが判明した.
はじめに
F1-ATPaseはタンパク質でできた世界最小の回転分子モーターであり,ATPを加水分解することで反時計方向に回転する1).その回転運動の解析から,回転子が1回転するあいだに3分子のATPが加水分解され,40 pN nmの回転トルクを発生することが知られている.これを1回転でのエネルギー収支に置き換えると,放出される運動エネルギー量とATPの加水分解により獲得される化学エネルギー量とはほぼ等価であり,つまり,F1-ATPaseは100%の変換効率で化学エネルギーを力学的な運動に変換しているといえる2).また,F1-ATPaseはATPの加水分解を駆動力として回転するだけでなく,回転子を逆方向へ強制的に回転させるとADPと無機リン酸からATPを合成することが知られており,つまり,F1-ATPaseは化学エネルギーを力学的な運動へと変換する過程において可逆化を実現している3,4)(図1a).これをエンジンなどの熱機関にたとえると,ガソリンを燃焼して車輪を回転させるだけでなく,車輪を回転させることで排気ガスからガソリンを合成していることと同じで,現在の技術では実現することのできないものである.
筆者らは,このすばらしいエネルギー変換機構(高効率かつ可逆)の作動原理を理解するため,まずATPを加水分解しているときの化学反応と力学的な運動との共役スキームを明らかにすることをめざした.近年,回転運動の1分子観察法によりATP加水分解のそれぞれの反応素過程(ATPの結合,ATPの加水分解,生成物であるADPと無機リン酸の解離)はそれぞれ異なる回転角度(反応角度)においてひき起こされることが明らかにされ,つまり,ATP加水分解の際の化学反応と力学的な運動との共役スキームが反応素過程の単位で完成した5-7)(図1a).現在ではつぎの課題として,ATP合成のときの共役スキーム,また,ATPの加水分解と合成との化学平衡の制御機構を解明することが求められている.しかし,従来の1分子観察法では合成反応の反応速度やその平衡定数を計測することは非常にむずかしい.そこで,近年,開発した1分子操作ののちの分子の応答から触媒反応の進行のようすを明らかにする実験系を利用し8),さまざまな回転角度におけるATPの結合と解離およびATPの加水分解と合成の反応速度定数と平衡定数を網羅的に計測することで,ATP合成の際の共役スキームや回転角度に依存した化学平衡の制御機構の解明を試みた.
1.磁気ピンセットを利用したF1-ATPase -ATPaseの1分子操作
F1-ATPaseは化学反応と回転運動とが強固に共役しているため,溶液のATPの濃度を減らすとATP結合の反応中間体に起因した長時間の停止が観察され,また,ATPの加水分解が著しく遅い変異体を利用するとATP加水分解の反応中間体に起因した長時間の停止をともない回転するようすが観察される2,9).従来の1分子観察法では,この停止角度および停止時間の解析によりATP加水分解のそれぞれの反応素過程における反応角度および反応速度を同定してきた.しかし,この方法では停止角度の近傍(つまり,触媒部位が安定構造をとる回転角度)での反応速度を計測することはできたが,停止角度から大きく離れた回転角度(つまり,触媒部位が準安定構造をとる回転角度)での測定はできなかった.そこで,1分子操作ののちの分子の応答から触媒反応の進行のようすを明らかにする実験系を利用し,さまざまな回転角度における反応速度および平衡定数を計測した.具体的には,ATPの結合およびATPの加水分解の反応中間体に起因する長時間の停止中に,磁気ピンセットを利用してF1-ATPaseの回転子を任意の角度に強制的に拘束した.そして,拘束から解放した直後の挙動から,特定の触媒部位におけるATPの結合およびATPの加水分解の進行状況を識別した.拘束からの解放の直後に観察された挙動は,つぎの停止角度へ回転する(つまり,反応が完了する),あるいは,拘束前の停止角度へ戻る(つまり,反応が完了しない)の2つであった.
化学反応と回転運動との強固な共役関係から,“つぎの停止角度へ回転する”挙動は拘束からの解放の直前に反応が完了していたことを意味し,一方,“拘束前の停止角度へ戻る”挙動は反応が未完了であったことを意味していた(図2).つまりは,磁気ピンセットによる拘束から解放した直後のF1-ATPaseの挙動を観察し,2つの挙動の出現確率から反応の進行状況に関する情報を獲得することができたのである.
2.反応速度定数および平衡定数の測定
ATPの結合と解離およびATPの加水分解と合成の2つの計測において,“つぎの停止角度へ回転した”事例の出現確率(つまり,反応が完了した確率)は拘束時間および拘束角度に依存して増大し,ある一定の値で収束した.この結果は,それぞれの反応が化学平衡へいたるまでの経時変化を表わしており,また,その割合が一定の値に収束することから,ATPの結合と解離およびATPの加水分解と合成がともに可逆的であることが証明された.さらに,この経時変化を速度論的に解析することで,さまざまな拘束角度における反応速度定数および平衡定数を導出することができた.結果をみると,ATP加水分解の方向への反応(ATPの結合およびATPの加水分解)は反時計方向の回転にともない指数関数的に加速し,一方,それらの逆反応(ATPの解離およびATPの合成)は減速していた.また,単位角度あたりの平衡定数の変化率からそれぞれの反応素過程で放出されるエネルギー量を求めたところ,ATPの結合では20 pN nmと大きく回転トルクの50%以上をしめる一方,ATPの加水分解では5 pN nmと小さいことが判明した.筆者らの先行研究では,生成物である無機リン酸の解離で約20 pN nmのエネルギーが放出されることを確認しており6),つまりは,基質の結合と生成物の解離とを主としてF1-ATPaseの回転運動が駆動されていることが確認された.
3.ATP合成の際の反応スキーム
ATPの解離定数はATP結合の反応角度(0度)では約10-8 Mと非常に小さいことが判明した.ATP合成の際の生体におけるATP濃度(数百μM)を考えると,ATP結合の反応角度では化学平衡はATP結合側に大きくかたよっている.これをATP合成の際の反応スキームに置き換えると,ATP結合の反応角度ではATPは解離できないことがわかった.また,ATPの解離定数が時計方向の回転にともない指数関数的に増大し,化学平衡がATP解離側にかたよることも明らかにされた.つまり,これらの実験結果をふまえると,F1-ATPaseはATPの結合角度から時計方向へ大きく回転した角度で実際にATPを解離するものと考えられた.一方,ATP加水分解の平衡定数はその反応角度(200度)において約1であり,つまりは,ATPの合成はATP加水分解の反応角度とほぼ同じ角度で行われるものと考えられた.これらの情報を統合すると,ATP加水分解の際の反応角度とその逆反応の反応角度とは必ずしも一致しておらず,ATP合成の際の化学-力学共役スキームはATP加水分解の際の共役スキームの裏返しではないことがわかった(図1).
4.回転の角度に依存した触媒活性の制御
ATPの加水分解を構成する4つの反応素過程のうち,ATPの結合,および,無機リン酸の解離過程で大きな回転トルクの出力されることが明らかになった.また,ATP加水分解の際の化学-力学共役スキームでは,F1-ATPaseを構成する3つの触媒部位はATPの結合と無機リン酸の解離とのタイミングをずらし,一方,無機リン酸の解離とATPの加水分解とのタイミングを合わせていた.つまり,ATPの結合および無機リン酸の解離で得られる大きな回転トルクを特定の回転角度でいちどに出力するのではなく,360度にわたりほぼ一定の回転トルクを出力できるよう大きな回転トルクを生む反応と生まない反応とを組み合わせていることがわかった(図3).これは,ロータリーエンジンがガソリンの燃焼で得られる化学エネルギーを車輪の回転運動に変換する過程において高効率化を実現するために採用している機構と非常に似ており,つまり,F1-ATPaseは化学エネルギーを力学エネルギーに高効率で変換するための合理的なしくみをもちあわせていたのである.
また,反時計方向の回転にともないATPの分解方向の反応速度が加速し,また,その逆方向(時計方向)の回転にともないATPの合成方向の反応速度が加速することが明らかにされた.これは,F1-ATPaseが反時計方向に自律的に回転しているとき,その回転にしたがってATPの分解しやすい環境がじわじわと整っていることを意味し,一方,これを逆説的に考えると,F1-ATPaseの回転子を無理やり逆回転させると力学エネルギーが連続的に注入されて合成反応をしやすい環境が“じわじわ”と整うことを示唆していた.つまり,これらの回転方向に依存した触媒活性の制御により,化学エネルギーと力学エネルギーとの可逆的な変換がF1-ATPaseにおいて実現しているものと考えられた.
おわりに
筆者らは,従来の1分子観察法では困難であった準安定構造の触媒活性の計測を,1分子操作による分子の応答の計測から可能にした.この研究により得られた新しい情報から,F1-ATPaseが回転の方向に依存して触媒活性を連続的に制御していることが明らかになった.このF1-ATPaseの作動原理は,生体において重要な役割を担う分子モーターがどのように化学エネルギーを利用して効率的に運動するのか,また,どのようにして化学エネルギーを可逆的に力学エネルギーに変換するのか,重要な手がかりをあたえてくれた.今後は,ほかの分子モーターにも同様の作動原理が保存されているのか検証したいと考えている.
文 献
- Noji, H., Yasuda, R., Yoshida, M. et al.: Direct observation of the rotation of F1-ATPase. Nature, 386, 299-302 (1997)[PubMed]
- Yasuda, R., Noji, H., Kinosita, K. Jr. et al.: F1-ATPase is a highly efficient molecular motor that rotates with discrete 120°steps. Cell, 93, 1117-1124 (1998)[PubMed]
- Itoh, H., Takahashi, A., Adachi, K. et al.: Mechanically driven ATP synthesis by F1-ATPase. Nature, 427, 465-468 (2004)[PubMed]
- Rondelez, Y., Tresset, G., Nakashima, T. et al.: Highly coupled ATP synthesis by F1-ATPase single molecules. Nature, 433, 773-777 (2005)[PubMed]
- Ariga, T., Muneyuki, E. & Yoshida, M.: F1-ATPase rotates by an asymmetric, sequential mechanism using all three catalytic subunits. Nat. Struct. Mol. Biol., 14, 841-846 (2007)[PubMed]
- Watanabe, R., Iino, R. & Noji, H.: Phosphate release in F1-ATPase catalytic cycle follows ADP release. Nat. Chem. Biol., 6, 814-820 (2010)[PubMed] [新着論文レビュー]
- Adachi, K., Oiwa, K., Nishizaka, T. et al.: Coupling of rotation and catalysis in F1-ATPase revealed by single-molecule imaging and manipulation. Cell, 130, 309-321 (2007)[PubMed]
- Hirono-Hara, Y., Ishizuka, K., Kinosita, K. Jr. et al.: Activation of pausing F1 motor by external force. Proc. Natl. Acad. Sci. USA, 102, 4288-4293 (2005)[PubMed]
- Shimabukuro, K., Yasuda, R., Muneyuki, E. et al.: Catalysis and rotation of F1 motor: cleavage of ATP at the catalytic site occurs in 1 ms before 40°substep rotation. Proc. Natl. Acad. Sci. USA, 100, 14731-14736 (2003)[PubMed]
著者プロフィール
略歴:2009年 大阪大学大学院工学研究科博士課程 修了,同年 大阪大学産業科学研究所 博士研究員を経て,2011年より東京大学大学院工学系研究科 助教.
研究テーマ:タンパク質でできた分子モーターの1分子生物物理学.
抱負:自転車で日本一周.
野地 博行(Hiroyuki Noji)
略歴:1997年 東京工業大学大学院総合理工学研究科博士課程 修了,2005年 大阪大学産業科学研究所 教授を経て,2010年より東京大学大学院工学系研究科 教授.
研究テーマ:1分子生物物理学.
抱負:羊蹄山からのスキー滑降.
研究室URL:http://www.nojilab.t.u-tokyo.ac.jp/
© 2011 渡邉力也・野地博行 Licensed under CC 表示 2.1 日本