1分子操作技術に立脚した回転モータータンパク質F1-ATPaseの化学-力学共役機構の解明
渡邉力也1・野地博行2
(1大阪大学産業科学研究所 生体分子エナジェティクス研究分野,2東京大学大学院工学系研究科 応用化学専攻)
email:渡邉力也
DOI: 10.7875/first.author.2010.042
Phosphate release in F1-ATPase catalytic cycle follows ADP release.
Rikiya Watanabe, Ryota Iino, Hiroyuki Noji
Nature Chemical Biology, 6, 814-820 (2010)
われわれの細胞のなかにはF1-ATPaseとよばれるタンパク質でできた分子モーターが存在する.このF1-ATPaseは化学反応と力学的な回転運動とが可逆的に共役するという稀少な性質をもっており,ATPの加水分解で得られるエネルギーを利用し反時計方向に自律的に回転するだけでなく,外から力をくわえてモーターの回転子を時計方向に強制回転させるとADPと無機リン酸からATPを合成することが知られている.この稀少な性質とATP合成反応の大半を生体で担っていることから,長年にわたりF1-ATPaseの化学-力学共役関係は反応素過程レベルの高い分解能で解明されてきたが,そのうちの無機リン酸の解離過程の共役関係だけがなお不明であった.そこで,この研究において筆者らは,1分子操作技術に立脚した実験系をデザインし無機リン酸の解離過程の共役関係を明らかにした.さらに,この無機リン酸の解離機構が生体でのATP合成反応において重要な役割をはたしていることをつきとめた.
われわれの細胞のなかにはロータリーエンジンのような回転モーターが存在する.そのなかでも筆者らが研究対象としてきたのは,F1-ATPaseとよばれるタンパク質でできた分子モーターである1,2).このF1-ATPaseはATPの加水分解で得られるエネルギーを利用して反時計方向に自律的に回転するだけでなく,外から力をくわえて回転子を時計方向に強制回転させるとADPと無機リン酸からATPを合成することが知られている3,4).つまり,F1-ATPaseは化学反応と力学的な運動とが共役しているだけでなく,その共役関係が可逆的であるという稀少なタンパク質なのである.この化学-力学共役関係を解明すべく,長年にわたり1分子計測技術に立脚した研究が行われてきた.F1-ATPaseは化学反応と力学的な運動とが共役しているので,1分子単位でその運動を観察することにより触媒部位での化学状態を間接的に検出することが可能である.たとえば,基質であるATPの濃度を下げるとF1-ATPaseはATPの結合待ちに起因する停止をともないながら回転するようになる5).この停止は化学反応における反応中間体の存在を意味しており,つまりは,停止角度や停止時間を解析することにより化学反応の反応角度や反応時間を知ることが可能なのである.
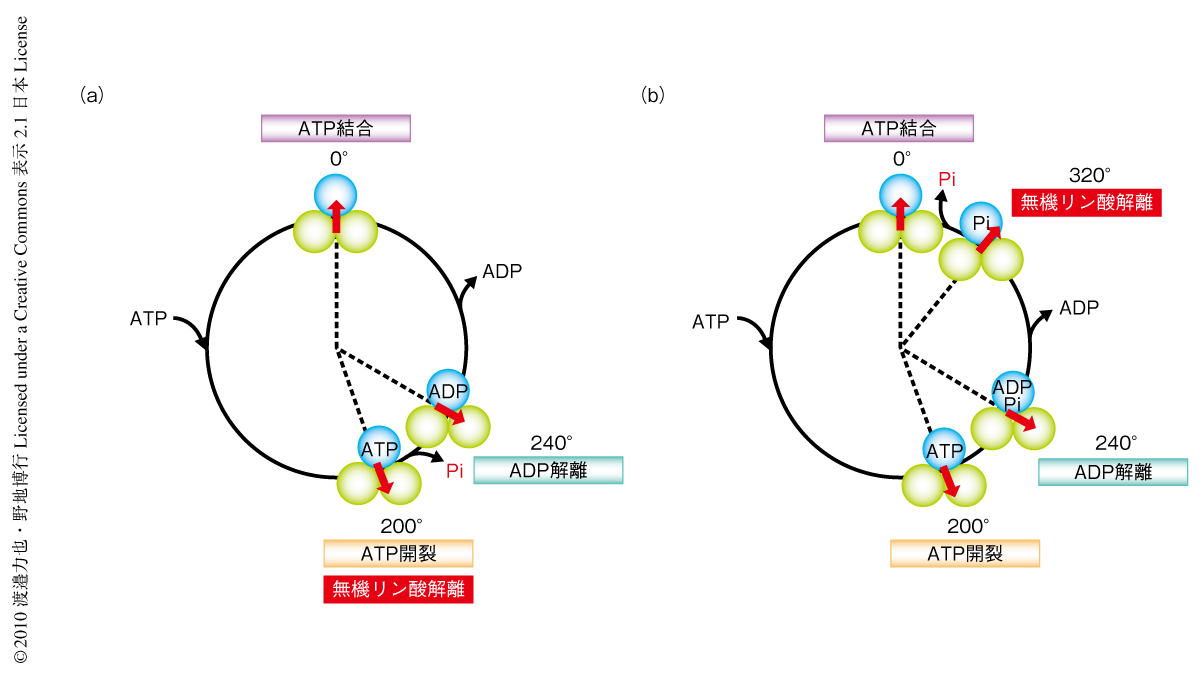
ATPの加水分解反応は,ATPの結合,ATPの開裂,そして,生成物であるADPの解離,無機リン酸の解離,の4つの反応素過程から構成される.現在までに,ATPの結合,ATPの開裂,生成物であるADPの解離について,それらの反応角度が明らかにされた.一方,無機リン酸の解離の反応角度は,ATP開裂の反応角度,もしくは,ATP開裂の角度から120度回転した角度(つまり,ADP解離の角度から80度回転した角度)のいずれかであると示唆されているが(図1),いまだに決定打に欠け一義的に確定していなかった6-11).これは,ATPの加水分解を駆動力とするほかの分子モーターにも共通する問題点である.この原因として,無機リン酸の解離速度が非常に高速(毎秒1000回)であること,また,無機リン酸を1分子単位で検出することが困難であることなど,時間分解能と空間分解能とともに既存の1分子計測技術の限界をこえていたことがあげられる.そこで,この研究において筆者らは,1分子計測技術だけでなく1分子単位での操作技術に立脚した実験をデザインし,無機リン酸の解離の反応角度を同定しようと試みた.
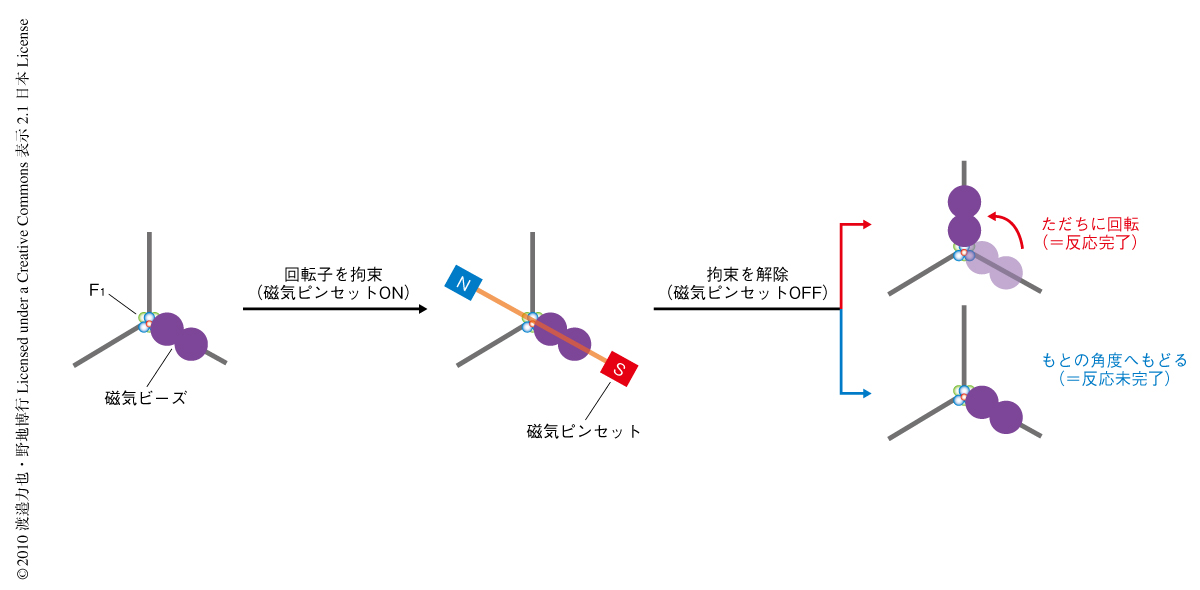
F1-ATPaseは直径約10 nmの非常に小さな回転モーターであり,その回転のようすを1分子単位で直接に観察することは非常に困難である12).そこで,直径約200 nmの大きな磁気ビーズを回転プローブとして回転子の頂点に結合させ,そのプローブの動きから間接的にF1-ATPaseの回転運動を検出した.また,この研究では,1分子操作技術を利用して化学平衡を計測する実験系を構築した.これは磁気ピンセットとF1-ATPaseの回転子に結合した磁気ビーズとの組合せから構成される13).磁気ピンセットは任意の方向に磁場を発生させる装置で,磁気ビーズは発生した磁場の方向に配向する性質をもつ操作用のプローブである.F1-ATPaseの回転子は磁気ビーズに結合しているので,磁気ピンセットによって磁場を発生させると,回転子も磁気ビーズに追随して任意の方向に配向しその方向に拘束される.
では,この1分子操作技術を利用してどのように化学平衡を計測したのだろうか? 化学平衡を計測するうえでの既存の問題点として,化学反応と力学的な運動とが共役している分子モーターすべてに共通することであるが,いったん化学反応が完了するとただちに化学エネルギーは力学エネルギーに変換されて分子モーターは運動し,この運動によって化学反応は実質的に不可逆になることがあげられる.つまり,受動的に運動を観察するだけでは化学平衡を計測することは困難なのである.そこで,化学反応の反応中間体に起因する停止状態の回転子を化学反応が完了しても回転できないよう拘束することで逆反応を顕在化させ,さらには,化学平衡の計測を可能にした.
以下に,具体的な化学平衡の計測手法を示す.F1-ATPaseに特徴的な化学-力学共役機構をかんがみ,回転子を拘束したあとの回転運動を解析することで化学平衡の計測をした.磁気ピンセットによる拘束から解放した直後,F1-ATPaseはつぎの2つの挙動を示した(図2).1)ただちにつぎの停止角度まで回転する(つまり,化学反応が完了).2)拘束前の停止角度にもどる(つまり,化学反応が未完了).F1-ATPaseは化学反応と回転運動とが共役しているため,“ただちにつぎの停止角度まで回転した”挙動は,拘束中に化学反応が完了しつぎの停止角度まで回転するのに必要なトルクの発生していたことを意味する.また一方,“拘束前の停止角度へもどる”挙動は,拘束中に化学反応が完了しなかったことを意味する.つまりは,磁気ピンセットによる拘束から解放した直後のF1-ATPaseの挙動を観察し,さらに,この2つの挙動の出現確率から化学平衡を計測することが可能なのである.
さきに述べたとおり,無機リン酸の解離速度は非常に速く物理的な停止としての反応中間体を直接に検出するのは困難である.そこで,ATP開裂/合成の化学平衡の経時変化から無機リン酸の解離速度を導出することにした.そのしくみは,ATP開裂/合成が平衡状態にある触媒部位からいったん生成物である無機リン酸が解離した場合,溶液中に過剰の無機リン酸が存在しないかぎり二度と無機リン酸とは結合することができず,ATPをふたたび合成することができなくなり,つまりは,無機リン酸の解離にともない化学平衡がATP開裂側に偏ることが期待される.そして,ATP開裂/合成の化学平衡の経時変化から無機リン酸の解離速度を導出する,という算段である.ATP開裂の反応中間体に着目し,さきの1分子操作技術を用いてATP開裂の反応角度におけるATP開裂/合成の化学平衡の経時変化を計測した.その結果,無機リン酸の解離にともなった化学平衡の経時変化を確認でき,ATP開裂の反応角度における無機リン酸の解離速度は毎秒0.021回と非常に遅いことが判明した.この反応速度は自由回転におけるリン酸の解離速度と比較すると極端に遅いことから,ATP開裂直後に無機リン酸は解離しない,つまりは,無機リン酸はADPの解離のあと80度回転した角度で解離することが判明した.
この研究によって完成したF1-ATPaseの化学-力学共役機構のモデル図を示す(図1b).生成物である無機リン酸の解離のタイミングが明らかにされたのであるが,驚くべきことに,そのタイミングは同じ生成物であるADPの解離よりもあとであった.ちなみに,ほかのATP加水分解を駆動力とする分子モーターにおいては,無機リン酸はADPよりもさきに触媒部位から解離するものと考えられている14).
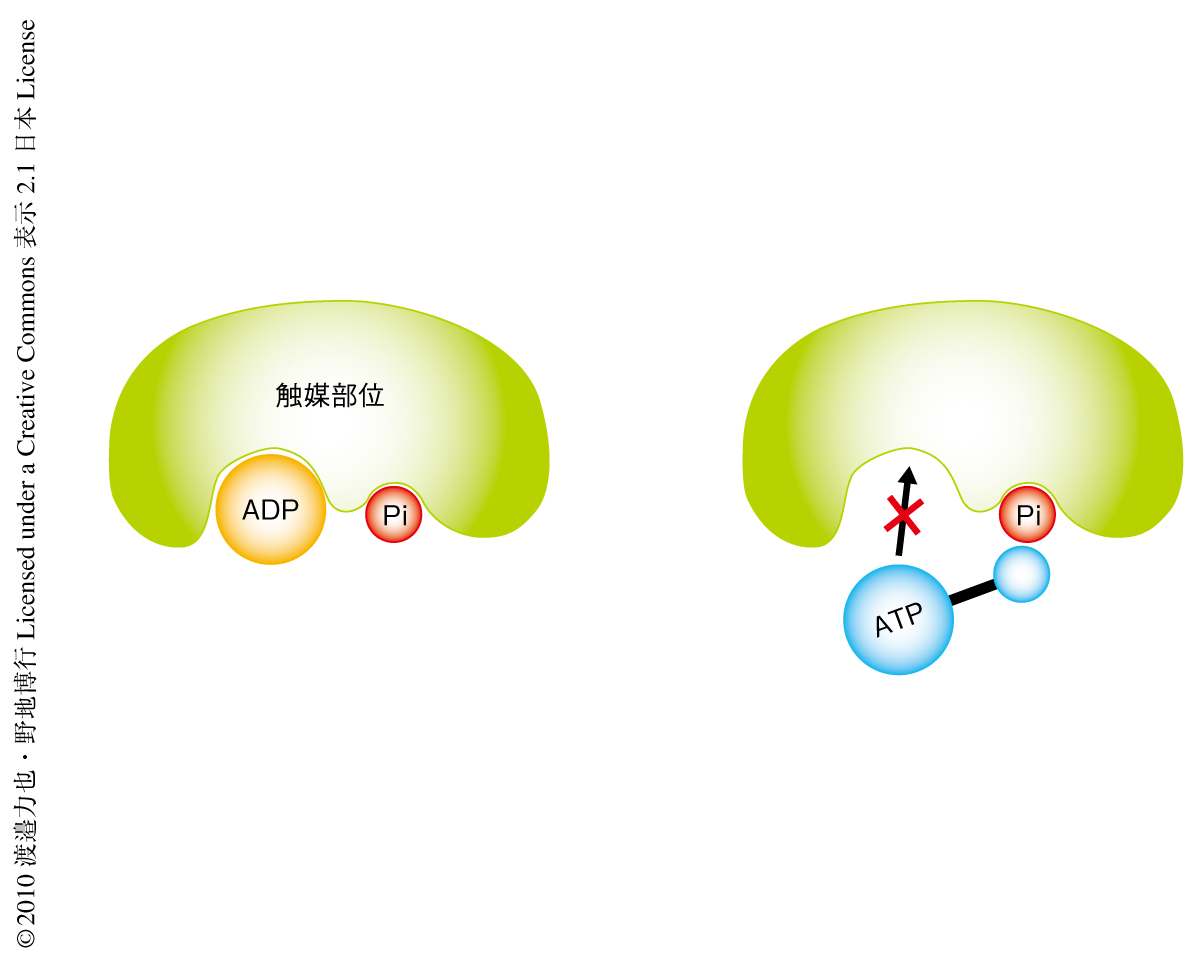
では,この無機リン酸の解離のタイミングの違いに起因するF1-ATPase固有の機能は何であろうか? さきに述べたとおり,F1-ATPaseはほかの分子モーターと異なりATPの加水分解と力学的な回転運動とが可逆的に共役している3,4,15,16).事実,F1-ATPaseは生体でFoモーターとよばれる分子モーターによって外力が印加され,消費されるATPの大半を合成している.生体におけるATP濃度はADP濃度よりも10倍以上も高いとされ,ATPを合成するのであれば10倍も濃度の高いATPのなかからADPを基質として選択的に結合するしくみが必要になる.ここで,無機リン酸の解離のタイミングをもういちど考えてみよう.F1-ATPaseがATPの加水分解反応によって自律的な回転を行っているとき,生成物である無機リン酸はADPよりもあとに触媒部位から解離することが明らかにされた.これを逆説的に考えると,ATP合成の際に基質である無機リン酸はもう一方の基質であるADPよりもさきに触媒部位へ結合することを意味する.無機リン酸の結合部位とATPのγリン酸の結合部位とは一致しており,無機リン酸が触媒部位に結合することでATPの結合が物理的に阻害されることが予想される.また,生体内でのATPの濃度よりも無機リン酸の濃度のほうが高いため,必然的に,触媒部位への親和性はATPよりも無機リン酸のほうが高いことがわかる.つまり,これらの情報を総合すると,生体内では無機リン酸の優先的な触媒部位への結合によって,もう一方の基質であるADPの選択的な結合が誘起されているのである(図3).また,この特異的な無機リン酸の解離機構により,F1-ATPaseにおいて効率的なATP合成反応が排他的に成立しているものと考えられる.
筆者らは,1分子単位での操作技術を利用することで無機リン酸の解離過程における化学-力学共役機構を解明し,さらに,この無機リン酸の解離機構がATPの合成反応を効率的に遂行するうえで重要な役割をはたしていることを示した.今後,受動的な観察だけでは検出の困難な酵素反応を検出する際に1分子操作技術を応用した成功例として,この実験手法がほかのタンパク質にも適応されることが期待される.
略歴:2009年 大阪大学大学院工学研究科博士課程 修了,同年より同 産業科学研究所 博士研究員.
研究テーマ:タンパク質でできた分子モーターの1分子生物物理学.
抱負:自転車で日本一周.
野地 博行(Hiroyuki Noji)
略歴:1997年 東京工業大学大学院総合理工学研究科博士課程 修了,2005年 大阪大学産業科学研究所 教授を経て,2010年より東京大学大学院工学系研究科 教授.
研究テーマ:1分子生物物理学.
抱負:羊蹄山からのスキー滑降.
研究室URL:http://www.sanken.osaka-u.ac.jp/labs/smbio/sanken/
© 2010 渡邉力也・野地博行 Licensed under CC 表示 2.1 日本
(1大阪大学産業科学研究所 生体分子エナジェティクス研究分野,2東京大学大学院工学系研究科 応用化学専攻)
email:渡邉力也
DOI: 10.7875/first.author.2010.042
Phosphate release in F1-ATPase catalytic cycle follows ADP release.
Rikiya Watanabe, Ryota Iino, Hiroyuki Noji
Nature Chemical Biology, 6, 814-820 (2010)
要 約
われわれの細胞のなかにはF1-ATPaseとよばれるタンパク質でできた分子モーターが存在する.このF1-ATPaseは化学反応と力学的な回転運動とが可逆的に共役するという稀少な性質をもっており,ATPの加水分解で得られるエネルギーを利用し反時計方向に自律的に回転するだけでなく,外から力をくわえてモーターの回転子を時計方向に強制回転させるとADPと無機リン酸からATPを合成することが知られている.この稀少な性質とATP合成反応の大半を生体で担っていることから,長年にわたりF1-ATPaseの化学-力学共役関係は反応素過程レベルの高い分解能で解明されてきたが,そのうちの無機リン酸の解離過程の共役関係だけがなお不明であった.そこで,この研究において筆者らは,1分子操作技術に立脚した実験系をデザインし無機リン酸の解離過程の共役関係を明らかにした.さらに,この無機リン酸の解離機構が生体でのATP合成反応において重要な役割をはたしていることをつきとめた.
はじめに
われわれの細胞のなかにはロータリーエンジンのような回転モーターが存在する.そのなかでも筆者らが研究対象としてきたのは,F1-ATPaseとよばれるタンパク質でできた分子モーターである1,2).このF1-ATPaseはATPの加水分解で得られるエネルギーを利用して反時計方向に自律的に回転するだけでなく,外から力をくわえて回転子を時計方向に強制回転させるとADPと無機リン酸からATPを合成することが知られている3,4).つまり,F1-ATPaseは化学反応と力学的な運動とが共役しているだけでなく,その共役関係が可逆的であるという稀少なタンパク質なのである.この化学-力学共役関係を解明すべく,長年にわたり1分子計測技術に立脚した研究が行われてきた.F1-ATPaseは化学反応と力学的な運動とが共役しているので,1分子単位でその運動を観察することにより触媒部位での化学状態を間接的に検出することが可能である.たとえば,基質であるATPの濃度を下げるとF1-ATPaseはATPの結合待ちに起因する停止をともないながら回転するようになる5).この停止は化学反応における反応中間体の存在を意味しており,つまりは,停止角度や停止時間を解析することにより化学反応の反応角度や反応時間を知ることが可能なのである.
ATPの加水分解反応は,ATPの結合,ATPの開裂,そして,生成物であるADPの解離,無機リン酸の解離,の4つの反応素過程から構成される.現在までに,ATPの結合,ATPの開裂,生成物であるADPの解離について,それらの反応角度が明らかにされた.一方,無機リン酸の解離の反応角度は,ATP開裂の反応角度,もしくは,ATP開裂の角度から120度回転した角度(つまり,ADP解離の角度から80度回転した角度)のいずれかであると示唆されているが(図1),いまだに決定打に欠け一義的に確定していなかった6-11).これは,ATPの加水分解を駆動力とするほかの分子モーターにも共通する問題点である.この原因として,無機リン酸の解離速度が非常に高速(毎秒1000回)であること,また,無機リン酸を1分子単位で検出することが困難であることなど,時間分解能と空間分解能とともに既存の1分子計測技術の限界をこえていたことがあげられる.そこで,この研究において筆者らは,1分子計測技術だけでなく1分子単位での操作技術に立脚した実験をデザインし,無機リン酸の解離の反応角度を同定しようと試みた.
1.F1-ATPaseの1分子計測と1分子操作の技術
F1-ATPaseは直径約10 nmの非常に小さな回転モーターであり,その回転のようすを1分子単位で直接に観察することは非常に困難である12).そこで,直径約200 nmの大きな磁気ビーズを回転プローブとして回転子の頂点に結合させ,そのプローブの動きから間接的にF1-ATPaseの回転運動を検出した.また,この研究では,1分子操作技術を利用して化学平衡を計測する実験系を構築した.これは磁気ピンセットとF1-ATPaseの回転子に結合した磁気ビーズとの組合せから構成される13).磁気ピンセットは任意の方向に磁場を発生させる装置で,磁気ビーズは発生した磁場の方向に配向する性質をもつ操作用のプローブである.F1-ATPaseの回転子は磁気ビーズに結合しているので,磁気ピンセットによって磁場を発生させると,回転子も磁気ビーズに追随して任意の方向に配向しその方向に拘束される.
では,この1分子操作技術を利用してどのように化学平衡を計測したのだろうか? 化学平衡を計測するうえでの既存の問題点として,化学反応と力学的な運動とが共役している分子モーターすべてに共通することであるが,いったん化学反応が完了するとただちに化学エネルギーは力学エネルギーに変換されて分子モーターは運動し,この運動によって化学反応は実質的に不可逆になることがあげられる.つまり,受動的に運動を観察するだけでは化学平衡を計測することは困難なのである.そこで,化学反応の反応中間体に起因する停止状態の回転子を化学反応が完了しても回転できないよう拘束することで逆反応を顕在化させ,さらには,化学平衡の計測を可能にした.
以下に,具体的な化学平衡の計測手法を示す.F1-ATPaseに特徴的な化学-力学共役機構をかんがみ,回転子を拘束したあとの回転運動を解析することで化学平衡の計測をした.磁気ピンセットによる拘束から解放した直後,F1-ATPaseはつぎの2つの挙動を示した(図2).1)ただちにつぎの停止角度まで回転する(つまり,化学反応が完了).2)拘束前の停止角度にもどる(つまり,化学反応が未完了).F1-ATPaseは化学反応と回転運動とが共役しているため,“ただちにつぎの停止角度まで回転した”挙動は,拘束中に化学反応が完了しつぎの停止角度まで回転するのに必要なトルクの発生していたことを意味する.また一方,“拘束前の停止角度へもどる”挙動は,拘束中に化学反応が完了しなかったことを意味する.つまりは,磁気ピンセットによる拘束から解放した直後のF1-ATPaseの挙動を観察し,さらに,この2つの挙動の出現確率から化学平衡を計測することが可能なのである.
2.無機リン酸の解離速度の測定
さきに述べたとおり,無機リン酸の解離速度は非常に速く物理的な停止としての反応中間体を直接に検出するのは困難である.そこで,ATP開裂/合成の化学平衡の経時変化から無機リン酸の解離速度を導出することにした.そのしくみは,ATP開裂/合成が平衡状態にある触媒部位からいったん生成物である無機リン酸が解離した場合,溶液中に過剰の無機リン酸が存在しないかぎり二度と無機リン酸とは結合することができず,ATPをふたたび合成することができなくなり,つまりは,無機リン酸の解離にともない化学平衡がATP開裂側に偏ることが期待される.そして,ATP開裂/合成の化学平衡の経時変化から無機リン酸の解離速度を導出する,という算段である.ATP開裂の反応中間体に着目し,さきの1分子操作技術を用いてATP開裂の反応角度におけるATP開裂/合成の化学平衡の経時変化を計測した.その結果,無機リン酸の解離にともなった化学平衡の経時変化を確認でき,ATP開裂の反応角度における無機リン酸の解離速度は毎秒0.021回と非常に遅いことが判明した.この反応速度は自由回転におけるリン酸の解離速度と比較すると極端に遅いことから,ATP開裂直後に無機リン酸は解離しない,つまりは,無機リン酸はADPの解離のあと80度回転した角度で解離することが判明した.
3.F1-ATPaseの化学-力学共役モデル
この研究によって完成したF1-ATPaseの化学-力学共役機構のモデル図を示す(図1b).生成物である無機リン酸の解離のタイミングが明らかにされたのであるが,驚くべきことに,そのタイミングは同じ生成物であるADPの解離よりもあとであった.ちなみに,ほかのATP加水分解を駆動力とする分子モーターにおいては,無機リン酸はADPよりもさきに触媒部位から解離するものと考えられている14).
では,この無機リン酸の解離のタイミングの違いに起因するF1-ATPase固有の機能は何であろうか? さきに述べたとおり,F1-ATPaseはほかの分子モーターと異なりATPの加水分解と力学的な回転運動とが可逆的に共役している3,4,15,16).事実,F1-ATPaseは生体でFoモーターとよばれる分子モーターによって外力が印加され,消費されるATPの大半を合成している.生体におけるATP濃度はADP濃度よりも10倍以上も高いとされ,ATPを合成するのであれば10倍も濃度の高いATPのなかからADPを基質として選択的に結合するしくみが必要になる.ここで,無機リン酸の解離のタイミングをもういちど考えてみよう.F1-ATPaseがATPの加水分解反応によって自律的な回転を行っているとき,生成物である無機リン酸はADPよりもあとに触媒部位から解離することが明らかにされた.これを逆説的に考えると,ATP合成の際に基質である無機リン酸はもう一方の基質であるADPよりもさきに触媒部位へ結合することを意味する.無機リン酸の結合部位とATPのγリン酸の結合部位とは一致しており,無機リン酸が触媒部位に結合することでATPの結合が物理的に阻害されることが予想される.また,生体内でのATPの濃度よりも無機リン酸の濃度のほうが高いため,必然的に,触媒部位への親和性はATPよりも無機リン酸のほうが高いことがわかる.つまり,これらの情報を総合すると,生体内では無機リン酸の優先的な触媒部位への結合によって,もう一方の基質であるADPの選択的な結合が誘起されているのである(図3).また,この特異的な無機リン酸の解離機構により,F1-ATPaseにおいて効率的なATP合成反応が排他的に成立しているものと考えられる.
おわりに
筆者らは,1分子単位での操作技術を利用することで無機リン酸の解離過程における化学-力学共役機構を解明し,さらに,この無機リン酸の解離機構がATPの合成反応を効率的に遂行するうえで重要な役割をはたしていることを示した.今後,受動的な観察だけでは検出の困難な酵素反応を検出する際に1分子操作技術を応用した成功例として,この実験手法がほかのタンパク質にも適応されることが期待される.
文 献
- Yoshida, M., Muneyuki, E. & Hisabori, T.: ATP synthase -a marvellous rotary engine of the cell. Nat. Rev. Mol. Cell Biol., 2, 669-677 (2001)[PubMed]
- Noji, H., Yasuda, R., Yoshida, M. et al.: Direct observation of the rotation of F1-ATPase. Nature, 386, 299-302 (1997)[PubMed]
- Rondelez, Y., Tresset, G., Nakashima, T. et al.: Highly coupled ATP synthesis by F1-ATPase single molecules. Nature, 433, 773-777 (2005)[PubMed]
- Itoh, H., Takahashi, A., Adachi, K. et al.: Mechanically driven ATP synthesis by F1-ATPase. Nature, 427, 465-468 (2004)[PubMed]
- Yasuda, R., Noji, H., Kinosita, K. Jr. et al.: F1-ATPase is a highly efficient molecular motor that rotates with discrete 120 degree steps. Cell, 93, 1117-1124 (1998)[PubMed]
- Nishizaka, T., Oiwa, K., Noji, H. et al.: Chemomechanical coupling in F1-ATPase revealed by simultaneous observation of nucleotide kinetics and rotation. Nat. Struct. Mol. Biol., 11, 142-148 (2004)[PubMed]
- Adachi, K., Oiwa, K., Nishizaka, T. et al.: Coupling of rotation and catalysis in F1-ATPase revealed by single-molecule imaging and manipulation. Cell, 130, 309-321 (2007)[PubMed]
- Shimabukuro, K., Yasuda, R., Muneyuki, E. et al.: Catalysis and rotation of F1 motor: cleavage of ATP at the catalytic site occurs in 1 ms before 40 degree substep rotation. Proc. Natl. Acad. Sci. USA, 100, 14731-14736 (2003)[PubMed]
- Ariga, T., Muneyuki, E. & Yoshida, M.: F1-ATPase rotates by an asymmetric, sequential mechanism using all three catalytic subunits. Nat. Struct. Mol. Biol., 14, 841-846 (2007)[PubMed]
- Yasuda, R., Noji, H., Yoshida, M. et al.: Resolution of distinct rotational substeps by submillisecond kinetic analysis of F1-ATPase. Nature, 410, 898-904 (2001)[PubMed]
- Watanabe, R., Iino, R., Shimabukuro, K. et al.: Temperature-sensitive reaction intermediate of F1-ATPase. EMBO Rep., 9, 84-90 (2008)[PubMed]
- Abrahams, J. P., Leslie, A. G., Lutter, R. et al.: Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria. Nature, 370, 621-628 (1994)[PubMed]
- Hirono-Hara, Y., Ishizuka, K., Kinosita, K. Jr. et al.: Activation of pausing F1 motor by external force. Proc. Natl. Acad. Sci. USA, 102, 4288-4293 (2005)[PubMed]
- Gilbert, S. P., Webb, M. R., Brune, M. et al.: Pathway of processive ATP hydrolysis by kinesin. Nature, 373, 671-676 (1995)[PubMed]
- Gebhardt, J. C., Clemen, A. E., Jaud, J. et al.: Myosin-V is a mechanical ratchet. Proc. Natl. Acad. Sci. USA, 103, 8680-8685 (2006)[PubMed]
- Carter, N. J. & Cross, R. A.: Mechanics of the kinesin step. Nature, 435, 308-312 (2005)[PubMed]
著者プロフィール
略歴:2009年 大阪大学大学院工学研究科博士課程 修了,同年より同 産業科学研究所 博士研究員.
研究テーマ:タンパク質でできた分子モーターの1分子生物物理学.
抱負:自転車で日本一周.
野地 博行(Hiroyuki Noji)
略歴:1997年 東京工業大学大学院総合理工学研究科博士課程 修了,2005年 大阪大学産業科学研究所 教授を経て,2010年より東京大学大学院工学系研究科 教授.
研究テーマ:1分子生物物理学.
抱負:羊蹄山からのスキー滑降.
研究室URL:http://www.sanken.osaka-u.ac.jp/labs/smbio/sanken/
© 2010 渡邉力也・野地博行 Licensed under CC 表示 2.1 日本