small RNA二本鎖のATP依存的なRISC積み込み反応はHsc70/Hsp90シャペロンマシナリーによって媒介される
岩崎信太郎・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:泊 幸秀
DOI: 10.7875/first.author.2010.005
Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes.
Shintaro Iwasaki, Maki Kobayashi, Mayuko Yoda, Yuriko Sakaguchi, Susumu Katsuma, Tsutomu Suzuki, Yukihide Tomari
Molecular Cell, 39, 292-299 (2010)
小分子RNA(small RNA)は,通常,RNA-induced silencing complex(RISC)とよばれる複合体に取り込まれて機能する.RISCの中核をなすのはArgonaute(Ago)とよばれるタンパク質である.最近,筆者らは,RISCの形成過程において,前半の素過程であるAgoへのsmall RNA二本鎖積み込みには,Hsc70/Hsp90シャペロンマシナリーが必要であることを明らかにした.これは,かさ高いsmall RNA二本鎖を取り込むためにはAgoのダイナミックな構造変化が必要であることを強く支持するものである.
18~30塩基程度の小分子RNA(small RNA)が標的遺伝子の発現調節を介して,発生,細胞周期,細胞増殖,稔性,がん化といった重要な生物学的側面を緻密に制御していることが明らかになりつつある.small RNAは,一般に,それ自体と相補的な配列をもつRNAを標的としてはたらく.しかし,small RNAは単独で標的RNAの発現を調節できるわけではなく,RNA-induced silencing complex(RISC)とよばれるRNA-タンパク質複合体を形成することではじめて機能する.RISCの構成タンパク質のなかでも中心的役割を担うのがArgonaute(Ago)とよばれるタンパク質である.Agoはsmall RNAと直接に結合し,標的mRNAの認識と切断活性をもつことにくわえ,標的mRNAからの翻訳抑制,ポリA鎖の短縮,標的mRNAの分解など,多岐にわたる機能を誘導することがわかっている1).
代表的なsmall RNAとして,microRNA(miRNA)とsmall interfering RNA(siRNA)が知られている.これらのsmall RNAは前駆体RNAからRNaseⅢファミリーに属するDicerタンパク質によって切り出されて,それぞれmiRNA/miRNA*二本鎖,siRNA二本鎖とよばれるsmall RNA二本鎖中間体として生合成される.ショウジョウバエの場合は,Dicer-1がmiRNA前駆体からmiRNA/miRNA*二本鎖を切り出し,Dicer-2が長鎖二本鎖RNAからsiRNA二本鎖を切り出す.
small RNA二本鎖からRISCが形成される過程(RISC assembly)は複雑な過程をへるが,大きく分けると,small RNA二本鎖の積み込み(RISC loading)と,small RNA二本鎖の一本鎖化(unwinding)という2つの素過程から成り立つ(図1).
ショウジョウバエにはAgo1とAgo2という2つのAgoが存在するが,一般的に,miRNAはAgo1へ取り込まれ,siRNAはAgo2へと取り込まれる.また,ヒトにはAgo1~Ago4の4つのAgoが存在するが,miRNAもsiRNAもすべてのAgoに取り込まれることが知られている.
RISCの形成過程のうちもっとも解析の進んでいるのは,ショウジョウバエにおいてsiRNA二本鎖がAgo2へと取り込まれる経路である(図1,右).Dicer-2/R2D2は,前述のsiRNA二本鎖の生合成を行うほか,Ago2を含むRISCの形成にも必須であることが示されている.その役割はおもに3つに分けられる.1つ目は,small RNA二本鎖の“振り分け”である.ショウジョウバエではsmall RNA二本鎖の構造によってそのsmall RNA二本鎖がAgo1へ取り込まれるかAgo2に取り込まれるかが決まるが,siRNA二本鎖のように相補性の高いsmall RNAの場合にはAgo2へと取り込まれる.Dicer-2/R2D2はこの振り分けの際,small RNA二本鎖の構造を認識し,中心付近が相補的であるsiRNA二本鎖をAgo2への経路に進ませ,“門番”のような役割をはたしている2).2つ目は,“small RNAの非対称性”の認識である.通常,small RNA二本鎖のうち,片方のRNA鎖のみが最終的にAgoに保持される.siRNA二本鎖ではAgoに保持される側のRNA鎖をガイド鎖,取り除かれる側のRNA鎖をパッセンジャー鎖という.一般的に,両方の末端のうち5’末端が熱力学的に不安定なほうのRNA鎖がガイド鎖として選ばれる(これを“small RNAの非対称性”とよぶ).siRNA二本鎖の両方の末端のうち,より熱力学的に安定な末端にR2D2が,より不安定な末端にDicer-2が結合することによりsmall RNAの非対称性が認識され,これにより最終的にAgo2に保持されるRNA鎖が決定されるものと考えられている3).3つ目は,small RNA二本鎖の積み込みである.Dicer-2/R2D2がないとsiRNA二本鎖はAgo2へと取り込まれない4-6).おそらく,small RNA二本鎖の振り分け,small RNAの非対称性の認識,small RNA二本鎖の積み込みといった現象は同時並行に起こっており,これらをへることによりAgo2へと取り込まれるsmall RNAが厳密に制御されているものと考えられる.
これに対し,ショウジョウバエのAgo1におけるsmall RNA二本鎖の積み込みにはDicer-1,Dicer-2の双方とも必要がない(図1,左).Ago1におけるsmall RNAの積み込み二本鎖において,Dicer-2/R2D2のもつ役割を担うほかの因子が存在するのかどうかはよくわかっていないが,miRNA/miRNA*二本鎖のように中心付近(ガイド鎖の5’末端から8~11塩基)にミスマッチのある場合にはsmall RNA二本鎖の積み込みが促進される7).
ショウジョウバエの場合,small RNA二本鎖の一本鎖化についてもAgo1とAgo2は対照的である(図1).Ago2への経路の場合,small RNA二本鎖の振り分けの過程でRNA鎖の中心付近が相補的なsiRNA二本鎖が選択されることになる.この場合,パッセンジャー鎖があたかも標的RNAのようにふるまい,Ago2自体によって切断されることが知られている8).また,いちど切断されたパッセンジャー鎖をC3POとよばれる別のヌクレアーゼがさらに分解することで,パッセンジャー鎖が再びガイド鎖に結合することを防いでいる9).
これに対して,Ago1への経路では中心付近の10~11番目の塩基がミスマッチであるものが選ばれる.Ago1自体は標的RNAの切断活性をもっているが,切断が起こる位置がミスマッチになっているためRNA鎖の切断は起こらない.Ago1においてsmall RNA二本鎖の一本鎖化が効率的に起こるには,ガイド鎖の5’末端から数えて2~8塩基(seed領域)と12~16塩基(3’領域)のどちらか,あるいは,両方の位置にミスマッチの必要なことが知られている7).
以上のように,ショウジョウバエにおいて,Ago1あるいはAgo2におけるsmall RNA二本鎖の積み込みとsmall RNA二本鎖の一本鎖化は,それぞれ対照的な経路をたどる(図1).また,ヒトのAgo1~Ago4におけるRISC形成はショウジョウバエのAgo1におけるRISC形成に類似している10).これらすべてのAgoのRISC形成に共通する重要な生化学的事実が知られている.それは,small RNA二本鎖の積み込みにはATPの加水分解が必要であるのに対し,small RNA二本鎖の一本鎖化にはATPは必要ないということである10,11).
これまでの研究により,small RNA二本鎖の積み込みにはATPの加水分解が必要であり,さらに,精製したAgoだけではsmall RNA二本鎖は取り込まれないことがわかっていた12)(図1).これらのことは,Agoがsmall RNA二本鎖を取り込むには,ATPの加水分解を必要とするなんらかの因子が必要であることを示唆する.しかし,それがいったいどんな因子なのかについては,これまでまったくわかっていなかった.
筆者らは,今回,ショウジョウバエのAgo1,Ago2に結合する因子として,分子シャペロンHsp70の恒常的発現性ホモログであるHsc70-4,別の分子シャペロンHsp90のホモログであるHsp83,また,これらのコシャペロンであるHopやDroj2を同定した.さらに,Hsc70あるいはHsp90の特異的阻害剤を用いた実験により,ショウジョウバエとヒトにおけるsmall RNA二本鎖の積み込みにはHsc70/Hsp90シャペロンマシナリーが必要であるのに対し,small RNA二本鎖の一本鎖化には必要ないということを明らかにした.
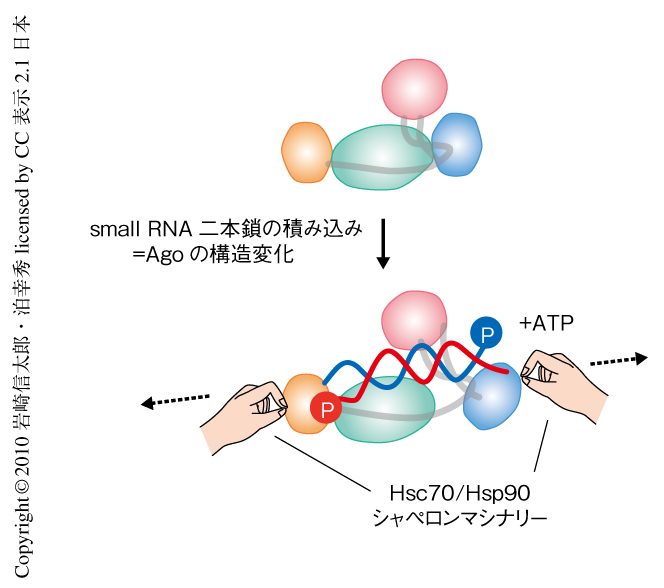
なぜ,small RNA二本鎖の積み込みにHsc70/Hsp90シャペロンマシナリーが必要なのだろうか? それを考察するには,small RNA二本鎖の積み込みとはいったいどういう反応なのかを考える必要がある.ATPの加水分解が必要であることから考えて,small RNA二本鎖の積み込みは単なるタンパク質とRNAとの結合ではない.ATPとsmall RNA二本鎖の積み込みの関係を考察するうえで参考になるのが,近年,解かれた高度好熱菌Thermus thermophilusのAgoの立体構造である13,14).この立体構造の解析からは,21塩基程度のA型ヘリックス構造を形成するsmall RNA二本鎖はAgoに対して大きすぎ,small RNA二本鎖が取り込まれるはずの位置には収まらないことが示唆された.よって,Agoが21塩基程度のsmall RNA二本鎖を取り込むためには,Agoの大規模な立体構造変化が必要であることが推察されていた.筆者らは,ATPの加水分解が,まさにこのAgoの大規模な立体構造変化をひき起こす駆動力になっているのではないかというモデルを提唱した11).
このモデルから考えると,Hsc70/Hsp90シャペロンマシナリーがsmall RNA二本鎖の積み込みに必要であることは理にかなっている.つまり,small RNA二本鎖の積み込みという反応は,“Hsc70/Hsp90シャペロンマシナリーがATPの加水分解を利用してAgoの構造を変化させることでsmall RNA二本鎖がAgoのなかに取り込まれる”ものであると説明することができる(図2).
内在性のタンパク質のなかには,Hsc70/Hsp90シャペロンマシナリーの助けをかりて構造を変化させることにより機能するものが数多く存在する.たとえば,ステロイド受容体であるグルココルチコイド受容体は,そのままではリガンドであるグルココルチコイドに結合できないが,Hsc70/Hsp90シャペロンマシナリーによる成熟化をうけてグルココルチコイドに結合できるような構造に変化する15).Agoのリガンドをsmall RNA二本鎖と考えれば,グルココルチコイド受容体の例に類似しているといえる.
この研究によって,small RNA二本鎖の積み込みという反応の中核となる因子が明らかになったとともに,このsmall RNA二本鎖の積み込みがいったいどういう反応なのかということについても理解が深まった.しかしながら,筆者らは,small RNA二本鎖の積み込みという反応はさらに複雑な素過程をへるものと考えている.通常,Hsc70やHsp90などの分子シャペロンはコシャペロンにより活性が制御されている.また,グルココルチコイド受容体の場合においては,Hsc70,Hsp90,そして,多くのコシャペロンが標的タンパク質へ順序よく作用してはじめてその構造が変化することが知られている15).実際,Agoの場合も,精製したHsc70やHsp90だけを反応系にくわえてもsmall RNA二本鎖の積み込み反応が再現されないことから,このsmall RNA二本鎖の積み込みもグルココルチコイド受容体の成熟化と同様の複雑な分子機構により起こることが考えられる.そのためにはどのようなコシャペロンが必要なのか,それらがどのような順序でAgoに作用するのか,といった問題は,small RNA二本鎖の積み込みという反応を理解するうえで非常に重要であり,今後,解明されるべき問題であると考えている.
なお,small RNA二本鎖の積み込みに分子シャペロンHsp90が必要であることに関しては,このたび,同時に植物においても同様の報告がなされており16)(新着論文レビュー でも掲載),RISCの形成における分子シャペロン依存性の普遍性が示唆されている.
略歴:東京大学大学院新領域創成科学研究科 博士課程 在学中.
研究テーマ:サイレンシングの分子機構.
座右の銘:一身独立して一国独立す.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/index.html
© 2010 岩崎信太郎・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:泊 幸秀
DOI: 10.7875/first.author.2010.005
Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes.
Shintaro Iwasaki, Maki Kobayashi, Mayuko Yoda, Yuriko Sakaguchi, Susumu Katsuma, Tsutomu Suzuki, Yukihide Tomari
Molecular Cell, 39, 292-299 (2010)
要 約
小分子RNA(small RNA)は,通常,RNA-induced silencing complex(RISC)とよばれる複合体に取り込まれて機能する.RISCの中核をなすのはArgonaute(Ago)とよばれるタンパク質である.最近,筆者らは,RISCの形成過程において,前半の素過程であるAgoへのsmall RNA二本鎖積み込みには,Hsc70/Hsp90シャペロンマシナリーが必要であることを明らかにした.これは,かさ高いsmall RNA二本鎖を取り込むためにはAgoのダイナミックな構造変化が必要であることを強く支持するものである.
はじめに
18~30塩基程度の小分子RNA(small RNA)が標的遺伝子の発現調節を介して,発生,細胞周期,細胞増殖,稔性,がん化といった重要な生物学的側面を緻密に制御していることが明らかになりつつある.small RNAは,一般に,それ自体と相補的な配列をもつRNAを標的としてはたらく.しかし,small RNAは単独で標的RNAの発現を調節できるわけではなく,RNA-induced silencing complex(RISC)とよばれるRNA-タンパク質複合体を形成することではじめて機能する.RISCの構成タンパク質のなかでも中心的役割を担うのがArgonaute(Ago)とよばれるタンパク質である.Agoはsmall RNAと直接に結合し,標的mRNAの認識と切断活性をもつことにくわえ,標的mRNAからの翻訳抑制,ポリA鎖の短縮,標的mRNAの分解など,多岐にわたる機能を誘導することがわかっている1).
1.small RNAの生合成とRISCの形成
代表的なsmall RNAとして,microRNA(miRNA)とsmall interfering RNA(siRNA)が知られている.これらのsmall RNAは前駆体RNAからRNaseⅢファミリーに属するDicerタンパク質によって切り出されて,それぞれmiRNA/miRNA*二本鎖,siRNA二本鎖とよばれるsmall RNA二本鎖中間体として生合成される.ショウジョウバエの場合は,Dicer-1がmiRNA前駆体からmiRNA/miRNA*二本鎖を切り出し,Dicer-2が長鎖二本鎖RNAからsiRNA二本鎖を切り出す.
small RNA二本鎖からRISCが形成される過程(RISC assembly)は複雑な過程をへるが,大きく分けると,small RNA二本鎖の積み込み(RISC loading)と,small RNA二本鎖の一本鎖化(unwinding)という2つの素過程から成り立つ(図1).
2.small RNA二本鎖の積み込み
ショウジョウバエにはAgo1とAgo2という2つのAgoが存在するが,一般的に,miRNAはAgo1へ取り込まれ,siRNAはAgo2へと取り込まれる.また,ヒトにはAgo1~Ago4の4つのAgoが存在するが,miRNAもsiRNAもすべてのAgoに取り込まれることが知られている.
RISCの形成過程のうちもっとも解析の進んでいるのは,ショウジョウバエにおいてsiRNA二本鎖がAgo2へと取り込まれる経路である(図1,右).Dicer-2/R2D2は,前述のsiRNA二本鎖の生合成を行うほか,Ago2を含むRISCの形成にも必須であることが示されている.その役割はおもに3つに分けられる.1つ目は,small RNA二本鎖の“振り分け”である.ショウジョウバエではsmall RNA二本鎖の構造によってそのsmall RNA二本鎖がAgo1へ取り込まれるかAgo2に取り込まれるかが決まるが,siRNA二本鎖のように相補性の高いsmall RNAの場合にはAgo2へと取り込まれる.Dicer-2/R2D2はこの振り分けの際,small RNA二本鎖の構造を認識し,中心付近が相補的であるsiRNA二本鎖をAgo2への経路に進ませ,“門番”のような役割をはたしている2).2つ目は,“small RNAの非対称性”の認識である.通常,small RNA二本鎖のうち,片方のRNA鎖のみが最終的にAgoに保持される.siRNA二本鎖ではAgoに保持される側のRNA鎖をガイド鎖,取り除かれる側のRNA鎖をパッセンジャー鎖という.一般的に,両方の末端のうち5’末端が熱力学的に不安定なほうのRNA鎖がガイド鎖として選ばれる(これを“small RNAの非対称性”とよぶ).siRNA二本鎖の両方の末端のうち,より熱力学的に安定な末端にR2D2が,より不安定な末端にDicer-2が結合することによりsmall RNAの非対称性が認識され,これにより最終的にAgo2に保持されるRNA鎖が決定されるものと考えられている3).3つ目は,small RNA二本鎖の積み込みである.Dicer-2/R2D2がないとsiRNA二本鎖はAgo2へと取り込まれない4-6).おそらく,small RNA二本鎖の振り分け,small RNAの非対称性の認識,small RNA二本鎖の積み込みといった現象は同時並行に起こっており,これらをへることによりAgo2へと取り込まれるsmall RNAが厳密に制御されているものと考えられる.
これに対し,ショウジョウバエのAgo1におけるsmall RNA二本鎖の積み込みにはDicer-1,Dicer-2の双方とも必要がない(図1,左).Ago1におけるsmall RNAの積み込み二本鎖において,Dicer-2/R2D2のもつ役割を担うほかの因子が存在するのかどうかはよくわかっていないが,miRNA/miRNA*二本鎖のように中心付近(ガイド鎖の5’末端から8~11塩基)にミスマッチのある場合にはsmall RNA二本鎖の積み込みが促進される7).
3.small RNA二本鎖の一本鎖化
ショウジョウバエの場合,small RNA二本鎖の一本鎖化についてもAgo1とAgo2は対照的である(図1).Ago2への経路の場合,small RNA二本鎖の振り分けの過程でRNA鎖の中心付近が相補的なsiRNA二本鎖が選択されることになる.この場合,パッセンジャー鎖があたかも標的RNAのようにふるまい,Ago2自体によって切断されることが知られている8).また,いちど切断されたパッセンジャー鎖をC3POとよばれる別のヌクレアーゼがさらに分解することで,パッセンジャー鎖が再びガイド鎖に結合することを防いでいる9).
これに対して,Ago1への経路では中心付近の10~11番目の塩基がミスマッチであるものが選ばれる.Ago1自体は標的RNAの切断活性をもっているが,切断が起こる位置がミスマッチになっているためRNA鎖の切断は起こらない.Ago1においてsmall RNA二本鎖の一本鎖化が効率的に起こるには,ガイド鎖の5’末端から数えて2~8塩基(seed領域)と12~16塩基(3’領域)のどちらか,あるいは,両方の位置にミスマッチの必要なことが知られている7).
4.small RNA二本鎖の積み込みにはHsc70/Hsp90が必要である
以上のように,ショウジョウバエにおいて,Ago1あるいはAgo2におけるsmall RNA二本鎖の積み込みとsmall RNA二本鎖の一本鎖化は,それぞれ対照的な経路をたどる(図1).また,ヒトのAgo1~Ago4におけるRISC形成はショウジョウバエのAgo1におけるRISC形成に類似している10).これらすべてのAgoのRISC形成に共通する重要な生化学的事実が知られている.それは,small RNA二本鎖の積み込みにはATPの加水分解が必要であるのに対し,small RNA二本鎖の一本鎖化にはATPは必要ないということである10,11).
これまでの研究により,small RNA二本鎖の積み込みにはATPの加水分解が必要であり,さらに,精製したAgoだけではsmall RNA二本鎖は取り込まれないことがわかっていた12)(図1).これらのことは,Agoがsmall RNA二本鎖を取り込むには,ATPの加水分解を必要とするなんらかの因子が必要であることを示唆する.しかし,それがいったいどんな因子なのかについては,これまでまったくわかっていなかった.
筆者らは,今回,ショウジョウバエのAgo1,Ago2に結合する因子として,分子シャペロンHsp70の恒常的発現性ホモログであるHsc70-4,別の分子シャペロンHsp90のホモログであるHsp83,また,これらのコシャペロンであるHopやDroj2を同定した.さらに,Hsc70あるいはHsp90の特異的阻害剤を用いた実験により,ショウジョウバエとヒトにおけるsmall RNA二本鎖の積み込みにはHsc70/Hsp90シャペロンマシナリーが必要であるのに対し,small RNA二本鎖の一本鎖化には必要ないということを明らかにした.
5.small RNA二本鎖の積み込みとAgoの構造変化
なぜ,small RNA二本鎖の積み込みにHsc70/Hsp90シャペロンマシナリーが必要なのだろうか? それを考察するには,small RNA二本鎖の積み込みとはいったいどういう反応なのかを考える必要がある.ATPの加水分解が必要であることから考えて,small RNA二本鎖の積み込みは単なるタンパク質とRNAとの結合ではない.ATPとsmall RNA二本鎖の積み込みの関係を考察するうえで参考になるのが,近年,解かれた高度好熱菌Thermus thermophilusのAgoの立体構造である13,14).この立体構造の解析からは,21塩基程度のA型ヘリックス構造を形成するsmall RNA二本鎖はAgoに対して大きすぎ,small RNA二本鎖が取り込まれるはずの位置には収まらないことが示唆された.よって,Agoが21塩基程度のsmall RNA二本鎖を取り込むためには,Agoの大規模な立体構造変化が必要であることが推察されていた.筆者らは,ATPの加水分解が,まさにこのAgoの大規模な立体構造変化をひき起こす駆動力になっているのではないかというモデルを提唱した11).
このモデルから考えると,Hsc70/Hsp90シャペロンマシナリーがsmall RNA二本鎖の積み込みに必要であることは理にかなっている.つまり,small RNA二本鎖の積み込みという反応は,“Hsc70/Hsp90シャペロンマシナリーがATPの加水分解を利用してAgoの構造を変化させることでsmall RNA二本鎖がAgoのなかに取り込まれる”ものであると説明することができる(図2).
内在性のタンパク質のなかには,Hsc70/Hsp90シャペロンマシナリーの助けをかりて構造を変化させることにより機能するものが数多く存在する.たとえば,ステロイド受容体であるグルココルチコイド受容体は,そのままではリガンドであるグルココルチコイドに結合できないが,Hsc70/Hsp90シャペロンマシナリーによる成熟化をうけてグルココルチコイドに結合できるような構造に変化する15).Agoのリガンドをsmall RNA二本鎖と考えれば,グルココルチコイド受容体の例に類似しているといえる.
おわりに
この研究によって,small RNA二本鎖の積み込みという反応の中核となる因子が明らかになったとともに,このsmall RNA二本鎖の積み込みがいったいどういう反応なのかということについても理解が深まった.しかしながら,筆者らは,small RNA二本鎖の積み込みという反応はさらに複雑な素過程をへるものと考えている.通常,Hsc70やHsp90などの分子シャペロンはコシャペロンにより活性が制御されている.また,グルココルチコイド受容体の場合においては,Hsc70,Hsp90,そして,多くのコシャペロンが標的タンパク質へ順序よく作用してはじめてその構造が変化することが知られている15).実際,Agoの場合も,精製したHsc70やHsp90だけを反応系にくわえてもsmall RNA二本鎖の積み込み反応が再現されないことから,このsmall RNA二本鎖の積み込みもグルココルチコイド受容体の成熟化と同様の複雑な分子機構により起こることが考えられる.そのためにはどのようなコシャペロンが必要なのか,それらがどのような順序でAgoに作用するのか,といった問題は,small RNA二本鎖の積み込みという反応を理解するうえで非常に重要であり,今後,解明されるべき問題であると考えている.
なお,small RNA二本鎖の積み込みに分子シャペロンHsp90が必要であることに関しては,このたび,同時に植物においても同様の報告がなされており16)(新着論文レビュー でも掲載),RISCの形成における分子シャペロン依存性の普遍性が示唆されている.
文 献
- Carthew, R. W. & Sontheimer, E. J.: Origins and mechanisms of miRNAs and siRNAs. Cell, 136, 642-655 (2009)[PubMed]
- Tomari, Y., Du, T. & Zamore, P. D.: Sorting of Drosophila small silencing RNAs. Cell, 130, 299-308 (2007)[PubMed]
- Tomari, Y. et al.: A protein sensor for siRNA asymmetry. Science, 306, 1377-1380 (2004)[PubMed]
- Liu, Q. et al.: R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway. Science, 301, 1921-1925 (2003)[PubMed]
- Pham, J. W. et al.: A Dicer-2-dependent 80S complex cleaves targeted mRNAs during RNAi in Drosophila. Cell, 117, 83-94 (2004)[PubMed]
- Tomari, Y. et al.: RISC assembly defects in the Drosophila RNAi mutant armitage. Cell, 116, 831-841 (2004)[PubMed]
- Kawamata, T., Seitz, H. & Tomari, Y.: Structural determinants of miRNAs for RISC loading and slicer-independent unwinding. Nat. Struct. Mol. Biol., 16, 953-960 (2009)[PubMed]
- Matranga, C. et al.: Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes. Cell, 123, 607-620 (2005)[PubMed]
- Liu, Y. et al.: C3PO, an endoribonuclease that promotes RNAi by facilitating RISC activation. Science, 325, 750-753 (2009)[PubMed]
- Yoda, M. et al.: ATP-dependent human RISC assembly pathways. Nat. Struct. Mol. Biol., 17, 17-23 (2010)[PubMed]
- Kawamata, T. & Tomari, Y.: Making RISC. Trends Biochem. Sci., 35, 368-376 (2010)[PubMed]
- Rivas, F. V. et al.: Purified Argonaute2 and an siRNA form recombinant human RISC. Nat. Struct. Mol. Biol., 12, 340-349 (2005)[PubMed]
- Wang, Y. et al.: Structure of an argonaute silencing complex with a seed-containing guide DNA and target RNA duplex. Nature, 456, 921-926 (2008)[PubMed]
- Wang, Y. et al.: Nucleation, propagation and cleavage of target RNAs in Ago silencing complexes. Nature, 461, 754-761 (2009)[PubMed]
- Grad, I. & Picard, D.: The glucocorticoid responses are shaped by molecular chaperones. Mol. Cell. Endocrinol., 275, 2-12 (2007)[PubMed]
- Iki, T. et al.: In vitro assembly of plant RNA-induced silencing complexes facilitated by molecular chaperone HSP90. Mol. Cell, 39, 282-291 (2010)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科 博士課程 在学中.
研究テーマ:サイレンシングの分子機構.
座右の銘:一身独立して一国独立す.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/index.html
© 2010 岩崎信太郎・泊 幸秀 Licensed under CC 表示 2.1 日本