植物における無細胞RISC形成系の確立と分子シャペロンHSP90によるRISC形成の促進
井木太一郎・石川雅之
(農業生物資源研究所植物科学研究領域 植物・微生物間相互作用研究ユニット)
email:石川雅之
DOI: 10.7875/first.author.2010.004
In vitro assembly of plant RNA-induced silencing complexes facilitated by molecular chaperone HSP90.
Taichiro Iki, Manabu Yoshikawa, Masaki Nishikiori, Mauren C. Jaudal, Eiko Matsumoto-Yokoyama, Ichiro Mitsuhara, Tetsuo Meshi, Masayuki Ishikawa
Molecular Cell, 39, 282-291 (2010)
RNA-induced silencing complex(RISC)はRNAサイレンシングの中核を担う複合体のひとつである.RISCにはARGONAUTEタンパク質(AGO)と一本鎖の小分子RNA(small RNA)とが含まれることが知られているが,これまで,植物のRISC形成を再現する無細胞系が存在しなかったため,その分子機構については十分な知見が得られていなかった.筆者らは,タバコ培養細胞BY-2の脱液胞化プロトプラスト抽出液中で,翻訳反応によりAGO1を新規合成し,つづいて,small RNAの前駆体である二本鎖small RNAを添加すると,RISCが形成されることを見いだした.さらに,この脱液胞化抽出液を用いた実験により,AGO1はATP結合型の分子シャペロンHSP90に結合した状態で二本鎖small RNAを取り込み,HSP90によるATPの加水分解を機にAGO1からHSP90と二本鎖small RNAの一方のRNA鎖が脱離することでRISCが形成される可能性を示した.
植物における転写後遺伝子サイレンシング(post-transcriptional gene silencing;PTGS)や動物におけるRNAi(RNA interference,RNA干渉)は,20~30塩基程度の小分子RNA(small RNA)が関与して転写ののちに起こる遺伝子発現抑制機構で,同様にsmall RNAを介して誘起され転写そのものを抑制する転写型遺伝子サイレンシング(transcriptional gene silencing;TGS)とあわせて,RNAサイレンシングと総称される.RNAサイレンシングは広く真核生物に保存されており,形態形成,ウイルスに対する防御,トランスポゾンの鎮静化などにおいてきわめて重要な役割をはたしている1).RNAサイレンシングは遺伝子発現を抑制する研究手法としてすでに汎用されており,将来的には医療などへの活用が期待されている.
PTGS(RNAi)に関与するsmall RNAとしては,microRNA(miRNA)とsmall interfering RNA(siRNA)とが知られている.miRNAとsiRNAは,それぞれ,内在性遺伝子転写産物のヘアピン構造部分あるいはさまざまな機構により産生された長鎖二本鎖RNAから,RNaseⅢファミリーに属するDicerタンパク質によって二本鎖の状態で切り出される.一般に,二本鎖miRNAはミスマッチをもつが,二本鎖siRNAは完全に相補的である2).切り出された二本鎖small RNAは3’末端側に2塩基の突出をもち,5’末端がモノリン酸化されている.また,植物ではsmall RNAの3’末端ヌクレオチド2'位の水酸基がメチル化され,この修飾は安定性に寄与していることが知られている.
生成した二本鎖small RNAは一本鎖の状態になってPTGSを誘起する.まず,二本鎖small RNAはArgonauteタンパク質(AGO)に結合する.つぎに,二本鎖の片方の鎖(siRNAではパッセンジャー鎖,miRNAではmiRNA*鎖)が取り除かれ,もう一方の鎖(siRNAではガイド鎖,miRNAではmiRNA鎖)がAGOに結合したまま残る.ショウジョウバエでは,完全に相補的である二本鎖siRNAはエンドヌクレアーゼ活性をもつAgo2に取り込まれ,パッセンジャー鎖は切断されて排除される.一方,ミスマッチをもつ二本鎖miRNAはおもにAgo1に取り込まれ,miRNA*鎖は切断されずにmiRNA鎖から引きはがされて排除される3,4).以上により,最終的に一本鎖small RNA(ガイド鎖,または,miRNA鎖)とAGOを含むエフェクター複合体であるRNA-induced silencing complex(RISC)が完成する.ガイド鎖(または,miRNA鎖)としてはたらく一本鎖small RNAは,標的mRNAと塩基対を形成することで標的mRNAの認識にあたる.PTGSにおいては,標的mRNAはAGOのエンドヌクレアーゼ活性による切断をうけて分解されるか,あるいは,RISCとの結合をへて翻訳抑制をうける5).いずれにせよ,標的mRNAからのタンパク質合成はRISCにより阻害される.
いくつかの動物細胞抽出液では,二本鎖small RNAの添加により内在性のAGOからRISCを形成させることができる.このため,動物ではRISCの形成や機能に関する知見が積み重ねられてきた.しかしながら,RISC形成の初期段階において二本鎖small RNAがAGOに結合する分子機構はよくわかっていなかった.
シロイヌナズナのゲノムには10個のAGO遺伝子がコードされていて,それぞれのAGOタンパク質はRNAサイレンシングにおいて一部重複しながらも異なった役割を担っている6).そのなかでも,AGO1はmiRNAを介した成長および形態形成の制御において中心的に機能し,また,siRNAを介したウイルス防御機構においても重要な役割を担っている.AGO1はエンドヌクレアーゼ活性をもち,植物細胞から精製されたAGO1を含むRISCは標的RNAを切断する.AGO1に結合したsmall RNAの塩基配列の解析結果などから,AGO1は5’末端にウリジル酸をもつ約21塩基のsmall RNAに優先して結合することが知られている.
動物細胞抽出液とは異なり,植物細胞抽出液では二本鎖small RNAを添加してもRISCは形成されない.このため,RISC形成に関する生化学的な解析を進めることができず,植物におけるRISC形成機構の解明は動物に比べ大きく後れをとっていた.植物細胞抽出液中でRISCが形成されない原因のひとつとして,植物細胞の大部分をしめる液胞に由来する非特異的なプロテアーゼやヌクレアーゼの混入があげられる.筆者らは,以前の研究において,タバコ培養細胞BY-2の脱液胞化プロトプラスト抽出液にはそうした非特異的なプロテアーゼあるいはヌクレアーゼの混入が少なく,この脱液胞化抽出液を用いることによりタバコモザイクウイルスRNAの翻訳および複製を生体内と同様のパターンで再現できることを示した7).こうした背景から,筆者らは,このBY-2脱液胞化プロトプラスト抽出液を使えばRISCの形成が再現できるのではないかと考えた.そこで,AGO1に取り込まれるようにデザインした合成二本鎖siRNAをこの脱液胞化抽出液に添加し,ここに含まれるAGO1からRISCの形成を試みた.しかしながら,期待に反してRISCは形成されなかった.
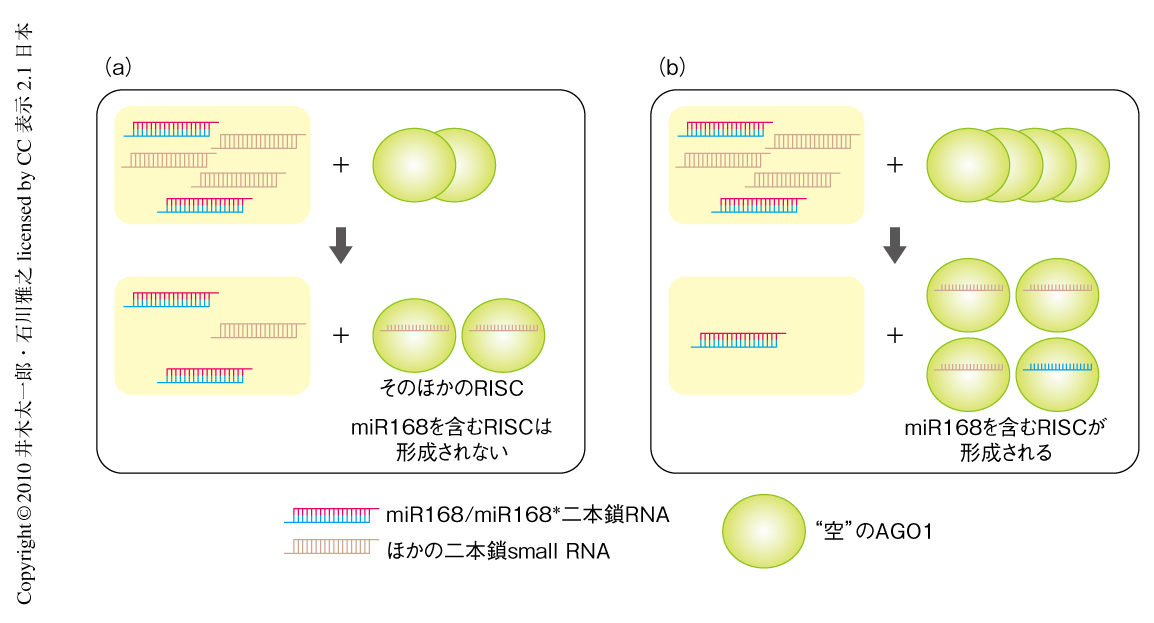
植物細胞には,AGO1 mRNAを標的RNAとするmiRNAであるmiR168を介したAGO1遺伝子発現の恒常性維持機構が存在する8).miR168/miR168*二本鎖RNAはなんらかの分子機構によりほかの二本鎖small RNAよりもAGO1に取り込まれにくく,細胞中にはmiR168/miR168*が余っていることが示唆されている(図1a).“空”のAGO1(RISCを形成していないもの)が増加すると,余っていたmiR168/miR168*がAGO1に取り込まれてmiR168を含むRISCが増加する.すると,AGO1 mRNAの分解が促進され,AGO1タンパク質の新規合成が抑制される.これにより,余計なAGO1の合成が阻止される(図1b).筆者らは,このモデルから,BY-2脱液胞化プロトプラスト抽出液に含まれる“空”のAGO1の量が限られているため,ここに二本鎖small RNAを添加しても検出可能な量のRISCが形成されなかったのではないかと考えた.そこで,この脱液胞化抽出液の翻訳活性を利用して合成AGO1 mRNAから新規にAGO1タンパク質を試験管内合成し,そこにAGO1に取り込まれるようにデザインした合成二本鎖siRNAを添加してみた.すると,期待どおり,AGO1はsiRNAの一方の鎖(パッセンジャー鎖)を排除してもう一方の鎖(ガイド鎖)のみを結合し,ガイド鎖と相補的な標的RNAを特異的に切断する活性を獲得した.すなわち,RISCが形成されたのである.同様に,二本鎖miRNAからもRISCが形成された.エンドヌクレアーゼ活性を失わせたAGO1の変異体は,二本鎖siRNAを取り込むことはできたがパッセンジャー鎖を排除することはできなかった.一方,同じAGO1の変異体は,二本鎖miRNAを取り込みmiRNA*を排除した.これらのことから,植物の系においても動物の系と同様に,RISCの形成において,siRNAのパッセンジャー鎖はAGO1によって切断されて除かれるのに対し,miRNAのmiRNA*鎖は切断をへずに除かれることが示唆された.
動物のRISC形成にはATPが必要であることが知られているので9),筆者らは,植物のRISC形成にもATPが必要なのかどうか調べた.BY-2脱液胞化プロトプラスト抽出液においてAGO1を試験管内合成したのち,限外ろ過を利用してATPを除去すると,合成二本鎖siRNAを添加してもRISCの形成は起こらなくなった.RISC形成ののちにATPを除去してもRISC活性は影響をうけなかったこととあわせて,この結果から,植物でもRISCの形成にはATPが必要であることがわかった.
動物のRISC形成においてなぜATPが必要なのかは明らかでなかったが,一方で,分子シャペロンのひとつであるHSP90がRNAサイレンシングになんらかの関与をしていることが示唆されていた10).HSP90はホモ2量体として機能するが,ATP結合型HSP90 2量体は標的となるタンパク質(クライアントタンパク質)と安定した複合体を形成し,ATPが加水分解されるとクライアントタンパク質から解離する.この過程で,クライアントタンパク質のフォールディングが促進される11).このモデルは,HSP90の代表的なクライアントタンパク質のひとつである動物のステロイドホルモン受容体の研究などにもとづいて提唱された.HSP90のATP結合部位にATPと競合的に結合するHSP90特異的な阻害剤として,ゲルダナマイシンが知られている.筆者らは,HSP90が植物のRISC形成段階に関与する可能性を,まず,このゲルダナマイシンを用いて検討した.BY-2脱液胞化プロトプラスト抽出液において,AGO1を試験管内合成したのちゲルダナマイシンを添加すると,そののち,合成二本鎖siRNAをくわえてもRISCは形成されなくなった.ゲルダナマイシンはすでに形成されたRISCの活性には影響をあたえなかったこととあわせて,この結果は,HSP90が植物のRISC形成を促進することを示唆した.
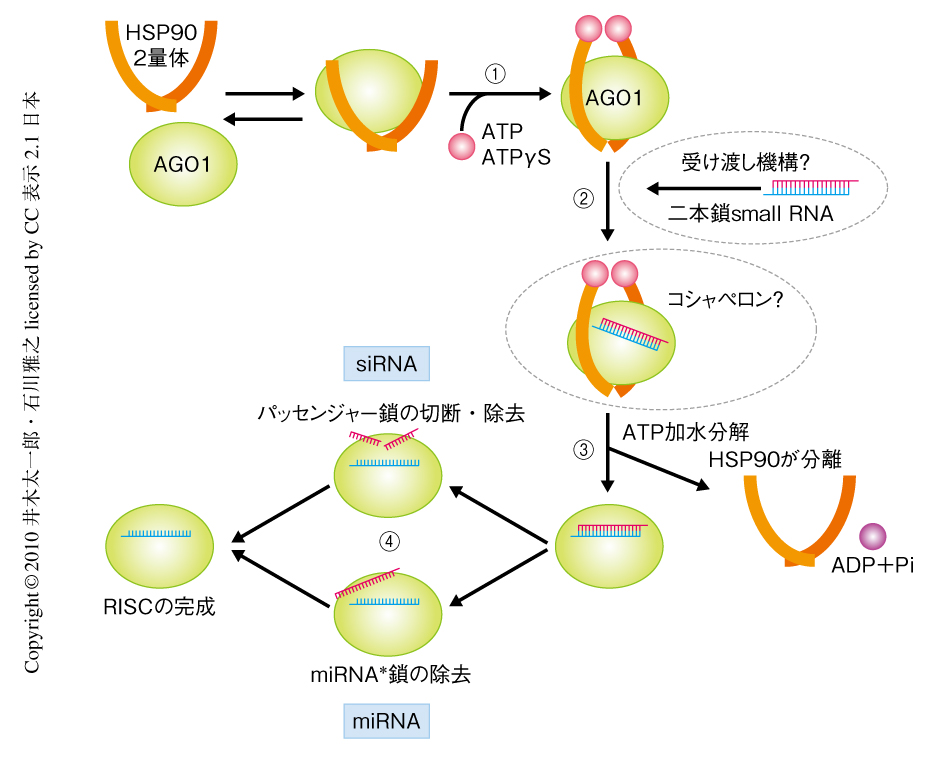
では,HSP90はどのような分子機構でRISCの形成を促進しているのだろうか? ATPγSは難加水分解性ATPアナログとして知られるが,BY-2脱液胞化プロトプラスト抽出液において,AGO1を試験管内合成したのちATPγSを添加すると,HSP90(おそらく,ATPγS結合型)とAGO1とを含む複合体が蓄積した.さらに,合成二本鎖siRNAを添加すると,HSP90,AGO1と合成二本鎖siRNAとを含む複合体が蓄積した(合成二本鎖siRNAの一本鎖化は阻害されていた).これらの結果をもとに,筆者らは,① ATP結合型HSP90がAGO1と安定した複合体を形成し,② HSP90と結合したAGO1に二本鎖small RNAが結合し,③ ATP加水分解によりHSP90がAGO1-二本鎖small RNA複合体から解離し,④ AGO1の内部で二本鎖small RNAの一本鎖化が起こる,というRISC形成モデルを提示した(図2).すでに解かれたいくつかのAGOの立体構造から,二本鎖small RNAはAGOにあるRNAの結合する溝にそのまま入り込むには大きすぎるといわれてきた.このRISC形成モデルは,AGO1にHSP90が結合することによってその溝が広がり,二本鎖small RNAが入り込めるようになるという可能性を暗示する.
この研究により,植物のAGO1は分子シャペロンHSP90の助けを借りて二本鎖small RNAというリガンドを受容していることが示された.動物においても同様の報告がなされ12,13)(新着論文レビュー でも掲載),RISCの形成における分子シャペロン依存性の普遍性が示唆された.HSP90はクライアントタンパク質によって異なるセットのコシャペロンとともに機能することが知られている.AGO1による二本鎖small RNAの受容にかかわるHSP90以外のコシャペロンなど因子の特定は,今後の課題のひとつである.また,二本鎖small RNAをAGOへとわたすタンパク質複合体(Dcr-2とR2D2のヘテロ2量体)がショウジョウバエのAgo2で報告されている4).しかし,この受け渡しの機構が真核生物において普遍的であるのかどうは定かではない.植物において,二本鎖small RNAがHSP90に結合しているAGO1にどのようにして受け渡されるのかも,今後の重要な課題である.
2008年 東京大学大学院農学生命科学研究科 博士課程 修了,同年より農業生物資源研究所植物科学研究領域 特別研究員.
研究テーマ:植物におけるRNAサイレンシングの分子機構.
関心事:RNAサイレンシング,mRNAメタボリズム,分子シャペロン,ウイルス複製,根粒形成.
石川 雅之(Masayuki Ishikawa)
農業生物資源研究所植物科学研究領域 上級研究員.
© 2010 井木太一郎・石川雅之 Licensed under CC 表示 2.1 日本
(農業生物資源研究所植物科学研究領域 植物・微生物間相互作用研究ユニット)
email:石川雅之
DOI: 10.7875/first.author.2010.004
In vitro assembly of plant RNA-induced silencing complexes facilitated by molecular chaperone HSP90.
Taichiro Iki, Manabu Yoshikawa, Masaki Nishikiori, Mauren C. Jaudal, Eiko Matsumoto-Yokoyama, Ichiro Mitsuhara, Tetsuo Meshi, Masayuki Ishikawa
Molecular Cell, 39, 282-291 (2010)
要 約
RNA-induced silencing complex(RISC)はRNAサイレンシングの中核を担う複合体のひとつである.RISCにはARGONAUTEタンパク質(AGO)と一本鎖の小分子RNA(small RNA)とが含まれることが知られているが,これまで,植物のRISC形成を再現する無細胞系が存在しなかったため,その分子機構については十分な知見が得られていなかった.筆者らは,タバコ培養細胞BY-2の脱液胞化プロトプラスト抽出液中で,翻訳反応によりAGO1を新規合成し,つづいて,small RNAの前駆体である二本鎖small RNAを添加すると,RISCが形成されることを見いだした.さらに,この脱液胞化抽出液を用いた実験により,AGO1はATP結合型の分子シャペロンHSP90に結合した状態で二本鎖small RNAを取り込み,HSP90によるATPの加水分解を機にAGO1からHSP90と二本鎖small RNAの一方のRNA鎖が脱離することでRISCが形成される可能性を示した.
はじめに
植物における転写後遺伝子サイレンシング(post-transcriptional gene silencing;PTGS)や動物におけるRNAi(RNA interference,RNA干渉)は,20~30塩基程度の小分子RNA(small RNA)が関与して転写ののちに起こる遺伝子発現抑制機構で,同様にsmall RNAを介して誘起され転写そのものを抑制する転写型遺伝子サイレンシング(transcriptional gene silencing;TGS)とあわせて,RNAサイレンシングと総称される.RNAサイレンシングは広く真核生物に保存されており,形態形成,ウイルスに対する防御,トランスポゾンの鎮静化などにおいてきわめて重要な役割をはたしている1).RNAサイレンシングは遺伝子発現を抑制する研究手法としてすでに汎用されており,将来的には医療などへの活用が期待されている.
1.small RNAの生成から機能へ
PTGS(RNAi)に関与するsmall RNAとしては,microRNA(miRNA)とsmall interfering RNA(siRNA)とが知られている.miRNAとsiRNAは,それぞれ,内在性遺伝子転写産物のヘアピン構造部分あるいはさまざまな機構により産生された長鎖二本鎖RNAから,RNaseⅢファミリーに属するDicerタンパク質によって二本鎖の状態で切り出される.一般に,二本鎖miRNAはミスマッチをもつが,二本鎖siRNAは完全に相補的である2).切り出された二本鎖small RNAは3’末端側に2塩基の突出をもち,5’末端がモノリン酸化されている.また,植物ではsmall RNAの3’末端ヌクレオチド2'位の水酸基がメチル化され,この修飾は安定性に寄与していることが知られている.
生成した二本鎖small RNAは一本鎖の状態になってPTGSを誘起する.まず,二本鎖small RNAはArgonauteタンパク質(AGO)に結合する.つぎに,二本鎖の片方の鎖(siRNAではパッセンジャー鎖,miRNAではmiRNA*鎖)が取り除かれ,もう一方の鎖(siRNAではガイド鎖,miRNAではmiRNA鎖)がAGOに結合したまま残る.ショウジョウバエでは,完全に相補的である二本鎖siRNAはエンドヌクレアーゼ活性をもつAgo2に取り込まれ,パッセンジャー鎖は切断されて排除される.一方,ミスマッチをもつ二本鎖miRNAはおもにAgo1に取り込まれ,miRNA*鎖は切断されずにmiRNA鎖から引きはがされて排除される3,4).以上により,最終的に一本鎖small RNA(ガイド鎖,または,miRNA鎖)とAGOを含むエフェクター複合体であるRNA-induced silencing complex(RISC)が完成する.ガイド鎖(または,miRNA鎖)としてはたらく一本鎖small RNAは,標的mRNAと塩基対を形成することで標的mRNAの認識にあたる.PTGSにおいては,標的mRNAはAGOのエンドヌクレアーゼ活性による切断をうけて分解されるか,あるいは,RISCとの結合をへて翻訳抑制をうける5).いずれにせよ,標的mRNAからのタンパク質合成はRISCにより阻害される.
いくつかの動物細胞抽出液では,二本鎖small RNAの添加により内在性のAGOからRISCを形成させることができる.このため,動物ではRISCの形成や機能に関する知見が積み重ねられてきた.しかしながら,RISC形成の初期段階において二本鎖small RNAがAGOに結合する分子機構はよくわかっていなかった.
2.植物におけるRISC形成
シロイヌナズナのゲノムには10個のAGO遺伝子がコードされていて,それぞれのAGOタンパク質はRNAサイレンシングにおいて一部重複しながらも異なった役割を担っている6).そのなかでも,AGO1はmiRNAを介した成長および形態形成の制御において中心的に機能し,また,siRNAを介したウイルス防御機構においても重要な役割を担っている.AGO1はエンドヌクレアーゼ活性をもち,植物細胞から精製されたAGO1を含むRISCは標的RNAを切断する.AGO1に結合したsmall RNAの塩基配列の解析結果などから,AGO1は5’末端にウリジル酸をもつ約21塩基のsmall RNAに優先して結合することが知られている.
動物細胞抽出液とは異なり,植物細胞抽出液では二本鎖small RNAを添加してもRISCは形成されない.このため,RISC形成に関する生化学的な解析を進めることができず,植物におけるRISC形成機構の解明は動物に比べ大きく後れをとっていた.植物細胞抽出液中でRISCが形成されない原因のひとつとして,植物細胞の大部分をしめる液胞に由来する非特異的なプロテアーゼやヌクレアーゼの混入があげられる.筆者らは,以前の研究において,タバコ培養細胞BY-2の脱液胞化プロトプラスト抽出液にはそうした非特異的なプロテアーゼあるいはヌクレアーゼの混入が少なく,この脱液胞化抽出液を用いることによりタバコモザイクウイルスRNAの翻訳および複製を生体内と同様のパターンで再現できることを示した7).こうした背景から,筆者らは,このBY-2脱液胞化プロトプラスト抽出液を使えばRISCの形成が再現できるのではないかと考えた.そこで,AGO1に取り込まれるようにデザインした合成二本鎖siRNAをこの脱液胞化抽出液に添加し,ここに含まれるAGO1からRISCの形成を試みた.しかしながら,期待に反してRISCは形成されなかった.
植物細胞には,AGO1 mRNAを標的RNAとするmiRNAであるmiR168を介したAGO1遺伝子発現の恒常性維持機構が存在する8).miR168/miR168*二本鎖RNAはなんらかの分子機構によりほかの二本鎖small RNAよりもAGO1に取り込まれにくく,細胞中にはmiR168/miR168*が余っていることが示唆されている(図1a).“空”のAGO1(RISCを形成していないもの)が増加すると,余っていたmiR168/miR168*がAGO1に取り込まれてmiR168を含むRISCが増加する.すると,AGO1 mRNAの分解が促進され,AGO1タンパク質の新規合成が抑制される.これにより,余計なAGO1の合成が阻止される(図1b).筆者らは,このモデルから,BY-2脱液胞化プロトプラスト抽出液に含まれる“空”のAGO1の量が限られているため,ここに二本鎖small RNAを添加しても検出可能な量のRISCが形成されなかったのではないかと考えた.そこで,この脱液胞化抽出液の翻訳活性を利用して合成AGO1 mRNAから新規にAGO1タンパク質を試験管内合成し,そこにAGO1に取り込まれるようにデザインした合成二本鎖siRNAを添加してみた.すると,期待どおり,AGO1はsiRNAの一方の鎖(パッセンジャー鎖)を排除してもう一方の鎖(ガイド鎖)のみを結合し,ガイド鎖と相補的な標的RNAを特異的に切断する活性を獲得した.すなわち,RISCが形成されたのである.同様に,二本鎖miRNAからもRISCが形成された.エンドヌクレアーゼ活性を失わせたAGO1の変異体は,二本鎖siRNAを取り込むことはできたがパッセンジャー鎖を排除することはできなかった.一方,同じAGO1の変異体は,二本鎖miRNAを取り込みmiRNA*を排除した.これらのことから,植物の系においても動物の系と同様に,RISCの形成において,siRNAのパッセンジャー鎖はAGO1によって切断されて除かれるのに対し,miRNAのmiRNA*鎖は切断をへずに除かれることが示唆された.
3.RISC形成における分子シャペロンHSP90の役割
動物のRISC形成にはATPが必要であることが知られているので9),筆者らは,植物のRISC形成にもATPが必要なのかどうか調べた.BY-2脱液胞化プロトプラスト抽出液においてAGO1を試験管内合成したのち,限外ろ過を利用してATPを除去すると,合成二本鎖siRNAを添加してもRISCの形成は起こらなくなった.RISC形成ののちにATPを除去してもRISC活性は影響をうけなかったこととあわせて,この結果から,植物でもRISCの形成にはATPが必要であることがわかった.
動物のRISC形成においてなぜATPが必要なのかは明らかでなかったが,一方で,分子シャペロンのひとつであるHSP90がRNAサイレンシングになんらかの関与をしていることが示唆されていた10).HSP90はホモ2量体として機能するが,ATP結合型HSP90 2量体は標的となるタンパク質(クライアントタンパク質)と安定した複合体を形成し,ATPが加水分解されるとクライアントタンパク質から解離する.この過程で,クライアントタンパク質のフォールディングが促進される11).このモデルは,HSP90の代表的なクライアントタンパク質のひとつである動物のステロイドホルモン受容体の研究などにもとづいて提唱された.HSP90のATP結合部位にATPと競合的に結合するHSP90特異的な阻害剤として,ゲルダナマイシンが知られている.筆者らは,HSP90が植物のRISC形成段階に関与する可能性を,まず,このゲルダナマイシンを用いて検討した.BY-2脱液胞化プロトプラスト抽出液において,AGO1を試験管内合成したのちゲルダナマイシンを添加すると,そののち,合成二本鎖siRNAをくわえてもRISCは形成されなくなった.ゲルダナマイシンはすでに形成されたRISCの活性には影響をあたえなかったこととあわせて,この結果は,HSP90が植物のRISC形成を促進することを示唆した.
では,HSP90はどのような分子機構でRISCの形成を促進しているのだろうか? ATPγSは難加水分解性ATPアナログとして知られるが,BY-2脱液胞化プロトプラスト抽出液において,AGO1を試験管内合成したのちATPγSを添加すると,HSP90(おそらく,ATPγS結合型)とAGO1とを含む複合体が蓄積した.さらに,合成二本鎖siRNAを添加すると,HSP90,AGO1と合成二本鎖siRNAとを含む複合体が蓄積した(合成二本鎖siRNAの一本鎖化は阻害されていた).これらの結果をもとに,筆者らは,① ATP結合型HSP90がAGO1と安定した複合体を形成し,② HSP90と結合したAGO1に二本鎖small RNAが結合し,③ ATP加水分解によりHSP90がAGO1-二本鎖small RNA複合体から解離し,④ AGO1の内部で二本鎖small RNAの一本鎖化が起こる,というRISC形成モデルを提示した(図2).すでに解かれたいくつかのAGOの立体構造から,二本鎖small RNAはAGOにあるRNAの結合する溝にそのまま入り込むには大きすぎるといわれてきた.このRISC形成モデルは,AGO1にHSP90が結合することによってその溝が広がり,二本鎖small RNAが入り込めるようになるという可能性を暗示する.
おわりに
この研究により,植物のAGO1は分子シャペロンHSP90の助けを借りて二本鎖small RNAというリガンドを受容していることが示された.動物においても同様の報告がなされ12,13)(新着論文レビュー でも掲載),RISCの形成における分子シャペロン依存性の普遍性が示唆された.HSP90はクライアントタンパク質によって異なるセットのコシャペロンとともに機能することが知られている.AGO1による二本鎖small RNAの受容にかかわるHSP90以外のコシャペロンなど因子の特定は,今後の課題のひとつである.また,二本鎖small RNAをAGOへとわたすタンパク質複合体(Dcr-2とR2D2のヘテロ2量体)がショウジョウバエのAgo2で報告されている4).しかし,この受け渡しの機構が真核生物において普遍的であるのかどうは定かではない.植物において,二本鎖small RNAがHSP90に結合しているAGO1にどのようにして受け渡されるのかも,今後の重要な課題である.
文 献
- Baulcombe, D.: RNA silencing in plants. Nature, 431, 356-363 (2004) [PubMed]
- Tomari, Y., Zamore, P. D.: Perspective: machines for RNAi. Genes Dev., 19, 517-529 (2005) [PubMed]
- Matranga, C. et al.: Passenger-strand cleavage facilitates assembly of siRNA into Ago2-containing RNAi enzyme complexes. Cell, 123, 607-620 (2005) [PubMed]
- Tomari, Y., Du, T. & Zamore, P. D.: Sorting of Drosophila small silencing RNAs. Cell, 130, 299-308 (2007) [PubMed]
- Carthew, R. W. & Sontheimer, E. J.: Origins and mechanisms of miRNAs and siRNAs. Cell, 136, 642-655 (2009) [PubMed]
- Vaucheret, H.: Plant ARGONAUTES. Trends Plant Sci., 13, 350-358 (2008) [PubMed]
- Komoda, K., Naito, S. & Ishikawa, M.: Replication of plant RNA virus genomes in a cell-free extract of evacuolated plant protoplasts. Proc. Natl. Acad. Sci. USA, 101, 1863-1867 (2004) [PubMed]
- Vaucheret, H., Mallory, A. C. & Bartel, D. P.: AGO1 homeostasis entails coexpression of MIR168 and AGO1 and preferential stabilization of miR168 by AGO1. Mol. Cell, 22, 129-136 (2006) [PubMed]
- Yoda, M. et al.: ATP-dependent human RISC assembly pathways. Nat. Struct. Mol. Biol., 17, 17-23 (2010) [PubMed]
- Johnston, M. et al.: HSP90 protein stabilizes unloaded Argonaute complexes and microscopic P-bodies in human cells. Mol. Biol. Cell, 21, 1462-1469 (2010) [PubMed]
- Pearl, L. H. & Prodromou, C.: Structure and mechanism of the Hsp90 molecular chaperone machinery. Annu. Rev. Biochem., 75, 271-294 (2006) [PubMed]
- Iwasaki, S. et al.: Hsc70/Hsp90 chaperone machinery mediates ATP-dependent RISC loading of small RNA duplexes. Mol. Cell, 39, 292-299 (2010) [PubMed] [新着論文レビュー]
- Miyoshi, T. et al.: A direct role for Hsp90 in pre-RISC formation in Drosophila. Nat. Struct. Mol. Biol., 17, 1024-1026 (2010) [PubMed]
著者プロフィール
2008年 東京大学大学院農学生命科学研究科 博士課程 修了,同年より農業生物資源研究所植物科学研究領域 特別研究員.
研究テーマ:植物におけるRNAサイレンシングの分子機構.
関心事:RNAサイレンシング,mRNAメタボリズム,分子シャペロン,ウイルス複製,根粒形成.
石川 雅之(Masayuki Ishikawa)
農業生物資源研究所植物科学研究領域 上級研究員.
© 2010 井木太一郎・石川雅之 Licensed under CC 表示 2.1 日本