アニオン透過型のチャネルロドプシンにおけるイオンの選択性およびキネティクスの構造基盤
加藤英明1・Yoon Seok Kim 2・Karl Deisseroth 2
(1米国Stanford大学School of Medicine,Department of Molecular and Cellular Physiology,2米国Stanford大学Department of Bioengineering)
email:加藤英明
DOI: 10.7875/first.author.2018.092
Structural mechanisms of selectivity and gating in anion channelrhodopsins.
Hideaki E. Kato, Yoon Seok Kim, Joseph M. Paggi, Kathryn E. Evans, William E. Allen, Claire Richardson, Keiichi Inoue, Shota Ito, Charu Ramakrishnan, Lief E. Fenno, Keitaro Yamashita, Daniel Hilger, Soo Yeun Lee, Andre Berndt, Kang Shen, Hideki Kandori, Ron O. Dror, Brian K. Kobilka, Karl Deisseroth
Nature, 561, 349-354 (2018)
ヒトを含め多くの生物はロドプシンとよばれるタンパク質を用いて光を受容するが,なかでも近年,光を感受してイオンを輸送するイオン輸送型のロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして,とくに神経科学の分野における光遺伝学的な手法として非常な注目をあびている.このような状況において,2014年には,光駆動性のカチオンチャネルをもとに光駆動性のアニオンチャネルであるiC1C2およびChloCが開発され,さらにその翌年には,自然界より光駆動性のアニオンチャネルが発見されGtACR1およびGtACR2と名づけられた.そののち,iC1C2およびChloCはiC++およびiChloCへと改良され,GtACR1およびGtACR2とともに,幅広いモデル生物において神経活動を効率的に抑制する光遺伝学な手法のツールとして利用されている.しかしながら,2005年よりツールの開発が進められてきた光駆動性のカチオンチャネルと比較して,単離あるいは開発から日の浅い光駆動性のアニオンチャネルはツールとしての多様性が低く,改良の余地が多く残されていた.また,人工型のアニオンチャネルと天然型のアニオンチャネルとのあいだにはコンダクタンスやキネティクスといったさまざまな面において違いがあり,これらの違いがどのように生じるのかといった問題が残されていた.この研究において,筆者らは,人工型のアニオンチャネルであるiC++の結晶構造を決定した.さらに,同じ時期に構造を解析した天然型のアニオンチャネルであるGtACR1との比較により,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンは,全体構造こそ類似しているが,キネティクス,コンダクタンス,イオンの選択性といった性質は異なっており,このことより性質の違いが生じることが明らかにされた.さらに,立体構造をもとにGtACR1のアミノ酸配列を改変することにより,高いコンダクタンスおよびアニオンの高い選択性を保持しながら速いキネティクスをもつアニオンチャネルロドプシンであるFLASHを開発した.FLASHを既存のアニオンチャネルロドプシンであるZipACRとin vitroおよびin vivoにおいて比較することにより,FLASHが実際にすぐれた光遺伝学的な手法のツールであることが実証された.今回の結果は,単に光駆動性のアニオンチャネルの立体構造を解析したという点にとどまらない.自然界が進化という手法を用いて,そして,ヒトがタンパク質工学という手法を用いて開発したアニオンチャネルロドプシンどうしを比較することにより,イオンチャネルの性質を規定する構造基盤の一端を明らかにし,さらには,その知見をもって新規の光遺伝学的な手法のツールを開発しその有用性の実証までふみこんだという点で,今後のロドプシンの研究,また,光遺伝学的な手法の開発にひとつの指針をあたえ,幅広い研究分野に大きな影響をおよぼすことが期待される.
ヒトから微生物までほとんどの生物は光を受容しその情報に応じた行動をとるが,多くの場合,光の受容はロドプシンとよばれるタンパク質により担われる.通常,ロドプシンはタンパク質であるオプシンにビタミンAの誘導体であるレチナールが結合した状態で機能しており,オプシンのアミノ酸配列の違いにより動物型のロドプシンと微生物型のロドプシン,そして,ヘリオロドプシンに大別される.おもにGタンパク質共役型受容体としてはたらく動物型のロドプシンと比較して,微生物型のロドプシンの機能はセンサー,酵素,イオンチャネル,イオンポンプなど多岐にわたる.なかでも近年,イオン輸送型のロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして利用が可能であることが判明し,とくに神経科学の分野における光遺伝学的な手法として非常な注目をあつめている.2005年および2006年に日本,ドイツ,米国の複数の研究グループが光駆動性のカチオンチャネルであるチャネルロドプシン2を用いてニューロンを興奮させることに成功して以来,さまざまな研究グループがイオン輸送型のロドプシンを用いた光遺伝学的な手法のツールを開発してきた1).微生物型のロドプシンとしてバクテリオロドプシンがはじめて単離されてから40年あまり,イオン輸送型のロドプシンとして報告されていたのは,カチオンチャネル,外向きH+ポンプ,内向きCl-ポンプのわずか3種類であった.カチオンの細胞への取り込みあるいはアニオンの細胞からの排出は膜電位の脱分極をひき起こしニューロンを興奮させる.逆に,カチオンの細胞からの排出あるいははアニオンの細胞への取り込みは膜電位を過分極させニューロンの興奮を抑制する.そのため,光駆動性のカチオンチャネルであるChR2はニューロンを興奮させるツールとして,また,外向きH+ポンプであるアーキロドプシン3や内向きCl-ポンプであるハロロドプシンはニューロンの興奮を抑制するツールとして利用されてきた.しかし,一般にイオンポンプとイオンチャネルとを比較すると,イオンチャネルのほうがコンダクタンスは圧倒的に高い.また,光駆動性のイオンポンプは光駆動性のイオンチャネルと比較して光感受性が低いといった問題が存在した.そのため,ニューロンを興奮させるツールと同様に,ニューロンの興奮を抑制させるツールにおいてもイオンチャネル型が望ましいと考えられていた.
そうした状況において,2012年,筆者らが光駆動性のカチオンチャネルであるC1C2の結晶構造を解明し2)(新着論文レビュー でも掲載),2014年には,その構造情報にもとづき変異を導入することにより,米国の研究グループおよびドイツの研究グループが光駆動性のカチオンチャネルをアニオンチャネルであるiC1C2およびChloCへと変換した3,4).翌年,この2つの研究グループはiC1C2およびChloCにさらなる変異を導入することによりその性質を向上させたiC++およびiChloCを報告した5,6).さらに同年,別の米国の研究グループがGuillardia thetaとよばれる緑藻から光駆動性のアニオンチャネルであるGtACR1およびGtACR2を単離した7).これら人工型および天然型のアニオンチャネルロドプシンの出現により,ニューロンの興奮を抑制させるツールのかかえていたコンダクタンスや光感受性の問題は解決されつつある.しかしながら,発見より日が浅くその立体構造すら未知であったアニオンチャネルロドプシンは,カチオンチャネルロドプシンと比較してツールの改良が遅れていた.また,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンのあいだには,天然型のほうが人工型よりも一般的にコンダクタンスが高い,人工型は天然型と比較して利用の可能なキネティクスの範囲が広い,といった,いわば一長一短の関係が存在した.そのため,天然型および人工型のアニオンチャネルロドプシンの立体構造を解明しその構造機能相関を明らかにすることは,光駆動性のアニオンチャネルという新規の機能をもつロドプシンへの理解を深めるのみならず,人工型と天然型のアニオンチャネルロドプシンの長所を組み合わせることにより,光遺伝学的な手法における新しい抑制性のツールを開発する可能性をひめていた.
現在まで,in vivoにおける光遺伝学的な実験においてもっとも頻繁に用いられる人工型のアニオンチャネルロドプシンはiC++であったため,これを構造解析の対象とした.iC++は以前に構造を解析したC1C2に10個のアミノ酸変異を導入したタンパク質であったため,C1C2とほぼ同様の手法を用いて発現および精製し,脂質キュービック法を利用して結晶化した.その結果,pH 6.5およびpH 8.5という2つの条件において,その暗状態における結晶構造がそれぞれ3.2Åおよび2.9Åという分解能で決定された(PDB ID:6CSO,および,PDB ID:6CSN).以降,分解能の高いpH 8.5の構造について述べる.
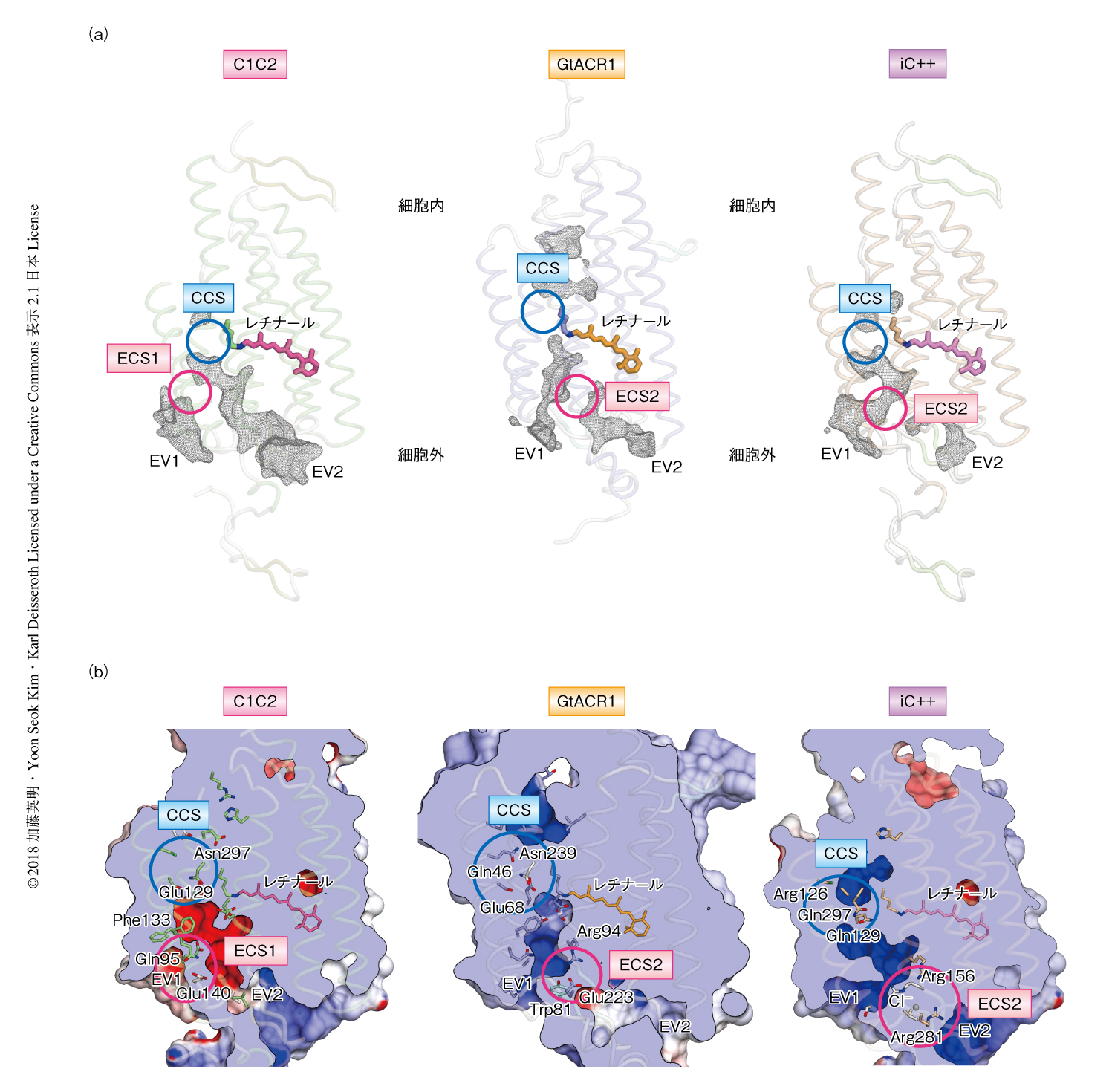
同じ時期に天然型のアニオンチャネルロドプシンであるGtACR1の結晶構造も解析したため8),iC++とGtACR1,そして,カチオンチャネルロドプシンであるC1C2の構造を比較した.C1C2およびGtACR1を含め,これまでに構造が解析されたチャネル型のロドプシンは,すべて4本の膜貫通ヘリックスによりかこまれたイオンの透過経路をもつが,iC++も同様であった.また,これらの構造を用いてイオンの透過経路の静電ポテンシャルを計算したところ,C1C2では透過経路の表面が強く負に帯電していた一方,GtACR1およびiC++ではこれが正に帯電していた.これは,C1C2がカチオンチャネル,GtACR1およびiC++がアニオンチャネルとしてはたらくことを非常によく説明した(図1).
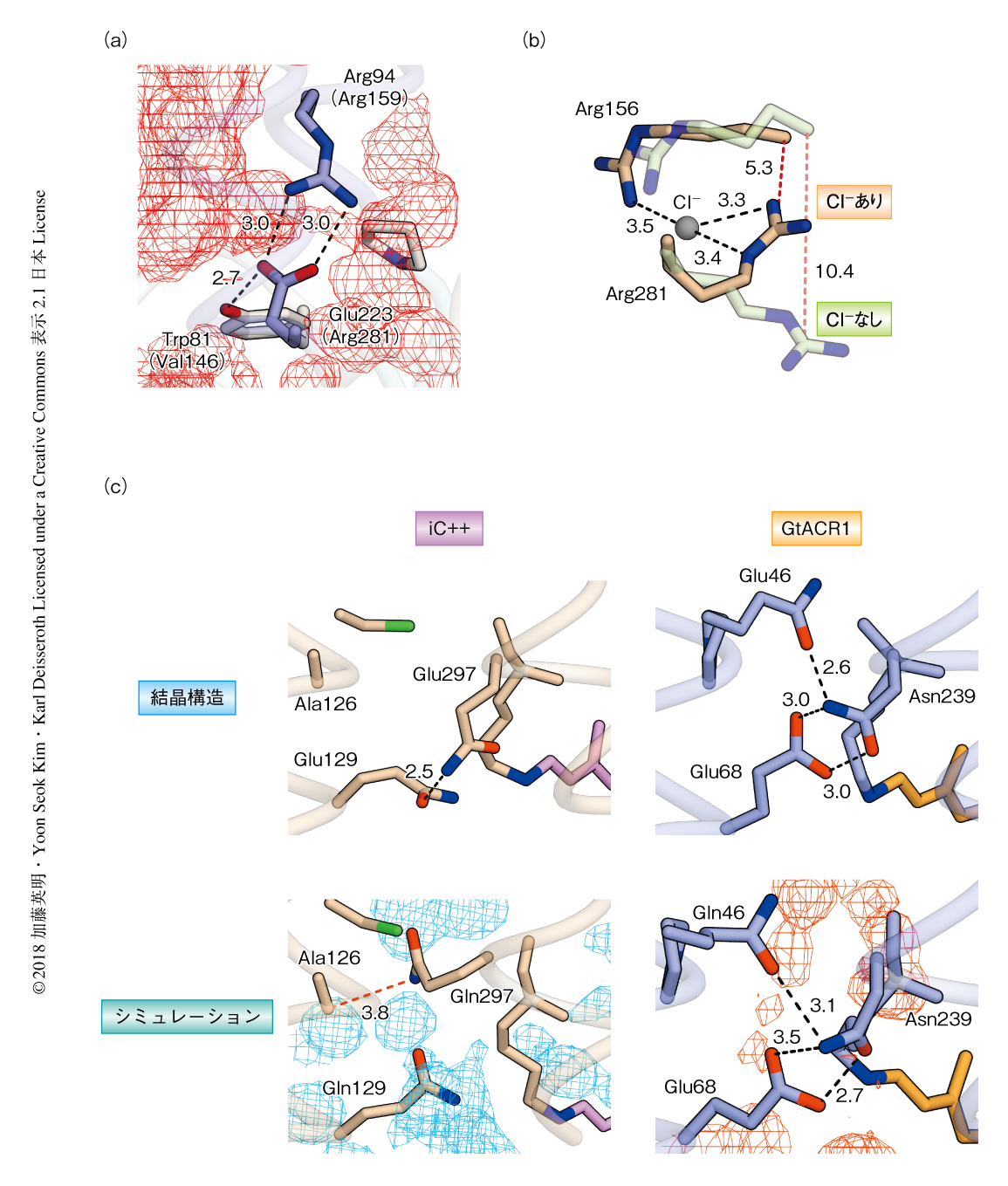
C1C2,GtACR1,iC++はいずれも暗条件において結晶化されており,結晶構造は閉状態の構造を表わすと考えられた.イオンの透過経路の細胞外側に存在する狭窄部位ECSに着目した.C1C2およびGtACR1には細胞外側からイオンの透過経路の中心へとむかう2つの空洞,EV1およびEV2が存在し,それはiC++においても同様であった.しかしながら,C1C2の結晶構造においては実際にイオンの透過経路の中心へとつながるのはEV2のみであったのに対し,GtACR1およびiC++の結晶構造においては逆にEV1のみがイオンの透過経路の中心へとつながっていた(図1a).これは,iC++がC1C2に変異を導入して作製されたことを考慮すると予想外であった.EV1あるいはEV2とイオンの透過経路の中心とをへだてる狭窄部位ECS1あるいはECS2について,iC++およびGtACR1に存在するECS2の性質を調べるため分子動力学シミュレーションを実施した.その結果,GtACR1のECS2を構成する3つのアミノ酸残基のあいだの相互作用は非常に強固であった一方(図1b,図2a),iC++のECS2を構成するArg156とArg281のあいだの相互作用は壊れやすく,Arg281は先端を細胞外につき出した構造とイオンの透過経路の中心にむいた構造の2つのコンフォメーションをとることが判明した(図1b,図2b,図2c).このコンフォメーションの違いが何に起因するのかを解析したところ,Arg156とArg281のあいだに水分子ではなくCl-が存在するときのみArg281はイオンの透過経路の中心にむいた構造をとり,Arg156とArg281のあいだの相互作用が安定化されることが見い出された.このことは,結晶構造においてArg156とArg281のあいだに強い電子密度が観測される事実とも一致した.さらに,GtACR1およびiC++においてECS2を構成するあわせて5つのアミノ酸残基に変異を導入し電気生理的な性質を解析した.その結果,GtACR1の変異体においては光の照射ののちチャネルが閉じるまでの時間が有意に長くなること,そして,iC++の変異体,とくにArg281の変異体においてはチャネルの活性がいちじるしく低下することが見い出された.このことは,人工型のアニオンチャネルロドプシンであるiC++と天然型のアニオンチャネルロドプシンであるGtACR1は,イオンの透過経路としてよく似たアーキテクチャをもつにもかかわらず,ECS2という共通の構造の役割がまったく異なることを示していた.GtACR1のECS2を構成するアミノ酸残基とそのあいだの相互作用は光の照射ののちチャネルが閉状態にもどるのに重要であり,iC++のECS2を構成するアミノ酸残基はキネティクスよりもイオンの透過そのものに重要,おそらく,Arg281には細胞の外に存在するCl-をイオンの透過経路にひき込むはたらきがあるのではないかと考えられた.
iC++とGtACR1とのあいだのもうひとつの共通の構造であるイオンの透過経路の中央に存在する狭窄部位CCSに着目した.結晶構造において,GtACR1のCCSは3つのアミノ酸残基から構成される一方,iC++のCCSはGln129およびGln297から構成されていた.ECS2と同様にiC++およびGtACR1を対象に分子動力学シミュレーションを実施したところ,GtACR1のCCSは安定である一方,iC++のCCSを構成するアミノ酸残基の相互作用は壊れやすく,Gln297はGln129よりむしろAla126と安定な疎水性の相互作用を形成することにより狭窄部位を維持していた.これらのアミノ酸残基の役割をさらに調べるため,GtACR1およびiC++においてCCSを構成するあわせて5つのアミノ酸残基に変異を導入しその性質を調べた.その結果,iC++のGln129を負電荷をもつGluに置換したところ反転電位がいちじるしく上昇し,とくにGln129をGlu,Gln297をAsnに置換した二重変異体においては反転電位が約-60 mVから約-20 mVまで上昇した.反転電位とは,イオンチャネルにおいてその電流値がゼロになる膜電位を意味する.理想的なイオンチャネルにおける反転電位はNernstの式より計算され,生理的な条件における理想的なCl-チャネルの反転電位は-60~-70 mV,非選択的なカチオンチャネルは0 mV付近となる.生理的な条件に近いイオン組成においてiC++およびその二重変異体の反転電位がそれぞれ約-60 mVおよび約-20 mVであったということは,iC++はもともと光駆動性のCl-チャネルであったことを考慮すると,二重変異体においてはイオンの選択性が低下しアニオンと同時にカチオンを透過していると考えられた.つまり,iC++においてはCCSを構成するアミノ酸残基の静電ポテンシャルや側鎖の大きさがイオンの選択性に大きく寄与するといえた.一方で,GtACR1のCCSに変異を導入しても反転電位の上昇はiC++と比較してわずかであり,Gln129に相当するアミノ酸残基はもともとGluであった.そのため,GtACR1におけるイオンの選択性はどのような構造基盤により規定されるのかという問いが生じた.
GtACR1におけるイオンの選択性を調べるにあたり,ふたたび,その分子表面の静電ポテンシャルに着目した.GtACR1の分子表面には正電荷を帯びたアミノ酸残基が多く分布しており,これがGtACR1におけるイオンの選択性に重要な役割をはたすことが予想された.これら12残基のアミノ酸残基についてそれぞれAla変異体を作製し反転電位を測定した結果,イオンの透過経路の近傍に存在するアミノ酸残基に変異を導入すると反転電位は-30~-40 mVまで上昇することが判明した.
iC++においてCCSを構成するアミノ酸残基の性質はイオンの選択性に大きく寄与していた.それでは,GtACR1においてCCSを構成するアミノ酸残基にはいかなる役割があるのだろうか.GtACR1においてCCSを構成するアミノ酸残基に変異を導入する過程において,いくつかの変異の導入によりチャネルの閉速度が劇的に速くなることが見い出された.このうち,Asn239をGluに置換した変異体は野生型のGtACR1と同様にアニオンに対する高い選択性と高いチャネル活性を維持しながら,野生型と比較して20倍以上も速いチャネルの閉速度をもつことが判明したため,この変異体にArg83のGluへの置換をくわえた変異体をFLASH(fast, light-activated anion-selective rhodopsin)と名づけた.閉速度の速いアニオンチャネルロドプシンとして,2017年に米国の研究グループがZipACRとよばれる新しい天然型のアニオンチャネルロドプシンを報告していたため9),FLASHとZipACRのどちらが光遺伝学的な手法における抑制性のツールとしてすぐれているのか性能を比較した.HEK細胞および培養ニューロンを用いて電気生理学的な実験を実施したところ,FLASHとZipACRは同じ程度のチャネル活性をもち,閉速度はZipACRのほうがわずかに速いが,どちらも少なくとも約40 Hzの神経発火であれば単一のスパイクのレベルで抑制が可能なことがわかった.しかしながら,反転電位に着目すると,ZipACRはFLASHと比較して約15 mVも高い値を示した.このことは,ZipACRがアニオンだけでなくカチオンも透過してしまうことを意味し,実際に,ZipACRを発現させたHEK細胞の静止膜電位を-40 mV,-50 mV,-60 mV…と下げつつ光を照射したところ,-50 mV以下の静止膜電位では膜電位が過分極するのではなく脱分極し神経発火が生じた.さらに,海馬にFLASHあるいはZipACRを発現させたマウスの脳切片を用いて,より生理的な環境に近い条件において電気生理学的な実験を実施したが,結果は同様であった.くわえて,多点電極を用いて海馬に発現させたFLASHあるいはZipACRによるニューロンの抑制の効率をin vivoにおいて評価したが,やはりFLASHの優位性が示された.最後に,FLASHあるいはZipACRを線虫の筋細胞およびコリン作動性ニューロンに発現させ,FLASHあるいはZipACRの活性化にともなう線虫の移動運動の阻害の効率を評価したが,ここでもFLASHはZipACRよりも効率よく行動を阻害した.以上の結果から,光遺伝学的な手法においてすばやい閉速度をもつ抑制性のツールとしては,FLASHが第1の選択肢となりうると結論づけられた.
この研究において,筆者らは,人工型のアニオンチャネルロドプシンであるiC++の結晶構造を解明し,これを同じ時期に構造を解析したGtACR1と比較することにより,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンは類似した構造的な特徴をもつにもかかわらず,その役割はまったく異なることを見い出した.たとえば,人工型のアニオンチャネルロドプシンにおいて細胞外側に存在する狭窄部位は基質の輸送に重要と考えられた一方,天然型のアニオンチャネルロドプシンにおいてはチャネルの開閉速度に重要であった.また,人工型および天然型のアニオンチャネルロドプシンはイオンの透過経路の内部および周辺の静電ポテンシャルによりアニオンに対する高い選択性を獲得しているが,より詳細にみていくと,人工型のアニオンチャネルロドプシンにおいてはイオンの透過経路の中央に存在する狭窄部位がより重要であり,天然型のアニオンチャネルロドプシンにおいては細胞内側のイオンの透過経路の周辺のアミノ酸残基がより重要であるなど,寄与の大きなアミノ酸残基の分布は異なっていた.一般的に,人工型のアニオンチャネルロドプシンは天然型のアニオンチャネルロドプシンよりもチャネル活性が低いことが報告されているが,これは,人工型のアニオンチャネルロドプシンにおいて正電荷をもつアミノ酸残基がイオンの透過経路の周辺ではなくイオンの透過経路の内部に分布しており,アニオンが透過経路の内部に強く結合しすぎてしまうためではないかと予想された.また,天然型のアニオンチャネルロドプシンにおいてイオンの透過経路の中央に存在する狭窄部位を構成するアミノ酸残基はチャネルの閉速度を決定するのに重要であることが見い出され,新しい変異体FLASHが開発された.今後,“クローズドループ”光遺伝学の技術と組み合わせることにより,生理的なニューロンの発火頻度を(ゼロにするのではなく)減少させたときの影響を解析する,といった研究に利用されると思われる.
筆者らは,iC++のほかGtACR1の構造も解析し8),Nature誌のArticleとして2報を発表した.ここでは,より内容の濃いiC++の構造解析の論文についてレビューをしたが,わずかではあるがGtACR1の構造解析の論文の内容についてもふれている.
さて,論文こそ同時に投稿したが,じつは,iC++とGtACR1とでは構造解析に成功した時期に大きな違いがある.iC++は以前に構造を解析したC1C2に10アミノ酸残基の変異を導入しただけのタンパク質であったため,その構造解析は特別むずかしくはなかった.しかし,iC++の構造をながめても,そのおもしろさをどう抽出したらよいのか考えがまとまらず,いちどはお蔵入りになりかけていたのである.しかし,1年後にGtACR1の構造解析が成功し,両者を比較しはじめてから状況は一変した.iC++という人工型のアニオンチャネルロドプシンとGtACR1という天然型のアニオンチャネルロドプシンはいっけん似た構造をとり,機能としても同じ光駆動性のアニオンチャネルでありながら,まったく違っていた.共同研究者の助けを借り,計算科学的な手法,また,電気生理学的な手法を用いて解析を深めていくうち,これは別々の論文として発表すべきであると確信し,共同研究先の研究室主宰者を徹夜で作成した図を見せながら説得し,大きく方向を転換した.おかげで年末年始の休みを返上し研究室にひきこもって2報の論文の原稿を同時に書き上げる羽目になったのだが,結果的にみれば,この選択は正解であった.なお,Nature誌に論文を投稿した2日後,競争相手である研究グループがGtACR1の構造解析の論文をプレプリントリポジトリであるBioRxivに発表した(DOI:10.1101/405308).紙一重の差であり,今回もまた,よい研究環境,そして,よい研究グループに恵まれたことを感謝するばかりである.
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,同年より米国Stanford大学School of Medicine研究員.2017年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:ロドプシンおよびGタンパク質共役型受容体の構造機能解析および構造情報を用いたタンパク質工学.
関心事:つぎの行き先.
Yoon Seok Kim
米国Stanford大学大学院 在学中.
Karl Deisseroth
米国Stanford大学 教授.
© 2018 加藤英明・Yoon Seok Kim・Karl Deisseroth Licensed under CC 表示 2.1 日本
(1米国Stanford大学School of Medicine,Department of Molecular and Cellular Physiology,2米国Stanford大学Department of Bioengineering)
email:加藤英明
DOI: 10.7875/first.author.2018.092
Structural mechanisms of selectivity and gating in anion channelrhodopsins.
Hideaki E. Kato, Yoon Seok Kim, Joseph M. Paggi, Kathryn E. Evans, William E. Allen, Claire Richardson, Keiichi Inoue, Shota Ito, Charu Ramakrishnan, Lief E. Fenno, Keitaro Yamashita, Daniel Hilger, Soo Yeun Lee, Andre Berndt, Kang Shen, Hideki Kandori, Ron O. Dror, Brian K. Kobilka, Karl Deisseroth
Nature, 561, 349-354 (2018)
要 約
ヒトを含め多くの生物はロドプシンとよばれるタンパク質を用いて光を受容するが,なかでも近年,光を感受してイオンを輸送するイオン輸送型のロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして,とくに神経科学の分野における光遺伝学的な手法として非常な注目をあびている.このような状況において,2014年には,光駆動性のカチオンチャネルをもとに光駆動性のアニオンチャネルであるiC1C2およびChloCが開発され,さらにその翌年には,自然界より光駆動性のアニオンチャネルが発見されGtACR1およびGtACR2と名づけられた.そののち,iC1C2およびChloCはiC++およびiChloCへと改良され,GtACR1およびGtACR2とともに,幅広いモデル生物において神経活動を効率的に抑制する光遺伝学な手法のツールとして利用されている.しかしながら,2005年よりツールの開発が進められてきた光駆動性のカチオンチャネルと比較して,単離あるいは開発から日の浅い光駆動性のアニオンチャネルはツールとしての多様性が低く,改良の余地が多く残されていた.また,人工型のアニオンチャネルと天然型のアニオンチャネルとのあいだにはコンダクタンスやキネティクスといったさまざまな面において違いがあり,これらの違いがどのように生じるのかといった問題が残されていた.この研究において,筆者らは,人工型のアニオンチャネルであるiC++の結晶構造を決定した.さらに,同じ時期に構造を解析した天然型のアニオンチャネルであるGtACR1との比較により,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンは,全体構造こそ類似しているが,キネティクス,コンダクタンス,イオンの選択性といった性質は異なっており,このことより性質の違いが生じることが明らかにされた.さらに,立体構造をもとにGtACR1のアミノ酸配列を改変することにより,高いコンダクタンスおよびアニオンの高い選択性を保持しながら速いキネティクスをもつアニオンチャネルロドプシンであるFLASHを開発した.FLASHを既存のアニオンチャネルロドプシンであるZipACRとin vitroおよびin vivoにおいて比較することにより,FLASHが実際にすぐれた光遺伝学的な手法のツールであることが実証された.今回の結果は,単に光駆動性のアニオンチャネルの立体構造を解析したという点にとどまらない.自然界が進化という手法を用いて,そして,ヒトがタンパク質工学という手法を用いて開発したアニオンチャネルロドプシンどうしを比較することにより,イオンチャネルの性質を規定する構造基盤の一端を明らかにし,さらには,その知見をもって新規の光遺伝学的な手法のツールを開発しその有用性の実証までふみこんだという点で,今後のロドプシンの研究,また,光遺伝学的な手法の開発にひとつの指針をあたえ,幅広い研究分野に大きな影響をおよぼすことが期待される.
はじめに
ヒトから微生物までほとんどの生物は光を受容しその情報に応じた行動をとるが,多くの場合,光の受容はロドプシンとよばれるタンパク質により担われる.通常,ロドプシンはタンパク質であるオプシンにビタミンAの誘導体であるレチナールが結合した状態で機能しており,オプシンのアミノ酸配列の違いにより動物型のロドプシンと微生物型のロドプシン,そして,ヘリオロドプシンに大別される.おもにGタンパク質共役型受容体としてはたらく動物型のロドプシンと比較して,微生物型のロドプシンの機能はセンサー,酵素,イオンチャネル,イオンポンプなど多岐にわたる.なかでも近年,イオン輸送型のロドプシンは光の照射により任意のニューロンを興奮あるいは抑制させることのできるツールとして利用が可能であることが判明し,とくに神経科学の分野における光遺伝学的な手法として非常な注目をあつめている.2005年および2006年に日本,ドイツ,米国の複数の研究グループが光駆動性のカチオンチャネルであるチャネルロドプシン2を用いてニューロンを興奮させることに成功して以来,さまざまな研究グループがイオン輸送型のロドプシンを用いた光遺伝学的な手法のツールを開発してきた1).微生物型のロドプシンとしてバクテリオロドプシンがはじめて単離されてから40年あまり,イオン輸送型のロドプシンとして報告されていたのは,カチオンチャネル,外向きH+ポンプ,内向きCl-ポンプのわずか3種類であった.カチオンの細胞への取り込みあるいはアニオンの細胞からの排出は膜電位の脱分極をひき起こしニューロンを興奮させる.逆に,カチオンの細胞からの排出あるいははアニオンの細胞への取り込みは膜電位を過分極させニューロンの興奮を抑制する.そのため,光駆動性のカチオンチャネルであるChR2はニューロンを興奮させるツールとして,また,外向きH+ポンプであるアーキロドプシン3や内向きCl-ポンプであるハロロドプシンはニューロンの興奮を抑制するツールとして利用されてきた.しかし,一般にイオンポンプとイオンチャネルとを比較すると,イオンチャネルのほうがコンダクタンスは圧倒的に高い.また,光駆動性のイオンポンプは光駆動性のイオンチャネルと比較して光感受性が低いといった問題が存在した.そのため,ニューロンを興奮させるツールと同様に,ニューロンの興奮を抑制させるツールにおいてもイオンチャネル型が望ましいと考えられていた.
そうした状況において,2012年,筆者らが光駆動性のカチオンチャネルであるC1C2の結晶構造を解明し2)(新着論文レビュー でも掲載),2014年には,その構造情報にもとづき変異を導入することにより,米国の研究グループおよびドイツの研究グループが光駆動性のカチオンチャネルをアニオンチャネルであるiC1C2およびChloCへと変換した3,4).翌年,この2つの研究グループはiC1C2およびChloCにさらなる変異を導入することによりその性質を向上させたiC++およびiChloCを報告した5,6).さらに同年,別の米国の研究グループがGuillardia thetaとよばれる緑藻から光駆動性のアニオンチャネルであるGtACR1およびGtACR2を単離した7).これら人工型および天然型のアニオンチャネルロドプシンの出現により,ニューロンの興奮を抑制させるツールのかかえていたコンダクタンスや光感受性の問題は解決されつつある.しかしながら,発見より日が浅くその立体構造すら未知であったアニオンチャネルロドプシンは,カチオンチャネルロドプシンと比較してツールの改良が遅れていた.また,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンのあいだには,天然型のほうが人工型よりも一般的にコンダクタンスが高い,人工型は天然型と比較して利用の可能なキネティクスの範囲が広い,といった,いわば一長一短の関係が存在した.そのため,天然型および人工型のアニオンチャネルロドプシンの立体構造を解明しその構造機能相関を明らかにすることは,光駆動性のアニオンチャネルという新規の機能をもつロドプシンへの理解を深めるのみならず,人工型と天然型のアニオンチャネルロドプシンの長所を組み合わせることにより,光遺伝学的な手法における新しい抑制性のツールを開発する可能性をひめていた.
1.iC++の結晶構造の解析
現在まで,in vivoにおける光遺伝学的な実験においてもっとも頻繁に用いられる人工型のアニオンチャネルロドプシンはiC++であったため,これを構造解析の対象とした.iC++は以前に構造を解析したC1C2に10個のアミノ酸変異を導入したタンパク質であったため,C1C2とほぼ同様の手法を用いて発現および精製し,脂質キュービック法を利用して結晶化した.その結果,pH 6.5およびpH 8.5という2つの条件において,その暗状態における結晶構造がそれぞれ3.2Åおよび2.9Åという分解能で決定された(PDB ID:6CSO,および,PDB ID:6CSN).以降,分解能の高いpH 8.5の構造について述べる.
2.C1C2,GtACR1,iC++におけるイオンの透過経路の静電ポテンシャル
同じ時期に天然型のアニオンチャネルロドプシンであるGtACR1の結晶構造も解析したため8),iC++とGtACR1,そして,カチオンチャネルロドプシンであるC1C2の構造を比較した.C1C2およびGtACR1を含め,これまでに構造が解析されたチャネル型のロドプシンは,すべて4本の膜貫通ヘリックスによりかこまれたイオンの透過経路をもつが,iC++も同様であった.また,これらの構造を用いてイオンの透過経路の静電ポテンシャルを計算したところ,C1C2では透過経路の表面が強く負に帯電していた一方,GtACR1およびiC++ではこれが正に帯電していた.これは,C1C2がカチオンチャネル,GtACR1およびiC++がアニオンチャネルとしてはたらくことを非常によく説明した(図1).
3.iC++およびGtACR1におけるイオンの透過経路の細胞外側に存在する狭窄部位
C1C2,GtACR1,iC++はいずれも暗条件において結晶化されており,結晶構造は閉状態の構造を表わすと考えられた.イオンの透過経路の細胞外側に存在する狭窄部位ECSに着目した.C1C2およびGtACR1には細胞外側からイオンの透過経路の中心へとむかう2つの空洞,EV1およびEV2が存在し,それはiC++においても同様であった.しかしながら,C1C2の結晶構造においては実際にイオンの透過経路の中心へとつながるのはEV2のみであったのに対し,GtACR1およびiC++の結晶構造においては逆にEV1のみがイオンの透過経路の中心へとつながっていた(図1a).これは,iC++がC1C2に変異を導入して作製されたことを考慮すると予想外であった.EV1あるいはEV2とイオンの透過経路の中心とをへだてる狭窄部位ECS1あるいはECS2について,iC++およびGtACR1に存在するECS2の性質を調べるため分子動力学シミュレーションを実施した.その結果,GtACR1のECS2を構成する3つのアミノ酸残基のあいだの相互作用は非常に強固であった一方(図1b,図2a),iC++のECS2を構成するArg156とArg281のあいだの相互作用は壊れやすく,Arg281は先端を細胞外につき出した構造とイオンの透過経路の中心にむいた構造の2つのコンフォメーションをとることが判明した(図1b,図2b,図2c).このコンフォメーションの違いが何に起因するのかを解析したところ,Arg156とArg281のあいだに水分子ではなくCl-が存在するときのみArg281はイオンの透過経路の中心にむいた構造をとり,Arg156とArg281のあいだの相互作用が安定化されることが見い出された.このことは,結晶構造においてArg156とArg281のあいだに強い電子密度が観測される事実とも一致した.さらに,GtACR1およびiC++においてECS2を構成するあわせて5つのアミノ酸残基に変異を導入し電気生理的な性質を解析した.その結果,GtACR1の変異体においては光の照射ののちチャネルが閉じるまでの時間が有意に長くなること,そして,iC++の変異体,とくにArg281の変異体においてはチャネルの活性がいちじるしく低下することが見い出された.このことは,人工型のアニオンチャネルロドプシンであるiC++と天然型のアニオンチャネルロドプシンであるGtACR1は,イオンの透過経路としてよく似たアーキテクチャをもつにもかかわらず,ECS2という共通の構造の役割がまったく異なることを示していた.GtACR1のECS2を構成するアミノ酸残基とそのあいだの相互作用は光の照射ののちチャネルが閉状態にもどるのに重要であり,iC++のECS2を構成するアミノ酸残基はキネティクスよりもイオンの透過そのものに重要,おそらく,Arg281には細胞の外に存在するCl-をイオンの透過経路にひき込むはたらきがあるのではないかと考えられた.
4.iC++およびGtACR1におけるイオンの透過経路の中央に存在する狭窄部位
iC++とGtACR1とのあいだのもうひとつの共通の構造であるイオンの透過経路の中央に存在する狭窄部位CCSに着目した.結晶構造において,GtACR1のCCSは3つのアミノ酸残基から構成される一方,iC++のCCSはGln129およびGln297から構成されていた.ECS2と同様にiC++およびGtACR1を対象に分子動力学シミュレーションを実施したところ,GtACR1のCCSは安定である一方,iC++のCCSを構成するアミノ酸残基の相互作用は壊れやすく,Gln297はGln129よりむしろAla126と安定な疎水性の相互作用を形成することにより狭窄部位を維持していた.これらのアミノ酸残基の役割をさらに調べるため,GtACR1およびiC++においてCCSを構成するあわせて5つのアミノ酸残基に変異を導入しその性質を調べた.その結果,iC++のGln129を負電荷をもつGluに置換したところ反転電位がいちじるしく上昇し,とくにGln129をGlu,Gln297をAsnに置換した二重変異体においては反転電位が約-60 mVから約-20 mVまで上昇した.反転電位とは,イオンチャネルにおいてその電流値がゼロになる膜電位を意味する.理想的なイオンチャネルにおける反転電位はNernstの式より計算され,生理的な条件における理想的なCl-チャネルの反転電位は-60~-70 mV,非選択的なカチオンチャネルは0 mV付近となる.生理的な条件に近いイオン組成においてiC++およびその二重変異体の反転電位がそれぞれ約-60 mVおよび約-20 mVであったということは,iC++はもともと光駆動性のCl-チャネルであったことを考慮すると,二重変異体においてはイオンの選択性が低下しアニオンと同時にカチオンを透過していると考えられた.つまり,iC++においてはCCSを構成するアミノ酸残基の静電ポテンシャルや側鎖の大きさがイオンの選択性に大きく寄与するといえた.一方で,GtACR1のCCSに変異を導入しても反転電位の上昇はiC++と比較してわずかであり,Gln129に相当するアミノ酸残基はもともとGluであった.そのため,GtACR1におけるイオンの選択性はどのような構造基盤により規定されるのかという問いが生じた.
5.GtACR1におけるイオンの選択性の構造基盤
GtACR1におけるイオンの選択性を調べるにあたり,ふたたび,その分子表面の静電ポテンシャルに着目した.GtACR1の分子表面には正電荷を帯びたアミノ酸残基が多く分布しており,これがGtACR1におけるイオンの選択性に重要な役割をはたすことが予想された.これら12残基のアミノ酸残基についてそれぞれAla変異体を作製し反転電位を測定した結果,イオンの透過経路の近傍に存在するアミノ酸残基に変異を導入すると反転電位は-30~-40 mVまで上昇することが判明した.
6.閉速度の速いアニオンチャネルロドプシンFLASHの開発およびその評価
iC++においてCCSを構成するアミノ酸残基の性質はイオンの選択性に大きく寄与していた.それでは,GtACR1においてCCSを構成するアミノ酸残基にはいかなる役割があるのだろうか.GtACR1においてCCSを構成するアミノ酸残基に変異を導入する過程において,いくつかの変異の導入によりチャネルの閉速度が劇的に速くなることが見い出された.このうち,Asn239をGluに置換した変異体は野生型のGtACR1と同様にアニオンに対する高い選択性と高いチャネル活性を維持しながら,野生型と比較して20倍以上も速いチャネルの閉速度をもつことが判明したため,この変異体にArg83のGluへの置換をくわえた変異体をFLASH(fast, light-activated anion-selective rhodopsin)と名づけた.閉速度の速いアニオンチャネルロドプシンとして,2017年に米国の研究グループがZipACRとよばれる新しい天然型のアニオンチャネルロドプシンを報告していたため9),FLASHとZipACRのどちらが光遺伝学的な手法における抑制性のツールとしてすぐれているのか性能を比較した.HEK細胞および培養ニューロンを用いて電気生理学的な実験を実施したところ,FLASHとZipACRは同じ程度のチャネル活性をもち,閉速度はZipACRのほうがわずかに速いが,どちらも少なくとも約40 Hzの神経発火であれば単一のスパイクのレベルで抑制が可能なことがわかった.しかしながら,反転電位に着目すると,ZipACRはFLASHと比較して約15 mVも高い値を示した.このことは,ZipACRがアニオンだけでなくカチオンも透過してしまうことを意味し,実際に,ZipACRを発現させたHEK細胞の静止膜電位を-40 mV,-50 mV,-60 mV…と下げつつ光を照射したところ,-50 mV以下の静止膜電位では膜電位が過分極するのではなく脱分極し神経発火が生じた.さらに,海馬にFLASHあるいはZipACRを発現させたマウスの脳切片を用いて,より生理的な環境に近い条件において電気生理学的な実験を実施したが,結果は同様であった.くわえて,多点電極を用いて海馬に発現させたFLASHあるいはZipACRによるニューロンの抑制の効率をin vivoにおいて評価したが,やはりFLASHの優位性が示された.最後に,FLASHあるいはZipACRを線虫の筋細胞およびコリン作動性ニューロンに発現させ,FLASHあるいはZipACRの活性化にともなう線虫の移動運動の阻害の効率を評価したが,ここでもFLASHはZipACRよりも効率よく行動を阻害した.以上の結果から,光遺伝学的な手法においてすばやい閉速度をもつ抑制性のツールとしては,FLASHが第1の選択肢となりうると結論づけられた.
おわりに
この研究において,筆者らは,人工型のアニオンチャネルロドプシンであるiC++の結晶構造を解明し,これを同じ時期に構造を解析したGtACR1と比較することにより,人工型のアニオンチャネルロドプシンと天然型のアニオンチャネルロドプシンは類似した構造的な特徴をもつにもかかわらず,その役割はまったく異なることを見い出した.たとえば,人工型のアニオンチャネルロドプシンにおいて細胞外側に存在する狭窄部位は基質の輸送に重要と考えられた一方,天然型のアニオンチャネルロドプシンにおいてはチャネルの開閉速度に重要であった.また,人工型および天然型のアニオンチャネルロドプシンはイオンの透過経路の内部および周辺の静電ポテンシャルによりアニオンに対する高い選択性を獲得しているが,より詳細にみていくと,人工型のアニオンチャネルロドプシンにおいてはイオンの透過経路の中央に存在する狭窄部位がより重要であり,天然型のアニオンチャネルロドプシンにおいては細胞内側のイオンの透過経路の周辺のアミノ酸残基がより重要であるなど,寄与の大きなアミノ酸残基の分布は異なっていた.一般的に,人工型のアニオンチャネルロドプシンは天然型のアニオンチャネルロドプシンよりもチャネル活性が低いことが報告されているが,これは,人工型のアニオンチャネルロドプシンにおいて正電荷をもつアミノ酸残基がイオンの透過経路の周辺ではなくイオンの透過経路の内部に分布しており,アニオンが透過経路の内部に強く結合しすぎてしまうためではないかと予想された.また,天然型のアニオンチャネルロドプシンにおいてイオンの透過経路の中央に存在する狭窄部位を構成するアミノ酸残基はチャネルの閉速度を決定するのに重要であることが見い出され,新しい変異体FLASHが開発された.今後,“クローズドループ”光遺伝学の技術と組み合わせることにより,生理的なニューロンの発火頻度を(ゼロにするのではなく)減少させたときの影響を解析する,といった研究に利用されると思われる.
筆者らは,iC++のほかGtACR1の構造も解析し8),Nature誌のArticleとして2報を発表した.ここでは,より内容の濃いiC++の構造解析の論文についてレビューをしたが,わずかではあるがGtACR1の構造解析の論文の内容についてもふれている.
さて,論文こそ同時に投稿したが,じつは,iC++とGtACR1とでは構造解析に成功した時期に大きな違いがある.iC++は以前に構造を解析したC1C2に10アミノ酸残基の変異を導入しただけのタンパク質であったため,その構造解析は特別むずかしくはなかった.しかし,iC++の構造をながめても,そのおもしろさをどう抽出したらよいのか考えがまとまらず,いちどはお蔵入りになりかけていたのである.しかし,1年後にGtACR1の構造解析が成功し,両者を比較しはじめてから状況は一変した.iC++という人工型のアニオンチャネルロドプシンとGtACR1という天然型のアニオンチャネルロドプシンはいっけん似た構造をとり,機能としても同じ光駆動性のアニオンチャネルでありながら,まったく違っていた.共同研究者の助けを借り,計算科学的な手法,また,電気生理学的な手法を用いて解析を深めていくうち,これは別々の論文として発表すべきであると確信し,共同研究先の研究室主宰者を徹夜で作成した図を見せながら説得し,大きく方向を転換した.おかげで年末年始の休みを返上し研究室にひきこもって2報の論文の原稿を同時に書き上げる羽目になったのだが,結果的にみれば,この選択は正解であった.なお,Nature誌に論文を投稿した2日後,競争相手である研究グループがGtACR1の構造解析の論文をプレプリントリポジトリであるBioRxivに発表した(DOI:10.1101/405308).紙一重の差であり,今回もまた,よい研究環境,そして,よい研究グループに恵まれたことを感謝するばかりである.
文 献
- Deisseroth, K. & Hegemann, P.: The form and function of channelrhodopsin. Science, 357, eaan5544 (2017)[PubMed]
- Kato, H. E., Zhang, F., Yizhar, O. et al.: Crystal structure of the channelrhodopsin light-gated cation channel. Nature, 482, 369-374 (2012)[PubMed] [新着論文レビュー]
- Berndt, A., Lee, S. Y., Ramakrishnan, C. et al.: Structure-guided transformation of channelrhodopsin into a light-activated chloride channel. Science, 344, 420-424 (2014)[PubMed]
- Wietek, J., Wiegert, J. S., Adeishvili, N. et al.: Conversion of channelrhodopsin into a light-gated chloride channel. Science, 344, 409-412 (2014)[PubMed]
- Wietek, J., Beltramo, R., Scanziani, M. et al.: An improved chloride-conducting channelrhodopsin for light-induced inhibition of neuronal activity in vivo. Sci. Rep., 5, 14807 (2015)[PubMed]
- Berndt, A., Lee, S. Y., Wietek, J. et al.: Structural foundations of optogenetics: determinants of channelrhodopsin ion selectivity. Proc. Natl. Acad. Sci. USA, 113, 822-829 (2016)[PubMed]
- Govorunova, E. G., Sineshchekov, O. A., Janz, R. et al.: Natural light-gated anion channels: a family of microbial rhodopsins for advanced optogenetics. Science, 349, 647-650 (2015)[PubMed]
- Kim, Y. S., Kato, H. E., Yamashita, K. et al.: Crystal structure of the natural anion-conducting channelrhodopsin GtACR1. Nature, 561, 343-348 (2018)[PubMed]
- Govorunova, E. G., Sineshchekov, O. A., Rodarte, E. M. et al.: The expanding family of natural anion channelrhodopsins reveals large variations in kinetics, conductance, and spectral sensitivity. Sci. Rep., 7, 43358 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院理学系研究科博士課程 修了,同年 同 特任研究員を経て,同年より米国Stanford大学School of Medicine研究員.2017年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:ロドプシンおよびGタンパク質共役型受容体の構造機能解析および構造情報を用いたタンパク質工学.
関心事:つぎの行き先.
Yoon Seok Kim
米国Stanford大学大学院 在学中.
Karl Deisseroth
米国Stanford大学 教授.
© 2018 加藤英明・Yoon Seok Kim・Karl Deisseroth Licensed under CC 表示 2.1 日本