ヒトに固有なNOTCH2NLB遺伝子はNotchシグナルの制御を介して大脳皮質のニューロンを増加させる
鈴木郁夫・Pierre Vanderhaeghen
(ベルギーLibre de Bruxelles大学Institute for Interdisciplinary Research)
email:鈴木郁夫
DOI: 10.7875/first.author.2018.064
Human-specific NOTCH2NL genes expand cortical neurogenesis through Delta/Notch regulation.
Ikuo K. Suzuki, David Gacquer, Roxane Van Heurck, Devesh Kumar, Marta Wojno, Angéline Bilheu, Adèle Herpoel, Nelle Lambert, Julian Cheron, Franck Polleux, Vincent Detours, Pierre Vanderhaeghen
Cell, 173, 1370-1384.e16 (2018)
ヒトの発達した認知機能の基盤は大きく拡大した大脳皮質である.しかし,ヒトにおける大脳皮質の進化の背景にある遺伝的な機構についてはあまりわかっていない.遺伝子の重複により新しい遺伝子が出現することは,表現型の進化を駆動する機構となりうることが広く受け入れられている.そこで,ヒトの進化の過程において重複した遺伝子が大脳皮質の発生に関与する可能性について検討するため,重複した遺伝子の発現を解析した.この解析により発見されたNOTCH2NLB遺伝子はヒト以外の生物種には存在せず,ヒトのゲノムにおいて脳の容積の異常と関連するゲノム領域にコードされていた.実験的な解析により,NOTCH2NLB遺伝子はヒトの大脳皮質の前駆細胞においてNotchシグナルを活性化することにより,前駆細胞を未分化なまま維持する効果をもつことが明らかにされた.これらのことから,ヒトはチンパンジーと分岐したのちNOTCH2NLB遺伝子を獲得したことにより,より長期間にわたりニューロンの産生がつづくようになり,その結果,より多くのニューロンにより構成される大きな大脳皮質を獲得したと考えられた.
ヒトはチンパンジーと分岐したのち,大脳皮質の容積が大幅に拡大し神経回路が複雑化した.大脳皮質の構造的な変化によりヒトらしい高次認知機能がもたらされたものと考えられるが,ヒトにおける大脳皮質の進化はどのような遺伝的な機構により駆動されたのかについてはあまりわかっていない.一方,近年のゲノム解析により,ヒトのゲノムにはほかの類人猿とのあいだで保存されていない,ヒトに固有の遺伝子が存在することが明らかにされた.ヒトに固有の遺伝子の多くは染色体の一部の重複により生じており,これらのゲノム領域における変異の多くは,脳の発生の異常や統合失調症などの精神神経疾患と関連があることが明らかにされている.遺伝子の重複は表現型の進化を駆動する機構のひとつとして長年にわたり議論されてきた1).重複により機能的な冗長性の生じた遺伝子のペアは,その一方に対する制約が弱まり,別の機能をもつような変異が許容されると考えられている.この研究において,筆者らは,ヒトの進化系統において重複した遺伝子のなかに,ヒト,もしくは,ヒトを含む一部の類人猿に固有に存在し大脳皮質の発生を制御する遺伝子が存在するという可能性について検討した.
類人猿の比較ゲノム解析により,ヒトの進化系統においてコピー数の変化した遺伝子がみつかっている2).こういったヒトの進化のごく最近の過程において重複した遺伝子の多くはくり返し構造の多い複雑なゲノム領域にコードされているため塩基配列の解読が困難であったが,ようやく近年になり,正確な塩基配列が明らかにされた.そこで,先行研究において発見された148個のコピー数の変動した遺伝子に対し十分な相同性をもつ遺伝子をヒトのすべての遺伝子のなかから網羅的にスクリーニングし,ヒトの進化系統において重複した434個の遺伝子を発見した.これらのヒト系統重複遺伝子は配列の類似性をもとに126の遺伝子ファミリーに分類された.発見されたヒト系統重複遺伝子が大脳皮質の発生に関与するのかどうか調べるため,RNA-seq法を用いてその発現を解析した.次世代シークエンサーを用いた一般的な解析においては,配列の類似性がきわめて高い重複遺伝子を正確に識別して定量することは困難である.なぜなら,得られたリードをリファレンスゲノムにマップする際に,通常,ゲノムにおいて複数の箇所にマップされる重複した配列に由来するリードは無視するように設定されているためで,このため,重複遺伝子の発現量は実際よりも過小に評価される傾向にある.そこで,シミュレーションにより個々のヒト系統重複遺伝子について発現量がどのくらい過小に評価されるかをあらかじめ計算し,その結果をもとに実験的に得られた発現データを修正し正確な情報を推定した.ヒトの胎児の大脳皮質における発現データを解析したところ,大脳皮質の発生のマーカー遺伝子すべてが,少なくともFPKMが5以上の発現量(FPKM:fragments per kilobase of exon per million reads mapped,RNA-seq法における発現量の単位)を示したことから,ヒト系統重複遺伝子についてもFPKMが5以上の発現量を示すものを大脳皮質の発生に関係する可能性のある遺伝子とした.このスクリーニングにより434個のヒト系統重複遺伝子は107個(60の遺伝子ファミリー)にまでしぼり込まれ,さらに,24の遺伝子ファミリーは複数のメンバーがFPKMが5以上の発現量を示したことから,より注目した.ヒトの胎児の大脳皮質の切片におけるin situハイブリダイゼーション法により,しぼり込まれた遺伝子のすべてが発生の過程の大脳皮質において発現することが確認された.
発現解析によりしぼり込まれた24の遺伝子ファミリーに含まれる遺伝子のうち,とくにヒトの進化系統において固有でほかの哺乳類のオーソログ遺伝子と構造の異なる遺伝子について,全長のcDNAを入手し,子宮内エレクトロポレーション法により発生の過程のマウスの大脳皮質に強制発現させた.その結果,複数の遺伝子がなんらかの脳の発生の異常を示したが,ニューロンの産生に影響をおよぼしたのはNOTCH2NLB遺伝子ただひとつであった.
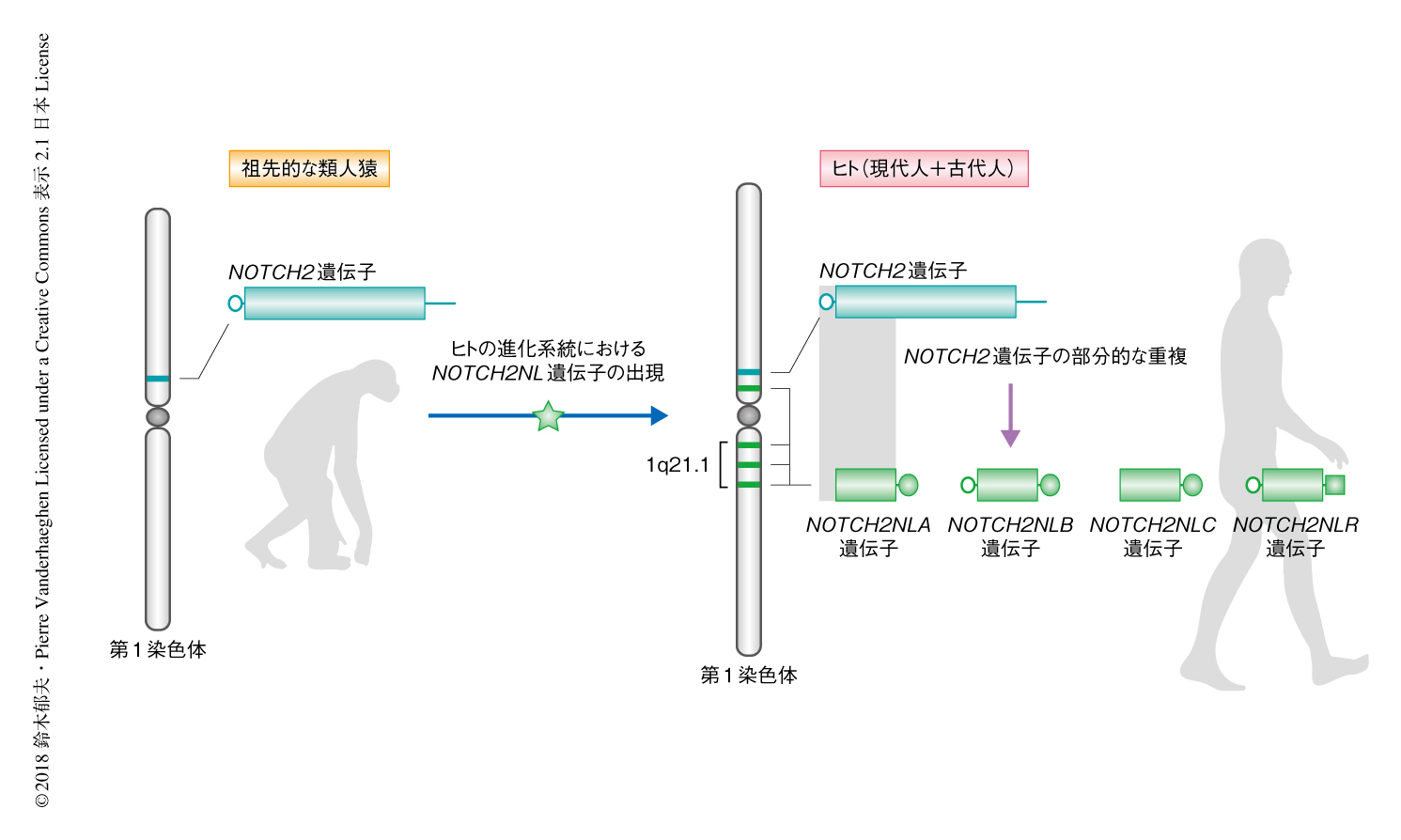
NOTCH2NL遺伝子は,以前にNOTCH2遺伝子のN末端側の領域ときわめて高い相同性を示す遺伝子として発見されたが,脳の発生への関与については知られていなかった3).ヒトのゲノムにはNOTCH2遺伝子にくわえ,NOTCH2NLA遺伝子,NOTCH2NLB遺伝子,NOTCH2NLC遺伝子,NOTCH2NLR遺伝子の4つのNOTCH2NL遺伝子が存在する(図1).Notchシグナルの受容体をコードするNOTCH2遺伝子は脊椎動物に広く保存されているが,タンパク質をコードするNOTCH2NL遺伝子はヒトにだけ存在することが,類人猿のゲノムの比較解析から明らかにされた4).4つのNOTCH2NL遺伝子は完全に同一ではなく少数のアミノ酸置換や欠失があり,もっとも高く発現するNOTCH2NLB遺伝子がもっとも長いタンパク質をコードする.NOTCH2NLBはN末端側から順に,シグナルペプチド,6つのEGFリピート,機能未知の24アミノ酸残基,の3つのドメインから構成される.このうち,シグナルペプチドおよびEGFリピートはNOTCH2とのあいだにきわめて高い保存性をもち,機能未知の24アミノ酸残基はNOTCH2NL以外のいかなるタンパク質とも配列の類似性はなかった.NOTCH2NLA遺伝子,NOTCH2NLB遺伝子,NOTCH2NLC遺伝子は第1染色体の1q21領域にコードされる.1q21領域における重複および欠失は脳の大きさの異常と関連するという複数の報告がある5,6).詳細な解析の結果,脳の発生に異常を示すヒトにおいて少なくとも1つのNOTCH2NL遺伝子にコピー数の異常のあることが明らかにされた4).これらのことから,NOTCH2NL遺伝子が脳の発生に関与する可能性が示唆された.
ヒトの胎児の大脳皮質の切片においてin situハイブリダイゼーション法を実施し詳細に観察したところ,NOTCH2NL遺伝子は発生の過程をつうじて神経前駆細胞において強く発現していた.
ヒトの大脳皮質の発生におけるNOTCH2NLB遺伝子の機能について明らかにするため,ヒトのES細胞から分化を誘導した大脳皮質の前駆細胞において過剰発現させた.このin vitroのモデルにおいては,大脳皮質における細胞系譜のパターンが胚の発生とほとんど同様に再現される7,8).NOTCH2NLB遺伝子を発現するレンチウイルスを培地にごく低濃度で添加することにより少数の大脳皮質の前駆細胞に感染させ,その子孫細胞を追跡した.その結果,NOTCH2NLB遺伝子を強制発現させた大脳皮質の前駆細胞はより多くの子孫細胞を産生することがわかった.さらに,各種のマーカー遺伝子の発現を観察したところ,NOTCH2NLB遺伝子を発現する細胞において神経前駆細胞のマーカー遺伝子を発現する割合が上昇し,Notchシグナルの標的遺伝子であるHes1遺伝子の発現が促進された.発生の過程のマウスの大脳皮質におけるNOTCH2NLB遺伝子の強制発現においても同様に,Notchシグナルの活性化および未分化な前駆細胞の維持が観察された.
NOTCH2NLBはNotchシグナルを活性化し,神経前駆細胞が維持されやすくする効果をもつことがわかった.つぎの疑問は,NOTCH2NLBがどのような機構でNotchシグナルを活性化するのかという点であった.
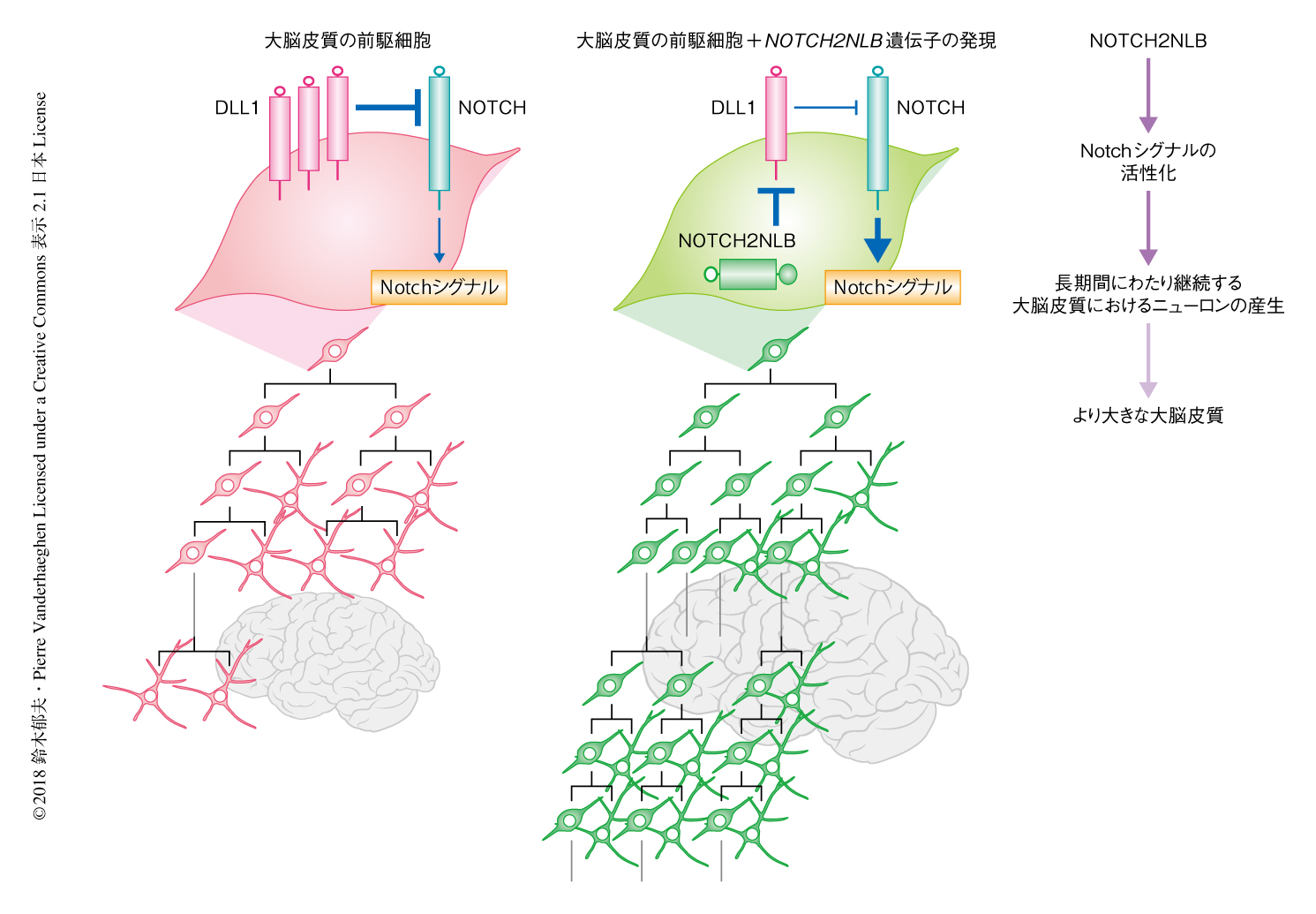
大脳皮質の発生においては,神経前駆細胞が一定の期間にわたり維持され適切な時間経過で多様なニューロンを産生するために,Notchシグナルが重要なはたらきをする.個々の神経前駆細胞はリガンドであるDLL1(Delta Like 1)と受容体であるNotchをさまざまなレベルで発現する.となりあう細胞どうしはつねにNotchシグナルをやりとりとし,周囲の細胞よりも高いレベルでNotchシグナルを受容した細胞はニューロンへの分化が抑制され前駆細胞として維持される.NotchシグナルはDLL1の発現を抑制するため,相対的に高いレベルのNotchシグナルを受容した細胞はとなりの細胞へ伝達するNotchシグナルのレベルが低下する.逆に,DLL1を高く発現する細胞はとなりの細胞へ伝達するNotchシグナルのレベルが上昇するため,結果として,自らが受容するNotchシグナルのレベルが相対的に低下しニューロンへと分化しやすくなる.実験的にDLL1を少数の神経前駆細胞において過剰発現するとニューロンへと分化する傾向が強まり,逆に,DLL1をノックアウトした神経前駆細胞は前駆細胞として維持されやすくなる9).
NOTCH2NLBにはNotchの細胞外領域が保存されているため,Notchのリガンドと相互作用する可能性が考えられた.そこで,HEK293T細胞においてDLL1およびNOTCH2NLBを強制発現させたところ,両者は複合体を形成することが免疫沈降法により確認された.また,DLL1の細胞あたりの全タンパク質量および細胞膜に存在するDLL1のタンパク質量を定量したところ,NOTCH2NLBを強制発現させた条件においては対照と比較して,細胞膜に存在するDLL1の量が減少することがわかった.さらに,DLL1とNOTCH2NLBの機能的な相互作用を示す実験として,発生の過程のマウスの大脳皮質においてDLL1を強制発現させるとニューロンへの分化の傾向が強くなったが,DLL1と同時にNOTCH2NLBを強制発現させるとDLL1のもつ分化の誘導能が抑制された.これらのことから,NOTCH2NLBは大脳皮質の前駆細胞において,DLL1の機能を抑制することにより受容するNotchシグナルのレベルを高め,それにより前駆細胞として維持されるよう機能することが明らかにされた.
以前の研究において,筆者は,大脳皮質の発生に特徴的な神経前駆細胞が一定の期間にわたり維持され多様なニューロンを決まった順序で産生する過程は,哺乳動物のあいだで共通しているばかりか,大脳皮質に相当する脳の領域に層構造をもたない鳥類においても保存されていることを明らかにした10)(新着論文レビュー でも掲載).また,Notchシグナルをはじめとして,脳において神経前駆細胞の挙動を制御する機構の多くもまた系統のあいだで保存されている.その保存的な発生プログラムの基盤のうえに,ヒトの進化の初期において新たにNOTCH2NLBによる微調整がくわわったことにより,大脳皮質においてニューロンが増加したと考えられた(図2).
NOTCH2NLBの分子的な機能については,DLL1と結合しその機能を抑制することは明らかにされたものの,細胞における両者の相互作用の詳細な機構を完全に理解するにはいたっていない.今後,NOTCH2NLBの分子的な機能をさらに詳細に調べることにより,ヒトの大脳皮質の発生におけるNotchシグナルの制御についての理解が深まると期待される.
略歴:2010年 総合研究大学大学院生命科学研究科 修了,同年 国立遺伝学研究所 博士研究員を経て,2012年よりベルギーLibre de Bruxelles大学 博士研究員.
研究テーマ:大脳皮質の発生および進化の背景にある神経幹細胞の機構.
抱負:動物の行動の多様性を生じる基盤となる脳および神経回路の進化についての研究をつづけていきたい.
Pierre Vanderhaeghen
ベルギーLibre de Bruxelles大学Professor.
研究室URL:http://www.vib.be/en/research/scientists/Pages/Pierre-Vanderhaeghen-Lab.aspx
© 2018 鈴木郁夫・Pierre Vanderhaeghen Licensed under CC 表示 2.1 日本
(ベルギーLibre de Bruxelles大学Institute for Interdisciplinary Research)
email:鈴木郁夫
DOI: 10.7875/first.author.2018.064
Human-specific NOTCH2NL genes expand cortical neurogenesis through Delta/Notch regulation.
Ikuo K. Suzuki, David Gacquer, Roxane Van Heurck, Devesh Kumar, Marta Wojno, Angéline Bilheu, Adèle Herpoel, Nelle Lambert, Julian Cheron, Franck Polleux, Vincent Detours, Pierre Vanderhaeghen
Cell, 173, 1370-1384.e16 (2018)
要 約
ヒトの発達した認知機能の基盤は大きく拡大した大脳皮質である.しかし,ヒトにおける大脳皮質の進化の背景にある遺伝的な機構についてはあまりわかっていない.遺伝子の重複により新しい遺伝子が出現することは,表現型の進化を駆動する機構となりうることが広く受け入れられている.そこで,ヒトの進化の過程において重複した遺伝子が大脳皮質の発生に関与する可能性について検討するため,重複した遺伝子の発現を解析した.この解析により発見されたNOTCH2NLB遺伝子はヒト以外の生物種には存在せず,ヒトのゲノムにおいて脳の容積の異常と関連するゲノム領域にコードされていた.実験的な解析により,NOTCH2NLB遺伝子はヒトの大脳皮質の前駆細胞においてNotchシグナルを活性化することにより,前駆細胞を未分化なまま維持する効果をもつことが明らかにされた.これらのことから,ヒトはチンパンジーと分岐したのちNOTCH2NLB遺伝子を獲得したことにより,より長期間にわたりニューロンの産生がつづくようになり,その結果,より多くのニューロンにより構成される大きな大脳皮質を獲得したと考えられた.
はじめに
ヒトはチンパンジーと分岐したのち,大脳皮質の容積が大幅に拡大し神経回路が複雑化した.大脳皮質の構造的な変化によりヒトらしい高次認知機能がもたらされたものと考えられるが,ヒトにおける大脳皮質の進化はどのような遺伝的な機構により駆動されたのかについてはあまりわかっていない.一方,近年のゲノム解析により,ヒトのゲノムにはほかの類人猿とのあいだで保存されていない,ヒトに固有の遺伝子が存在することが明らかにされた.ヒトに固有の遺伝子の多くは染色体の一部の重複により生じており,これらのゲノム領域における変異の多くは,脳の発生の異常や統合失調症などの精神神経疾患と関連があることが明らかにされている.遺伝子の重複は表現型の進化を駆動する機構のひとつとして長年にわたり議論されてきた1).重複により機能的な冗長性の生じた遺伝子のペアは,その一方に対する制約が弱まり,別の機能をもつような変異が許容されると考えられている.この研究において,筆者らは,ヒトの進化系統において重複した遺伝子のなかに,ヒト,もしくは,ヒトを含む一部の類人猿に固有に存在し大脳皮質の発生を制御する遺伝子が存在するという可能性について検討した.
1.ヒトの進化系統において重複した遺伝子の発現量にもとづくスクリーニング
類人猿の比較ゲノム解析により,ヒトの進化系統においてコピー数の変化した遺伝子がみつかっている2).こういったヒトの進化のごく最近の過程において重複した遺伝子の多くはくり返し構造の多い複雑なゲノム領域にコードされているため塩基配列の解読が困難であったが,ようやく近年になり,正確な塩基配列が明らかにされた.そこで,先行研究において発見された148個のコピー数の変動した遺伝子に対し十分な相同性をもつ遺伝子をヒトのすべての遺伝子のなかから網羅的にスクリーニングし,ヒトの進化系統において重複した434個の遺伝子を発見した.これらのヒト系統重複遺伝子は配列の類似性をもとに126の遺伝子ファミリーに分類された.発見されたヒト系統重複遺伝子が大脳皮質の発生に関与するのかどうか調べるため,RNA-seq法を用いてその発現を解析した.次世代シークエンサーを用いた一般的な解析においては,配列の類似性がきわめて高い重複遺伝子を正確に識別して定量することは困難である.なぜなら,得られたリードをリファレンスゲノムにマップする際に,通常,ゲノムにおいて複数の箇所にマップされる重複した配列に由来するリードは無視するように設定されているためで,このため,重複遺伝子の発現量は実際よりも過小に評価される傾向にある.そこで,シミュレーションにより個々のヒト系統重複遺伝子について発現量がどのくらい過小に評価されるかをあらかじめ計算し,その結果をもとに実験的に得られた発現データを修正し正確な情報を推定した.ヒトの胎児の大脳皮質における発現データを解析したところ,大脳皮質の発生のマーカー遺伝子すべてが,少なくともFPKMが5以上の発現量(FPKM:fragments per kilobase of exon per million reads mapped,RNA-seq法における発現量の単位)を示したことから,ヒト系統重複遺伝子についてもFPKMが5以上の発現量を示すものを大脳皮質の発生に関係する可能性のある遺伝子とした.このスクリーニングにより434個のヒト系統重複遺伝子は107個(60の遺伝子ファミリー)にまでしぼり込まれ,さらに,24の遺伝子ファミリーは複数のメンバーがFPKMが5以上の発現量を示したことから,より注目した.ヒトの胎児の大脳皮質の切片におけるin situハイブリダイゼーション法により,しぼり込まれた遺伝子のすべてが発生の過程の大脳皮質において発現することが確認された.
2.ヒトに固有のNOTCH2NLB遺伝子
発現解析によりしぼり込まれた24の遺伝子ファミリーに含まれる遺伝子のうち,とくにヒトの進化系統において固有でほかの哺乳類のオーソログ遺伝子と構造の異なる遺伝子について,全長のcDNAを入手し,子宮内エレクトロポレーション法により発生の過程のマウスの大脳皮質に強制発現させた.その結果,複数の遺伝子がなんらかの脳の発生の異常を示したが,ニューロンの産生に影響をおよぼしたのはNOTCH2NLB遺伝子ただひとつであった.
NOTCH2NL遺伝子は,以前にNOTCH2遺伝子のN末端側の領域ときわめて高い相同性を示す遺伝子として発見されたが,脳の発生への関与については知られていなかった3).ヒトのゲノムにはNOTCH2遺伝子にくわえ,NOTCH2NLA遺伝子,NOTCH2NLB遺伝子,NOTCH2NLC遺伝子,NOTCH2NLR遺伝子の4つのNOTCH2NL遺伝子が存在する(図1).Notchシグナルの受容体をコードするNOTCH2遺伝子は脊椎動物に広く保存されているが,タンパク質をコードするNOTCH2NL遺伝子はヒトにだけ存在することが,類人猿のゲノムの比較解析から明らかにされた4).4つのNOTCH2NL遺伝子は完全に同一ではなく少数のアミノ酸置換や欠失があり,もっとも高く発現するNOTCH2NLB遺伝子がもっとも長いタンパク質をコードする.NOTCH2NLBはN末端側から順に,シグナルペプチド,6つのEGFリピート,機能未知の24アミノ酸残基,の3つのドメインから構成される.このうち,シグナルペプチドおよびEGFリピートはNOTCH2とのあいだにきわめて高い保存性をもち,機能未知の24アミノ酸残基はNOTCH2NL以外のいかなるタンパク質とも配列の類似性はなかった.NOTCH2NLA遺伝子,NOTCH2NLB遺伝子,NOTCH2NLC遺伝子は第1染色体の1q21領域にコードされる.1q21領域における重複および欠失は脳の大きさの異常と関連するという複数の報告がある5,6).詳細な解析の結果,脳の発生に異常を示すヒトにおいて少なくとも1つのNOTCH2NL遺伝子にコピー数の異常のあることが明らかにされた4).これらのことから,NOTCH2NL遺伝子が脳の発生に関与する可能性が示唆された.
3.NOTCH2NLB遺伝子の大脳皮質の発生における機能
ヒトの胎児の大脳皮質の切片においてin situハイブリダイゼーション法を実施し詳細に観察したところ,NOTCH2NL遺伝子は発生の過程をつうじて神経前駆細胞において強く発現していた.
ヒトの大脳皮質の発生におけるNOTCH2NLB遺伝子の機能について明らかにするため,ヒトのES細胞から分化を誘導した大脳皮質の前駆細胞において過剰発現させた.このin vitroのモデルにおいては,大脳皮質における細胞系譜のパターンが胚の発生とほとんど同様に再現される7,8).NOTCH2NLB遺伝子を発現するレンチウイルスを培地にごく低濃度で添加することにより少数の大脳皮質の前駆細胞に感染させ,その子孫細胞を追跡した.その結果,NOTCH2NLB遺伝子を強制発現させた大脳皮質の前駆細胞はより多くの子孫細胞を産生することがわかった.さらに,各種のマーカー遺伝子の発現を観察したところ,NOTCH2NLB遺伝子を発現する細胞において神経前駆細胞のマーカー遺伝子を発現する割合が上昇し,Notchシグナルの標的遺伝子であるHes1遺伝子の発現が促進された.発生の過程のマウスの大脳皮質におけるNOTCH2NLB遺伝子の強制発現においても同様に,Notchシグナルの活性化および未分化な前駆細胞の維持が観察された.
4.NOTCH2NLBはNotchのリガンドであるDLL1の機能を抑制することによりNotchシグナルを活性化する
NOTCH2NLBはNotchシグナルを活性化し,神経前駆細胞が維持されやすくする効果をもつことがわかった.つぎの疑問は,NOTCH2NLBがどのような機構でNotchシグナルを活性化するのかという点であった.
大脳皮質の発生においては,神経前駆細胞が一定の期間にわたり維持され適切な時間経過で多様なニューロンを産生するために,Notchシグナルが重要なはたらきをする.個々の神経前駆細胞はリガンドであるDLL1(Delta Like 1)と受容体であるNotchをさまざまなレベルで発現する.となりあう細胞どうしはつねにNotchシグナルをやりとりとし,周囲の細胞よりも高いレベルでNotchシグナルを受容した細胞はニューロンへの分化が抑制され前駆細胞として維持される.NotchシグナルはDLL1の発現を抑制するため,相対的に高いレベルのNotchシグナルを受容した細胞はとなりの細胞へ伝達するNotchシグナルのレベルが低下する.逆に,DLL1を高く発現する細胞はとなりの細胞へ伝達するNotchシグナルのレベルが上昇するため,結果として,自らが受容するNotchシグナルのレベルが相対的に低下しニューロンへと分化しやすくなる.実験的にDLL1を少数の神経前駆細胞において過剰発現するとニューロンへと分化する傾向が強まり,逆に,DLL1をノックアウトした神経前駆細胞は前駆細胞として維持されやすくなる9).
NOTCH2NLBにはNotchの細胞外領域が保存されているため,Notchのリガンドと相互作用する可能性が考えられた.そこで,HEK293T細胞においてDLL1およびNOTCH2NLBを強制発現させたところ,両者は複合体を形成することが免疫沈降法により確認された.また,DLL1の細胞あたりの全タンパク質量および細胞膜に存在するDLL1のタンパク質量を定量したところ,NOTCH2NLBを強制発現させた条件においては対照と比較して,細胞膜に存在するDLL1の量が減少することがわかった.さらに,DLL1とNOTCH2NLBの機能的な相互作用を示す実験として,発生の過程のマウスの大脳皮質においてDLL1を強制発現させるとニューロンへの分化の傾向が強くなったが,DLL1と同時にNOTCH2NLBを強制発現させるとDLL1のもつ分化の誘導能が抑制された.これらのことから,NOTCH2NLBは大脳皮質の前駆細胞において,DLL1の機能を抑制することにより受容するNotchシグナルのレベルを高め,それにより前駆細胞として維持されるよう機能することが明らかにされた.
おわりに
以前の研究において,筆者は,大脳皮質の発生に特徴的な神経前駆細胞が一定の期間にわたり維持され多様なニューロンを決まった順序で産生する過程は,哺乳動物のあいだで共通しているばかりか,大脳皮質に相当する脳の領域に層構造をもたない鳥類においても保存されていることを明らかにした10)(新着論文レビュー でも掲載).また,Notchシグナルをはじめとして,脳において神経前駆細胞の挙動を制御する機構の多くもまた系統のあいだで保存されている.その保存的な発生プログラムの基盤のうえに,ヒトの進化の初期において新たにNOTCH2NLBによる微調整がくわわったことにより,大脳皮質においてニューロンが増加したと考えられた(図2).
NOTCH2NLBの分子的な機能については,DLL1と結合しその機能を抑制することは明らかにされたものの,細胞における両者の相互作用の詳細な機構を完全に理解するにはいたっていない.今後,NOTCH2NLBの分子的な機能をさらに詳細に調べることにより,ヒトの大脳皮質の発生におけるNotchシグナルの制御についての理解が深まると期待される.
文 献
- Ohno, S.: Gene duplication and the uniqueness of vertebrate genomes circa 1970-1999. Semin. Cell Dev. Biol., 10, 517-522 (1999)[PubMed]
- Sudmant, P. H., Kitzman, J. O., Antonacci, F. et al.: Diversity of human copy number variation and multicopy genes. Science, 330, 641-646 (2010)[PubMed]
- Duan, Z., Li, F. Q., Wechsler, J. et al.: A novel notch protein, N2N, targeted by neutrophil elastase and implicated in hereditary neutropenia. Mol. Cell. Biol., 24, 58-70 (2004)[PubMed]
- Fiddes, I. T., Lodewijk, G. A., Mooring, M. et al.: Human-specific NOTCH2NL genes affect Notch signaling and cortical neurogenesis. Cell, 173, 1356-1369.e22 (2018)[PubMed]
- Brunetti-Pierri, N., Berg, J .S., Scaglia, F. et al.: Recurrent reciprocal 1q21.1 deletions and duplications associated with microcephaly or macrocephaly and developmental and behavioral abnormalities. Nat. Genet., 40, 1466-1471 (2008)[PubMed]
- Mefford, H. C., Sharp, A. J., Baker, C. et al.: Recurrent rearrangements of chromosome 1q21.1 and variable pediatric phenotypes. N. Engl. J. Med., 359, 1685-1699 (2008)[PubMed]
- Espuny-Camacho, I., Michelsen, K. A., Gall, D. et al.: Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron, 77, 440-456 (2013)[PubMed]
- Suzuki, I. K. & Vanderhaeghen, P.: Is this a brain which I see before me? Modeling human neural development with pluripotent stem cells. Development, 142, 3138-3150 (2015)[PubMed]
- Kawaguchi, D., Yoshimatsu, T., Hozumi, K. et al.: Selection of differentiating cells by different levels of delta-like 1 among neural precursor cells in the developing mouse telencephalon. Development, 135, 3849-3858 (2008)[PubMed]
- Suzuki, I. K., Kawasaki, T., Gojobori, T. et al.: The temporal sequence of the mammalian neocortical neurogenetic program drives mediolateral pattern in the chick pallium. Dev. Cell, 22, 863-870 (2012)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 総合研究大学大学院生命科学研究科 修了,同年 国立遺伝学研究所 博士研究員を経て,2012年よりベルギーLibre de Bruxelles大学 博士研究員.
研究テーマ:大脳皮質の発生および進化の背景にある神経幹細胞の機構.
抱負:動物の行動の多様性を生じる基盤となる脳および神経回路の進化についての研究をつづけていきたい.
Pierre Vanderhaeghen
ベルギーLibre de Bruxelles大学Professor.
研究室URL:http://www.vib.be/en/research/scientists/Pages/Pierre-Vanderhaeghen-Lab.aspx
© 2018 鈴木郁夫・Pierre Vanderhaeghen Licensed under CC 表示 2.1 日本