脳損傷ののちのリハビリテーションの効果を促進する新規の化合物の同定
高橋 琢哉
(横浜市立大学大学院医学研究科 生理学教室)
email:高橋琢哉
DOI: 10.7875/first.author.2018.043
CRMP2-binding compound, edonerpic maleate, accelerates motor function recovery from brain damage.
Hiroki Abe, Susumu Jitsuki, Waki Nakajima, Yumi Murata, Aoi Jitsuki-Takahashi, Yuki Katsuno, Hirobumi Tada, Akane Sano, Kumiko Suyama, Nobuyuki Mochizuki, Takashi Komori, Hitoshi Masuyama, Tomohiro Okuda, Yoshio Goshima, Noriyuki Higo, Takuya Takahashi
Science, 360, 50-57 (2018)
脳卒中はわが国において毎年30万人が新たに罹患する疾患であり,ときとして非常に深刻な麻痺をひき起こし,麻痺の程度にかかわらず日常生活に大きな影をおとす.近年,急性期における治療は大きく進歩したが,リハビリテーションの時期にはいってからの治療には限界が多く,薬剤による介入もかぎられている.リハビリテーションによる回復の過程は可塑的な現象と考えられている.グルタミン酸シナプスは脳において興奮性シナプスの大半をしめ,AMPA受容体はその機能を中核的に担うグルタミン酸受容体である.AMPA受容体のシナプスへの移行はシナプスの可塑性の分子基盤である.この研究において,筆者らは,このAMPA受容体のシナプスへの移行を促進する化合物としてedonerpic maleateを同定した.この化合物は脳損傷ののちの機能の回復をトレーニングに依存して劇的に促進させた.edonerpic maleateによる機能の回復はげっ歯類および霊長類であるカニクイザルにおいて観察され,今後のヒトへの応用が重要なステップとなる.
世界中の研究者による長年の積み重ねにより,シナプスの可塑性の基礎研究においては多くの知見が蓄積されている.依然として明らかにすべき命題は存在するが,臨床応用に耐えうるだけの強固な基礎研究の地盤はできあがりつつあると考えられる.しかしながら,その臨床応用は非常に乏しいのが現状であろう.グルタミン酸シナプスは脳における情報処理において非常に重要な役割をはたす.筆者らの研究も含めた多くの研究により,脳に可塑的な変化が起こるとき,グルタミン酸受容体のひとつであるAMPA受容体がシナプスへと移行することが明らかにされている.この研究において,筆者らは,AMPA受容体のシナプスへの移行を促進する化合物としてedonerpic maleateを同定した.
脳においては記憶の形成や学習など外界の新しい刺激に応じて神経系にさまざまな変化が起こるが,この現象を神経の可塑性という.とくに,神経の機能の最小のユニットであるシナプスにおける可塑性は,記憶あるいは学習の基本となる機構として注目されつづけている.シナプスはニューロンをつなぐ構造であり,シナプス前神経が刺激をうけるとシナプス前終末から神経伝達物質が放出される.放出された神経伝達物質はシナプス後神経のシナプス後膜にある受容体と結合し,その結果,イオンチャネルを形成する受容体が活性化してイオンが細胞へと流入しシグナルが伝達される.グルタミン酸は脳において多くの興奮性シナプスから放出される神経伝達物質であり,それをうけとる複数のグルタミン酸受容体が存在する.そのうち,AMPA受容体は興奮性の神経伝達においてとくに重要な役割を担う.
1970年代前半,シナプス前神経を連続的に刺激するとシナプス後神経への伝達の効率が長期的に増強することが発見された1).この現象は長期増強(long term potentiation:LTP)とよばれ,記憶あるいは学習の研究においてシナプスのレベルでの中核的な機構とされてきた.この長期増強の研究を中心として記憶の分子機構の解明が爆発的に進んだ.2000年には,培養した海馬の切片を用いたin vitroにおいて,長期増強をひき起こす刺激がAMPA受容体のシナプス膜への移行を起こし,シナプス後膜におけるAMPA受容体の数が増加し,その結果,シナプス伝達の効率が増強されることが証明された2).
筆者らは,大脳皮質において神経回路が形成される際に,AMPA受容体がシナプスへと移行することを明らかにした.げっ歯類のバレル皮質はひげからの入力をうける部位であるが,ひげ-バレル皮質の機能的なマップが形成される幼若期において,ひげの経験に依存的にAMPA受容体がバレル皮質のシナプスへと移行することが見い出された3).さらに,この現象はすでに機能的なマップの形成が終了した生後3週間くらいからはみられないことも明らかにされた4)(新着論文レビュー でも掲載).
これらにくわえ,記憶あるいは学習の際に脳のシナプスにおいてAMPA受容体がシナプスへと移行することも明らかにされた.海馬に依存的な学習課題である回避学習においては,学習ののちの海馬CA1野におけるAMPA受容体のシナプス膜への移行が促進され,それにより海馬における特定の神経ネットワークが強化されて記憶の形成に寄与することが証明された5,6).また,この回避学習によりシナプスへと移行するAMPA受容体を光遺伝学的な手法にて不活性化すると記憶は消去されることも明らかにされた7).このことから,学習によりシナプスへと移行したAMPA受容体が記憶をコードすることが示された.
ヒトなど霊長類をはじめとして,動物は視覚,聴覚,嗅覚,体性感覚などの感覚器官から外界の情報を得ることにより,社会的な行動をはじめとしたさまざまな行動を遂行する.疾患や事故などにより感覚器官の一部が失われることがあるが,その一方で,たとえば盲目の人がときとして異常な聴覚をもつことがある.このように,ひとつの感覚器官が失われたときにそのほかの感覚器官の機能が向上することにより,得られなくなった情報をなるべく多く獲得できるよう代償するシステムが神経系には存在する.このような脳の機能を異種感覚間の可塑性(cross modal plasticity)とよぶ.異種感覚間の可塑性の例は多く報告されているが,その分子機構および細胞機構については不明の点が多かった.
筆者らは,視覚を剥奪したラットのバレル皮質におけるAMPA受容体のシナプスへの移行について観察した.正常なラットにおいては,AMPA受容体の主要なサブユニットのひとつであるGluA1について,バレル皮質の第4層-2/3層シナプスにおけるひげの経験に依存的なシナプスへの移行は生後20日をこえると観察されなくなる.これは,バレル皮質の第2/3層におけるひげ-バレル皮質の機能的なマップが生後20日をこえる時点ですでに形成されているため,新たなシナプスの再構築の必要がないためと思われた.一方,この日齢において視覚を剥奪すると,バレル皮質の第4層-第2/3層シナプスにおいてGluA1のシナプスへの移行が起こるようになった.さらに,視覚を剥奪したラットのバレル皮質においてセロトニンの分泌が増加し,このセロトニンの分泌によりGluA1のシナプスへの移行が仲介されることも明らかにされた.このようなGluA1のシナプスへの移行の促進により,バレル皮質の第2/3層におけるひげ-バレル皮質の機能的なマップがより鋭敏になることも明らかにされた.この現象から,失われた機能を脳が代償するという現象にAMPA受容体のシナプスへの移行が密接にかかわることが示唆された4).
アルツハイマー病の治療薬として開発中だったT817MA(現在の名称は,edonerpic maleate)について解析を進めた.まず,成熟したマウスのバレル皮質の第4層から第2/3層の錐体細胞にかけて形成されるシナプスにおいて,AMPA受容体のシナプスへの移行について調べた.AMPA受容体とNMDA受容体との比,および,刺激により誘発される微小興奮性シナプス後電流について調べたところ,edonerpic maleateを投与したマウスにおいては対照と比べ高い値を示した.さらに,この値の増加はひげを切ると観察されなくなったことから,edonerpic maleateは入力に依存的にAMPA受容体のシナプスへの移行を促進することが明らかにされた.脳卒中などの脳損傷ののちの機能の回復は代償野の形成による可塑的な現象であると考えられている.edonerpic maleateは脳損傷ののちのリハビリテーションの効果を促進するのではないかと考えた.
このことを検証するため,マウスに上肢の運動の機能を評価する行動を課した.4日間の学習ののち,学習が成立したマウスの運動野を凍結により損傷させ,持続的な機能の低下を呈する脳損傷のモデルマウスを作出した.このマウスにedonerpic maleateを投与してリハビリテーションを施したところ,edonerpic maleateの投与およびリハビリテーションを併用したマウスは大きく回復したのに対し,水の投与およびリハビリテーションの併用,あるいは,水の投与のみのマウスは顕著な回復がみられなかった.さらに,edonerpic maleateの投与のみでリハビリテーションを併用しなかったマウスにおいても顕著な回復はみられなかった.すなわち,edonerpic maleateによる機能の回復の効果はトレーニングに依存的であった.edonerpic maleateは入力に依存的に特定のシナプスの伝達効率が変化するというシナプスの可塑性の概念を反映する薬剤であると考えられた.
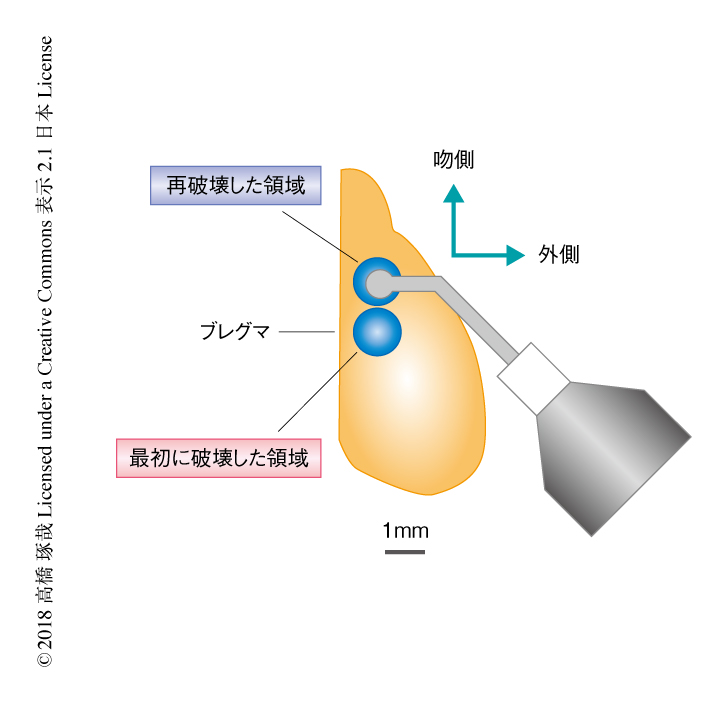
この機能的な代償野を形成する脳の領域を特定するため,edonerpic maleateにより回復したマウスの脳を再破壊したところ,最初に破壊した領域の前部を破壊したマウスにおいて機能の低下がみられた(図1).このことから,この領域がedonerpic maleateによる機能の回復を担う代償野であることが示された.AMPA受容体にはGluA1からGluA4の4つのサブユニットのあり,そのうちGluA1は入力に依存的にシナプスへと移行することが知られている8).GluA1のC末端側にある細胞内ドメインを発現させると入力に依存的なAMPA受容体のシナプスへの移行が阻害される3).edonerpic maleateによる代償野の領域にGluA1のC末端側の細胞内ドメインを発現させたところ,edonerpic maleateによる機能の回復が阻害された.このことから,edonerpic maleateによる機能の回復はAMPA受容体のシナプスへの移行により起こることが示された.実際に,edonerpic maleateにより回復したマウスは代償野の領域においてAMPA受容体のシナプスへの移行が起こっていることも観察された.
edonerpic maleateがCRMP2と結合していることも見い出された.もともとCRMP2は神経軸索を反発するタンパク質として発見されたセマフォリンの細胞内シグナルタンパク質として同定された9).最近,CRMP2はシナプスの機能に影響のあることも見い出されている10).CRMP2のノックアウトマウスにおいて,バレル皮質におけるedonerpic maleateによるAMPA受容体のシナプスへの移行の促進,および,脳損傷からの回復はみられなかった.このことから,CRMP2はedonerpic maleateによるリハビリテーションの効果の促進を仲介することが示唆された.
霊長類であるカニクイザルを用いてedonerpic maleateの薬効について検証した.コラゲナーゼを用いてカニクイザルの内包に出血をひき起した.内包はヒトにおいても脳梗塞や脳出血がよく発生する部位で,重篤な運動の麻痺の起こることが知られている.カニクイザルにおいても出血の反対側のとくに上肢において強い麻痺が出現した.このカニクイザルに2つの行動を課した.ひとつは離れた場所にある餌をスリットから手を出してとる動作で,もうひとつはアクリルパイプの中に餌を提示し人差し指と親指とで餌をとる動作である.とくに後者は,人間の日常生活のレベルに直結する指先の巧緻性を調べるものである.その結果,edonerpic maleateの投与により両者とも劇的に回復し,とくに,指先の巧緻性をみる行動における効果が顕著であった.
これらの結果により,edonerpic maleateはリハビリテーションの効果を促進する薬剤としての期待を大きくもてる化合物であることが明らかにされた.
現在の医療の現場において,リハビリテーションの効果を促進する薬剤はない.リハビリテーションは地道にトレーニングを積み重ねるのが基本であり,可塑性を増強することによりリハビリテーションの効果を高める薬剤は未充足の医療ニーズ(unmet medical needs)である.edonerpic maleateはAMPA受容体のシナプスへの移行を促進することによりトレーニングに依存的なリハビリテーションの効果を促進するものであり,これまでにない概念の薬剤である.現在,edonerpic maleateの治験の準備を進めており,科学的な治験を実施し成功させることがつぎに重要なステップとなる.また,脊髄損傷や発語障害などにも応用が可能と考えられる.この薬剤が一日も早く麻痺に苦しむ患者さんにとどくことを切望している.
略歴:2000年 米国Yale大学大学院博士課程 修了,米国Cold Spring Harbor Laboratory博士研究員を経て,2006年より横浜市立大学大学院医学研究科 教授.
研究テーマ:脳の可塑性.
抱負:面白きこともなき世を面白く.
研究室URL:http://neurosci.med.yokohama-cu.ac.jp/
© 2018 高橋 琢哉 Licensed under CC 表示 2.1 日本
(横浜市立大学大学院医学研究科 生理学教室)
email:高橋琢哉
DOI: 10.7875/first.author.2018.043
CRMP2-binding compound, edonerpic maleate, accelerates motor function recovery from brain damage.
Hiroki Abe, Susumu Jitsuki, Waki Nakajima, Yumi Murata, Aoi Jitsuki-Takahashi, Yuki Katsuno, Hirobumi Tada, Akane Sano, Kumiko Suyama, Nobuyuki Mochizuki, Takashi Komori, Hitoshi Masuyama, Tomohiro Okuda, Yoshio Goshima, Noriyuki Higo, Takuya Takahashi
Science, 360, 50-57 (2018)
要 約
脳卒中はわが国において毎年30万人が新たに罹患する疾患であり,ときとして非常に深刻な麻痺をひき起こし,麻痺の程度にかかわらず日常生活に大きな影をおとす.近年,急性期における治療は大きく進歩したが,リハビリテーションの時期にはいってからの治療には限界が多く,薬剤による介入もかぎられている.リハビリテーションによる回復の過程は可塑的な現象と考えられている.グルタミン酸シナプスは脳において興奮性シナプスの大半をしめ,AMPA受容体はその機能を中核的に担うグルタミン酸受容体である.AMPA受容体のシナプスへの移行はシナプスの可塑性の分子基盤である.この研究において,筆者らは,このAMPA受容体のシナプスへの移行を促進する化合物としてedonerpic maleateを同定した.この化合物は脳損傷ののちの機能の回復をトレーニングに依存して劇的に促進させた.edonerpic maleateによる機能の回復はげっ歯類および霊長類であるカニクイザルにおいて観察され,今後のヒトへの応用が重要なステップとなる.
はじめに
世界中の研究者による長年の積み重ねにより,シナプスの可塑性の基礎研究においては多くの知見が蓄積されている.依然として明らかにすべき命題は存在するが,臨床応用に耐えうるだけの強固な基礎研究の地盤はできあがりつつあると考えられる.しかしながら,その臨床応用は非常に乏しいのが現状であろう.グルタミン酸シナプスは脳における情報処理において非常に重要な役割をはたす.筆者らの研究も含めた多くの研究により,脳に可塑的な変化が起こるとき,グルタミン酸受容体のひとつであるAMPA受容体がシナプスへと移行することが明らかにされている.この研究において,筆者らは,AMPA受容体のシナプスへの移行を促進する化合物としてedonerpic maleateを同定した.
1.AMPA受容体のシナプスへの移行
脳においては記憶の形成や学習など外界の新しい刺激に応じて神経系にさまざまな変化が起こるが,この現象を神経の可塑性という.とくに,神経の機能の最小のユニットであるシナプスにおける可塑性は,記憶あるいは学習の基本となる機構として注目されつづけている.シナプスはニューロンをつなぐ構造であり,シナプス前神経が刺激をうけるとシナプス前終末から神経伝達物質が放出される.放出された神経伝達物質はシナプス後神経のシナプス後膜にある受容体と結合し,その結果,イオンチャネルを形成する受容体が活性化してイオンが細胞へと流入しシグナルが伝達される.グルタミン酸は脳において多くの興奮性シナプスから放出される神経伝達物質であり,それをうけとる複数のグルタミン酸受容体が存在する.そのうち,AMPA受容体は興奮性の神経伝達においてとくに重要な役割を担う.
1970年代前半,シナプス前神経を連続的に刺激するとシナプス後神経への伝達の効率が長期的に増強することが発見された1).この現象は長期増強(long term potentiation:LTP)とよばれ,記憶あるいは学習の研究においてシナプスのレベルでの中核的な機構とされてきた.この長期増強の研究を中心として記憶の分子機構の解明が爆発的に進んだ.2000年には,培養した海馬の切片を用いたin vitroにおいて,長期増強をひき起こす刺激がAMPA受容体のシナプス膜への移行を起こし,シナプス後膜におけるAMPA受容体の数が増加し,その結果,シナプス伝達の効率が増強されることが証明された2).
筆者らは,大脳皮質において神経回路が形成される際に,AMPA受容体がシナプスへと移行することを明らかにした.げっ歯類のバレル皮質はひげからの入力をうける部位であるが,ひげ-バレル皮質の機能的なマップが形成される幼若期において,ひげの経験に依存的にAMPA受容体がバレル皮質のシナプスへと移行することが見い出された3).さらに,この現象はすでに機能的なマップの形成が終了した生後3週間くらいからはみられないことも明らかにされた4)(新着論文レビュー でも掲載).
これらにくわえ,記憶あるいは学習の際に脳のシナプスにおいてAMPA受容体がシナプスへと移行することも明らかにされた.海馬に依存的な学習課題である回避学習においては,学習ののちの海馬CA1野におけるAMPA受容体のシナプス膜への移行が促進され,それにより海馬における特定の神経ネットワークが強化されて記憶の形成に寄与することが証明された5,6).また,この回避学習によりシナプスへと移行するAMPA受容体を光遺伝学的な手法にて不活性化すると記憶は消去されることも明らかにされた7).このことから,学習によりシナプスへと移行したAMPA受容体が記憶をコードすることが示された.
2.異種感覚間の可塑性におけるAMPA受容体のシナプスへの移行の役割および機能的な代償野の形成
ヒトなど霊長類をはじめとして,動物は視覚,聴覚,嗅覚,体性感覚などの感覚器官から外界の情報を得ることにより,社会的な行動をはじめとしたさまざまな行動を遂行する.疾患や事故などにより感覚器官の一部が失われることがあるが,その一方で,たとえば盲目の人がときとして異常な聴覚をもつことがある.このように,ひとつの感覚器官が失われたときにそのほかの感覚器官の機能が向上することにより,得られなくなった情報をなるべく多く獲得できるよう代償するシステムが神経系には存在する.このような脳の機能を異種感覚間の可塑性(cross modal plasticity)とよぶ.異種感覚間の可塑性の例は多く報告されているが,その分子機構および細胞機構については不明の点が多かった.
筆者らは,視覚を剥奪したラットのバレル皮質におけるAMPA受容体のシナプスへの移行について観察した.正常なラットにおいては,AMPA受容体の主要なサブユニットのひとつであるGluA1について,バレル皮質の第4層-2/3層シナプスにおけるひげの経験に依存的なシナプスへの移行は生後20日をこえると観察されなくなる.これは,バレル皮質の第2/3層におけるひげ-バレル皮質の機能的なマップが生後20日をこえる時点ですでに形成されているため,新たなシナプスの再構築の必要がないためと思われた.一方,この日齢において視覚を剥奪すると,バレル皮質の第4層-第2/3層シナプスにおいてGluA1のシナプスへの移行が起こるようになった.さらに,視覚を剥奪したラットのバレル皮質においてセロトニンの分泌が増加し,このセロトニンの分泌によりGluA1のシナプスへの移行が仲介されることも明らかにされた.このようなGluA1のシナプスへの移行の促進により,バレル皮質の第2/3層におけるひげ-バレル皮質の機能的なマップがより鋭敏になることも明らかにされた.この現象から,失われた機能を脳が代償するという現象にAMPA受容体のシナプスへの移行が密接にかかわることが示唆された4).
3.AMPA受容体のシナプスへの移行を促進する薬剤による脳損傷ののちのリハビリテーションの効果の促進
アルツハイマー病の治療薬として開発中だったT817MA(現在の名称は,edonerpic maleate)について解析を進めた.まず,成熟したマウスのバレル皮質の第4層から第2/3層の錐体細胞にかけて形成されるシナプスにおいて,AMPA受容体のシナプスへの移行について調べた.AMPA受容体とNMDA受容体との比,および,刺激により誘発される微小興奮性シナプス後電流について調べたところ,edonerpic maleateを投与したマウスにおいては対照と比べ高い値を示した.さらに,この値の増加はひげを切ると観察されなくなったことから,edonerpic maleateは入力に依存的にAMPA受容体のシナプスへの移行を促進することが明らかにされた.脳卒中などの脳損傷ののちの機能の回復は代償野の形成による可塑的な現象であると考えられている.edonerpic maleateは脳損傷ののちのリハビリテーションの効果を促進するのではないかと考えた.
このことを検証するため,マウスに上肢の運動の機能を評価する行動を課した.4日間の学習ののち,学習が成立したマウスの運動野を凍結により損傷させ,持続的な機能の低下を呈する脳損傷のモデルマウスを作出した.このマウスにedonerpic maleateを投与してリハビリテーションを施したところ,edonerpic maleateの投与およびリハビリテーションを併用したマウスは大きく回復したのに対し,水の投与およびリハビリテーションの併用,あるいは,水の投与のみのマウスは顕著な回復がみられなかった.さらに,edonerpic maleateの投与のみでリハビリテーションを併用しなかったマウスにおいても顕著な回復はみられなかった.すなわち,edonerpic maleateによる機能の回復の効果はトレーニングに依存的であった.edonerpic maleateは入力に依存的に特定のシナプスの伝達効率が変化するというシナプスの可塑性の概念を反映する薬剤であると考えられた.
この機能的な代償野を形成する脳の領域を特定するため,edonerpic maleateにより回復したマウスの脳を再破壊したところ,最初に破壊した領域の前部を破壊したマウスにおいて機能の低下がみられた(図1).このことから,この領域がedonerpic maleateによる機能の回復を担う代償野であることが示された.AMPA受容体にはGluA1からGluA4の4つのサブユニットのあり,そのうちGluA1は入力に依存的にシナプスへと移行することが知られている8).GluA1のC末端側にある細胞内ドメインを発現させると入力に依存的なAMPA受容体のシナプスへの移行が阻害される3).edonerpic maleateによる代償野の領域にGluA1のC末端側の細胞内ドメインを発現させたところ,edonerpic maleateによる機能の回復が阻害された.このことから,edonerpic maleateによる機能の回復はAMPA受容体のシナプスへの移行により起こることが示された.実際に,edonerpic maleateにより回復したマウスは代償野の領域においてAMPA受容体のシナプスへの移行が起こっていることも観察された.
edonerpic maleateがCRMP2と結合していることも見い出された.もともとCRMP2は神経軸索を反発するタンパク質として発見されたセマフォリンの細胞内シグナルタンパク質として同定された9).最近,CRMP2はシナプスの機能に影響のあることも見い出されている10).CRMP2のノックアウトマウスにおいて,バレル皮質におけるedonerpic maleateによるAMPA受容体のシナプスへの移行の促進,および,脳損傷からの回復はみられなかった.このことから,CRMP2はedonerpic maleateによるリハビリテーションの効果の促進を仲介することが示唆された.
霊長類であるカニクイザルを用いてedonerpic maleateの薬効について検証した.コラゲナーゼを用いてカニクイザルの内包に出血をひき起した.内包はヒトにおいても脳梗塞や脳出血がよく発生する部位で,重篤な運動の麻痺の起こることが知られている.カニクイザルにおいても出血の反対側のとくに上肢において強い麻痺が出現した.このカニクイザルに2つの行動を課した.ひとつは離れた場所にある餌をスリットから手を出してとる動作で,もうひとつはアクリルパイプの中に餌を提示し人差し指と親指とで餌をとる動作である.とくに後者は,人間の日常生活のレベルに直結する指先の巧緻性を調べるものである.その結果,edonerpic maleateの投与により両者とも劇的に回復し,とくに,指先の巧緻性をみる行動における効果が顕著であった.
これらの結果により,edonerpic maleateはリハビリテーションの効果を促進する薬剤としての期待を大きくもてる化合物であることが明らかにされた.
おわりに
現在の医療の現場において,リハビリテーションの効果を促進する薬剤はない.リハビリテーションは地道にトレーニングを積み重ねるのが基本であり,可塑性を増強することによりリハビリテーションの効果を高める薬剤は未充足の医療ニーズ(unmet medical needs)である.edonerpic maleateはAMPA受容体のシナプスへの移行を促進することによりトレーニングに依存的なリハビリテーションの効果を促進するものであり,これまでにない概念の薬剤である.現在,edonerpic maleateの治験の準備を進めており,科学的な治験を実施し成功させることがつぎに重要なステップとなる.また,脊髄損傷や発語障害などにも応用が可能と考えられる.この薬剤が一日も早く麻痺に苦しむ患者さんにとどくことを切望している.
文 献
- Bliss, T. V. & Lomo, T.: Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. J. Physiol., 232, 331-356 (1973)[PubMed]
- Hayashi, Y., Shi, S. H., Esteban, J. A. et al.: Driving AMPA receptors into synapses by LTP and CaMKII: requirement for GluR1 and PDZ domain interaction. Science, 287, 2262-2267 (2000)[PubMed]
- Takahashi, T., Svoboda, K. & Malinow, R.: Experience strengthening transmission by driving AMPA receptors into synapses. Science, 299, 1585-1588 (2003)[PubMed]
- Jitsuki, S., Takemoto, K., Kawasaki, T. et al.: Serotonin mediates cross-modal reorganization of cortical circuits. Neuron, 69, 780-792 (2011)[PubMed] [新着論文レビュー]
- Mitsushima, D., Ishihara, K., Sano, A. et al.: Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc. Natl. Acad. Sci. USA, 108, 12503-12508 (2011)[PubMed]
- Mitsushima, D., Sano, A. & Takahashi, T.: A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat. Commun., 4, 2760 (2013)[PubMed]
- Takemoto, K., Iwanari, H., Tada, H. et al.: Optical inactivation of synaptic AMPA receptors erases fear memory. Nat. Biotechnol., 35, 38-47 (2017)[PubMed]
- Malinow, R. & Malenka, R. C.: AMPA receptor trafficking and synaptic plasticity. Annu. Rev. Neurosci., 25, 103-126 (2002)[PubMed]
- Goshima, Y., Nakamura, F., Strittmatter, P. et al.: Collapsin-induced growth cone collapse mediated by an intracellular protein related to UNC-33. Nature, 376, 509-514 (1995)[PubMed]
- Jin, X., Sasamoto, K., Nagai, J. et al.: Phosphorylation of CRMP2 by Cdk5 regulates dendritic spine development of cortical neuron in the mouse hippocampus. Neural Plast., 2016, 6790743 (2016)[PubMed]
著者プロフィール
略歴:2000年 米国Yale大学大学院博士課程 修了,米国Cold Spring Harbor Laboratory博士研究員を経て,2006年より横浜市立大学大学院医学研究科 教授.
研究テーマ:脳の可塑性.
抱負:面白きこともなき世を面白く.
研究室URL:http://neurosci.med.yokohama-cu.ac.jp/
© 2018 高橋 琢哉 Licensed under CC 表示 2.1 日本