異なる感覚のあいだの可塑性を生じる分子細胞機構
高橋 琢哉
(横浜市立大学大学院医学研究科 生理学教室)
email:高橋琢哉
DOI: 10.7875/first.author.2011.054
Serotonin mediates cross-modal reorganization of cortical circuits.
Susumu Jitsuki, Kiwamu Takemoto, Taisuke Kawasaki, Hirobumi Tada, Aoi Takahashi, Carine Becamel, Akane Sano, Michisuke Yuzaki, R. Suzanne Zukin, Edward B. Ziff, Helmut W. Kessels, Takuya Takahashi
Neuron, 69, 780-792 (2011)
視覚を失った人がときとして常人をうわまわる聴覚や体性感覚をもつことがある.このように,ある感覚器系が損傷された場合にそのほかの感覚器系の機能が向上することを異種感覚間の可塑性(cross-modal plasticity)とよぶが,その分子細胞機構は不明であった.最近,筆者らは,視覚剥奪ラットのバレル皮質においてAMPA受容体のシナプスへの移行が促進すること,視覚剥奪ラットのバレル皮質におけるセロトニンの分泌が増加し,その増加がAMPA受容体のシナプスへの移行の促進を仲介すること,これらの機序によりヒゲとバレル皮質とのあいだの機能の向上することを明らかにした.
ヒトなど霊長類をはじめとした動物は,視覚,聴覚,嗅覚,体性感覚など感覚器から外界の情報を得ることにより社会的な行動をはじめとしたさまざまな行動を遂行することができる.しかしながら,疾患や事故などにより感覚器官の一部が失われてしまうことがある.その一方で,たとえば,盲目の人がときとして異常な聴覚をもつなどということがある.このように,ひとつの感覚器官が失われたときそのほかの感覚器官の機能が向上することにより,失われた感覚器官で得られなくなった情報をなるべく多く獲得できるよう代償するシステムが神経系には存在する.このような脳の機能を異種感覚間の可塑性(cross-modal plasticity)とよぶ.その例は数多く報告されているが,その分子細胞機構については不明の点が多い.ここでは,最近,筆者らが報告した論文について紹介する.
グルタミン酸シナプスは興奮性シナプスのひとつであり,脳での情報処理において中心的な役割を担っている1).シナプス前神経に刺激が入力すると,シナプス前末端からシナプス間隙にグルタミン酸が放出され,これがシナプス後膜に存在するグルタミン酸受容体に結合することによりシナプス後神経に情報が伝わる.数多くのグルタミン酸受容体が知られているが,そのなかでもAMPA受容体は非常に重要な役割をはたしている.AMPA受容体は四量体からなるイオンチャネルを形成しており,リガンドであるグルタミン酸が結合するとそのイオンチャネルが開きイオンが通過するようになってこれがシナプス後神経の反応となる.AMPA受容体には大きく4つのサブタイプが存在する(GluR1,GluR2,GluR3,GluR4).通常はGluR1-GluR2あるいはGluR2-GluR3からなるヘテロマーを形成している1).
新しい経験に反応するときには脳には可塑的な変化が起こる.その際,脳細胞のあいだの情報伝達を担うシナプスにおいて可塑的な変化が起こることが知られている.シナプス長期増強(long term potentiation:LTP)とよばれる現象はシナプス可塑性の代表的なもので,シナプスに連続的な刺激をあたえるとシナプス応答が長期的に増強するという現象である.このLTPの分子機構については10年ほどまえから世界中の多くのグループがさまざまな系で研究を進めてきた.in vitroの海馬スライスを用いた実験により,LTPが誘導される際にAMPA受容体サブユニットのひとつであるGluR1を含んだ複合体がシナプスに移行し,シナプスにおけるAMPA受容体の数が増加することによってシナプス応答が長期的に増強することが明らかになった2,3).また,ラットの個体を用いた実験により,ヒゲからの入力に依存してバレル皮質の第4層から2/3層にかけて形成されるシナプスにおいてGluR1受容体のシナプスへの移行が起こること4),恐怖学習によって視床から扁桃体にかけて形成されるシナプスにおいてGluR1受容体のシナプスへの移行が起こり,なおかつ,それが恐怖記憶の獲得に必要であること5),などが明らかになっている.
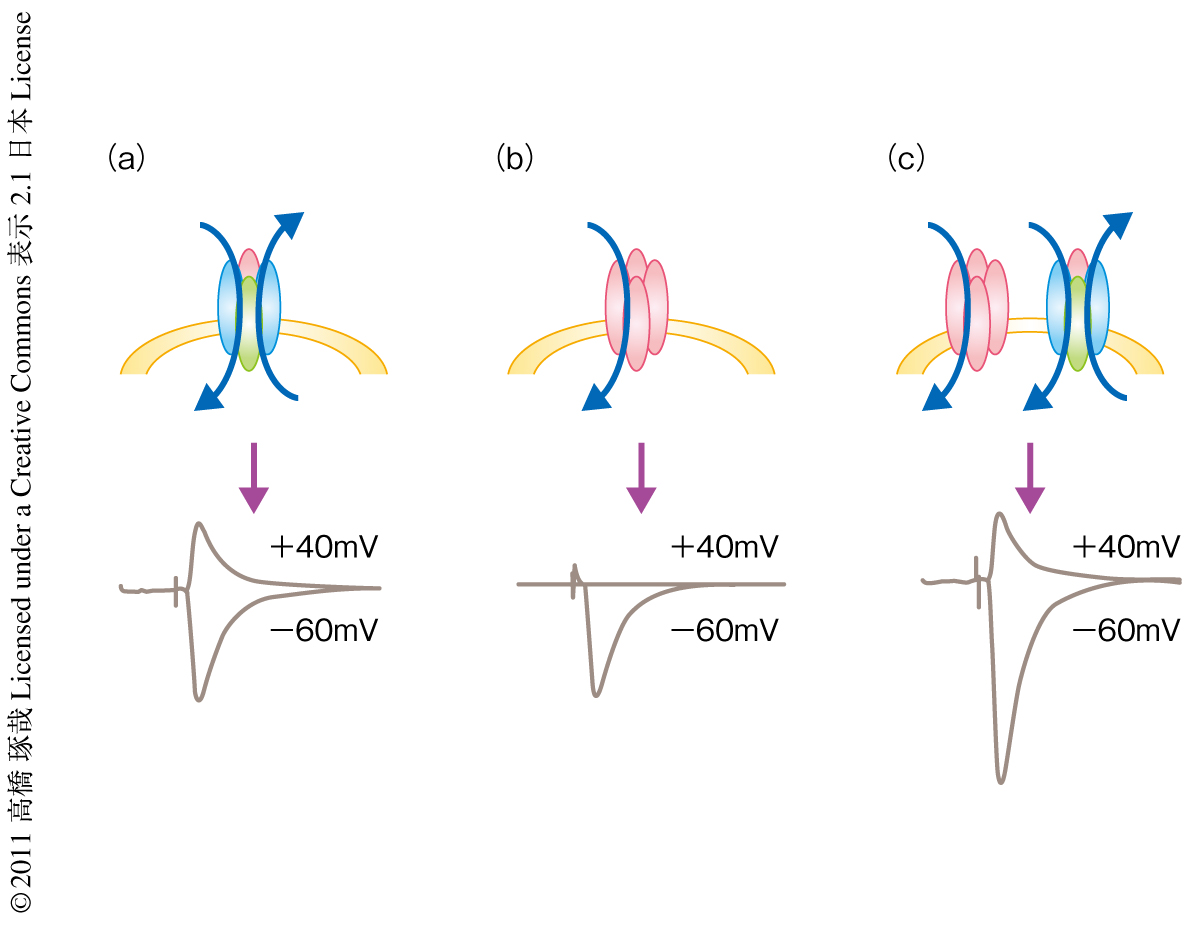
組換えAMPA受容体のシナプスへの移行をモニターする方法として,“電気生理学的な標識”という方法が開発されている3).生体のAMPA受容体では膜電位が負のときも正のときもイオンはチャネルを通過することができる.したがって,膜電位が正の場合も負の場合もシナプス応答がみられるが,組換えAMPA受容体では膜電位が負のときのみイオンはチャネルを通過する.これを内向き整流という.もし,この内向き整流を示す組換えAMPA受容体がシナプスに挿入された場合,挿入されていないシナプスに比べより大きい内向き整流を示すようになる.この内向き整流の度合いを調べることにより組換えAMPA受容体がシナプスに挿入されたかどうかを判定できる(図1).
以前の研究において,筆者らは,in vivoにおける感覚入力に依存的なAMPA受容体のシナプスへの移行を観察するため,ウイルスを用いたin vivo遺伝子導入法と急性スライスを用いた電気生理学的な手法とを組み合わせて実験を行った.そこでは,ラットのヒゲからの入力をうける大脳皮質の一部であるバレル皮質を使った.バレル皮質は30個ほどのバレルとよばれる直径300μmほどの細胞集団から構成されている.それぞれのバレルはひとつのヒゲに対応して反応し,ヒゲとバレルとのあいだには整然とした1対1の機能的なマップが形成される.ヒゲを切ることにより感覚入力を簡単にコントロールすることのできるこの系は,感覚入力に依存的な神経系の変化を調べることにおいて非常にすぐれた実験系である.そのとき,生後12日から14日におけるバレル皮質の第4層から第2/3層の錐体細胞にかけて形成されるシナプスに着目した.過去の報告により,この時期の第2/3層錐体細胞において経験に依存的な形態変化の活発であることが明らかになっていたからである6).
まず,GFP-GluR1融合タンパク質を発現するウイルスを生後12日のバレル皮質の第2/3層にin vivoにて導入した.そののち,ヒゲを切るか,あるいは,そのままヒゲの残っている状態で母親とほかのラットがいるケージに戻し,生後14日まで2日間おいた.生後14日目に脳を取り出し,急性スライスを作製して電気生理学的な解析を行った.その結果,ヒゲのある状態においてはGluR1を発現した細胞は発現していない細胞に比べてより大きな内向き整流を示した.このことは,GFP-GluR1融合タンパク質がシナプスへと挿入されていることを示していた.一方,ヒゲのない状態においてはGluR1を発現した細胞と発現していない細胞とのあいだに内向き整流に差はなかった.以上のことにより,ヒゲ経験に依存的に組換えGluR1がシナプスへと移行することが明らかになった4).さらに,AMPA受容体の応答とほかのグルタミン酸受容体であるNMDA受容体の応答との比を調べたところ,ヒゲのある状態のラットにおいてはヒゲのない状態のラットよりこの比の大きいことが明らかになった.このことは,内在性のAMPA受容体がヒゲ経験に依存的にバレル皮質の第4層から2/3層のシナプスに挿入されていることを示唆していた4).
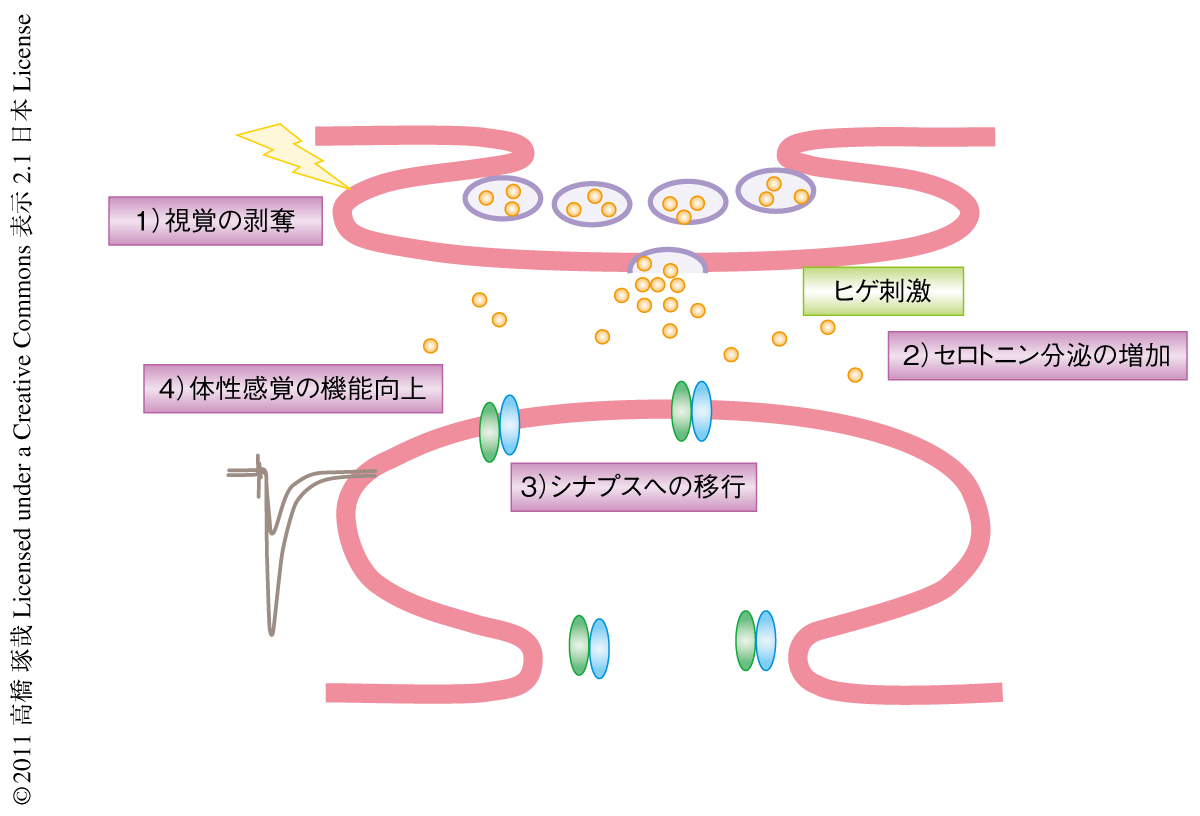
今回の研究において,筆者らは,さきに述べた方法を中心に,視覚剥奪ラットのバレル皮質におけるAMPA受容体のシナプスへの移行を観察した.正常なラットにおいて,バレル皮質の第4層から2/3層のシナプスにおけるGluR1のヒゲ経験に依存的なシナプスの移行は生後20日をこえると観察されなくなった.バレル皮質の第2/3層におけるヒゲとバレルとのあいだの機能的なマップが生後20日をこえる時点ですでに構築されているため,新たなシナプスの再構築の必要がないためと思われた.一方,この日齢において視覚を剥奪すると,バレル皮質の第4層から第2/3層のシナプスにおいてGluR1のシナプスへの移行が起こるようになった(図2).
in vivoマイクロ透析法を用いて視覚剥奪ラットのバレル皮質における神経伝達物質の放出を測定したところ,セロトニンの分泌の増えていることが明らかになった.セロトニン分泌の増加は視覚野ではみられなかった.一方,バレル皮質におけるドーパミンの分泌には視覚の剥奪による影響はみられなかった.さらに,セロトニン受容体(5HT2A/2C受容体)のアンタゴニストであるケタンセリンをバレル皮質に投与したところ,視覚の剥奪に依存的なGluR1のシナプスへの移行が阻害された.また,セロトニン受容体(5HT2A/2C受容体)のアゴニストであるDOIをバレル皮質に投与することにより,視覚を剥奪していない正常なラットにおいてもGluR1のシナプスへの移行が観察された.バレル皮質の急性スライスをこのセロトニン受容体アゴニストを含む溶液にひたすとLTPの誘導が促進されることも明らかになった.以上の結果より,視覚剥奪ラットにおいては,セロトニンの分泌の増加によりGluR1のシナプスへの移行が促進され,実際に移行の起こることが明らかになった(図2).
セロトニン受容体のひとつである5HT2A受容体の発現をRNAi法によりノックダウンすると,視覚の剥奪に依存的なGluR1のシナプスへの移行が阻害された.このことは,セロトニンシグナルが視覚剥奪ラットにおけるGluR1のシナプスへの移行を仲介していることを示していた.さらに,キナーゼであるERKの活性化,および,GluR1のSer845のリン酸化の上昇(GluR1の細胞膜の表面への露出を促進する7))も,視覚剥奪ラットのバレル皮質において観察された.以上より,視覚剥奪ラットのバレル皮質においてはセロトニンの分泌が増加し,これによりセロトニン受容体のうち5HT2A/2C受容体が活性化しその下流にあると考えられるERKの活性化によってGluR1のSer845のリン酸化の上昇が起こり,GluR1の細胞膜の表面への露出が増えることでGluR1のシナプスへの移行の促進につながると考えられた.このようなセロトニンシグナルに依存的なGluR1のシナプスへの移行の促進により,バレル皮質第2/3層におけるヒゲとバレルとのあいだの機能的なマップがより鋭敏になることも明らかになった(図2).
AMPA受容体のシナプスへの移行は経験に依存的な脳の可塑的な変化の分子基盤のひとつであるが,異種感覚間の可塑性(cross-modal plasticity)においてもこのしくみの使われていることが明らかになった.今後は,視覚の剥奪によりバレル皮質においてセロトニンの分泌が増加する神経回路の解明,セロトニンを介したGluR1のシナプスへの移行の促進のシグナル伝達機構の解明などが課題になると思われる.また,この研究は感覚器の障害ののちのリハビリテーション促進薬の開発においてその糸口になるとも期待される.
略歴:2000年 米国Yale大学大学院博士課程 修了,米国Cold Spring Harbor Laboratory博士研究員を経て,2006年より横浜市立大学大学院医学研究科 教授.
研究テーマ:脳の可塑性.
抱負:面白きこともなき世を面白く.
研究室URL:http://neurosci.med.yokohama-cu.ac.jp/
© 2011 高橋 琢哉 Licensed under CC 表示 2.1 日本
(横浜市立大学大学院医学研究科 生理学教室)
email:高橋琢哉
DOI: 10.7875/first.author.2011.054
Serotonin mediates cross-modal reorganization of cortical circuits.
Susumu Jitsuki, Kiwamu Takemoto, Taisuke Kawasaki, Hirobumi Tada, Aoi Takahashi, Carine Becamel, Akane Sano, Michisuke Yuzaki, R. Suzanne Zukin, Edward B. Ziff, Helmut W. Kessels, Takuya Takahashi
Neuron, 69, 780-792 (2011)
要 約
視覚を失った人がときとして常人をうわまわる聴覚や体性感覚をもつことがある.このように,ある感覚器系が損傷された場合にそのほかの感覚器系の機能が向上することを異種感覚間の可塑性(cross-modal plasticity)とよぶが,その分子細胞機構は不明であった.最近,筆者らは,視覚剥奪ラットのバレル皮質においてAMPA受容体のシナプスへの移行が促進すること,視覚剥奪ラットのバレル皮質におけるセロトニンの分泌が増加し,その増加がAMPA受容体のシナプスへの移行の促進を仲介すること,これらの機序によりヒゲとバレル皮質とのあいだの機能の向上することを明らかにした.
はじめに
ヒトなど霊長類をはじめとした動物は,視覚,聴覚,嗅覚,体性感覚など感覚器から外界の情報を得ることにより社会的な行動をはじめとしたさまざまな行動を遂行することができる.しかしながら,疾患や事故などにより感覚器官の一部が失われてしまうことがある.その一方で,たとえば,盲目の人がときとして異常な聴覚をもつなどということがある.このように,ひとつの感覚器官が失われたときそのほかの感覚器官の機能が向上することにより,失われた感覚器官で得られなくなった情報をなるべく多く獲得できるよう代償するシステムが神経系には存在する.このような脳の機能を異種感覚間の可塑性(cross-modal plasticity)とよぶ.その例は数多く報告されているが,その分子細胞機構については不明の点が多い.ここでは,最近,筆者らが報告した論文について紹介する.
1.AMPA受容体のシナプスへの移行
グルタミン酸シナプスは興奮性シナプスのひとつであり,脳での情報処理において中心的な役割を担っている1).シナプス前神経に刺激が入力すると,シナプス前末端からシナプス間隙にグルタミン酸が放出され,これがシナプス後膜に存在するグルタミン酸受容体に結合することによりシナプス後神経に情報が伝わる.数多くのグルタミン酸受容体が知られているが,そのなかでもAMPA受容体は非常に重要な役割をはたしている.AMPA受容体は四量体からなるイオンチャネルを形成しており,リガンドであるグルタミン酸が結合するとそのイオンチャネルが開きイオンが通過するようになってこれがシナプス後神経の反応となる.AMPA受容体には大きく4つのサブタイプが存在する(GluR1,GluR2,GluR3,GluR4).通常はGluR1-GluR2あるいはGluR2-GluR3からなるヘテロマーを形成している1).
新しい経験に反応するときには脳には可塑的な変化が起こる.その際,脳細胞のあいだの情報伝達を担うシナプスにおいて可塑的な変化が起こることが知られている.シナプス長期増強(long term potentiation:LTP)とよばれる現象はシナプス可塑性の代表的なもので,シナプスに連続的な刺激をあたえるとシナプス応答が長期的に増強するという現象である.このLTPの分子機構については10年ほどまえから世界中の多くのグループがさまざまな系で研究を進めてきた.in vitroの海馬スライスを用いた実験により,LTPが誘導される際にAMPA受容体サブユニットのひとつであるGluR1を含んだ複合体がシナプスに移行し,シナプスにおけるAMPA受容体の数が増加することによってシナプス応答が長期的に増強することが明らかになった2,3).また,ラットの個体を用いた実験により,ヒゲからの入力に依存してバレル皮質の第4層から2/3層にかけて形成されるシナプスにおいてGluR1受容体のシナプスへの移行が起こること4),恐怖学習によって視床から扁桃体にかけて形成されるシナプスにおいてGluR1受容体のシナプスへの移行が起こり,なおかつ,それが恐怖記憶の獲得に必要であること5),などが明らかになっている.
2.in vivoにおけるAMPA受容体のシナプスへの移行の評価
組換えAMPA受容体のシナプスへの移行をモニターする方法として,“電気生理学的な標識”という方法が開発されている3).生体のAMPA受容体では膜電位が負のときも正のときもイオンはチャネルを通過することができる.したがって,膜電位が正の場合も負の場合もシナプス応答がみられるが,組換えAMPA受容体では膜電位が負のときのみイオンはチャネルを通過する.これを内向き整流という.もし,この内向き整流を示す組換えAMPA受容体がシナプスに挿入された場合,挿入されていないシナプスに比べより大きい内向き整流を示すようになる.この内向き整流の度合いを調べることにより組換えAMPA受容体がシナプスに挿入されたかどうかを判定できる(図1).
以前の研究において,筆者らは,in vivoにおける感覚入力に依存的なAMPA受容体のシナプスへの移行を観察するため,ウイルスを用いたin vivo遺伝子導入法と急性スライスを用いた電気生理学的な手法とを組み合わせて実験を行った.そこでは,ラットのヒゲからの入力をうける大脳皮質の一部であるバレル皮質を使った.バレル皮質は30個ほどのバレルとよばれる直径300μmほどの細胞集団から構成されている.それぞれのバレルはひとつのヒゲに対応して反応し,ヒゲとバレルとのあいだには整然とした1対1の機能的なマップが形成される.ヒゲを切ることにより感覚入力を簡単にコントロールすることのできるこの系は,感覚入力に依存的な神経系の変化を調べることにおいて非常にすぐれた実験系である.そのとき,生後12日から14日におけるバレル皮質の第4層から第2/3層の錐体細胞にかけて形成されるシナプスに着目した.過去の報告により,この時期の第2/3層錐体細胞において経験に依存的な形態変化の活発であることが明らかになっていたからである6).
まず,GFP-GluR1融合タンパク質を発現するウイルスを生後12日のバレル皮質の第2/3層にin vivoにて導入した.そののち,ヒゲを切るか,あるいは,そのままヒゲの残っている状態で母親とほかのラットがいるケージに戻し,生後14日まで2日間おいた.生後14日目に脳を取り出し,急性スライスを作製して電気生理学的な解析を行った.その結果,ヒゲのある状態においてはGluR1を発現した細胞は発現していない細胞に比べてより大きな内向き整流を示した.このことは,GFP-GluR1融合タンパク質がシナプスへと挿入されていることを示していた.一方,ヒゲのない状態においてはGluR1を発現した細胞と発現していない細胞とのあいだに内向き整流に差はなかった.以上のことにより,ヒゲ経験に依存的に組換えGluR1がシナプスへと移行することが明らかになった4).さらに,AMPA受容体の応答とほかのグルタミン酸受容体であるNMDA受容体の応答との比を調べたところ,ヒゲのある状態のラットにおいてはヒゲのない状態のラットよりこの比の大きいことが明らかになった.このことは,内在性のAMPA受容体がヒゲ経験に依存的にバレル皮質の第4層から2/3層のシナプスに挿入されていることを示唆していた4).
3.視覚剥奪ラットのバレル皮質におけるAMPA受容体のシナプスへの移行の促進
今回の研究において,筆者らは,さきに述べた方法を中心に,視覚剥奪ラットのバレル皮質におけるAMPA受容体のシナプスへの移行を観察した.正常なラットにおいて,バレル皮質の第4層から2/3層のシナプスにおけるGluR1のヒゲ経験に依存的なシナプスの移行は生後20日をこえると観察されなくなった.バレル皮質の第2/3層におけるヒゲとバレルとのあいだの機能的なマップが生後20日をこえる時点ですでに構築されているため,新たなシナプスの再構築の必要がないためと思われた.一方,この日齢において視覚を剥奪すると,バレル皮質の第4層から第2/3層のシナプスにおいてGluR1のシナプスへの移行が起こるようになった(図2).
in vivoマイクロ透析法を用いて視覚剥奪ラットのバレル皮質における神経伝達物質の放出を測定したところ,セロトニンの分泌の増えていることが明らかになった.セロトニン分泌の増加は視覚野ではみられなかった.一方,バレル皮質におけるドーパミンの分泌には視覚の剥奪による影響はみられなかった.さらに,セロトニン受容体(5HT2A/2C受容体)のアンタゴニストであるケタンセリンをバレル皮質に投与したところ,視覚の剥奪に依存的なGluR1のシナプスへの移行が阻害された.また,セロトニン受容体(5HT2A/2C受容体)のアゴニストであるDOIをバレル皮質に投与することにより,視覚を剥奪していない正常なラットにおいてもGluR1のシナプスへの移行が観察された.バレル皮質の急性スライスをこのセロトニン受容体アゴニストを含む溶液にひたすとLTPの誘導が促進されることも明らかになった.以上の結果より,視覚剥奪ラットにおいては,セロトニンの分泌の増加によりGluR1のシナプスへの移行が促進され,実際に移行の起こることが明らかになった(図2).
セロトニン受容体のひとつである5HT2A受容体の発現をRNAi法によりノックダウンすると,視覚の剥奪に依存的なGluR1のシナプスへの移行が阻害された.このことは,セロトニンシグナルが視覚剥奪ラットにおけるGluR1のシナプスへの移行を仲介していることを示していた.さらに,キナーゼであるERKの活性化,および,GluR1のSer845のリン酸化の上昇(GluR1の細胞膜の表面への露出を促進する7))も,視覚剥奪ラットのバレル皮質において観察された.以上より,視覚剥奪ラットのバレル皮質においてはセロトニンの分泌が増加し,これによりセロトニン受容体のうち5HT2A/2C受容体が活性化しその下流にあると考えられるERKの活性化によってGluR1のSer845のリン酸化の上昇が起こり,GluR1の細胞膜の表面への露出が増えることでGluR1のシナプスへの移行の促進につながると考えられた.このようなセロトニンシグナルに依存的なGluR1のシナプスへの移行の促進により,バレル皮質第2/3層におけるヒゲとバレルとのあいだの機能的なマップがより鋭敏になることも明らかになった(図2).
おわりに
AMPA受容体のシナプスへの移行は経験に依存的な脳の可塑的な変化の分子基盤のひとつであるが,異種感覚間の可塑性(cross-modal plasticity)においてもこのしくみの使われていることが明らかになった.今後は,視覚の剥奪によりバレル皮質においてセロトニンの分泌が増加する神経回路の解明,セロトニンを介したGluR1のシナプスへの移行の促進のシグナル伝達機構の解明などが課題になると思われる.また,この研究は感覚器の障害ののちのリハビリテーション促進薬の開発においてその糸口になるとも期待される.
文 献
- Malinow, R. & Malenka, R. C.: AMPA receptor trafficking and synaptic plasticity. Annu. Rev. Neurosci., 25, 103-126 (2002)[PubMed]
- Shi, S. H., Hayashi, Y., Petralia, R. S. et al.: Rapid spine delivery and redistribution of AMPA receptors after synaptic NMDA receptor activation. Science, 284, 1811-1816 (1999)[PubMed]
- Hayashi, Y., Shi, S. H., Esteban, J. A. et al.: Driving AMPA receptors into synapses by LTP and CaMKII: requirement for GluR1 and PDZ domain interaction. Science, 287, 2262-2267 (2000)[PubMed]
- Takahashi, T., Svoboda, K. & Malinow, R.: Experience strengthening transmission by driving AMPA receptors into synapses. Science, 299, 1585-1588 (2003)[PubMed]
- Rumpel, S., LeDoux, J., Zador, A. et al.: Postsynaptic receptor trafficking underlying a form of associative learning. Science, 308, 83-88 (2005)[PubMed]
- Lendvai, B., Stern, E. A., Chen, B. et al.: Experience-dependent plasticity of dendritic spines in the developing rat barrel cortex in vivo. Nature, 404, 876-881 (2000)[PubMed]
- Derkach, V. A., Oh, M. C., Guire, E. S. et al.: Regulatory mechanisms of AMPA receptors in synaptic plasticity. Nat. Rev. Neurosci., 8, 101-113 (2007)[PubMed]
著者プロフィール
略歴:2000年 米国Yale大学大学院博士課程 修了,米国Cold Spring Harbor Laboratory博士研究員を経て,2006年より横浜市立大学大学院医学研究科 教授.
研究テーマ:脳の可塑性.
抱負:面白きこともなき世を面白く.
研究室URL:http://neurosci.med.yokohama-cu.ac.jp/
© 2011 高橋 琢哉 Licensed under CC 表示 2.1 日本