2種類のDNAによるToll様受容体TLR9の活性化の機構
大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:大戸梅治,清水敏之
DOI: 10.7875/first.author.2018.039
Toll-like receptor 9 contains two DNA binding sites that function cooperatively to promote receptor dimerization and activation.
Umeharu Ohto, Hanako Ishida, Takuma Shibata, Ryota Sato, Kensuke Miyake, Toshiyuki Shimizu
Immunity, 48, 649-658.e4 (2018)
Toll様受容体TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識し自然免疫を活性化する.これまでに,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造が明らかにされているが,TLR9を活性化するDNAの配列については不明な点が多かった.この研究において,筆者らは,TLR9はCpGモチーフをもつDNAとの結合部位とは別に,5'末端から2番目にシトシンをもつDNAとの結合部位をもつことを見い出した.5'末端から2番目にシトシンをもつDNAはCpGモチーフをもつDNAの存在のもとでTLR9と結合し,TLR9の二量体化および活性化を協調的に促進した.X線結晶構造解析の結果,TLR9の5'末端から2番目にシトシンをもつDNAとの結合部位は,TLR7あるいはTLR8におけるモノヌクレオシドとの結合部位と対応していた.この研究により,TLR9は2種類のDNAを2箇所の結合部位において認識することにより効率的に活性化する機構が明らかにされ,この知見はTLR9の活性を制御する薬剤の開発に寄与することが期待される.
病原体が体内に侵入すると免疫機構が発動する.自然免疫はその最前線で機能し,病原体の侵入を迅速に感知しそれに対する防御応答を開始する役割をはたす.DNAやRNAなどの核酸やリポ多糖のような微生物やウイルスなど病原体の構成成分は,各種の自然免疫受容体により認識され免疫応答をひき起こす1,2).自然免疫受容体のひとつであるToll様受容体(Toll-like receptor:TLR)は自然免疫において重要な役割をはたす.ヒトにおいてはTLR1~TLR10の10種類が知られており,それぞれ異なるリガンドにより活性化される.そのうちTLR9は細菌やウイルスに由来するCpGモチーフをもつDNAにより活性化され,インターフェロンや炎症性サイトカインの発現を誘導して抗ウイルス応答や炎症応答をひき起こす3,4).一方,TLR9は自己に由来するDNAによっても活性化される可能性があり,これが自己免疫疾患などの病態の一因となると考えられている5).そのため,TLR9はウイルスの感染,がん,アレルギーに対する治療薬の標的とされており,その活性化の機構の正しい理解がもとめられている.
近年,筆者らにより,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造が明らかにされ,TLR9にCpGモチーフをもつDNAが結合することにより二量体化する機構が解明された6)(新着論文レビュー でも掲載).一方,5'末端にTCGあるいはTCCをもつCpGモチーフをもつDNAは,それらをもたないCpGモチーフをもつDNAと比べ効率的にTLR9を活性化するとの報告もあり7,8),DNAの5'末端の配列がTLR9の活性化に重要であることが示唆されている.さらに,5'末端にTCGをもつ数塩基からなる短いDNAは,CpGモチーフをもつDNAによるTLR9の活性化を増強するとの報告もある9).これらの報告から,TLR9はCpGモチーフをもつDNAとの結合部位とは別に,第2のDNA結合部位をもつことが予想された.実際に,TLR9と同じくTLR7サブファミリーに属するTLR7およびTLR8は2箇所のリガンド結合部位をもち,それぞれが1本鎖RNAおよびモノヌクレオシドを認識することにより効率的に二量体化することが示された10,11)(文献10) は新着論文レビュー でも掲載,文献11) は新着論文レビュー でも掲載).TLR9とTLR7およびTLR8との機能的および構造的な類似性から,TLR9も同様に2箇所のリガンド結合部位をもつことが予想されたが,実際に,どのような配列のDNAがどこに結合してどのような機能をはたすのかは不明であった.
この研究において,筆者らは,5'末端から2番目にシトシンをもつDNAが,CpGモチーフをもつDNAと同時に,それぞれTLR9の別の部位と結合することによりTLR9を効率的に活性化させること,つまり,TLR9の活性化が2種類のDNAとの結合により制御されていることを,生化学的および構造生物学的に明らかにした.
TLR9のもつ第2のDNA結合部位は5'末端のTCGあるいはTCCを認識すると予想し,CpGモチーフをもつ10塩基のDNA,および,5'末端がTCGである6塩基のDNAを用い,ゲルろ過法および等温滴定カロリメトリー法によりTLR9との結合について検証した.その結果,ウマ,ウシ,マウスに由来するTLR9に対しCpGモチーフをもつDNAはいずれも解離定数が数十~数百nMという強い結合を示した.5'末端がTCGであるDNAのみではTLR9に対してまったく結合を示さなかったが,CpGモチーフをもつDNAの存在のもとではTLR9に対し解離定数が数~数十nMという非常に強い結合を示した.TLR9のみの溶液,TLR9とCpGモチーフをもつDNAとの混合溶液,TLR9,CpGモチーフをもつDNA,5'末端がTCGであるDNAからなる混合溶液,をゲルろ過法により分析し,TLR9のピークである波長260 nmと波長280 nmにおける吸光度の大きさおよびそれらの比をもとめることにより,CpGモチーフをもつDNAおよび5'末端がTCGであるDNAがTLR9と同時に結合することが示唆された.また,CpGモチーフをもつDNAのみ,あるいは,5'末端がTCGであるDNAのみをくわえた場合にはTLR9二量体のピークはほとんど検出されなかったが,CpGモチーフをもつDNAおよび5'末端がTCGであるDNAを同時にくわえた場合にはTLR9二量体のピークは顕著に増加した.なお,筆者らによる以前の結果では,CpGモチーフをもつDNAのみによるTLR9の二量体化は非常に弱く,TLR9の二量体化は超遠心法や結晶中など濃度が高い状態でのみ検出されゲルろ過法では検出されなかった6).これらの結果から,TLR9はCpGモチーフをもつDNAおよび5'末端がTCGであるDNAの2種類のDNAに対し別の結合部位をもち,それらは協調的にTLR9の二量体化に関与することが示された.
5'末端がTCGであるDNAとの結合部位に対する塩基配列の特異性について調べた.5'末端がTCGである6塩基のDNAについて,5'側から3つの塩基をそれぞれ別の塩基に置換し,CpGモチーフをもつDNAの存在のもとでのTLR9との結合を等温滴定カロリメトリー法により検証した.その結果,1番目あるいは3番目の塩基を置換した場合には結合に影響は認められなかったが,2番目のシトシンをいずれかの塩基に置換した場合にはTLR9に対する結合はほとんどあるいは完全に失われた.5'側に1塩基を付加した場合もまったく結合しなくなった.5'側にリン酸基を付加した場合も結合は完全に失われたが,3'側へのリン酸基の付加は影響がなかった.また,5'末端がTCGであるDNAの2番目のシトシンをメチル化すると結合は大きく減弱した.ゲルろ過法においても同様の傾向が示された.CpGモチーフをもつDNAと同時にくわえた場合,等温滴定カロリメトリー法により結合のみられた5'末端から2番目にシトシンをもつDNAについてはTLR9の二量体化が検出されたが,それ以外のDNAでは二量体化は認められなかった.これらの結果から,5'末端から2番目にシトシンをもつDNAがTLR9と結合し,その結合とTLR9の二量体化は連動することが明らかにされた.
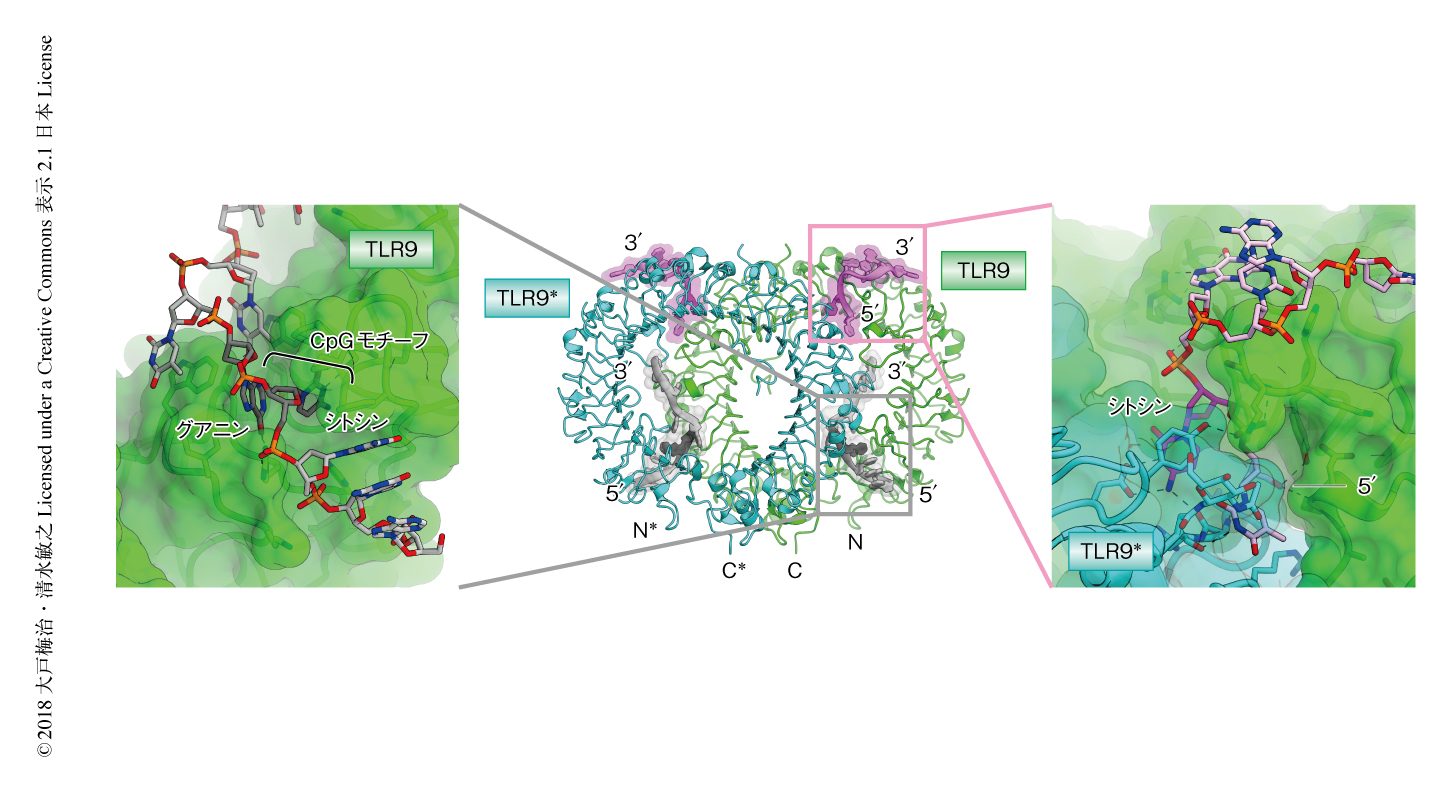
TLR9とCpGモチーフをもつDNAおよび5'末端がTCGであるDNAとの結合およびその二量体化への影響について調べるため,X線結晶構造解析法により,ウマに由来するTLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAからなる複合体の結晶構造を明らかにした(PDB ID:5Y3J,図1).その結果,TLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAは2対2対2の複合体を形成しており,全体構造は以前に報告したTLR9とCpGモチーフをもつDNAからなる2対2の複合体と類似していた6).
CpGモチーフをもつDNAのCpGモチーフの部位はTLR9のN末端側にある溝と,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造と同様の相互作用により結合していた.一方,5'末端から2番目にシトシンをもつDNAはTLR9のリング型構造の上部にある新規の結合部位と結合していた.この部位は,TLR7,1本鎖RNA,グアノシンからなる複合体の構造(PDB ID:5GMF)や,TLR8,1本鎖RNA,ウリジンからなる複合体の構造(PDB ID:4R07)における,モノヌクレオシドや合成リガンドとの結合部位に対応していた10-12)(文献12) は新着論文レビュー でも掲載)(図2).
5'末端から2番目にシトシンをもつDNAは5'側の3つのヌクレオチドがTLR9と相互作用していた.とくに,2番目のシトシンは,TLR7におけるグアノシン,TLR8におけるウリジンと完全に重なる位置と結合し,TLR9二量体を構成する2つのプロトマーそれぞれと多数の相互作用を形成し厳密に認識されていた.それに対し,1番目のヌクレオチドおよび3番目のヌクレオチドはそれほど厳密には認識されておらず,ゲルろ過法および等温滴定カロリメトリー法による結合実験の結果と対応していた.実際に,5'末端から2番目にシトシンをもつDNAの1番目の塩基をTからGに置換したDNAとの複合体(PDB ID:5Y3K),あるいは,Cに置換したDNAとの複合体(PDB ID:5Y3L)の結晶構造も明らかにされ,同様に結合することが示された.ただし,1番目のヌクレオチドの5'末端のOH基は特異的に認識されており,これは5'末端にリン酸基を付加すると結合が失われたことに対応した.また,4番目以降の塩基とTLR9との相互作用はみられなかった.さらに,ウシに由来するTLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAからなる複合体の結晶構造(PDB ID:5Y3M)においても,全体構造およびDNAの認識の様式は共通していた.
5'末端から2番目にシトシンをもつDNAとの結合部位へのDNAの結合が細胞におけるTLR9の活性化に重要であるのかどうかを調べた.TLR9を発現させたHEK293T細胞におけるNF-κBリポーターアッセイ,および,骨髄由来マクロファージ細胞におけるサイトカインの産生の測定において,CpGモチーフをもつDNAのみによる刺激,および,5'末端から2番目にシトシンをもつDNAのみによる刺激では,TLR9の活性化は非常に弱いかほとんど検出されなかったが,CpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激するとTLR9の活性化は顕著に上昇した.また,マクロファージをCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激したところTLR9の下流のシグナルタンパク質のリン酸化が顕著に亢進した.さらに,形質細胞様樹状細胞においてもCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激すると,TLR9に依存的なインターフェロンの産生の上昇が認められた.これらの結果から,さまざまな細胞において,TLR9の活性化にはCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAの両方が重要であることが示された.
この研究,および,筆者らによるこれまでの一連の研究により6,10-12),核酸を認識するTLR7サブファミリーTLR7,TLR8,TLR9に共通した,2種類のリガンドによる協調的な受容体の活性化の機構が明らかにされた.TLR7あるいはTLR8のモノヌクレオシド結合部位とTLR9の5'末端から2番目にシトシンをもつDNAとの結合部位は共通するのに対し,TLR7あるいはTLR8の1本鎖RNA結合部位とTLR9のCpGモチーフをもつDNAとの結合部位はそれぞれ異なる(図2).これらの類似点および相違点に関する情報は,これらの受容体の機能を正しく理解するための構造基盤を提供し,これらの受容体を標的にした薬剤の開発に貢献することが期待される.
略歴:2007年 東京大学大学院薬学系研究科 修了,同年 同 助教,2013年 同 講師を経て,2016年より同 准教授.
研究テーマ:受容体が機能するしくみを明らかにする.
抱負:あきらめない,つぎはきっとうまくいく.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2018 大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:大戸梅治,清水敏之
DOI: 10.7875/first.author.2018.039
Toll-like receptor 9 contains two DNA binding sites that function cooperatively to promote receptor dimerization and activation.
Umeharu Ohto, Hanako Ishida, Takuma Shibata, Ryota Sato, Kensuke Miyake, Toshiyuki Shimizu
Immunity, 48, 649-658.e4 (2018)
要 約
Toll様受容体TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識し自然免疫を活性化する.これまでに,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造が明らかにされているが,TLR9を活性化するDNAの配列については不明な点が多かった.この研究において,筆者らは,TLR9はCpGモチーフをもつDNAとの結合部位とは別に,5'末端から2番目にシトシンをもつDNAとの結合部位をもつことを見い出した.5'末端から2番目にシトシンをもつDNAはCpGモチーフをもつDNAの存在のもとでTLR9と結合し,TLR9の二量体化および活性化を協調的に促進した.X線結晶構造解析の結果,TLR9の5'末端から2番目にシトシンをもつDNAとの結合部位は,TLR7あるいはTLR8におけるモノヌクレオシドとの結合部位と対応していた.この研究により,TLR9は2種類のDNAを2箇所の結合部位において認識することにより効率的に活性化する機構が明らかにされ,この知見はTLR9の活性を制御する薬剤の開発に寄与することが期待される.
はじめに
病原体が体内に侵入すると免疫機構が発動する.自然免疫はその最前線で機能し,病原体の侵入を迅速に感知しそれに対する防御応答を開始する役割をはたす.DNAやRNAなどの核酸やリポ多糖のような微生物やウイルスなど病原体の構成成分は,各種の自然免疫受容体により認識され免疫応答をひき起こす1,2).自然免疫受容体のひとつであるToll様受容体(Toll-like receptor:TLR)は自然免疫において重要な役割をはたす.ヒトにおいてはTLR1~TLR10の10種類が知られており,それぞれ異なるリガンドにより活性化される.そのうちTLR9は細菌やウイルスに由来するCpGモチーフをもつDNAにより活性化され,インターフェロンや炎症性サイトカインの発現を誘導して抗ウイルス応答や炎症応答をひき起こす3,4).一方,TLR9は自己に由来するDNAによっても活性化される可能性があり,これが自己免疫疾患などの病態の一因となると考えられている5).そのため,TLR9はウイルスの感染,がん,アレルギーに対する治療薬の標的とされており,その活性化の機構の正しい理解がもとめられている.
近年,筆者らにより,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造が明らかにされ,TLR9にCpGモチーフをもつDNAが結合することにより二量体化する機構が解明された6)(新着論文レビュー でも掲載).一方,5'末端にTCGあるいはTCCをもつCpGモチーフをもつDNAは,それらをもたないCpGモチーフをもつDNAと比べ効率的にTLR9を活性化するとの報告もあり7,8),DNAの5'末端の配列がTLR9の活性化に重要であることが示唆されている.さらに,5'末端にTCGをもつ数塩基からなる短いDNAは,CpGモチーフをもつDNAによるTLR9の活性化を増強するとの報告もある9).これらの報告から,TLR9はCpGモチーフをもつDNAとの結合部位とは別に,第2のDNA結合部位をもつことが予想された.実際に,TLR9と同じくTLR7サブファミリーに属するTLR7およびTLR8は2箇所のリガンド結合部位をもち,それぞれが1本鎖RNAおよびモノヌクレオシドを認識することにより効率的に二量体化することが示された10,11)(文献10) は新着論文レビュー でも掲載,文献11) は新着論文レビュー でも掲載).TLR9とTLR7およびTLR8との機能的および構造的な類似性から,TLR9も同様に2箇所のリガンド結合部位をもつことが予想されたが,実際に,どのような配列のDNAがどこに結合してどのような機能をはたすのかは不明であった.
この研究において,筆者らは,5'末端から2番目にシトシンをもつDNAが,CpGモチーフをもつDNAと同時に,それぞれTLR9の別の部位と結合することによりTLR9を効率的に活性化させること,つまり,TLR9の活性化が2種類のDNAとの結合により制御されていることを,生化学的および構造生物学的に明らかにした.
1.5'末端から2番目にシトシンをもつDNAはCpGモチーフをもつDNAと同時にTLR9と結合し二量体化を促進する
TLR9のもつ第2のDNA結合部位は5'末端のTCGあるいはTCCを認識すると予想し,CpGモチーフをもつ10塩基のDNA,および,5'末端がTCGである6塩基のDNAを用い,ゲルろ過法および等温滴定カロリメトリー法によりTLR9との結合について検証した.その結果,ウマ,ウシ,マウスに由来するTLR9に対しCpGモチーフをもつDNAはいずれも解離定数が数十~数百nMという強い結合を示した.5'末端がTCGであるDNAのみではTLR9に対してまったく結合を示さなかったが,CpGモチーフをもつDNAの存在のもとではTLR9に対し解離定数が数~数十nMという非常に強い結合を示した.TLR9のみの溶液,TLR9とCpGモチーフをもつDNAとの混合溶液,TLR9,CpGモチーフをもつDNA,5'末端がTCGであるDNAからなる混合溶液,をゲルろ過法により分析し,TLR9のピークである波長260 nmと波長280 nmにおける吸光度の大きさおよびそれらの比をもとめることにより,CpGモチーフをもつDNAおよび5'末端がTCGであるDNAがTLR9と同時に結合することが示唆された.また,CpGモチーフをもつDNAのみ,あるいは,5'末端がTCGであるDNAのみをくわえた場合にはTLR9二量体のピークはほとんど検出されなかったが,CpGモチーフをもつDNAおよび5'末端がTCGであるDNAを同時にくわえた場合にはTLR9二量体のピークは顕著に増加した.なお,筆者らによる以前の結果では,CpGモチーフをもつDNAのみによるTLR9の二量体化は非常に弱く,TLR9の二量体化は超遠心法や結晶中など濃度が高い状態でのみ検出されゲルろ過法では検出されなかった6).これらの結果から,TLR9はCpGモチーフをもつDNAおよび5'末端がTCGであるDNAの2種類のDNAに対し別の結合部位をもち,それらは協調的にTLR9の二量体化に関与することが示された.
2.TLR9との結合には5'末端から2番目のシトシンが重要である
5'末端がTCGであるDNAとの結合部位に対する塩基配列の特異性について調べた.5'末端がTCGである6塩基のDNAについて,5'側から3つの塩基をそれぞれ別の塩基に置換し,CpGモチーフをもつDNAの存在のもとでのTLR9との結合を等温滴定カロリメトリー法により検証した.その結果,1番目あるいは3番目の塩基を置換した場合には結合に影響は認められなかったが,2番目のシトシンをいずれかの塩基に置換した場合にはTLR9に対する結合はほとんどあるいは完全に失われた.5'側に1塩基を付加した場合もまったく結合しなくなった.5'側にリン酸基を付加した場合も結合は完全に失われたが,3'側へのリン酸基の付加は影響がなかった.また,5'末端がTCGであるDNAの2番目のシトシンをメチル化すると結合は大きく減弱した.ゲルろ過法においても同様の傾向が示された.CpGモチーフをもつDNAと同時にくわえた場合,等温滴定カロリメトリー法により結合のみられた5'末端から2番目にシトシンをもつDNAについてはTLR9の二量体化が検出されたが,それ以外のDNAでは二量体化は認められなかった.これらの結果から,5'末端から2番目にシトシンをもつDNAがTLR9と結合し,その結合とTLR9の二量体化は連動することが明らかにされた.
3.TLR9の5'末端から2番目にシトシンをもつDNAとの結合部位の構造
TLR9とCpGモチーフをもつDNAおよび5'末端がTCGであるDNAとの結合およびその二量体化への影響について調べるため,X線結晶構造解析法により,ウマに由来するTLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAからなる複合体の結晶構造を明らかにした(PDB ID:5Y3J,図1).その結果,TLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAは2対2対2の複合体を形成しており,全体構造は以前に報告したTLR9とCpGモチーフをもつDNAからなる2対2の複合体と類似していた6).
CpGモチーフをもつDNAのCpGモチーフの部位はTLR9のN末端側にある溝と,TLR9とCpGモチーフをもつDNAとの複合体の結晶構造と同様の相互作用により結合していた.一方,5'末端から2番目にシトシンをもつDNAはTLR9のリング型構造の上部にある新規の結合部位と結合していた.この部位は,TLR7,1本鎖RNA,グアノシンからなる複合体の構造(PDB ID:5GMF)や,TLR8,1本鎖RNA,ウリジンからなる複合体の構造(PDB ID:4R07)における,モノヌクレオシドや合成リガンドとの結合部位に対応していた10-12)(文献12) は新着論文レビュー でも掲載)(図2).
5'末端から2番目にシトシンをもつDNAは5'側の3つのヌクレオチドがTLR9と相互作用していた.とくに,2番目のシトシンは,TLR7におけるグアノシン,TLR8におけるウリジンと完全に重なる位置と結合し,TLR9二量体を構成する2つのプロトマーそれぞれと多数の相互作用を形成し厳密に認識されていた.それに対し,1番目のヌクレオチドおよび3番目のヌクレオチドはそれほど厳密には認識されておらず,ゲルろ過法および等温滴定カロリメトリー法による結合実験の結果と対応していた.実際に,5'末端から2番目にシトシンをもつDNAの1番目の塩基をTからGに置換したDNAとの複合体(PDB ID:5Y3K),あるいは,Cに置換したDNAとの複合体(PDB ID:5Y3L)の結晶構造も明らかにされ,同様に結合することが示された.ただし,1番目のヌクレオチドの5'末端のOH基は特異的に認識されており,これは5'末端にリン酸基を付加すると結合が失われたことに対応した.また,4番目以降の塩基とTLR9との相互作用はみられなかった.さらに,ウシに由来するTLR9,CpGモチーフをもつDNA,5'末端から2番目にシトシンをもつDNAからなる複合体の結晶構造(PDB ID:5Y3M)においても,全体構造およびDNAの認識の様式は共通していた.
4.TLR9の活性化にはCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAの両方が重要である
5'末端から2番目にシトシンをもつDNAとの結合部位へのDNAの結合が細胞におけるTLR9の活性化に重要であるのかどうかを調べた.TLR9を発現させたHEK293T細胞におけるNF-κBリポーターアッセイ,および,骨髄由来マクロファージ細胞におけるサイトカインの産生の測定において,CpGモチーフをもつDNAのみによる刺激,および,5'末端から2番目にシトシンをもつDNAのみによる刺激では,TLR9の活性化は非常に弱いかほとんど検出されなかったが,CpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激するとTLR9の活性化は顕著に上昇した.また,マクロファージをCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激したところTLR9の下流のシグナルタンパク質のリン酸化が顕著に亢進した.さらに,形質細胞様樹状細胞においてもCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAにより共刺激すると,TLR9に依存的なインターフェロンの産生の上昇が認められた.これらの結果から,さまざまな細胞において,TLR9の活性化にはCpGモチーフをもつDNAおよび5'末端から2番目にシトシンをもつDNAの両方が重要であることが示された.
おわりに
この研究,および,筆者らによるこれまでの一連の研究により6,10-12),核酸を認識するTLR7サブファミリーTLR7,TLR8,TLR9に共通した,2種類のリガンドによる協調的な受容体の活性化の機構が明らかにされた.TLR7あるいはTLR8のモノヌクレオシド結合部位とTLR9の5'末端から2番目にシトシンをもつDNAとの結合部位は共通するのに対し,TLR7あるいはTLR8の1本鎖RNA結合部位とTLR9のCpGモチーフをもつDNAとの結合部位はそれぞれ異なる(図2).これらの類似点および相違点に関する情報は,これらの受容体の機能を正しく理解するための構造基盤を提供し,これらの受容体を標的にした薬剤の開発に貢献することが期待される.
文 献
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
- Palm, N. W. & Medzhitov, R.: Pattern recognition receptors and control of adaptive immunity. Immunol. Rev., 227, 221-233 (2009)[PubMed]
- Hemmi, H., Takeuchi, O., Kawai, T. et al.: A Toll-like receptor recognizes bacterial DNA. Nature, 408, 740-745 (2000)[PubMed]
- Krieg, A. M., Yi, A. K., Matson, S. et al.: CpG motifs in bacterial DNA trigger direct B-cell activation. Nature, 374, 546-549 (1995)[PubMed]
- Banchereau, J. & Pascual, V.: Type I interferon in systemic lupus erythematosus and other autoimmune diseases. Immunity, 25, 383-392 (2006)[PubMed]
- Ohto, U., Shibata, T., Tanji, H. et al.: Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9. Nature, 520, 702-705 (2015)[PubMed] [新着論文レビュー]
- Pohar, J., Lainscek, D., Fukui, R. et al.: Species-specific minimal sequence motif for oligodeoxyribonucleotides activating mouse TLR9. J. Immunol., 195, 4396-4405 (2015)[PubMed]
- Pohar, J., Krajnik, A. K., Jerala, R. et al.: Minimal sequence requirements for oligodeoxyribonucleotides activating human TLR9. J. Immunol., 194, 3901-3908 (2015)[PubMed]
- Pohar, J., Lainscek, D., Ivicak-Kocjan, K. et al.: Short single-stranded DNA degradation products augment the activation of Toll-like receptor 9. Nat. Commun., 8, 15363 (2017)[PubMed]
- Zhang, Z. K., Ohto, U., Shibata, T. et al.: Structural analysis reveals that Toll-like receptor 7 is a dual receptor for guanosine and single-stranded RNA. Immunity, 45, 737-748 (2016)[PubMed] [新着論文レビュー]
- Tanji, H., Ohto, U., Shibata, T. et al.: Toll-like receptor 8 senses degradation products of single-stranded RNA. Nat. Struct. Mol. Biol., 22, 109-115 (2015)[PubMed] [新着論文レビュー]
- Tanji, H., Ohto, U., Shibata, T. et al.: Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands. Science, 339, 1426-1429 (2013)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 東京大学大学院薬学系研究科 修了,同年 同 助教,2013年 同 講師を経て,2016年より同 准教授.
研究テーマ:受容体が機能するしくみを明らかにする.
抱負:あきらめない,つぎはきっとうまくいく.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2018 大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本