Toll様受容体TLR9によるDNAの認識の機構
大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2015.024
Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9.
Umeharu Ohto, Takuma Shibata, Hiromi Tanji, Hanako Ishida, Elena Krayukhina, Susumu Uchiyama, Kensuke Miyake, Toshiyuki Shimizu
Nature, 520, 702-705 (2015)
Toll様受容体TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識して活性化し,種々の自然免疫応答をひき起こす.TLR9の活性を制御する物質はウイルス感染,がん,アレルギーに対する治療薬として期待されているが,これまで,TLR9がCpGモチーフをもつDNAを認識して活性化する機構について構造生物学的な知見は得られていない.今回,筆者らは,DNAと結合していないTLR9,TLR9とCpGモチーフをもつDNAとの複合体,TLR9とアンタゴニストDNAとの複合体の結晶構造を明らかにした.その結果,TLR9とCpGモチーフをもつDNAは2対2の活性化型の複合体を形成することが明らかにされた.一方で,アンタゴニストDNAはTLR9の馬蹄型の構造の内側にループ構造を形成して結合することによりCpGモチーフをもつDNAの結合を阻害することが明らかにされた.この研究により,TLR9を標的とする治療薬の開発の進展が期待される.
細菌やウイルスなどの病原体の侵入に対する防御機構として,われわれのからだには免疫機構が備わっている.自然免疫は初期の免疫機構であり,生体に侵入した病原体の分子パターンをToll様受容体(Toll like receptor:TLR)などのパターン認識受容体が感知する1,2).Toll様受容体はI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと細胞内のTIRドメインからなる3,4).Toll様受容体のうちTLR3,TLR7,TLR8,TLR9はおもにエンドソームに存在し,病原体に由来するDNAやRNAなどの核酸の認識にかかわる5).TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識して活性化し,インターフェロンや炎症性サイトカインの産生を誘導して抗ウイルス応答や炎症応答をひき起こす6,7).一方,TLR9は自己に由来するDNAに反応することによりアレルギー疾患や自己免疫疾患などの病態とも関係する8).TLR9の活性を制御する物質はウイルス感染,がん,アレルギーに対する治療薬として期待されているが,これまで,TLR9が具体的にどのようにしてCpGモチーフをもつDNAを認識して活性化するのかについて,構造生物学的な知見は得られていなかった.
今回,筆者らは,DNAと結合していないTLR9,TLR9とCpGモチーフをもつDNAとの複合体,TLR9とアンタゴニストDNAとの複合体の結晶構造解析に成功し,TLR9によるCpGモチーフをもつDNAおよびアンタゴニストDNAの認識の機構,および,TLR9の活性化の機構を明らかにした.
TLR9の結晶構造を明らかにするため,さまざまな生物種に由来するTLR9の細胞外領域をショウジョウバエS2細胞において発現させた.その結果,ウマ,ウシ,マウスに由来するTLR9について,性状の解析および結晶化に十分な量の精製された試料を得ることに成功した.TLR7,TLR8,TLR9についてはLRRドメインにZループが存在し,この部位において切断されることが機能の発現に重要であることが示されている9,10).実際に,以前に筆者らが報告したTLR8の構造解析においてはTLR8は発現させた時点ですでにZループにおいて切断されていたが,N末端側の断片とC末端側の断片は互いに相互作用しておりいずれもリガンドの認識に重要であった11)(新着論文レビュー でも掲載).そこで,TLR9においても生体でのZループでの切断を模倣するため,V8プロテアーゼを用いてZループにおいて切断された試料を調製した.
Zループにおいて切断していないTLR9および切断したTLR9を用いて,ゲルろ過法および超遠心分析法によりリガンドとの結合および会合状態を評価した.その結果,Zループにおける切断の有無にかかわらず,CpGモチーフをもつDNAおよびアンタゴニストDNAとTLR9との結合が確認された.また,Zループにおける切断の有無にかかわらず,リガンドの非存在下およびアンタゴニストDNAの存在下ではTLR9は単量体として存在していた.CpGモチーフをもつDNAの存在下ではZループにおいて切断したTLR9は二量体の形成が促進されていたのに対し,切断していないTLR9は単量体のままであった.一方で,CpGモチーフをもつDNAのCG配列をGC配列に入れ替えたDNAの存在下では二量体の形成の促進はみられなかった.これらの結果より,TLR9のZループにおける切断はDNAとの結合には影響しないが,それにともなう二量体の形成において重要な役割をはたしていると考えられた.
DNAと結合していないTLR9につき2つ(PDB ID:3WPB,3WPF),TLR9とCpGモチーフをもつDNAとの複合体につき2つ(PDB ID:3WPC,3WPE),TLR9とアンタゴニストDNAとの複合体につき4つ(PDB ID:3WPD,3WPG,3WPH,3WPI)の結晶構造を明らかにした.構造解析はいずれもZループにおいて切断したTLR9について行った.DNAと結合していないTLR9およびTLR9とアンタゴニストDNAとの複合体はいずれも単量体であったが,TLR9とCpGモチーフをもつDNAとの複合体は二量体を形成していた.
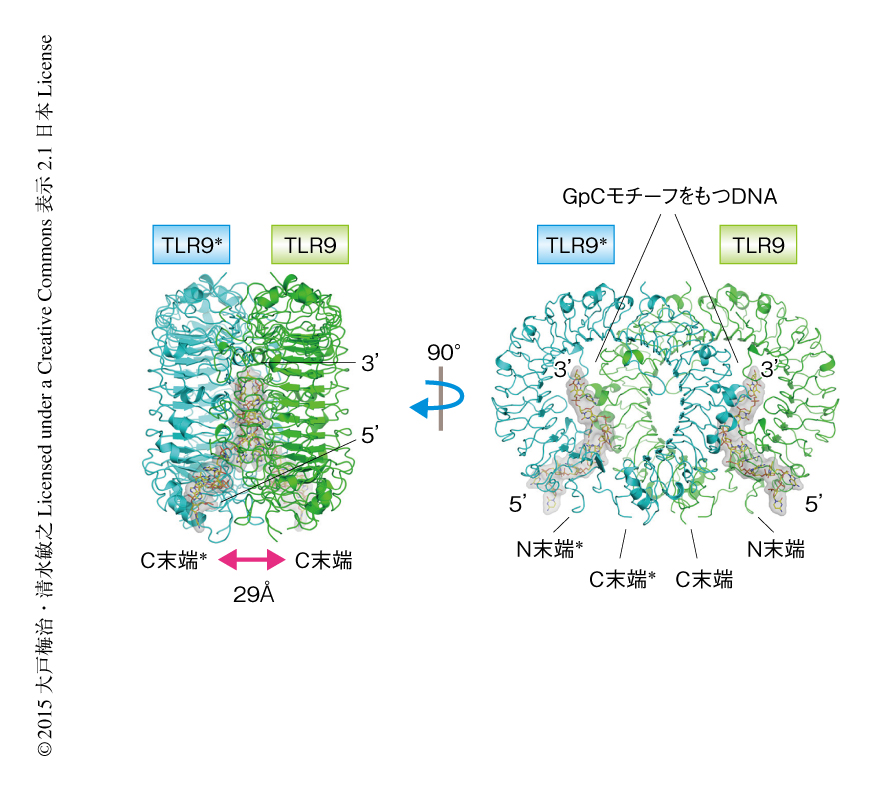
TLR9とCpGモチーフをもつDNAは2対2の複合体を形成しており,TLR9はm字型の二量体を形成していた(図1).複合体の構造においてTLR9の二量体のC末端側どうしが接近しており,これにより細胞内のTIRドメインを近接させて下流へとシグナル伝達していると考えられた.この活性化型の構造は,以前に筆者らが報告したTLR8の活性化型の構造と非常によく似ていた11).解析されたTLR9とCpGモチーフをもつDNAとの複合体の2つの構造は,TLR9の配置およびCpGモチーフをもつDNAの認識についてほぼ同一であった.結晶化に用いた12塩基のCpGモチーフをもつDNAのすべての残基はモデルに組み込むことができた.CpGモチーフをもつDNAはTLR9ともう1分子のTLR9にはさまれて伸びたかたちで結合していた.CpGモチーフをもつDNAとそれぞれのTLR9との相互作用部位をそれぞれインターフェース1とインターフェース2とよぶことにした.インターフェース1において,CpGモチーフの塩基の部分は,TLR9のN末端側のLRRNT,LRR1,LRR2により構成される溝にはまり込んでその周辺のアミノ酸残基と特徴的な相互作用を形成していた.また,インターフェース2においては,TLR9はおもにDNAのリン酸基の部分と相互作用していた.
CpGモチーフのシトシン部分では,TLR9のMet106およびSer104とのあいだに水素結合がみられた.また,水分子を介しTLR9と相互作用していた.CpGモチーフのシトシン環はPro105,Phe108,隣接するグアニン環に,また,CpGモチーフのグアニン環はTrp47,Phe49,隣接するシトシン環にかこまれており,いずれも周辺のアミノ酸残基と密に相互作用していた.グアニン部分はTrp96および2塩基あとのチミンとのあいだで水素結合を形成していた.この相互作用はグアニンに特異的であり,CpGモチーフのグアニン部分の特異性が規定されているものと考えられた.CpGモチーフの1塩基まえのグアニンおよび2塩基まえのアデニンのプリン環は,Phe108とともに3層のスタッキング相互作用を形成していた.また,CpGモチーフのリン酸基の部分はLys51,Arg74,His76,His77と静電相互作用を形成していた.実際に,TLR9の変異体を用いたHEK293T細胞におけるNF-κBリポーターアッセイにより,これらCpGモチーフをもつDNAと相互作用しているTLR9のアミノ酸残基の重要性が示された.
TLR9のCpGモチーフをもつDNAの認識におけるCG配列の重要性を調べるため,CpGモチーフをもつDNAのCG配列をGC配列,UG配列,TG配列,CA配列と置換したDNAを用い,等温滴定カロリメトリー法によりTLR9との結合の強さを調べた結果,CG配列がTLR9との結合に重要であることが示された.また,異なるpHにおける等温滴定カロリメトリー法の結果,TLR9とCpGモチーフをもつDNAとの結合は酸性側で強いのに対し塩基性側では弱くなることが明らかにされた.このことは,結晶構造において,DNAのリン酸基の認識に中性付近に酸解離定数をもつHisが多く関与していたことと対応しており,また,酸性条件にあるリソソームにおいてTLR9がDNAを認識するのに適していると考えられた.
CpGモチーフは哺乳動物ではメチル化されることが多いのに対し,細菌やウイルスではメチル化されないことがわかっており,メチル化したCpGモチーフはメチル化していないCpGモチーフに比べ免疫の活性化能が低いとされている7).等温滴定カロリメトリー法の結果,メチル化したCpGモチーフはメチル化していないCpGモチーフに比べTLR9との結合の弱いことが示された.さらに,メチル化したCpGモチーフをもつDNAは,超遠心分析の結果からTLR9の二量体の形成能が低いこと,また,HEK293T細胞のリポーターアッセイの結果からTLR9の活性化能が低いことが示された.これらの結果は,以前の報告とよく対応した7).
TLR9とアンタゴニストDNAは1対1の複合体を形成しており,TLR9は単量体であり,アンタゴニストDNAはTLR9の馬蹄型の構造の内側にコンパクトなループ構造を形成して結合していた(図2).TLR9はアンタゴニストDNAのリン酸基の骨格の部分をおもに認識しており,それにくわえ,ループ構造の2本鎖DNAの突出末端部分における相互作用も重要であることが示された.アンタゴニストDNAはCpGモチーフをもつDNAよりTLR9と強力に結合し,また,TLR9とアンタゴニストDNAの結合部位はCpGモチーフをもつDNAの結合部位と一部が重なっていたことから,アンタゴニストDNAはCpGモチーフをもつDNAとの結合と物理的に競合することによりTLR9の活性化を阻害していることが明らかにされた.
微生物に由来するDNAのもつCpGモチーフが免疫を活性化させること12),そして,その認識はTLR9によること6,7) が報告されて以来,十数年にわたり,TLR9によるCpGモチーフをもつDNAの認識に関して数多くの研究がなされてきた.この研究は,TLR9によるDNAの認識の機構の解明に対する大きな一歩であり,今後,この結果をもとにTLR9を標的にした創薬の進展が期待される.
略歴:2007年 東京大学大学院薬学系研究科 修了,2013年より同 講師.
研究テーマ:受容体の構造および機能.
抱負:着実に仕事をする.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2015 大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:清水敏之
DOI: 10.7875/first.author.2015.024
Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9.
Umeharu Ohto, Takuma Shibata, Hiromi Tanji, Hanako Ishida, Elena Krayukhina, Susumu Uchiyama, Kensuke Miyake, Toshiyuki Shimizu
Nature, 520, 702-705 (2015)
要 約
Toll様受容体TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識して活性化し,種々の自然免疫応答をひき起こす.TLR9の活性を制御する物質はウイルス感染,がん,アレルギーに対する治療薬として期待されているが,これまで,TLR9がCpGモチーフをもつDNAを認識して活性化する機構について構造生物学的な知見は得られていない.今回,筆者らは,DNAと結合していないTLR9,TLR9とCpGモチーフをもつDNAとの複合体,TLR9とアンタゴニストDNAとの複合体の結晶構造を明らかにした.その結果,TLR9とCpGモチーフをもつDNAは2対2の活性化型の複合体を形成することが明らかにされた.一方で,アンタゴニストDNAはTLR9の馬蹄型の構造の内側にループ構造を形成して結合することによりCpGモチーフをもつDNAの結合を阻害することが明らかにされた.この研究により,TLR9を標的とする治療薬の開発の進展が期待される.
はじめに
細菌やウイルスなどの病原体の侵入に対する防御機構として,われわれのからだには免疫機構が備わっている.自然免疫は初期の免疫機構であり,生体に侵入した病原体の分子パターンをToll様受容体(Toll like receptor:TLR)などのパターン認識受容体が感知する1,2).Toll様受容体はI型膜貫通タンパク質であり,リガンドを認識する細胞外のLRRドメインと細胞内のTIRドメインからなる3,4).Toll様受容体のうちTLR3,TLR7,TLR8,TLR9はおもにエンドソームに存在し,病原体に由来するDNAやRNAなどの核酸の認識にかかわる5).TLR9は細菌やウイルスに由来するCpGモチーフをもつDNAを認識して活性化し,インターフェロンや炎症性サイトカインの産生を誘導して抗ウイルス応答や炎症応答をひき起こす6,7).一方,TLR9は自己に由来するDNAに反応することによりアレルギー疾患や自己免疫疾患などの病態とも関係する8).TLR9の活性を制御する物質はウイルス感染,がん,アレルギーに対する治療薬として期待されているが,これまで,TLR9が具体的にどのようにしてCpGモチーフをもつDNAを認識して活性化するのかについて,構造生物学的な知見は得られていなかった.
今回,筆者らは,DNAと結合していないTLR9,TLR9とCpGモチーフをもつDNAとの複合体,TLR9とアンタゴニストDNAとの複合体の結晶構造解析に成功し,TLR9によるCpGモチーフをもつDNAおよびアンタゴニストDNAの認識の機構,および,TLR9の活性化の機構を明らかにした.
1.TLR9の細胞外領域の発現および性状の解析
TLR9の結晶構造を明らかにするため,さまざまな生物種に由来するTLR9の細胞外領域をショウジョウバエS2細胞において発現させた.その結果,ウマ,ウシ,マウスに由来するTLR9について,性状の解析および結晶化に十分な量の精製された試料を得ることに成功した.TLR7,TLR8,TLR9についてはLRRドメインにZループが存在し,この部位において切断されることが機能の発現に重要であることが示されている9,10).実際に,以前に筆者らが報告したTLR8の構造解析においてはTLR8は発現させた時点ですでにZループにおいて切断されていたが,N末端側の断片とC末端側の断片は互いに相互作用しておりいずれもリガンドの認識に重要であった11)(新着論文レビュー でも掲載).そこで,TLR9においても生体でのZループでの切断を模倣するため,V8プロテアーゼを用いてZループにおいて切断された試料を調製した.
Zループにおいて切断していないTLR9および切断したTLR9を用いて,ゲルろ過法および超遠心分析法によりリガンドとの結合および会合状態を評価した.その結果,Zループにおける切断の有無にかかわらず,CpGモチーフをもつDNAおよびアンタゴニストDNAとTLR9との結合が確認された.また,Zループにおける切断の有無にかかわらず,リガンドの非存在下およびアンタゴニストDNAの存在下ではTLR9は単量体として存在していた.CpGモチーフをもつDNAの存在下ではZループにおいて切断したTLR9は二量体の形成が促進されていたのに対し,切断していないTLR9は単量体のままであった.一方で,CpGモチーフをもつDNAのCG配列をGC配列に入れ替えたDNAの存在下では二量体の形成の促進はみられなかった.これらの結果より,TLR9のZループにおける切断はDNAとの結合には影響しないが,それにともなう二量体の形成において重要な役割をはたしていると考えられた.
2.TLR9の結晶構造解析
DNAと結合していないTLR9につき2つ(PDB ID:3WPB,3WPF),TLR9とCpGモチーフをもつDNAとの複合体につき2つ(PDB ID:3WPC,3WPE),TLR9とアンタゴニストDNAとの複合体につき4つ(PDB ID:3WPD,3WPG,3WPH,3WPI)の結晶構造を明らかにした.構造解析はいずれもZループにおいて切断したTLR9について行った.DNAと結合していないTLR9およびTLR9とアンタゴニストDNAとの複合体はいずれも単量体であったが,TLR9とCpGモチーフをもつDNAとの複合体は二量体を形成していた.
3.TLR9によるCpGモチーフをもつDNAの認識
TLR9とCpGモチーフをもつDNAは2対2の複合体を形成しており,TLR9はm字型の二量体を形成していた(図1).複合体の構造においてTLR9の二量体のC末端側どうしが接近しており,これにより細胞内のTIRドメインを近接させて下流へとシグナル伝達していると考えられた.この活性化型の構造は,以前に筆者らが報告したTLR8の活性化型の構造と非常によく似ていた11).解析されたTLR9とCpGモチーフをもつDNAとの複合体の2つの構造は,TLR9の配置およびCpGモチーフをもつDNAの認識についてほぼ同一であった.結晶化に用いた12塩基のCpGモチーフをもつDNAのすべての残基はモデルに組み込むことができた.CpGモチーフをもつDNAはTLR9ともう1分子のTLR9にはさまれて伸びたかたちで結合していた.CpGモチーフをもつDNAとそれぞれのTLR9との相互作用部位をそれぞれインターフェース1とインターフェース2とよぶことにした.インターフェース1において,CpGモチーフの塩基の部分は,TLR9のN末端側のLRRNT,LRR1,LRR2により構成される溝にはまり込んでその周辺のアミノ酸残基と特徴的な相互作用を形成していた.また,インターフェース2においては,TLR9はおもにDNAのリン酸基の部分と相互作用していた.
CpGモチーフのシトシン部分では,TLR9のMet106およびSer104とのあいだに水素結合がみられた.また,水分子を介しTLR9と相互作用していた.CpGモチーフのシトシン環はPro105,Phe108,隣接するグアニン環に,また,CpGモチーフのグアニン環はTrp47,Phe49,隣接するシトシン環にかこまれており,いずれも周辺のアミノ酸残基と密に相互作用していた.グアニン部分はTrp96および2塩基あとのチミンとのあいだで水素結合を形成していた.この相互作用はグアニンに特異的であり,CpGモチーフのグアニン部分の特異性が規定されているものと考えられた.CpGモチーフの1塩基まえのグアニンおよび2塩基まえのアデニンのプリン環は,Phe108とともに3層のスタッキング相互作用を形成していた.また,CpGモチーフのリン酸基の部分はLys51,Arg74,His76,His77と静電相互作用を形成していた.実際に,TLR9の変異体を用いたHEK293T細胞におけるNF-κBリポーターアッセイにより,これらCpGモチーフをもつDNAと相互作用しているTLR9のアミノ酸残基の重要性が示された.
TLR9のCpGモチーフをもつDNAの認識におけるCG配列の重要性を調べるため,CpGモチーフをもつDNAのCG配列をGC配列,UG配列,TG配列,CA配列と置換したDNAを用い,等温滴定カロリメトリー法によりTLR9との結合の強さを調べた結果,CG配列がTLR9との結合に重要であることが示された.また,異なるpHにおける等温滴定カロリメトリー法の結果,TLR9とCpGモチーフをもつDNAとの結合は酸性側で強いのに対し塩基性側では弱くなることが明らかにされた.このことは,結晶構造において,DNAのリン酸基の認識に中性付近に酸解離定数をもつHisが多く関与していたことと対応しており,また,酸性条件にあるリソソームにおいてTLR9がDNAを認識するのに適していると考えられた.
CpGモチーフは哺乳動物ではメチル化されることが多いのに対し,細菌やウイルスではメチル化されないことがわかっており,メチル化したCpGモチーフはメチル化していないCpGモチーフに比べ免疫の活性化能が低いとされている7).等温滴定カロリメトリー法の結果,メチル化したCpGモチーフはメチル化していないCpGモチーフに比べTLR9との結合の弱いことが示された.さらに,メチル化したCpGモチーフをもつDNAは,超遠心分析の結果からTLR9の二量体の形成能が低いこと,また,HEK293T細胞のリポーターアッセイの結果からTLR9の活性化能が低いことが示された.これらの結果は,以前の報告とよく対応した7).
4.TLR9によるアンタゴニストアンタゴニストDNAの認識
TLR9とアンタゴニストDNAは1対1の複合体を形成しており,TLR9は単量体であり,アンタゴニストDNAはTLR9の馬蹄型の構造の内側にコンパクトなループ構造を形成して結合していた(図2).TLR9はアンタゴニストDNAのリン酸基の骨格の部分をおもに認識しており,それにくわえ,ループ構造の2本鎖DNAの突出末端部分における相互作用も重要であることが示された.アンタゴニストDNAはCpGモチーフをもつDNAよりTLR9と強力に結合し,また,TLR9とアンタゴニストDNAの結合部位はCpGモチーフをもつDNAの結合部位と一部が重なっていたことから,アンタゴニストDNAはCpGモチーフをもつDNAとの結合と物理的に競合することによりTLR9の活性化を阻害していることが明らかにされた.
おわりに
微生物に由来するDNAのもつCpGモチーフが免疫を活性化させること12),そして,その認識はTLR9によること6,7) が報告されて以来,十数年にわたり,TLR9によるCpGモチーフをもつDNAの認識に関して数多くの研究がなされてきた.この研究は,TLR9によるDNAの認識の機構の解明に対する大きな一歩であり,今後,この結果をもとにTLR9を標的にした創薬の進展が期待される.
文 献
- Janeway, C. A. Jr. & Medzhitov, R.: Innate immune recognition. Annu. Rev. Immunol., 20, 197-216 (2002)[PubMed]
- Akira, S. & Takeda, K.: Toll-like receptor signalling. Nat. Rev. Immunol., 4, 499-511 (2004)[PubMed]
- Bell, J. K., Mullen, G. E., Leifer, C. A. et al.: Leucine-rich repeats and pathogen recognition in Toll-like receptors. Trends Immunol., 24, 528-533 (2003)[PubMed]
- Matsushima, N., Tanaka, T., Enkhbayar, P. et al.: Comparative sequence analysis of leucine-rich repeats (LRRs) within vertebrate toll-like receptors. BMC Genomics, 8, 124 (2007)[PubMed]
- Miggin, S. M. & O'Neill, L. A. J.: New insights into the regulation of TLR signaling. J. Leukocyte Biol., 80, 220-226 (2006)[PubMed]
- Bauer, S., Kirschning, C. J., Hacker, H. et al.: Human TLR9 confers responsiveness to bacterial DNA via species-specific CpG motif recognition. Proc. Natl. Acad. Sci. USA, 98, 9237-9242 (2001)[PubMed]
- Hemmi, H., Takeuchi, O., Kawai, T. et al.: A Toll-like receptor recognizes bacterial DNA. Nature, 408, 740-745 (2000)[PubMed]
- Banchereau, J. & Pascual, V.: Type I interferon in systemic lupus erythematosus and other autoimmune diseases. Immunity, 25, 383-392 (2006)[PubMed]
- Ewald, S. E., Lee, B. L., Lau, L. et al.: The ectodomain of Toll-like receptor 9 is cleaved to generate a functional receptor. Nature, 456, 658-662 (2008)[PubMed]
- Park, B., Brinkmann, M. M., Spooner, E. et al.: Proteolytic cleavage in an endolysosomal compartment is required for activation of Toll-like receptor 9. Nat. Immunol., 9, 1407-1414 (2008)[PubMed]
- Tanji, H., Ohto, U., Shibata, T. et al.: Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands. Science, 339, 1426-1429 (2013)[PubMed] [新着論文レビュー]
- Krieg, A. M., Yi, A. K., Matson, S. et al.: CpG motifs in bacterial DNA trigger direct B-cell activation. Nature, 374, 546-549 (1995)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院薬学系研究科 修了,2013年より同 講師.
研究テーマ:受容体の構造および機能.
抱負:着実に仕事をする.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2015 大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本