piRNAの生合成においてPapiとZucは階層的に機能する
西田知訓・塩見美喜子
(東京大学大学院理学系研究科 生物科学専攻生物化学講座RNA生物学研究室)
email:西田知訓,塩見美喜子
DOI: 10.7875/first.author.2018.037
Hierarchical roles of mitochondrial Papi and Zucchini in Bombyx germline piRNA biogenesis.
Kazumichi M. Nishida, Kazuhiro Sakakibara, Yuka W. Iwasaki, Hiromi Yamada, Ryo Murakami, Yukiko Murota, Takeshi Kawamura, Tatsuhiko Kodama, Haruhiko Siomi, Mikiko C. Siomi
Nature, 555, 260-264 (2018)
piRNAはトランスポゾンを抑制することにより生殖細胞においてゲノムの品質を管理する.先行研究により,カイコにおけるpiRNAの3’末端の形成には3’-5’エキソヌクレアーゼであるTrimが関与すること,また,ミトコンドリア外膜に存在するタンパク質であるPapiの欠失によりpiRNAの3’末端は数塩基ほど長くなることが示された.しかし,ショウジュウバエにおいてpiRNAの生合成に機能することが知られるエンドヌクレアーゼZucおよび3’-5’エキソヌクレアーゼNbrについては,カイコにおける必要性が不明であった.この研究において,筆者らは,カイコの卵巣に由来する生殖細胞株であるBmN4細胞を用い,カイコにおけるpiRNAの3’末端の形成にはZucが必要であること,PapiにPIWIが結合したのちPIWIにpiRNA中間体が結合すること,piRNA前駆体からのpiRNA中間体の切り出しはPIWIのスライサー活性によることを見い出した.また,PapiはPIWIとの相互作用およびそれ自体のリン酸化によりRNA結合能を獲得した.これらの結果は,piRNAの生合成機構におけるZucの必要性のみならず,この機構の分子階層性を物語る.ショウジョウバエにみられるphased piRNAはカイコにおいては検出されなかった.カイコにおけるpiRNAの生合成はエキソヌクレアーゼに依存的ではなかったことからも,ショウジョウバエにおける生合成機構よりも単純であるといえた.
生殖組織に特異的に発現する25~30塩基長の小分子RNAであるpiRNA(PIWI-interacting RNA)は,PIWIとpiRISC(piRNA-induced silencing complex)を形成することによりトランスポゾンを抑制し,生殖細胞においてゲノムの品質を管理する1,2).これまでの解析により,ショウジョウバエの生殖組織において,piRNAの5’末端はスライサーであるPIWIあるいはエンドヌクレアーゼであるZucchini(Zuc)により,一方,piRNAの3’末端はPIWI,Zuc,3’-5’エキソヌクレアーゼであるNibbler(Nbr)により形成されることが見い出された1-7).カイコの卵巣に由来する生殖細胞株であるBmN4細胞を用いた解析により,ミトコンドリア外膜に存在するタンパク質であるPapiはTudorドメインを介してPIWIと結合すること,この結合にはPIWI(SiwiおよびAgo3)の対称性ジメチル化アルギニン修飾が必要であること,Papiの欠失によりpiRNAの生合成量は変わらないがpiRNAの3’末端が数塩基ほど長くなること,3’-5’エキソヌクレアーゼであるTrimmer(Trim)がpiRNAの3’末端の形成に関与すること,が示された8,9).しかし,カイコのpiRNAの生合成におけるZucおよびNbrの必要性については不明であった.
Nbrを欠失したBmN4細胞においてSiwiを強制的に発現し,結合するpiRNAの量を調べた.対照としてTrimあるいはPapiを欠失したBmN4細胞も用いた.予想に反して,Papiの欠失によりSiwiへのpiRNAの結合量はいちじるしく減少したが,NbrあるいはTrimの欠失では変化はほとんどみられなかった.Siwiの代わりにAgo3を強制発現した場合においても同様の結果が得られた.カイコにおけるpiRNAの生合成にはPapiが不可欠であることが判明した.
Trimの欠失によりPIWIと結合するpiRNAの微弱な伸長が観察された.piRNAの塩基配列を決定し生物情報学的に解析したところ,3’末端が0.4~0.6塩基だけ長くなっていることがわかった.しかし,Trimが欠失した状態においてもPIWIと結合するpiRNAの量はほとんど変わらず,また,通常の場合と同等に2’-O-メチル化修飾をうけていた.これらの結果から,TrimはpiRNAの生合成および機能の発揮には不要であることが示唆された.
Papi-Siwi複合体に含まれるRNAを32Pにより可視化したところ,piRNA中間体に相当する長鎖RNAが検出された.この長鎖RNAはノーザンブロッティング解析においてpiRNAプローブに対し陽性を示したため,piRNA中間体であると断定した.
Siwiを欠失したBmN4細胞においてPapiのRNA結合能はいちじるしく減少した.対称性ジメチル化アルギニン修飾をもたないSiwiを発現させてもPapiのRNA結合能は回復しなかった.また,対称性ジメチル化アルギニン修飾をもたないSiwiはPapiと結合しなくなるが,同時に,piRNA中間体とも結合しなくなった.piRNAの生合成機構において,Siwiはまず対称性ジメチル化アルギニン修飾を介してPapiと結合し,そののち,このSiwiとpiRNA中間体が結合するという階層性が見い出された.
piRNAの生合成機構において,SiwiにはSiwiのpiRNA中間体を,Ago3にはAgo3のpiRNA中間体を,選択的に結合させなくてはならない.かりに,PIWI(SiwiあるいはAgo3)よりさきにpiRNA中間体がPapiと結合してしまうと,この選択性を維持することはむずかしくなる.よって,PIWIはPapiと結合したのちにpiRNA中間体と結合するような制御機構が生じたのではないかと考えられた.現時点では,Papiと結合したSiwi(あるいは,Ago3)にSiwi(あるいは,Ago3)のpiRNA中間体を結合させる制御機構は明らかにされておらず,今後の課題である.
Papiは2つのKHドメインをもつ.野生型のPapiはRNA結合能を示した一方,KHドメインの保存性の高いアミノ酸残基を置換した変異体はRNA結合能を示さなかった.PapiはKHドメインを介してRNAと結合することが証明された.Papiはウェスタンブロッティング解析において2本のバンドとして検出されたが,この2本のバンドのうち上側のバンドのみがRNA結合能を示した.強制発現させた外来性のPapiにおいても同様の結果が得られた.Papiを脱リン酸化したところ,上側のバンドが消失し下側のバンドに収束した.よって,Papiはリン酸化修飾をうけることによりRNA結合能を獲得すると考えられた.また,Papiと結合したSiwiには成熟型のpiRNAはほとんど結合していなかったことから,PapiはpiRISCの形成の場であり,piRISCを形成したSiwiはPapiからすみやかに解離すると考えられた.PapiからpiRISCが解離したのち,piRNA中間体の残骸がPapiに結合した状態ではpiRNAの生合成は阻害されてしまう.これを解消するためにPapiが脱リン酸化されるのではないかと予想され,今後,実験的に検証したい.
Zucを欠失させたBmN4細胞にSiwi(あるいは,Ago3)を強制発現させpiRNAの結合量を調べたところ,Siwi(あるいは,Ago3)へのpiRNAの結合量はいちじるしく減少していた.また,Zucを欠失させたBmN4細胞から精製したPapi-Siwi複合体にはpiRNA中間体の蓄積がみられた.Trimを欠失させたBmN4細胞から精製したPapi-Siwi複合体においてはそのような中間体の蓄積はみられず,また,Zucを欠失させたときのTrimの発現量に変化はなかった.カイコのpiRNAの生合成機構におけるZucの必要性が明らかにされた.
Zucを欠失させたときにPapi-Siwi複合体に蓄積するRNAの塩基配列を決定し,生物情報学的に解析した.その結果,98%以上のリード配列にpiRNAの配列がマップされた.また,50%以上のリード配列の5’末端が成熟型のpiRNAの5’末端と一致した.Papi-Siwi複合体に含まれるRNAは実際にpiRNA中間体であることが確認された.さらなる解析により,2つのpiRNA中間体がゲノムにすき間なく連結してマップされたこと,また,94%以上の連結部位に逆鎖のpiRNAが完全にマップされたことから,これらのpiRNA中間体はpiRNA前駆体からPIWIのスライサー(エンドヌクレアーゼ)活性により切り出されること,つまり,piRNA中間体の5’末端および3’末端はPIWIにより形成されることが強く示唆された.この結果はZucの有無により影響されなかったことから,カイコのpiRNA中間体の末端の形成にはZucは関与しないと結論づけた.
ZucがpiRNA中間体から成熟型のpiRNAを切り出すことを証明するため,大腸菌から組換えZucを精製し,Zucを欠失させたBmN4細胞から精製したPapi-Siwi複合体と反応させたところ,予想どおり,Papi-Siwi複合体に含まれるpiRNA中間体から成熟型のpiRNAが生成された.組換えZucを50塩基長のRNAと反応させたところ,数塩基長から50塩基長にわたるRNAが検出された.このRNA切断産物の末端には塩基に対する特有の嗜好性が観察されなかったことから,Zucは比較的ランダムにRNAを切断するエンドヌクレアーゼであることが判明した.50塩基長のRNAを事前にSiwiと結合させたところ,piRNAの長さである25塩基長のRNAが検出された.これらの結果から,ZucはpiRNA中間体の5’末端から成熟型のpiRNAを切り出すこと,つまり,成熟型のpiRNAの3’末端の形成にかかわることが示唆された.
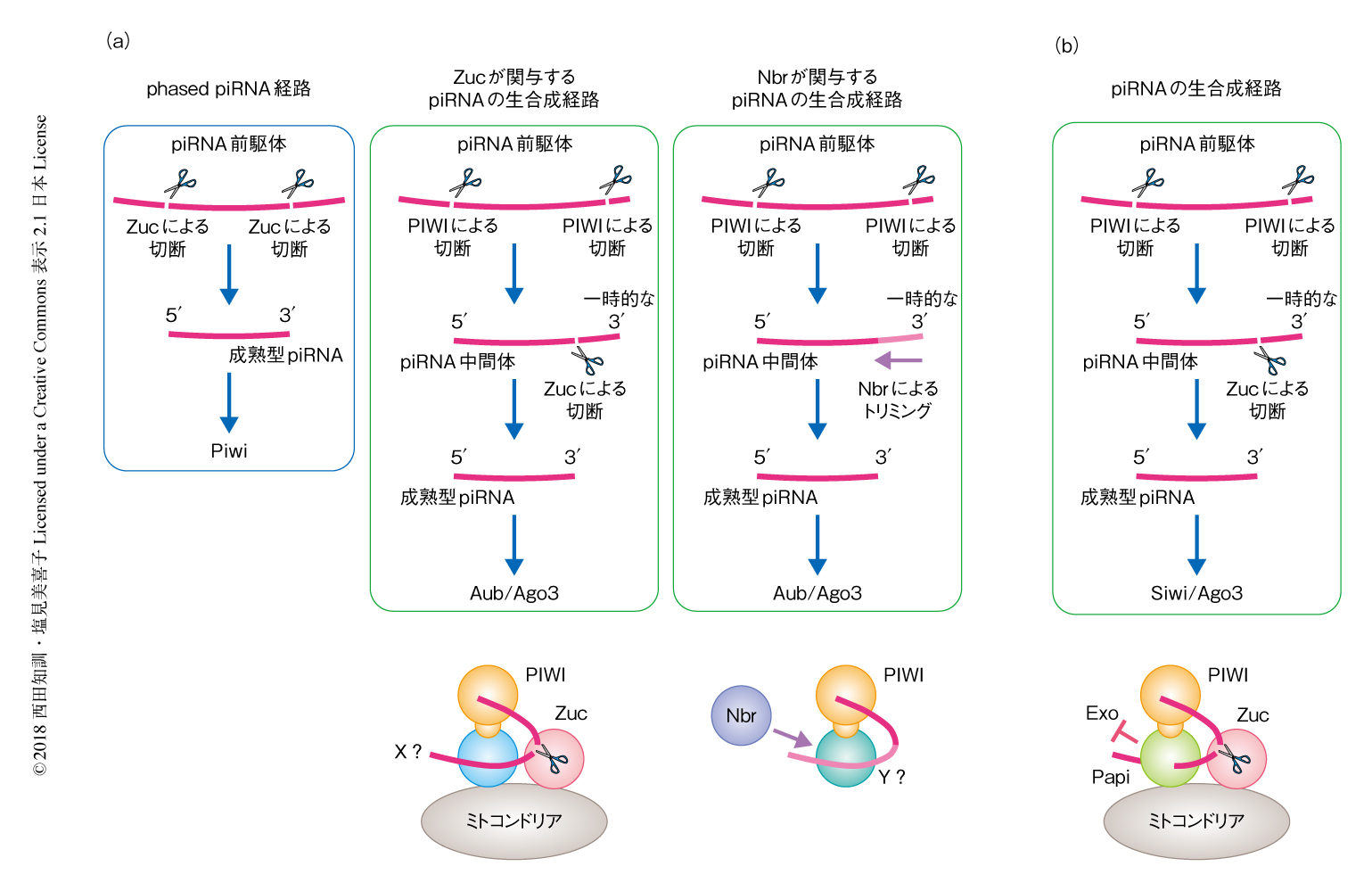
カイコにはショウジョウバエにおいてみられたphased piRNAが存在しないこともわかった.これは,ZucはpiRNA中間体の5’末端からpiRNAをひとつだけ切り出し,切れ残りのpiRNA中間体は細胞において分解される運命にあることを物語る.Papi-Siwi複合体(あるいは,Papi-Ago3複合体)に含まれるpiRNA中間体の5’末端にはSiwi(あるいは,Ago3)が結合し,Papiはその3’末端に結合していると考えられた(図1).この状態でpiRNA中間体の5’末端から成熟型のpiRNAを切り出すにはエキソヌクレアーゼではなくエンドヌクレアーゼが必要であると考えられるが,このことは,NbrやTrimではなくZucが必要であるという今回の研究結果を強く支持した.
ZucによるRNAの切断には塩基に対する強い嗜好性がみられなかったことから,Zucはエンドヌクレアーゼでありながら,PIWIとPapiとのあいだに位置するRNAの数箇所を切断することによりpiRNAの大きさを決定することができると考えられた.Zucはプリン塩基がならんだ配列を敬遠する傾向が多少みられたが,そのような場合,結果としてpiRNAがほんのすこし長くなってしまうのでこれをTrimが処理するのかもしれない.Zucが反応したのち,Papiには切れ残りのRNA断片が結合したまま残ってしまうが,これを処理するにはPapiからRNAが解離されない必要がある.この解離にPapiの脱リン酸化がかかわる可能性があり,今後,検証する予定である.
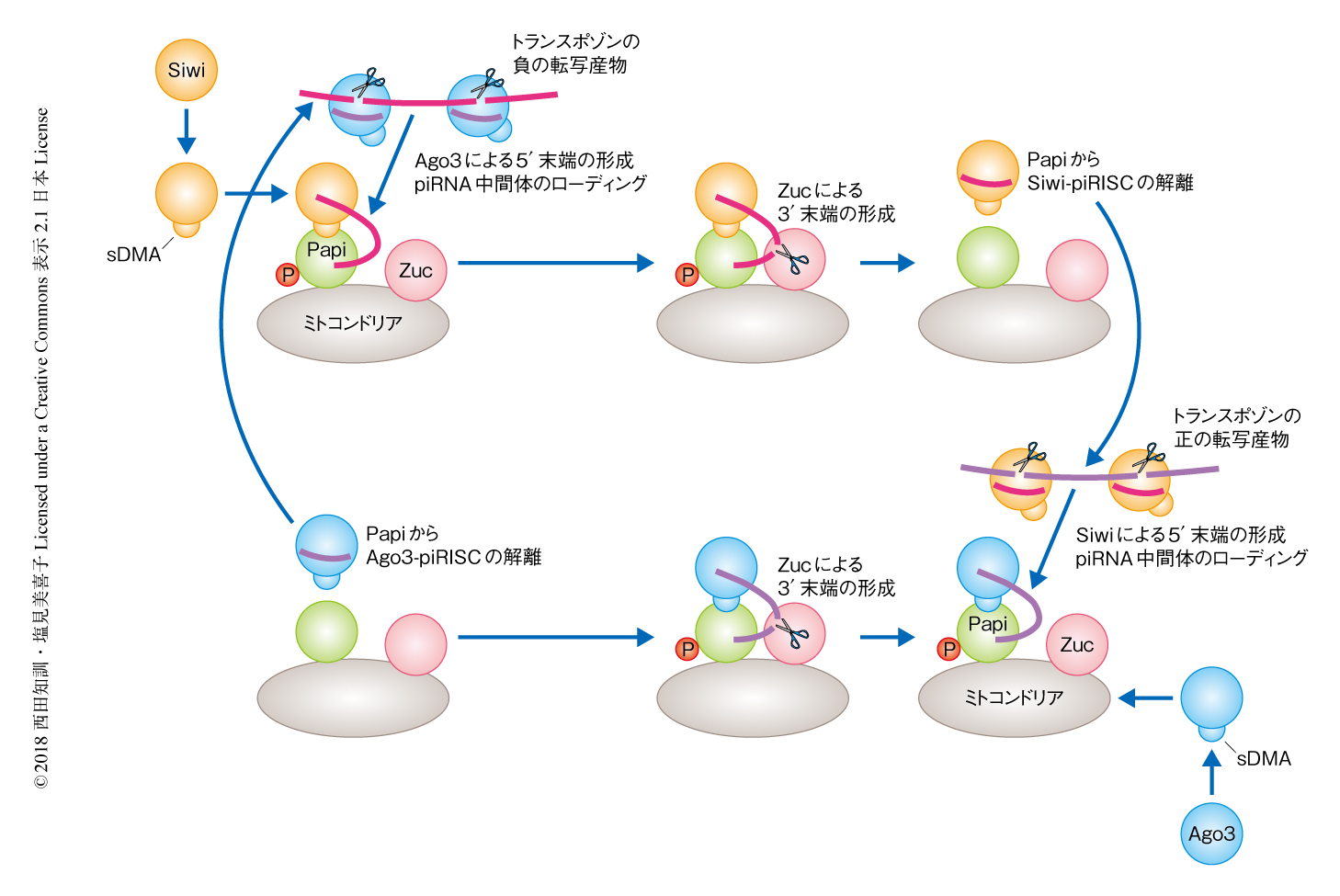
今回の研究をとおして,カイコにおけるpiRNAの生合成機構について新規のモデルが提唱された(図2).このモデルは,Siwiが対称性ジメチル化アルギニン修飾に依存的にミトコンドリア外膜に存在するPapiと結合するところからはじまる.つづいて,トランスポゾンの負の転写産物であるpiRNA前駆体からAgo3により切り出されたpiRNA中間体が,Papi-Siwi複合体のSiwiと結合する.そして,ミトコンドリアの表面に存在するZucによりpiRNA中間体の5’末端から成熟型のpiRNAが切り出される.成熟型のpiRNAはSiwi-piRISCとしてPapiから解離する.解離ののち,Siwi-piRISCはトランスポゾンの正の転写産物を切断し,Papi-Ago3複合体のAgo3に受けわたす.このpiRNA中間体はZucにより切断され,Ago3-piRISCが生じる.このPapiを足場としたPIWI(SiwiおよびAgo3)およびZucによる反応はピンポン経路とよばれ,これが継続的に起こることによりpiRNAが生合成される.Papi-Siwi複合体あるいはPapi-Ago3複合体とZucとの結合は免疫沈降実験により証明された.
ショウジョウバエにおいてみられるphased piRNAはカイコには存在しない.phased piRNAは,ショウジョウバエにおいてはPiwiと特異的に結合し,piRISCとして核に移行したのちにトランスポゾンを転写のレベルで抑制する.カイコにはPiwiの相同体はない.つまり,トランスポゾンを転写のレベルで抑制するしくみをもたないため,phased piRNAを生成する必要がないと考えられる.
ショウジョウバエのpiRNAの5’末端はPIWIあるいはZucにより,3’末端はZucおよびNbrにより形成される(図3a).一方,カイコのpiRNAの5’末端はPIWIにより,3’末端はZucにより形成されることがわかった(図3b).以上のことを総合すると,カイコにおけるpiRNAの生合成機構は,ショウジョウバエにおけるpiRNAの生合成機構と比べはるかに単純であるといえる.
魚類もカイコと同様,トランスポゾンを転写のレベルでは抑制しないと考えられており,よって,魚類におけるpiRNAの生合成機構はカイコのようにショウジョウバエに比べ単純であるのかもしれない.そもそも,トランスポゾンを転写のレベルで抑制する生物としない生物との違いは何か? その利点および欠点を進化的な観点から解析すると,興味深い発見につながるかもしれない.
略歴:2010年 徳島大学大学院医学教育部博士課程 修了,同年 慶應義塾大学医学部 特任助教を経て,2014年より東京大学大学院理学系研究科 特任助教.
研究テーマ:小分子RNAの生合成機構.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
研究室URL:http://www-siomilab.biochem.s.u-tokyo.ac.jp
© 2018 西田知訓・塩見美喜子 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座RNA生物学研究室)
email:西田知訓,塩見美喜子
DOI: 10.7875/first.author.2018.037
Hierarchical roles of mitochondrial Papi and Zucchini in Bombyx germline piRNA biogenesis.
Kazumichi M. Nishida, Kazuhiro Sakakibara, Yuka W. Iwasaki, Hiromi Yamada, Ryo Murakami, Yukiko Murota, Takeshi Kawamura, Tatsuhiko Kodama, Haruhiko Siomi, Mikiko C. Siomi
Nature, 555, 260-264 (2018)
要 約
piRNAはトランスポゾンを抑制することにより生殖細胞においてゲノムの品質を管理する.先行研究により,カイコにおけるpiRNAの3’末端の形成には3’-5’エキソヌクレアーゼであるTrimが関与すること,また,ミトコンドリア外膜に存在するタンパク質であるPapiの欠失によりpiRNAの3’末端は数塩基ほど長くなることが示された.しかし,ショウジュウバエにおいてpiRNAの生合成に機能することが知られるエンドヌクレアーゼZucおよび3’-5’エキソヌクレアーゼNbrについては,カイコにおける必要性が不明であった.この研究において,筆者らは,カイコの卵巣に由来する生殖細胞株であるBmN4細胞を用い,カイコにおけるpiRNAの3’末端の形成にはZucが必要であること,PapiにPIWIが結合したのちPIWIにpiRNA中間体が結合すること,piRNA前駆体からのpiRNA中間体の切り出しはPIWIのスライサー活性によることを見い出した.また,PapiはPIWIとの相互作用およびそれ自体のリン酸化によりRNA結合能を獲得した.これらの結果は,piRNAの生合成機構におけるZucの必要性のみならず,この機構の分子階層性を物語る.ショウジョウバエにみられるphased piRNAはカイコにおいては検出されなかった.カイコにおけるpiRNAの生合成はエキソヌクレアーゼに依存的ではなかったことからも,ショウジョウバエにおける生合成機構よりも単純であるといえた.
はじめに
生殖組織に特異的に発現する25~30塩基長の小分子RNAであるpiRNA(PIWI-interacting RNA)は,PIWIとpiRISC(piRNA-induced silencing complex)を形成することによりトランスポゾンを抑制し,生殖細胞においてゲノムの品質を管理する1,2).これまでの解析により,ショウジョウバエの生殖組織において,piRNAの5’末端はスライサーであるPIWIあるいはエンドヌクレアーゼであるZucchini(Zuc)により,一方,piRNAの3’末端はPIWI,Zuc,3’-5’エキソヌクレアーゼであるNibbler(Nbr)により形成されることが見い出された1-7).カイコの卵巣に由来する生殖細胞株であるBmN4細胞を用いた解析により,ミトコンドリア外膜に存在するタンパク質であるPapiはTudorドメインを介してPIWIと結合すること,この結合にはPIWI(SiwiおよびAgo3)の対称性ジメチル化アルギニン修飾が必要であること,Papiの欠失によりpiRNAの生合成量は変わらないがpiRNAの3’末端が数塩基ほど長くなること,3’-5’エキソヌクレアーゼであるTrimmer(Trim)がpiRNAの3’末端の形成に関与すること,が示された8,9).しかし,カイコのpiRNAの生合成におけるZucおよびNbrの必要性については不明であった.
1.PapiはカイコにおけるpiRNAの生合成に必須である
Nbrを欠失したBmN4細胞においてSiwiを強制的に発現し,結合するpiRNAの量を調べた.対照としてTrimあるいはPapiを欠失したBmN4細胞も用いた.予想に反して,Papiの欠失によりSiwiへのpiRNAの結合量はいちじるしく減少したが,NbrあるいはTrimの欠失では変化はほとんどみられなかった.Siwiの代わりにAgo3を強制発現した場合においても同様の結果が得られた.カイコにおけるpiRNAの生合成にはPapiが不可欠であることが判明した.
Trimの欠失によりPIWIと結合するpiRNAの微弱な伸長が観察された.piRNAの塩基配列を決定し生物情報学的に解析したところ,3’末端が0.4~0.6塩基だけ長くなっていることがわかった.しかし,Trimが欠失した状態においてもPIWIと結合するpiRNAの量はほとんど変わらず,また,通常の場合と同等に2’-O-メチル化修飾をうけていた.これらの結果から,TrimはpiRNAの生合成および機能の発揮には不要であることが示唆された.
2.Papiは階層的にPIWIおよびpiRNA中間体と結合する
Papi-Siwi複合体に含まれるRNAを32Pにより可視化したところ,piRNA中間体に相当する長鎖RNAが検出された.この長鎖RNAはノーザンブロッティング解析においてpiRNAプローブに対し陽性を示したため,piRNA中間体であると断定した.
Siwiを欠失したBmN4細胞においてPapiのRNA結合能はいちじるしく減少した.対称性ジメチル化アルギニン修飾をもたないSiwiを発現させてもPapiのRNA結合能は回復しなかった.また,対称性ジメチル化アルギニン修飾をもたないSiwiはPapiと結合しなくなるが,同時に,piRNA中間体とも結合しなくなった.piRNAの生合成機構において,Siwiはまず対称性ジメチル化アルギニン修飾を介してPapiと結合し,そののち,このSiwiとpiRNA中間体が結合するという階層性が見い出された.
piRNAの生合成機構において,SiwiにはSiwiのpiRNA中間体を,Ago3にはAgo3のpiRNA中間体を,選択的に結合させなくてはならない.かりに,PIWI(SiwiあるいはAgo3)よりさきにpiRNA中間体がPapiと結合してしまうと,この選択性を維持することはむずかしくなる.よって,PIWIはPapiと結合したのちにpiRNA中間体と結合するような制御機構が生じたのではないかと考えられた.現時点では,Papiと結合したSiwi(あるいは,Ago3)にSiwi(あるいは,Ago3)のpiRNA中間体を結合させる制御機構は明らかにされておらず,今後の課題である.
Papiは2つのKHドメインをもつ.野生型のPapiはRNA結合能を示した一方,KHドメインの保存性の高いアミノ酸残基を置換した変異体はRNA結合能を示さなかった.PapiはKHドメインを介してRNAと結合することが証明された.Papiはウェスタンブロッティング解析において2本のバンドとして検出されたが,この2本のバンドのうち上側のバンドのみがRNA結合能を示した.強制発現させた外来性のPapiにおいても同様の結果が得られた.Papiを脱リン酸化したところ,上側のバンドが消失し下側のバンドに収束した.よって,Papiはリン酸化修飾をうけることによりRNA結合能を獲得すると考えられた.また,Papiと結合したSiwiには成熟型のpiRNAはほとんど結合していなかったことから,PapiはpiRISCの形成の場であり,piRISCを形成したSiwiはPapiからすみやかに解離すると考えられた.PapiからpiRISCが解離したのち,piRNA中間体の残骸がPapiに結合した状態ではpiRNAの生合成は阻害されてしまう.これを解消するためにPapiが脱リン酸化されるのではないかと予想され,今後,実験的に検証したい.
3.ZucはpiRNAの生合成に必須である
Zucを欠失させたBmN4細胞にSiwi(あるいは,Ago3)を強制発現させpiRNAの結合量を調べたところ,Siwi(あるいは,Ago3)へのpiRNAの結合量はいちじるしく減少していた.また,Zucを欠失させたBmN4細胞から精製したPapi-Siwi複合体にはpiRNA中間体の蓄積がみられた.Trimを欠失させたBmN4細胞から精製したPapi-Siwi複合体においてはそのような中間体の蓄積はみられず,また,Zucを欠失させたときのTrimの発現量に変化はなかった.カイコのpiRNAの生合成機構におけるZucの必要性が明らかにされた.
4.piRNA中間体はpiRNA前駆体よりPIWIのスライサー活性により切り出される
Zucを欠失させたときにPapi-Siwi複合体に蓄積するRNAの塩基配列を決定し,生物情報学的に解析した.その結果,98%以上のリード配列にpiRNAの配列がマップされた.また,50%以上のリード配列の5’末端が成熟型のpiRNAの5’末端と一致した.Papi-Siwi複合体に含まれるRNAは実際にpiRNA中間体であることが確認された.さらなる解析により,2つのpiRNA中間体がゲノムにすき間なく連結してマップされたこと,また,94%以上の連結部位に逆鎖のpiRNAが完全にマップされたことから,これらのpiRNA中間体はpiRNA前駆体からPIWIのスライサー(エンドヌクレアーゼ)活性により切り出されること,つまり,piRNA中間体の5’末端および3’末端はPIWIにより形成されることが強く示唆された.この結果はZucの有無により影響されなかったことから,カイコのpiRNA中間体の末端の形成にはZucは関与しないと結論づけた.
5.成熟型のpiRNAはpiRNA中間体からZucのエンドヌクレアーゼ活性により切り出される
ZucがpiRNA中間体から成熟型のpiRNAを切り出すことを証明するため,大腸菌から組換えZucを精製し,Zucを欠失させたBmN4細胞から精製したPapi-Siwi複合体と反応させたところ,予想どおり,Papi-Siwi複合体に含まれるpiRNA中間体から成熟型のpiRNAが生成された.組換えZucを50塩基長のRNAと反応させたところ,数塩基長から50塩基長にわたるRNAが検出された.このRNA切断産物の末端には塩基に対する特有の嗜好性が観察されなかったことから,Zucは比較的ランダムにRNAを切断するエンドヌクレアーゼであることが判明した.50塩基長のRNAを事前にSiwiと結合させたところ,piRNAの長さである25塩基長のRNAが検出された.これらの結果から,ZucはpiRNA中間体の5’末端から成熟型のpiRNAを切り出すこと,つまり,成熟型のpiRNAの3’末端の形成にかかわることが示唆された.
カイコにはショウジョウバエにおいてみられたphased piRNAが存在しないこともわかった.これは,ZucはpiRNA中間体の5’末端からpiRNAをひとつだけ切り出し,切れ残りのpiRNA中間体は細胞において分解される運命にあることを物語る.Papi-Siwi複合体(あるいは,Papi-Ago3複合体)に含まれるpiRNA中間体の5’末端にはSiwi(あるいは,Ago3)が結合し,Papiはその3’末端に結合していると考えられた(図1).この状態でpiRNA中間体の5’末端から成熟型のpiRNAを切り出すにはエキソヌクレアーゼではなくエンドヌクレアーゼが必要であると考えられるが,このことは,NbrやTrimではなくZucが必要であるという今回の研究結果を強く支持した.
ZucによるRNAの切断には塩基に対する強い嗜好性がみられなかったことから,Zucはエンドヌクレアーゼでありながら,PIWIとPapiとのあいだに位置するRNAの数箇所を切断することによりpiRNAの大きさを決定することができると考えられた.Zucはプリン塩基がならんだ配列を敬遠する傾向が多少みられたが,そのような場合,結果としてpiRNAがほんのすこし長くなってしまうのでこれをTrimが処理するのかもしれない.Zucが反応したのち,Papiには切れ残りのRNA断片が結合したまま残ってしまうが,これを処理するにはPapiからRNAが解離されない必要がある.この解離にPapiの脱リン酸化がかかわる可能性があり,今後,検証する予定である.
おわりに
今回の研究をとおして,カイコにおけるpiRNAの生合成機構について新規のモデルが提唱された(図2).このモデルは,Siwiが対称性ジメチル化アルギニン修飾に依存的にミトコンドリア外膜に存在するPapiと結合するところからはじまる.つづいて,トランスポゾンの負の転写産物であるpiRNA前駆体からAgo3により切り出されたpiRNA中間体が,Papi-Siwi複合体のSiwiと結合する.そして,ミトコンドリアの表面に存在するZucによりpiRNA中間体の5’末端から成熟型のpiRNAが切り出される.成熟型のpiRNAはSiwi-piRISCとしてPapiから解離する.解離ののち,Siwi-piRISCはトランスポゾンの正の転写産物を切断し,Papi-Ago3複合体のAgo3に受けわたす.このpiRNA中間体はZucにより切断され,Ago3-piRISCが生じる.このPapiを足場としたPIWI(SiwiおよびAgo3)およびZucによる反応はピンポン経路とよばれ,これが継続的に起こることによりpiRNAが生合成される.Papi-Siwi複合体あるいはPapi-Ago3複合体とZucとの結合は免疫沈降実験により証明された.
ショウジョウバエにおいてみられるphased piRNAはカイコには存在しない.phased piRNAは,ショウジョウバエにおいてはPiwiと特異的に結合し,piRISCとして核に移行したのちにトランスポゾンを転写のレベルで抑制する.カイコにはPiwiの相同体はない.つまり,トランスポゾンを転写のレベルで抑制するしくみをもたないため,phased piRNAを生成する必要がないと考えられる.
ショウジョウバエのpiRNAの5’末端はPIWIあるいはZucにより,3’末端はZucおよびNbrにより形成される(図3a).一方,カイコのpiRNAの5’末端はPIWIにより,3’末端はZucにより形成されることがわかった(図3b).以上のことを総合すると,カイコにおけるpiRNAの生合成機構は,ショウジョウバエにおけるpiRNAの生合成機構と比べはるかに単純であるといえる.
魚類もカイコと同様,トランスポゾンを転写のレベルでは抑制しないと考えられており,よって,魚類におけるpiRNAの生合成機構はカイコのようにショウジョウバエに比べ単純であるのかもしれない.そもそも,トランスポゾンを転写のレベルで抑制する生物としない生物との違いは何か? その利点および欠点を進化的な観点から解析すると,興味深い発見につながるかもしれない.
文 献
- Yamashiro, H. & Siomi, M. C.: PIWI-interacting RNA in Drosophila: biogenesis, transposon regulation, and beyond. Chem. Rev., 118, 4404-4421 (2018)[PubMed]
- Sakakibara, K. & Siomi, M. C.: The PIWI-interacting RNA molecular pathway: insights from cultured silkworm germline cells. Bioessays, 40, 1700068 (2018)[PubMed]
- Brennecke, J., Aravin, A. A., Stark, A. et al.: Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila. Cell, 128, 1089-1103 (2007)[PubMed]
- Gunawardane, L. S., Saito, K., Nishida, K. M. et al.: A slicer-mediated mechanism for repeat-associated siRNA 5' end formation in Drosophila. Science, 315, 1587-1590 (2007)[PubMed]
- Han, B. W., Wang, W., Li, C. et al.: piRNA-guided transposon cleavage initiates Zucchini-dependent, phased piRNA production. Science, 348, 817-821 (2015)[PubMed]
- Mohn, F., Handler, D. & Brennecke, J.: piRNA-guided slicing specifies transcripts for Zucchini-dependent, phased piRNA biogenesis. Science, 348, 812-817 (2015)[PubMed]
- Hayashi, R., Schnabl, J., Handler, D. et al.: Genetic and mechanistic diversity of piRNA 3'-end formation. Nature, 539, 588-592 (2016)[PubMed]
- Honda, S., Kirino, Y., Maragkakis, M. et al.: Mitochondrial protein BmPAPI modulates the length of mature piRNAs. RNA, 19, 1405-1418 (2013)[PubMed]
- Izumi, N., Shoji, K., Sakaguchi, Y. et al.: Identification and functional analysis of the pre-piRNA 3' trimmer in silkworms. Cell, 164, 962-973 (2016)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2010年 徳島大学大学院医学教育部博士課程 修了,同年 慶應義塾大学医学部 特任助教を経て,2014年より東京大学大学院理学系研究科 特任助教.
研究テーマ:小分子RNAの生合成機構.
塩見 美喜子(Mikiko C. Siomi)
東京大学大学院理学系研究科 教授.
研究室URL:http://www-siomilab.biochem.s.u-tokyo.ac.jp
© 2018 西田知訓・塩見美喜子 Licensed under CC 表示 2.1 日本