piRNA前駆体の3'末端を削りこむヌクレアーゼTrimmerの同定および機能の解析
泉 奈津子・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:泉 奈津子,泊 幸秀
DOI: 10.7875/first.author.2016.017
Identification and functional analysis of the pre-piRNA 3' trimmer in silkworms.
Natsuko Izumi, Keisuke Shoji, Yuriko Sakaguchi, Shozo Honda, Yohei Kirino, Tsutomu Suzuki, Susumu Katsuma, Yukihide Tomari
Cell, 164, 962-973 (2016)
piRNAはおもに動物の生殖細胞に発現する小分子RNAであり,PIWIとともにトランスポゾンの発現の抑制に機能する.piRNAの産生の最終段階においては,成熟型より少し長いpiRNA前駆体がPIWIに取り込まれ,その3'末端が削りこまれることにより成熟型piRNAがつくられる.piRNA前駆体の3'末端を成熟型の長さまで削る因子はTrimmerとよばれ,これまで,その存在が予想されてはいたものの分子実体は不明であった.今回,筆者らは,piRNAを発現するカイコの卵巣に由来する培養細胞を用いた生化学的な解析により,カイコのTrimmerを同定することに成功した.TrimmerはPARN様のヌクレアーゼドメインおよび膜貫通ドメインをもつ機能未知のタンパク質で,piRNAの産生の場のひとつといわれるミトコンドリア外膜に存在すると考えられた.Trimmerは単独では機能できず,PIWIの結合タンパク質であるPapiと協同してpiRNA前駆体の3'末端を削りこんでいた.さらに,TrimmerおよびPapiのはたらきによりpiRNA前駆体が成熟型になることがpiRNAの機能の発揮に重要であることも明らかにされた.
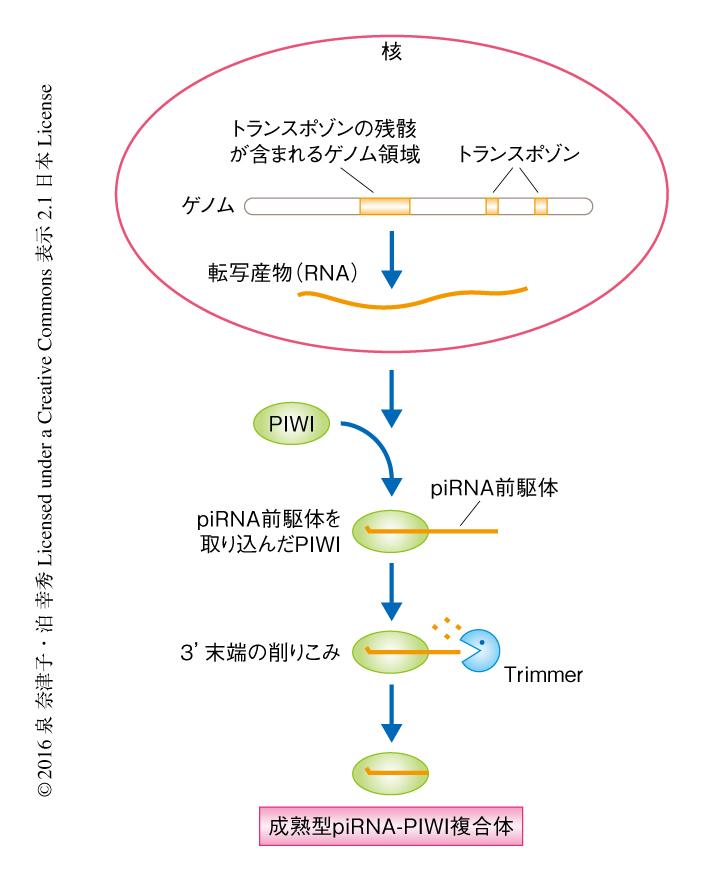
ヒトを含む生物のゲノムにはトランスポゾンとよばれる転移性の塩基配列が存在する.トランスポゾンの転移は遺伝情報を破壊する可能性があり,とくに,次世代をつくりだす生殖細胞においてその活性を抑制することは重要である.近年,piRNA(PIWI-interacting RNA)とよばれる24~30塩基の小分子RNAが動物の生殖巣に発現し,生殖細胞におけるトランスポゾンの発現の抑制に中心的な役割をはたすことが明らかにされてきた1-3).piRNAはRNA切断活性をもつタンパク質PIWIと複合体を形成し,その配列にもとづいてPIWIを標的となるトランスポゾンRNAへとガイドする.PIWIはpiRNAを介して標的となるトランスポゾンの転写抑制を誘導したり,転写されたトランスポゾンRNAを切断したりすることにより,トランスポゾンの活性を封じ込める1-3).piRNAを産生できないショウジョウバエやマウスにおいては,トランスポゾンの活性化がみられるだけでなく,配偶子の形成が異常になり不妊になることが知られている4).このように,piRNAの重要性が明らかにされている一方で,どのようにpiRNAがつくられるのか,その詳細にはいまだ不明な点が多い.これまでの研究により,piRNAはトランスポゾンの残骸が含まれるゲノム領域からの転写産物やトランスポゾンRNAに由来することがわかっている.これらpiRNAのもとになる転写産物は,さまざまな因子のはたらきにより成熟型より少し長いpiRNA前駆体へとプロセシングされ,このpiRNA前駆体がPIWIに取り込まれたのち,その3'末端が削られて成熟型piRNAになると考えられている1-3)(図1).
これまで,筆者らは,piRNAを発現するカイコの卵巣に由来するBmN4細胞を用い,piRNAの産生の過程の一部をin vitroにおいて再現する方法を確立してきた.そして,この実験系における解析により,piRNA前駆体の3'末端を成熟型の長さまで削りこむトリミング活性が細胞の不溶性画分に存在することを見い出し,その活性を担う仮想のヌクレアーゼをTrimmerと名づけた5)(新着論文レビュー でも掲載).しかし,活性が不溶性画分に存在していることが同定の大きな障壁となり,Trimmerの実体は不明のままであった.
まず,トリミング活性の存在する細胞の不溶性画分(細胞の懸濁液を低速遠心したときのペレット)から,さまざまな界面活性剤を用いてトリミング活性の可溶化を試みたが,トリミング活性はほとんど可溶化されなかった.そこで,不溶性画分のどこにトリミング活性が存在するのかを明らかにすることを目的として,細胞分画によりおのおのの画分のトリミング活性を調べたところ,ミトコンドリアを含む画分に細胞の不溶性画分と同様の強いトリミング活性が見い出され,リソソーム画分,小胞体画分,細胞質画分と軽い画分になるにつれトリミング活性は減弱することがわかった.piRNAの産生にかかわる因子のいくつかはミトコンドリア膜に局在することが知られており,ミトコンドリアの表面はpiRNAの産生の場のひとつと考えられている1-3).そこで,強いトリミング活性の検出されたミトコンドリア粗精製画分を用いて,再度,さまざまな界面活性剤による可溶化について検討した結果,一部ではあるがトリミング活性が可溶化される条件が見い出された.可溶化されたトリミング活性をスクロース密度勾配遠心により分画したところ,トリミング活性は比較的重い画分に存在していたことから,Trimmerはなんらかの因子と複合体を形成している可能性が考えられた.また,トリミング活性はPIWIの結合タンパク質として知られるPapiの分布とよく一致した.
Papiはミトコンドリア外膜に存在するタンパク質であり,その機能を阻害するとpiRNAの長さがわずかに伸長することから,piRNA前駆体の削りこみへの関与が示唆されていた6,7).しかし,Papiそれ自体にはヌクレアーゼ活性はなく,これまで,piRNA前駆体の削りこみにおける役割やTrimmerとの関係は不明であった.まず,PapiのノックダウンによりpiRNAが長くなるという知見が,in vitroにおけるトリミング反応において再現されることが確認された.このとき,Papiのノックダウンによりトリミング活性による産物が長くなるだけでなく,トリミング反応の効率が低下することに気づいた.また逆に,Papiを高発現した細胞溶解液においてはトリミング反応が促進された.このことから,Papiにはトリミング反応を促進する活性があるだけでなく,トリミング反応の律速因子になっていることが明らかにされた.
PapiはPIWIと結合するTudorドメインにくわえ,膜貫通ドメイン,および,核酸と結合するKHモチーフをもつ.これらの機能ドメインがPapiのトリミング促進活性に必要かどうかを調べたところ,いずれの機能ドメインの変異体も活性を失った.さらに,野生型のTudorドメインをもつ変異体は内在性のPapiに対し優性阻害効果を示したことから,Papiがトリミング反応を促進するうえでPapiとPIWIとの相互作用が重要であることが示唆された.また,KHモチーフの変異体はPIWIとの結合を維持していたにもかかわらずトリミング促進活性を失ったことから,PapiとpiRNA前駆体との結合がPapiによるトリミング促進活性に重要であることも示唆された.
Papiにトリミング促進活性があり,スクロース密度勾配遠心実験においてトリミング活性とPapiの分布が一致するという結果から,PapiがTrimmerと複合体を形成してpiRNA前駆体の削りこみを促進しているのではないかと予想し,Papiの免疫沈降物にトリミング活性があるかどうか調べた.予想どおり,Papiの免疫沈降物にトリミング活性が検出されたことから,Papi複合体の質量分析によりTrimmerの同定を試みた.同定された4つのヌクレアーゼをノックダウンし,トリミング活性への影響について調べたところ,ひとつだけ,PNLDC1のノックダウンにおいてトリミング活性が低下した.PNLDC1はPARNと相同性のあるヌクレアーゼドメインをもつ機能未知のタンパク質であったが,ミトコンドリア画分に多く存在し膜貫通ドメインが予想されたことから,Papiと同様にミトコンドリア外膜タンパク質だと考えられた.さらに,PNLDC1の免疫沈降物を解析したところ,Papiが含まれるとともに,トリミング活性がみられた.Papiとは異なり,PNLDC1を高発現させてもトリミング反応は促進されなかったが,PNLDC1のヌクレアーゼ活性変異体の高発現はトリミング反応を強く阻害した.このことから,PNLDC1の量はトリミング反応の律速にはなっていないが,その活性がトリミング反応に必要であることが強く示唆された.PNLDC1がpiRNA前駆体の削りこみに機能することをさらに確認するため,トリミング活性のみられないショウジョウバエのS2細胞にカイコのPNLDC1を発現させた.PNLDC1を単独で発現させた場合にはトリミング活性は検出されなかったが,PapiとPNLDC1を共発現させるとS2細胞にトリミング活性が付与された.一方,PapiとPNLDC1の活性変異体とを共発現した場合にはトリミング活性は検出されなかった.これらの実験結果から,PNLDC1がpiRNA前駆体の削りこみを担うヌクレアーゼTrimmerであり,Trimmerによる削りこみはPapiを必要とすることが明らかにされた.
TrimmerとPapiとの関係についてさらに調べるため,TrimmerあるいはPapiの単独のノックダウンとダブルノックダウンとでその効果を比較したところ,単独のノックダウンに比べダブルノックダウンではトリミング活性がより強く阻害された.この結果から,TrimmerとPapiはpiRNA前駆体の3'末端の削りこみに協同的に作用することが示唆された.
細胞においてTrimmerが実際にpiRNA前駆体の削りこみに機能していることを確認するため,TrimmerあるいはPapiをノックダウンした細胞からRNAを抽出し,ノーザンブロット法や次世代シークエンサーを用いた解析により内在性のpiRNAの長さの変化について調べた.その結果,いずれのノックダウンにおいても,piRNAの3'側が全体的に数塩基ほど長くなっていた.TrimmerとPapiのダブルノックダウンでは,単独のノックダウンではみられなかった,3'側が伸長した35~40 ntの長いpiRNAの蓄積が認められた.これは,TrimmerおよびPapiのはたらきにより3'末端が削りこまれるまえのpiRNA前駆体だと考えられた.
piRNA前駆体の3'末端が削りこまれることはpiRNAが機能するうえで重要なのか? この疑問に答えるため,in vitroにおいて,piRNA前駆体を模した50 ntの長さのRNAを取り込んだPIWIと,3'末端を削りこんだ約27 ntの長さのRNAを取り込んだPIWIについて,標的となるRNAの切断活性に差がみられるかどうか検証した.ガイドとなるRNAのそれぞれに相補的な配列をもつ2種類の標的RNAを用いた結果,どちらの場合も,3'末端が削りこまれた成熟型のRNAと結合したPIWIのほうが効率よく標的RNAを切断できることがわかった.この結果は,piRNA前駆体の3'末端が削りこみをうけ成熟型piRNAになることが,RNAの切断というpiRNAの機能を発揮するうえで重要であることを示した.
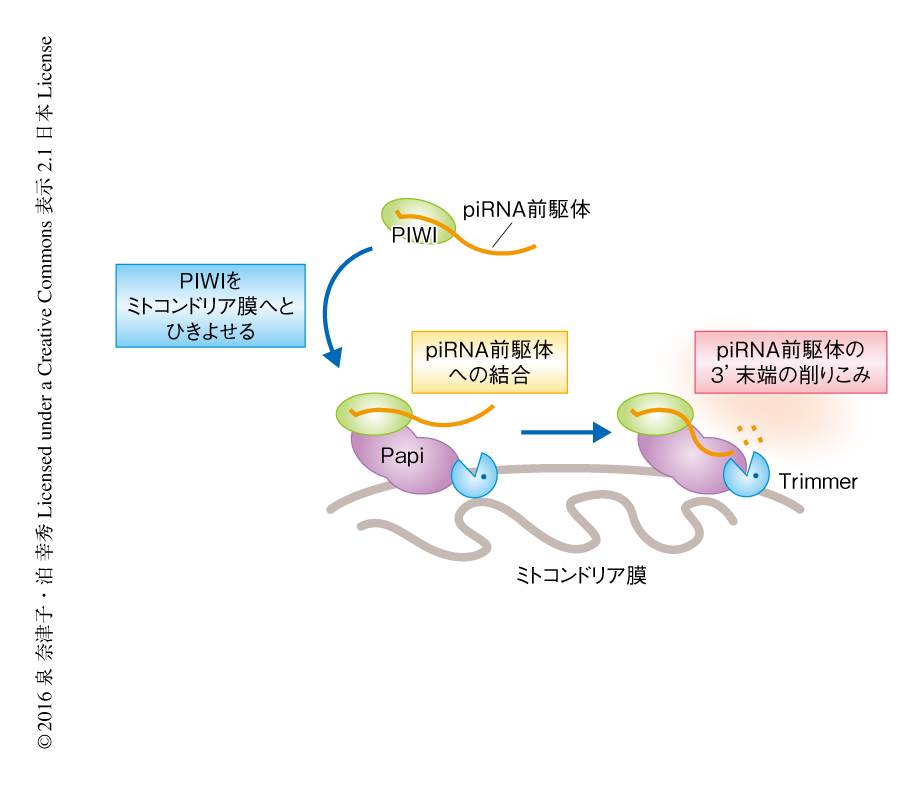
Trimmerの同定の鍵になったのは,ミトコンドリア画分からのトリミング活性の可溶化およびPapiへの着目であった.いま考えると,当初,トリミング活性の可溶化が困難だったのは,おそらく,PapiとTrimmerの相互作用を損なわない条件でなければトリミング活性が検出できなかったためだと思われる.一連の研究結果をふまえると,piRNA前駆体の3'末端の削りこみの分子機構として,まず,piRNA前駆体を取り込んだPIWIがPapiによりミトコンドリア膜にひきよせられ,さらに,PapiがpiRNA前駆体と結合することによりTrimmerがpiRNA前駆体の3'末端に近づきやすくなり,そののち,TrimmerがpiRNA前駆体の3'末端を削りこむ,というモデルが考えられた(図2).
筆者らによりカイコのTrimmerが同定されたが,Cell誌の同じ号において,線虫においてPARNのホモログのひとつがpiRNA前駆体の3'末端の削りこみにはたらくことが報告された8).また,Trimmer(PNLDC1)のオーソログは哺乳動物にも保存されていることから,哺乳動物においてもPNLDC1がpiRNA前駆体の3'末端の削りこみに機能することが予想される.一方,ショウジョウバエにPapiは存在するものの,TrimmerやPARNのホモログは存在せず,Nibblerという別のヌクレアーゼが3'末端の削りこみに機能することが示唆されている9).piRNA経路は動物界に広く保存されているにもかかわらず,種により3'末端の削りこみにはたらくヌクレアーゼが異なっているのは不思議である.この研究は,piRNAが成熟するしくみの一端を明らかにしたものであるが,これをもとに,今後,piRNAの産生の機構の理解がさらに進展することを期待したい.
略歴:2009年 横浜市立大学大学院医学研究科博士課程 修了,2010年 東京大学分子細胞生物学研究所 研究員を経て,2014年より同 助教.
研究テーマ:piRNAの産生の機構.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2016 泉 奈津子・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:泉 奈津子,泊 幸秀
DOI: 10.7875/first.author.2016.017
Identification and functional analysis of the pre-piRNA 3' trimmer in silkworms.
Natsuko Izumi, Keisuke Shoji, Yuriko Sakaguchi, Shozo Honda, Yohei Kirino, Tsutomu Suzuki, Susumu Katsuma, Yukihide Tomari
Cell, 164, 962-973 (2016)
要 約
piRNAはおもに動物の生殖細胞に発現する小分子RNAであり,PIWIとともにトランスポゾンの発現の抑制に機能する.piRNAの産生の最終段階においては,成熟型より少し長いpiRNA前駆体がPIWIに取り込まれ,その3'末端が削りこまれることにより成熟型piRNAがつくられる.piRNA前駆体の3'末端を成熟型の長さまで削る因子はTrimmerとよばれ,これまで,その存在が予想されてはいたものの分子実体は不明であった.今回,筆者らは,piRNAを発現するカイコの卵巣に由来する培養細胞を用いた生化学的な解析により,カイコのTrimmerを同定することに成功した.TrimmerはPARN様のヌクレアーゼドメインおよび膜貫通ドメインをもつ機能未知のタンパク質で,piRNAの産生の場のひとつといわれるミトコンドリア外膜に存在すると考えられた.Trimmerは単独では機能できず,PIWIの結合タンパク質であるPapiと協同してpiRNA前駆体の3'末端を削りこんでいた.さらに,TrimmerおよびPapiのはたらきによりpiRNA前駆体が成熟型になることがpiRNAの機能の発揮に重要であることも明らかにされた.
はじめに
ヒトを含む生物のゲノムにはトランスポゾンとよばれる転移性の塩基配列が存在する.トランスポゾンの転移は遺伝情報を破壊する可能性があり,とくに,次世代をつくりだす生殖細胞においてその活性を抑制することは重要である.近年,piRNA(PIWI-interacting RNA)とよばれる24~30塩基の小分子RNAが動物の生殖巣に発現し,生殖細胞におけるトランスポゾンの発現の抑制に中心的な役割をはたすことが明らかにされてきた1-3).piRNAはRNA切断活性をもつタンパク質PIWIと複合体を形成し,その配列にもとづいてPIWIを標的となるトランスポゾンRNAへとガイドする.PIWIはpiRNAを介して標的となるトランスポゾンの転写抑制を誘導したり,転写されたトランスポゾンRNAを切断したりすることにより,トランスポゾンの活性を封じ込める1-3).piRNAを産生できないショウジョウバエやマウスにおいては,トランスポゾンの活性化がみられるだけでなく,配偶子の形成が異常になり不妊になることが知られている4).このように,piRNAの重要性が明らかにされている一方で,どのようにpiRNAがつくられるのか,その詳細にはいまだ不明な点が多い.これまでの研究により,piRNAはトランスポゾンの残骸が含まれるゲノム領域からの転写産物やトランスポゾンRNAに由来することがわかっている.これらpiRNAのもとになる転写産物は,さまざまな因子のはたらきにより成熟型より少し長いpiRNA前駆体へとプロセシングされ,このpiRNA前駆体がPIWIに取り込まれたのち,その3'末端が削られて成熟型piRNAになると考えられている1-3)(図1).
これまで,筆者らは,piRNAを発現するカイコの卵巣に由来するBmN4細胞を用い,piRNAの産生の過程の一部をin vitroにおいて再現する方法を確立してきた.そして,この実験系における解析により,piRNA前駆体の3'末端を成熟型の長さまで削りこむトリミング活性が細胞の不溶性画分に存在することを見い出し,その活性を担う仮想のヌクレアーゼをTrimmerと名づけた5)(新着論文レビュー でも掲載).しかし,活性が不溶性画分に存在していることが同定の大きな障壁となり,Trimmerの実体は不明のままであった.
1.トリミング活性はミトコンドリアを含む画分に多く存在する
まず,トリミング活性の存在する細胞の不溶性画分(細胞の懸濁液を低速遠心したときのペレット)から,さまざまな界面活性剤を用いてトリミング活性の可溶化を試みたが,トリミング活性はほとんど可溶化されなかった.そこで,不溶性画分のどこにトリミング活性が存在するのかを明らかにすることを目的として,細胞分画によりおのおのの画分のトリミング活性を調べたところ,ミトコンドリアを含む画分に細胞の不溶性画分と同様の強いトリミング活性が見い出され,リソソーム画分,小胞体画分,細胞質画分と軽い画分になるにつれトリミング活性は減弱することがわかった.piRNAの産生にかかわる因子のいくつかはミトコンドリア膜に局在することが知られており,ミトコンドリアの表面はpiRNAの産生の場のひとつと考えられている1-3).そこで,強いトリミング活性の検出されたミトコンドリア粗精製画分を用いて,再度,さまざまな界面活性剤による可溶化について検討した結果,一部ではあるがトリミング活性が可溶化される条件が見い出された.可溶化されたトリミング活性をスクロース密度勾配遠心により分画したところ,トリミング活性は比較的重い画分に存在していたことから,Trimmerはなんらかの因子と複合体を形成している可能性が考えられた.また,トリミング活性はPIWIの結合タンパク質として知られるPapiの分布とよく一致した.
2.Papiはトリミング反応を促進する
Papiはミトコンドリア外膜に存在するタンパク質であり,その機能を阻害するとpiRNAの長さがわずかに伸長することから,piRNA前駆体の削りこみへの関与が示唆されていた6,7).しかし,Papiそれ自体にはヌクレアーゼ活性はなく,これまで,piRNA前駆体の削りこみにおける役割やTrimmerとの関係は不明であった.まず,PapiのノックダウンによりpiRNAが長くなるという知見が,in vitroにおけるトリミング反応において再現されることが確認された.このとき,Papiのノックダウンによりトリミング活性による産物が長くなるだけでなく,トリミング反応の効率が低下することに気づいた.また逆に,Papiを高発現した細胞溶解液においてはトリミング反応が促進された.このことから,Papiにはトリミング反応を促進する活性があるだけでなく,トリミング反応の律速因子になっていることが明らかにされた.
PapiはPIWIと結合するTudorドメインにくわえ,膜貫通ドメイン,および,核酸と結合するKHモチーフをもつ.これらの機能ドメインがPapiのトリミング促進活性に必要かどうかを調べたところ,いずれの機能ドメインの変異体も活性を失った.さらに,野生型のTudorドメインをもつ変異体は内在性のPapiに対し優性阻害効果を示したことから,Papiがトリミング反応を促進するうえでPapiとPIWIとの相互作用が重要であることが示唆された.また,KHモチーフの変異体はPIWIとの結合を維持していたにもかかわらずトリミング促進活性を失ったことから,PapiとpiRNA前駆体との結合がPapiによるトリミング促進活性に重要であることも示唆された.
3.Trimmerの同定
Papiにトリミング促進活性があり,スクロース密度勾配遠心実験においてトリミング活性とPapiの分布が一致するという結果から,PapiがTrimmerと複合体を形成してpiRNA前駆体の削りこみを促進しているのではないかと予想し,Papiの免疫沈降物にトリミング活性があるかどうか調べた.予想どおり,Papiの免疫沈降物にトリミング活性が検出されたことから,Papi複合体の質量分析によりTrimmerの同定を試みた.同定された4つのヌクレアーゼをノックダウンし,トリミング活性への影響について調べたところ,ひとつだけ,PNLDC1のノックダウンにおいてトリミング活性が低下した.PNLDC1はPARNと相同性のあるヌクレアーゼドメインをもつ機能未知のタンパク質であったが,ミトコンドリア画分に多く存在し膜貫通ドメインが予想されたことから,Papiと同様にミトコンドリア外膜タンパク質だと考えられた.さらに,PNLDC1の免疫沈降物を解析したところ,Papiが含まれるとともに,トリミング活性がみられた.Papiとは異なり,PNLDC1を高発現させてもトリミング反応は促進されなかったが,PNLDC1のヌクレアーゼ活性変異体の高発現はトリミング反応を強く阻害した.このことから,PNLDC1の量はトリミング反応の律速にはなっていないが,その活性がトリミング反応に必要であることが強く示唆された.PNLDC1がpiRNA前駆体の削りこみに機能することをさらに確認するため,トリミング活性のみられないショウジョウバエのS2細胞にカイコのPNLDC1を発現させた.PNLDC1を単独で発現させた場合にはトリミング活性は検出されなかったが,PapiとPNLDC1を共発現させるとS2細胞にトリミング活性が付与された.一方,PapiとPNLDC1の活性変異体とを共発現した場合にはトリミング活性は検出されなかった.これらの実験結果から,PNLDC1がpiRNA前駆体の削りこみを担うヌクレアーゼTrimmerであり,Trimmerによる削りこみはPapiを必要とすることが明らかにされた.
4.TrimmerとPapiは協同してpiRNA前駆体の3'末端の削りこみにはたらく
TrimmerとPapiとの関係についてさらに調べるため,TrimmerあるいはPapiの単独のノックダウンとダブルノックダウンとでその効果を比較したところ,単独のノックダウンに比べダブルノックダウンではトリミング活性がより強く阻害された.この結果から,TrimmerとPapiはpiRNA前駆体の3'末端の削りこみに協同的に作用することが示唆された.
細胞においてTrimmerが実際にpiRNA前駆体の削りこみに機能していることを確認するため,TrimmerあるいはPapiをノックダウンした細胞からRNAを抽出し,ノーザンブロット法や次世代シークエンサーを用いた解析により内在性のpiRNAの長さの変化について調べた.その結果,いずれのノックダウンにおいても,piRNAの3'側が全体的に数塩基ほど長くなっていた.TrimmerとPapiのダブルノックダウンでは,単独のノックダウンではみられなかった,3'側が伸長した35~40 ntの長いpiRNAの蓄積が認められた.これは,TrimmerおよびPapiのはたらきにより3'末端が削りこまれるまえのpiRNA前駆体だと考えられた.
5.3'末端の削りこみによるpiRNAの成熟化はpiRNAの機能に重要である
piRNA前駆体の3'末端が削りこまれることはpiRNAが機能するうえで重要なのか? この疑問に答えるため,in vitroにおいて,piRNA前駆体を模した50 ntの長さのRNAを取り込んだPIWIと,3'末端を削りこんだ約27 ntの長さのRNAを取り込んだPIWIについて,標的となるRNAの切断活性に差がみられるかどうか検証した.ガイドとなるRNAのそれぞれに相補的な配列をもつ2種類の標的RNAを用いた結果,どちらの場合も,3'末端が削りこまれた成熟型のRNAと結合したPIWIのほうが効率よく標的RNAを切断できることがわかった.この結果は,piRNA前駆体の3'末端が削りこみをうけ成熟型piRNAになることが,RNAの切断というpiRNAの機能を発揮するうえで重要であることを示した.
おわりに
Trimmerの同定の鍵になったのは,ミトコンドリア画分からのトリミング活性の可溶化およびPapiへの着目であった.いま考えると,当初,トリミング活性の可溶化が困難だったのは,おそらく,PapiとTrimmerの相互作用を損なわない条件でなければトリミング活性が検出できなかったためだと思われる.一連の研究結果をふまえると,piRNA前駆体の3'末端の削りこみの分子機構として,まず,piRNA前駆体を取り込んだPIWIがPapiによりミトコンドリア膜にひきよせられ,さらに,PapiがpiRNA前駆体と結合することによりTrimmerがpiRNA前駆体の3'末端に近づきやすくなり,そののち,TrimmerがpiRNA前駆体の3'末端を削りこむ,というモデルが考えられた(図2).
筆者らによりカイコのTrimmerが同定されたが,Cell誌の同じ号において,線虫においてPARNのホモログのひとつがpiRNA前駆体の3'末端の削りこみにはたらくことが報告された8).また,Trimmer(PNLDC1)のオーソログは哺乳動物にも保存されていることから,哺乳動物においてもPNLDC1がpiRNA前駆体の3'末端の削りこみに機能することが予想される.一方,ショウジョウバエにPapiは存在するものの,TrimmerやPARNのホモログは存在せず,Nibblerという別のヌクレアーゼが3'末端の削りこみに機能することが示唆されている9).piRNA経路は動物界に広く保存されているにもかかわらず,種により3'末端の削りこみにはたらくヌクレアーゼが異なっているのは不思議である.この研究は,piRNAが成熟するしくみの一端を明らかにしたものであるが,これをもとに,今後,piRNAの産生の機構の理解がさらに進展することを期待したい.
文 献
- Czech, B. & Hannon, G. J.: One loop to rule them all: the ping-pong cycle and piRNA-guided silencing. Trends Biochem. Sci., 41, 324-337 (2016)[PubMed]
- Siomi, M. C., Sato, K., Pezic, D. et al.: PIWI-interacting small RNAs: the vanguard of genome defence. Nat. Rev. Mol. Cell Biol., 12, 246-258 (2011)[PubMed]
- Weick, E. M. & Miska, E. A.: piRNAs: from biogenesis to function. Development, 141, 3458-3471 (2014)[PubMed]
- Juliano, C., Wang, J. & Lin, H.: Uniting germline and stem cells: the function of Piwi proteins and the piRNA pathway in diverse organisms. Annu. Rev. Genet., 45, 447-469 (2011)[PubMed]
- Kawaoka, S., Izumi, N., Katsuma, S. et al.: 3' end formation of PIWI-interacting RNAs in vitro. Mol Cell, 43, 1015-1022 (2011)[PubMed] [新着論文レビュー]
- Honda, S., Kirino, Y., Maragkakis, M. et al.: Mitochondrial protein BmPAPI modulates the length of mature piRNAs. RNA, 19, 1405-1418 (2013)[PubMed]
- Saxe, J. P., Chen, M., Zhao, H. et al.: Tdrkh is essential for spermatogenesis and participates in primary piRNA biogenesis in the germline. EMBO J., 32, 1869-1885 (2013)[PubMed]
- Tang, W., Tu, S., Lee, H. C. et al.: The RNase PARN-1 trims piRNA 3' ends to promote transcriptome surveillance in C. elegans. Cell, 164, 974-984 (2016)[PubMed]
- Feltzin, V. L., Khaladkar, M., Abe, M. et al.: The exonuclease Nibbler regulates age-associated traits and modulates piRNA length in Drosophila. Aging Cell, 14, 443-452 (2015)[PubMed]
著者プロフィール
略歴:2009年 横浜市立大学大学院医学研究科博士課程 修了,2010年 東京大学分子細胞生物学研究所 研究員を経て,2014年より同 助教.
研究テーマ:piRNAの産生の機構.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2016 泉 奈津子・泊 幸秀 Licensed under CC 表示 2.1 日本