カイコ発:piRNAがつくられるしくみ
河岡慎平・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:河岡慎平,泊 幸秀
DOI: 10.7875/first.author.2011.153
3' end formation of PIWI-interacting RNAs in vitro.
Shinpei Kawaoka, Natsuko Izumi, Susumu Katsuma, Yukihide Tomari
Molecular Cell, 43, 1015-1022 (2011)
われわれヒトをはじめとする真核生物の遺伝情報は生殖細胞をとおして次世代へ正確に受け継がれる.ところが,真核生物のゲノムにはこの正確な遺伝情報の伝達を撹乱するトランスポゾンとよばれる利己的な配列が存在する.近年,piRNAとよばれる低分子RNAがトランスポゾンのはたらきを抑えることにより,次世代への正確な遺伝情報の伝達を助けていることがわかってきた.piRNA経路に異常が生じると,トランスポゾンのはたらきが活発化するのみならず,精子や卵の形成が正常に行われなくなり不妊となることがショウジョウバエやマウスを用いた研究により示されている.しかしながらこれまで,piRNA経路の中核となるpiRNAのつくられるしくみは未解明のままであった.筆者らは,今回,鱗翅目に属する昆虫であるカイコの卵巣に由来する培養細胞を活用することで,piRNAがつくられるようすを試験管内で再現することに世界ではじめて成功し,その過程を明らかにした.
PIWI-interacting RNA(piRNA)は動物の生殖細胞におけるトランスポゾン抑制系の中核をなす低分子RNAである.piRNAはほかのよく研究されている低分子RNAであるsmall interfering RNA(siRNA)やmicroRNA(miRNA)よりも数塩基ほど長い1).興味深いことに,二本鎖の中間体をへてつくられるsiRNAやmiRNAとは異なり,piRNAは一本鎖のままつくられることがわかっている1).しかしながらこれまで,piRNAがどのようにつくられるかについては大部分が不明なままであった.その一因として,piRNA生合成を再現するようなin vitro系のないことがあげられる2).これは,piRNAの発現が生殖巣にかぎられているため多量のタンパク質抽出液を調製することが困難であること,そして,piRNA経路を発現するような培養細胞がみつかっていなかったこと,などによるところが大きい.筆者らは,非モデル生物であるカイコという生物の有用性に着目しながらpiRNAに関する研究を行ってきた.2008年にカイコpiRNA経路の基本的な性質を報告すると3,4),2009年にはカイコの卵巣に由来する培養細胞であるBmN4細胞がpiRNA経路を完全なかたちで保持することを報告した5).今回は,このBmN4細胞を活用することにより,試験管内においてpiRNA生合成を再現することに成功し,その反応の性質を明らかにした.
筆者らの過去の研究から,カイコのゲノムにはSiwiとBmAgo3という2つのPIWIタンパク質がコードされていることが明らかになっている4).Siwiに結合するpiRNAは1番目の塩基がUにかたよっており,また,BmAgo3に結合するpiRNAの10塩基目の塩基はAにかたよっている5).また,Argonaute/PIWIタンパク質ファミリーは自らに結合するRNAの1塩基目と直接に相互作用していることが明らかになっている6,7).そこで,この塩基のかたよりを試験管内で再現することを試みた.
まず,成熟型piRNAを模した,1番目の塩基がそれぞれU,A,G,Cである26塩基の合成RNAを放射性同位体により標識し,Flag-Siwi融合タンパク質およびFlag-BmAgo3融合タンパク質を定常的に発現するBmN4細胞から調製したタンパク質抽出物とインキュベーションした.そののち,抗Flag抗体による免疫沈降を行い,免疫沈降物に含まれる放射性同位体により標識されたRNAの量を定量した.すると,Siwiは1番目の塩基がUであるRNAに好んで結合することが明らかになった.一方で,BmAgo3は1番目の塩基に対する好みを示さなかった.興味深いことに,これらの好みは使用する合成RNAの長さを50塩基としても同様であった.つまり,Siwiの1番目の塩基がUであるRNAに対する好みは,使用するRNAの長さによらなかった.
PIWIタンパク質の構造的な見地から,Siwiに結合した1番目の塩基がUである50塩基のRNAの3'末端は,ほぼまちがいなくSiwiから“はみだして”いるものと考えられたので,はみだしたこの3'末端をかじる反応あるいは活性が存在するという仮説をたてた.そこで,Siwiと1番目の塩基がUである50塩基の合成RNAとの複合体を,BmN4細胞から得たタンパク質抽出物とインキュベーションした.Siwiとは結合していない合成RNAとインキュベーションした際には強いRNase活性が認められたので,当然,Siwiから“はみだした”3'末端は適切な長さまで分解されるものと予想したが,それに反してそのような活性は認められなかった.piRNAがどのように生合成されるかを試験管内で立証した報告はなかったので,その時点では単純にこの仮説がまちがっているという可能性がもっとも高く,実験はいちどここで頓挫した.
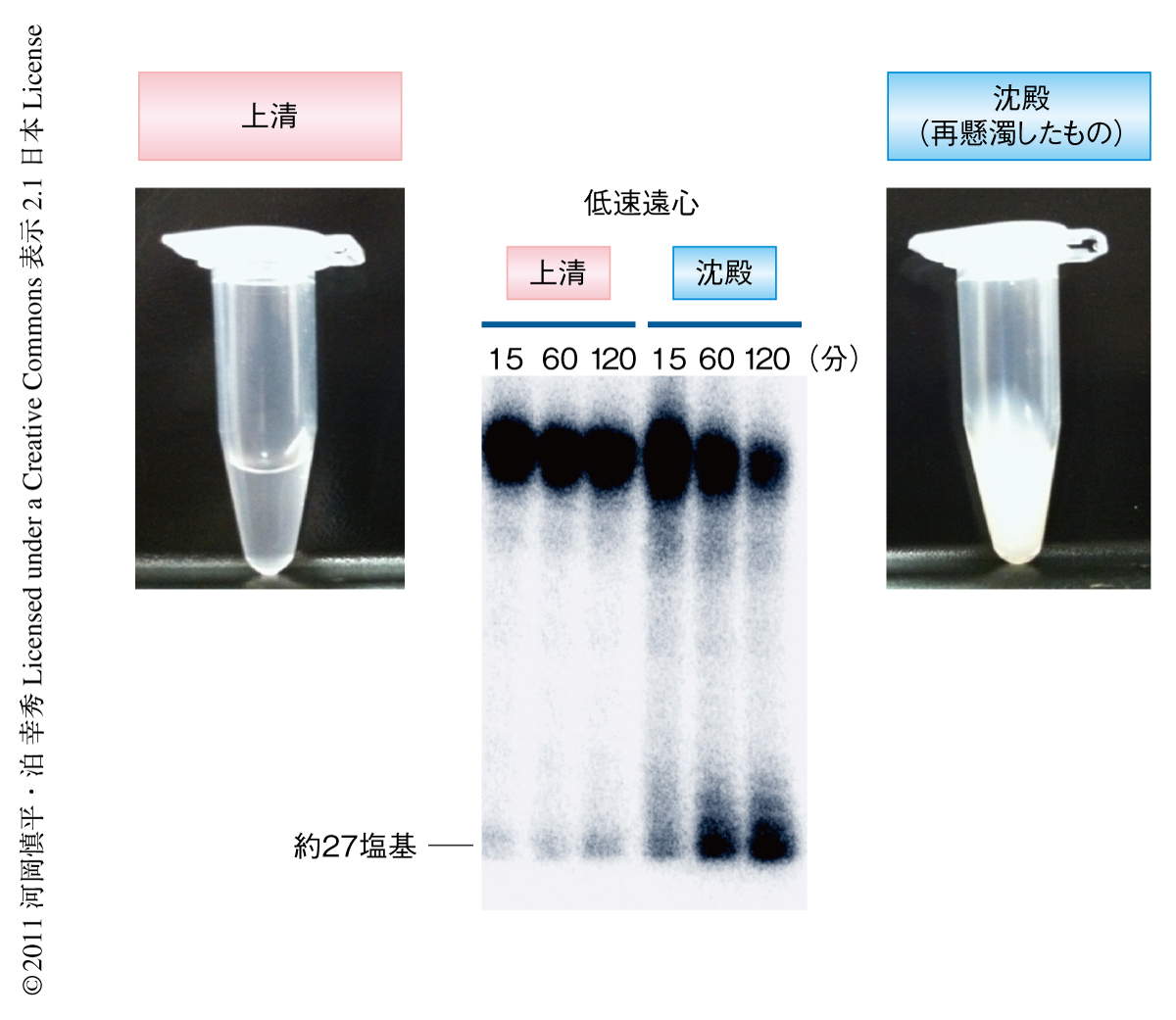
ところで,ここで使用したタンパク質抽出物は細胞を破砕し遠心した得た上清に該当し,生化学実験で使われるもっともスタンダードなものであった.ここで,一縷の望みをもって常識外の実験を試みた.すなわち,遠心による分離を行わない細胞破砕液そのものを実験に使用してみたのである.この細胞破砕液そのものは見た目にもたいへん汚く,また,細胞破砕液そのものを扱ったという話は,少なくとも筆者らは聞いたことがなかった.ところが驚くべきことに,この細胞破砕液がSiwiに結合した1番目の塩基がUである50塩基の合成RNAの3'末端を成熟型piRNAの長さまで削り込む活性(トリミング活性)をもっていたのである.のちの実験により,このトリミング活性は1000×gという非常に低速な遠心でも不溶画分に沈殿すること(図1),一般的な界面活性剤や超音波破砕といった方法ではまったく可溶化できないことが明らかになった.よって,17,000×gの遠心により調製したスタンダードなタンパク質抽出物が活性を示さなかったのはむしろ合理的であった.piRNA生合成にかかわることが遺伝学的に示されているタンパク質の多くは核膜の周辺のヌアージュという構造体に局在することが知られている8).筆者らは,トリミング活性をもつタンパク質(複合体)はこのヌアージュに存在するものと予想している.
トリミング反応の中核分子を仮にトリマーと名づけ,その生化学的な性質を明らかにしようと試みた.まず,トリマーがエキソヌクレアーゼなのかエンドヌクレアーゼなのかを検証した.もしトリマーがエンドヌクレアーゼであれば,トリミング反応は基質となるRNAの3'末端の構造には依存しないはずである.そこで,これまで使ってきた3'末端が水酸基であるRNAではなく,3'末端がリン酸基であるRNAをトリミング反応に供したところ,このRNAはトリミングされなかった.また,1番目の塩基がUである50塩基の合成RNAの38番目と39番目の塩基のあいだにホスホロチオエートを導入すると,39番目の塩基においてトリミング反応が停止することがわかった.このホスホロチオエートは導入した部位における切断のみを阻害するものと考えられた.もしトリミング反応がエンドヌクレアーゼによるものであれば,ホスホロチオエートを導入しても正しく成熟型piRNAができるはずである.以上の実験結果から,トリマーは3'-5'エキソヌクレアーゼであると結論した.また,このトリミング反応にはMg2+が必要であったので,トリマーはMg2+依存性の3'-5'エキソヌクレアーゼであることが明らかになった.
piRNAの3'末端には2'-O-メチル化修飾が導入されることが知られている9,10).そこで,トリミング反応により生じたRNAの3'末端の構造を調べたところ,確かにメチル化修飾されていることがわかった.おもしろいことに,それ以上はトリミングされない基質,すなわち,1番目の塩基がUである28塩基以下の合成RNAをトリミング反応液とインキュベーションしてもこのメチル化修飾は導入されなかった.以上から,トリミングされなければメチル化修飾されない,すなわち,piRNAの3'末端の2'-O-メチル化修飾はトリミング反応と共役していることがわかった.ホスホロチオエートの導入により29塩基以上の長さでトリミング反応を停止させた場合には十分なメチル化修飾が起こらなかったため,メチル化修飾が導入されるためには成熟型piRNAの長さまでトリミングされることが必要であることがわかった.なおかつ,メチル化修飾そのものを阻害した場合でもトリミング産物の長さは不変であった.すなわち,メチル化修飾そのものはpiRNAの長さを決定することには無関係であった.
今回,筆者らは,カイコという非モデル生物を活用してpiRNA生合成の一部を再現するin vitro系をたちあげることに成功した.長いRNAがランダムに分解されることにより確率的に生じる,1番目の塩基がUであるRNAがSiwiに取り込まれることによりpiRNA生合成がはじまるものと考えている.Siwiがどのようにして1番目の塩基がUであるRNAを認識しているのかについて現時点では不明である.Siwiが1番目の塩基がUであるRNAを取り込むと,3'末端のはみだした部分をトリマーがトリミングし,それと共役するかたちで3'末端に2'-O-メチル化修飾が導入される.これで成熟型piRNA複合体の完成である.この成熟型piRNA複合体はPIWIタンパク質による切断反応により新たなpiRNAをつくりだす11-13).これがpiRNA生合成経路のモデルである(図2).その発見の経緯からも明らかなように,トリマーは多数のおもしろい性質を備えている.しかしながら,その性質そのものがトリマーの実体をとらえる障害となっており,その分子実体はいまだ明らかではない.今後,筆者らの構築したこのin vitro系をあしがかりとして,これまで踏み込むことができなかったpiRNA生合成経路の詳細を明らかにするような研究が増えていくだろう.
この研究で活躍したBmN4細胞は,いまなお生殖細胞系列のpiRNA経路を完全なかたちで保持することが証明された唯一の培養細胞である.筆者(のひとり)には苦い経験がある.いたいけな学部学生であった際“どうしてカイコを使って研究しているの?”という(教育的な)質問に歯切れよく答えることができなかったのだ.そういった意味でも,BmN4細胞は最高の相棒である.BmN4細胞を用いてpiRNAの生合成や作用機序に挑む研究者が少しでも増えてくれれば望外の喜びである.また,カイコ個体を用いたpiRNAの解析から興味深い事実がわかりつつある13,14).もはや,さきの質問の答えに窮することはない.
略歴:東京大学大学院農学生命科学研究科博士課程 在学中.
関心事:大研究者への道,体重の削減,がん研究.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
© 2011 河岡慎平・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:河岡慎平,泊 幸秀
DOI: 10.7875/first.author.2011.153
3' end formation of PIWI-interacting RNAs in vitro.
Shinpei Kawaoka, Natsuko Izumi, Susumu Katsuma, Yukihide Tomari
Molecular Cell, 43, 1015-1022 (2011)
要 約
われわれヒトをはじめとする真核生物の遺伝情報は生殖細胞をとおして次世代へ正確に受け継がれる.ところが,真核生物のゲノムにはこの正確な遺伝情報の伝達を撹乱するトランスポゾンとよばれる利己的な配列が存在する.近年,piRNAとよばれる低分子RNAがトランスポゾンのはたらきを抑えることにより,次世代への正確な遺伝情報の伝達を助けていることがわかってきた.piRNA経路に異常が生じると,トランスポゾンのはたらきが活発化するのみならず,精子や卵の形成が正常に行われなくなり不妊となることがショウジョウバエやマウスを用いた研究により示されている.しかしながらこれまで,piRNA経路の中核となるpiRNAのつくられるしくみは未解明のままであった.筆者らは,今回,鱗翅目に属する昆虫であるカイコの卵巣に由来する培養細胞を活用することで,piRNAがつくられるようすを試験管内で再現することに世界ではじめて成功し,その過程を明らかにした.
はじめに
PIWI-interacting RNA(piRNA)は動物の生殖細胞におけるトランスポゾン抑制系の中核をなす低分子RNAである.piRNAはほかのよく研究されている低分子RNAであるsmall interfering RNA(siRNA)やmicroRNA(miRNA)よりも数塩基ほど長い1).興味深いことに,二本鎖の中間体をへてつくられるsiRNAやmiRNAとは異なり,piRNAは一本鎖のままつくられることがわかっている1).しかしながらこれまで,piRNAがどのようにつくられるかについては大部分が不明なままであった.その一因として,piRNA生合成を再現するようなin vitro系のないことがあげられる2).これは,piRNAの発現が生殖巣にかぎられているため多量のタンパク質抽出液を調製することが困難であること,そして,piRNA経路を発現するような培養細胞がみつかっていなかったこと,などによるところが大きい.筆者らは,非モデル生物であるカイコという生物の有用性に着目しながらpiRNAに関する研究を行ってきた.2008年にカイコpiRNA経路の基本的な性質を報告すると3,4),2009年にはカイコの卵巣に由来する培養細胞であるBmN4細胞がpiRNA経路を完全なかたちで保持することを報告した5).今回は,このBmN4細胞を活用することにより,試験管内においてpiRNA生合成を再現することに成功し,その反応の性質を明らかにした.
1.カイコのPIWIタンパク質であるSiwiは1番目の塩基がUであるRNAを好む
筆者らの過去の研究から,カイコのゲノムにはSiwiとBmAgo3という2つのPIWIタンパク質がコードされていることが明らかになっている4).Siwiに結合するpiRNAは1番目の塩基がUにかたよっており,また,BmAgo3に結合するpiRNAの10塩基目の塩基はAにかたよっている5).また,Argonaute/PIWIタンパク質ファミリーは自らに結合するRNAの1塩基目と直接に相互作用していることが明らかになっている6,7).そこで,この塩基のかたよりを試験管内で再現することを試みた.
まず,成熟型piRNAを模した,1番目の塩基がそれぞれU,A,G,Cである26塩基の合成RNAを放射性同位体により標識し,Flag-Siwi融合タンパク質およびFlag-BmAgo3融合タンパク質を定常的に発現するBmN4細胞から調製したタンパク質抽出物とインキュベーションした.そののち,抗Flag抗体による免疫沈降を行い,免疫沈降物に含まれる放射性同位体により標識されたRNAの量を定量した.すると,Siwiは1番目の塩基がUであるRNAに好んで結合することが明らかになった.一方で,BmAgo3は1番目の塩基に対する好みを示さなかった.興味深いことに,これらの好みは使用する合成RNAの長さを50塩基としても同様であった.つまり,Siwiの1番目の塩基がUであるRNAに対する好みは,使用するRNAの長さによらなかった.
2.1番目の塩基がUである50塩基のRNAの3'末端をトリミングする反応の発見
PIWIタンパク質の構造的な見地から,Siwiに結合した1番目の塩基がUである50塩基のRNAの3'末端は,ほぼまちがいなくSiwiから“はみだして”いるものと考えられたので,はみだしたこの3'末端をかじる反応あるいは活性が存在するという仮説をたてた.そこで,Siwiと1番目の塩基がUである50塩基の合成RNAとの複合体を,BmN4細胞から得たタンパク質抽出物とインキュベーションした.Siwiとは結合していない合成RNAとインキュベーションした際には強いRNase活性が認められたので,当然,Siwiから“はみだした”3'末端は適切な長さまで分解されるものと予想したが,それに反してそのような活性は認められなかった.piRNAがどのように生合成されるかを試験管内で立証した報告はなかったので,その時点では単純にこの仮説がまちがっているという可能性がもっとも高く,実験はいちどここで頓挫した.
ところで,ここで使用したタンパク質抽出物は細胞を破砕し遠心した得た上清に該当し,生化学実験で使われるもっともスタンダードなものであった.ここで,一縷の望みをもって常識外の実験を試みた.すなわち,遠心による分離を行わない細胞破砕液そのものを実験に使用してみたのである.この細胞破砕液そのものは見た目にもたいへん汚く,また,細胞破砕液そのものを扱ったという話は,少なくとも筆者らは聞いたことがなかった.ところが驚くべきことに,この細胞破砕液がSiwiに結合した1番目の塩基がUである50塩基の合成RNAの3'末端を成熟型piRNAの長さまで削り込む活性(トリミング活性)をもっていたのである.のちの実験により,このトリミング活性は1000×gという非常に低速な遠心でも不溶画分に沈殿すること(図1),一般的な界面活性剤や超音波破砕といった方法ではまったく可溶化できないことが明らかになった.よって,17,000×gの遠心により調製したスタンダードなタンパク質抽出物が活性を示さなかったのはむしろ合理的であった.piRNA生合成にかかわることが遺伝学的に示されているタンパク質の多くは核膜の周辺のヌアージュという構造体に局在することが知られている8).筆者らは,トリミング活性をもつタンパク質(複合体)はこのヌアージュに存在するものと予想している.
3.トリミング反応はMg2+依存性の3'-5'エキソヌクレアーゼにより行われる
トリミング反応の中核分子を仮にトリマーと名づけ,その生化学的な性質を明らかにしようと試みた.まず,トリマーがエキソヌクレアーゼなのかエンドヌクレアーゼなのかを検証した.もしトリマーがエンドヌクレアーゼであれば,トリミング反応は基質となるRNAの3'末端の構造には依存しないはずである.そこで,これまで使ってきた3'末端が水酸基であるRNAではなく,3'末端がリン酸基であるRNAをトリミング反応に供したところ,このRNAはトリミングされなかった.また,1番目の塩基がUである50塩基の合成RNAの38番目と39番目の塩基のあいだにホスホロチオエートを導入すると,39番目の塩基においてトリミング反応が停止することがわかった.このホスホロチオエートは導入した部位における切断のみを阻害するものと考えられた.もしトリミング反応がエンドヌクレアーゼによるものであれば,ホスホロチオエートを導入しても正しく成熟型piRNAができるはずである.以上の実験結果から,トリマーは3'-5'エキソヌクレアーゼであると結論した.また,このトリミング反応にはMg2+が必要であったので,トリマーはMg2+依存性の3'-5'エキソヌクレアーゼであることが明らかになった.
4.piRNAの3'末端のメチル化修飾はトリミング反応と共役している
piRNAの3'末端には2'-O-メチル化修飾が導入されることが知られている9,10).そこで,トリミング反応により生じたRNAの3'末端の構造を調べたところ,確かにメチル化修飾されていることがわかった.おもしろいことに,それ以上はトリミングされない基質,すなわち,1番目の塩基がUである28塩基以下の合成RNAをトリミング反応液とインキュベーションしてもこのメチル化修飾は導入されなかった.以上から,トリミングされなければメチル化修飾されない,すなわち,piRNAの3'末端の2'-O-メチル化修飾はトリミング反応と共役していることがわかった.ホスホロチオエートの導入により29塩基以上の長さでトリミング反応を停止させた場合には十分なメチル化修飾が起こらなかったため,メチル化修飾が導入されるためには成熟型piRNAの長さまでトリミングされることが必要であることがわかった.なおかつ,メチル化修飾そのものを阻害した場合でもトリミング産物の長さは不変であった.すなわち,メチル化修飾そのものはpiRNAの長さを決定することには無関係であった.
5.piRNAがつくられるしくみ
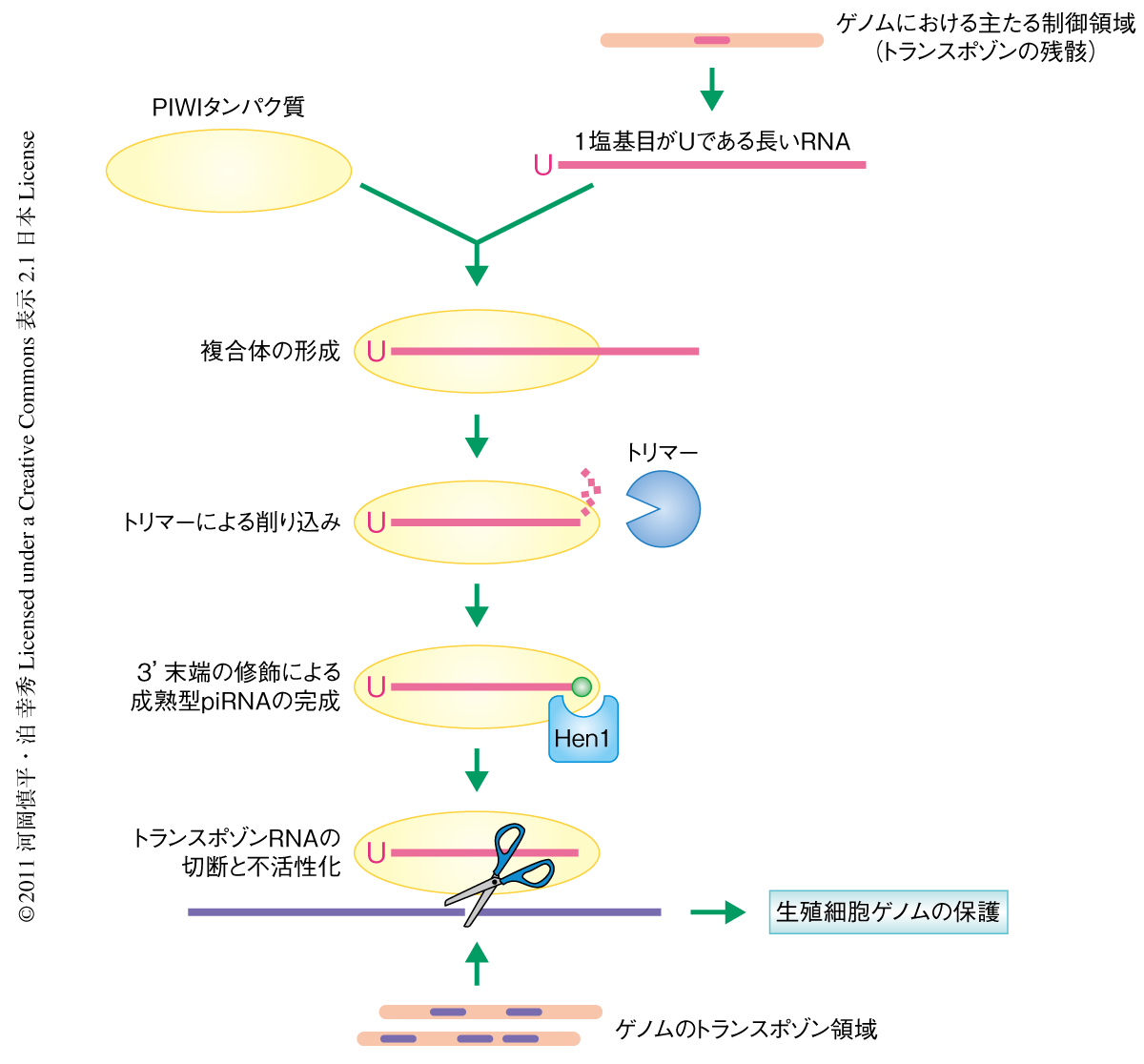
今回,筆者らは,カイコという非モデル生物を活用してpiRNA生合成の一部を再現するin vitro系をたちあげることに成功した.長いRNAがランダムに分解されることにより確率的に生じる,1番目の塩基がUであるRNAがSiwiに取り込まれることによりpiRNA生合成がはじまるものと考えている.Siwiがどのようにして1番目の塩基がUであるRNAを認識しているのかについて現時点では不明である.Siwiが1番目の塩基がUであるRNAを取り込むと,3'末端のはみだした部分をトリマーがトリミングし,それと共役するかたちで3'末端に2'-O-メチル化修飾が導入される.これで成熟型piRNA複合体の完成である.この成熟型piRNA複合体はPIWIタンパク質による切断反応により新たなpiRNAをつくりだす11-13).これがpiRNA生合成経路のモデルである(図2).その発見の経緯からも明らかなように,トリマーは多数のおもしろい性質を備えている.しかしながら,その性質そのものがトリマーの実体をとらえる障害となっており,その分子実体はいまだ明らかではない.今後,筆者らの構築したこのin vitro系をあしがかりとして,これまで踏み込むことができなかったpiRNA生合成経路の詳細を明らかにするような研究が増えていくだろう.
おわりに
この研究で活躍したBmN4細胞は,いまなお生殖細胞系列のpiRNA経路を完全なかたちで保持することが証明された唯一の培養細胞である.筆者(のひとり)には苦い経験がある.いたいけな学部学生であった際“どうしてカイコを使って研究しているの?”という(教育的な)質問に歯切れよく答えることができなかったのだ.そういった意味でも,BmN4細胞は最高の相棒である.BmN4細胞を用いてpiRNAの生合成や作用機序に挑む研究者が少しでも増えてくれれば望外の喜びである.また,カイコ個体を用いたpiRNAの解析から興味深い事実がわかりつつある13,14).もはや,さきの質問の答えに窮することはない.
文 献
- Ghildiyal, M. & Zamore, P. D.: Small silencing RNAs: an expanding universe. Nat. Rev. Genet., 10, 94-108 (2009)[PubMed]
- Hartig, J. V., Tomari, Y. & Forstemann, K.: piRNAs: the ancient hunters of genome invaders. Genes Dev., 21, 1707-1713 (2007)[PubMed]
- Kawaoka, S., Hayashi, N., Katsuma, S. et al.: Bombyx small RNAs: genomic defense system against transposons in the silkworm, Bombyx mori. Insect Biochem. Mol. Biol., 38, 1058-1065 (2008)[PubMed]
- Kawaoka, S., Minami, K., Katsuma, S. et al.: Developmentally synchronized expression of two Bombyx mori Piwi subfamily genes, SIWI and BmAGO3 in germ-line cells. Biochem. Biophys. Res. Commun., 367, 755-760 (2008)[PubMed]
- Kawaoka, S., Hayashi, N., Suzuki, Y. et al.: The Bombyx ovary-derived cell line endogenously expresses PIWI/PIWI-interacting RNA complexes. RNA, 15, 1258-1264 (2009)[PubMed]
- Ma, J. B., Yuan, Y. R., Meister, G. et al.: Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein. Nature, 434, 666-670 (2005)[PubMed]
- Parker, J. S., Roe, S. M. & Barford, D.: Structural insights into mRNA recognition from a PIWI domain-siRNA guide complex. Nature, 434, 663-666 (2005)[PubMed]
- Lim, A. K. & Kai, T.: Unique germ-line organelle, nuage, functions to repress selfish genetic elements in Drosophila melanogaster. Proc. Natl. Acad. Sci. USA, 104, 6714-6719 (2007)[PubMed]
- Kirino, Y. & Mourelatos, Z.: 2'-O-methyl modification in mouse piRNAs and its methylase. Nucleic Acids Symp. Ser., 417-418 (2007)[PubMed]
- Ohara, T., Sakaguchi, Y., Suzuki, T. et al.: The 3' termini of mouse Piwi-interacting RNAs are 2'-O-methylated. Nat. Struct. Mol .Biol., 14, 349-350 (2007)[PubMed]
- Brennecke, J., Aravin, A. A., Stark, A. et al.: Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila. Cell, 128, 1089-1103 (2007)[PubMed]
- Gunawardane, L. S., Saito, K., Nishida, K. M. et al.: A slicer-mediated mechanism for repeat-associated siRNA 5' end formation in Drosophila. Science, 315, 1587-1590 (2007)[PubMed]
- Kawaoka, S., Arai, Y., Kadota, K. et al.: Zygotic amplification of secondary piRNAs during silkworm embryogenesis. RNA, 17, 1401-1407 (2011)[PubMed]
- Kawaoka, S., Kadota, K., Arai, Y. et al.: Silkworm W chromosome is a source of female-enriched piRNAs. RNA, 17, 2144-2151 (2011)[PubMed]
著者プロフィール
略歴:東京大学大学院農学生命科学研究科博士課程 在学中.
関心事:大研究者への道,体重の削減,がん研究.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授
© 2011 河岡慎平・泊 幸秀 Licensed under CC 表示 2.1 日本