維持型DNAメチル化酵素DNMT1とモノユビキチン化されたヒストンH3との複合体の結晶構造から明らかにされたDNA維持メチル化の分子基盤
西山敦哉1・有田恭平2・中西 真1
(1東京大学医科学研究所 癌防御シグナル分野,2横浜市立大学大学院生命医科学研究科 構造生物学研究室)
email:西山敦哉,有田恭平
DOI: 10.7875/first.author.2017.125
Structure of the Dnmt1 reader module complexed with a unique two-mono-ubiquitin mark on histone H3 reveals the basis for DNA methylation maintenance.
Satoshi Ishiyama, Atsuya Nishiyama, Yasushi Saeki, Kei Moritsugu, Daichi Morimoto, Luna Yamaguchi, Naoko Arai, Rumie Matsumura, Toru Kawakami, Yuichi Mishima, Hironobu Hojo, Shintaro Shimamura, Fuyuki Ishikawa, Shoji Tajima, Keiji Tanaka, Mariko Ariyoshi, Masahiro Shirakawa, Mitsunori Ikeguchi, Akinori Kidera, Isao Suetake, Kyohei Arita, Makoto Nakanishi
Molecular Cell, 68, 350-360.e7 (2017)
DNAメチル化パターンの継承は細胞に固有の遺伝子発現の制御において重要な役割をはたし,維持型DNAメチル化酵素であるDNMT1と,その集積にかかわる片鎖メチル化DNA結合タンパク質であるユビキチンリガーゼUHRF1がその中心としてはたらく.しかし,DNMT1がどのようにしてDNAメチル化部位に集積し,どのような機構により活性化されるのか,その詳細は明らかではなかった.筆者らは,アフリカツメガエルの卵に由来する無細胞系および質量分析法を用いて,UHRF1により2箇所がモノユビキチン化されたヒストンH3がユニークな目印としてはたらき,DNMT1がDNAメチル化部位に集積することを発見した.さらに,DNMT1のRFTSドメインと2箇所がモノユビキチン化されたヒストンH3との複合体のX線結晶構造解析により,DNMT1のもつ新規のモジュールによるユビキチンの認識機構の詳細,および,DNAヘミメチル化部位におけるDNMT1の活性化の機序が明らかにされた.
DNAメチル化はヒストンの修飾とともに古くから知られるエピジェネティックな修飾であり,遺伝子発現の制御をはじめさまざまな生命現象において重要な役割をはたす.細胞の増殖にともなうDNAメチル化パターンの継承はその細胞の形質を維持するために不可欠であり,DNAメチル化の維持機構の破綻は異常な発生あるいは分化にくわえ,細胞のがん化や染色体の不安定化をひき起こす原因になる1).
DNAメチル化パターンの継承においては,維持型DNAメチル化酵素DNMT1およびユビキチンリガーゼUHRF1が重要なはたらきをする.UHRF1はDNAの複製ののちに一時的に生じる片鎖メチル化DNAと特異的に結合し2-4),ヒストンH3をユビキチン化する役割を担う5-7).DNMT1はRFTSドメインが触媒ドメインの活性部位に入り込む自己活性阻害の状態にあるが8),DNA複製の際にはユビキチン化されたヒストンH3とRFTSドメインを介し結合することによりDNAメチル化部位に集積する9)(新着論文レビュー でも掲載).そののち,片鎖メチル化DNAを両鎖メチル化DNAに変換することによりDNAメチル化パターンの維持にはたらく10).しかし,この過程において,UHRF1はどのような形状のユビキチン鎖をヒストンH3に結合させるのか,DNMT1はユビキチン化されたヒストンH3をどのように認識するのか,そして,その結合がDNMT1の活性化にどのような役割をもつのかは不明であった.
DNAメチル化パターンの継承の過程について解析するため,その再現の可能なin vitroにおける染色体の複製系であるアフリカツメガエルの卵抽出液を用いた.間期の卵から調製した抽出液に脱ユビキチン化酵素の不可逆的な阻害剤であるユビキチンビニルスルホンをくわえることにより,UHRF1に依存的なヒストンH3のユビキチン化がひき起こされる.ユビキチン化されたヒストンH3を高度に含むクロマチン抽出液を変性処理し,組換えDNMT1を用いて結合実験を行ったところ,2分子のモノユビキチンと結合したヒストンH3がDNMT1と特異的に結合することがわかった.
ヒストンH3のユビキチン化の様式を決定するため,ユビキチン化されたヒストンH3を抗ヒストンH3抗体により免疫沈降し,質量分析法によりユビキチン鎖を絶対定量した11).その結果,ポリユビキチン鎖は全体の5%以下しか存在しなかったことから,ヒストンH3はポリユビキチンにより修飾されるのではなく,複数の部位がモノユビキチン化されることが明らかにされた.また,ヒストンH3のLys14,Lys18,Lys23がモノユビキチン化の標的となることも示された.これは,Lys14,Lys18,Lys23をArgと置換したヒストンH3の変異体がユビキチン化されなかったことと一致した.以上の結果から,UHRF1により2箇所のLysがモノユビキチン化されたヒストンH3が,DNMT1をDNAメチル化部位に集積させる非常にユニークな目印としてはたらくことが示された.
モノユビキチン化の標的となるLysをCysと置換したヒストンH3とGly76をCysと置換したユビキチンとをジスルフィド結合させることによりモノユビキチン化されたヒストンH3のアナログを作製し,ヒトのDNMT1のRFTSドメインとの複合体を調製した.等温滴定型カロリメトリーを用いた相互作用の解析により,Lys14およびLys18,Lys14およびLys23,Lys18およびLys23の2箇所がモノユビキチン化されたヒストンH3は,いずれもRFTSドメインと非常に強い親和性で結合し,その結合の化学量論比は1対1であることがわかった.RFTSドメインは単独のユビキチンとは結合せず,また,1箇所のみモノユビキチン化されたヒストンH3に対しては1対1の特異的な複合体の形成はみられなかった.
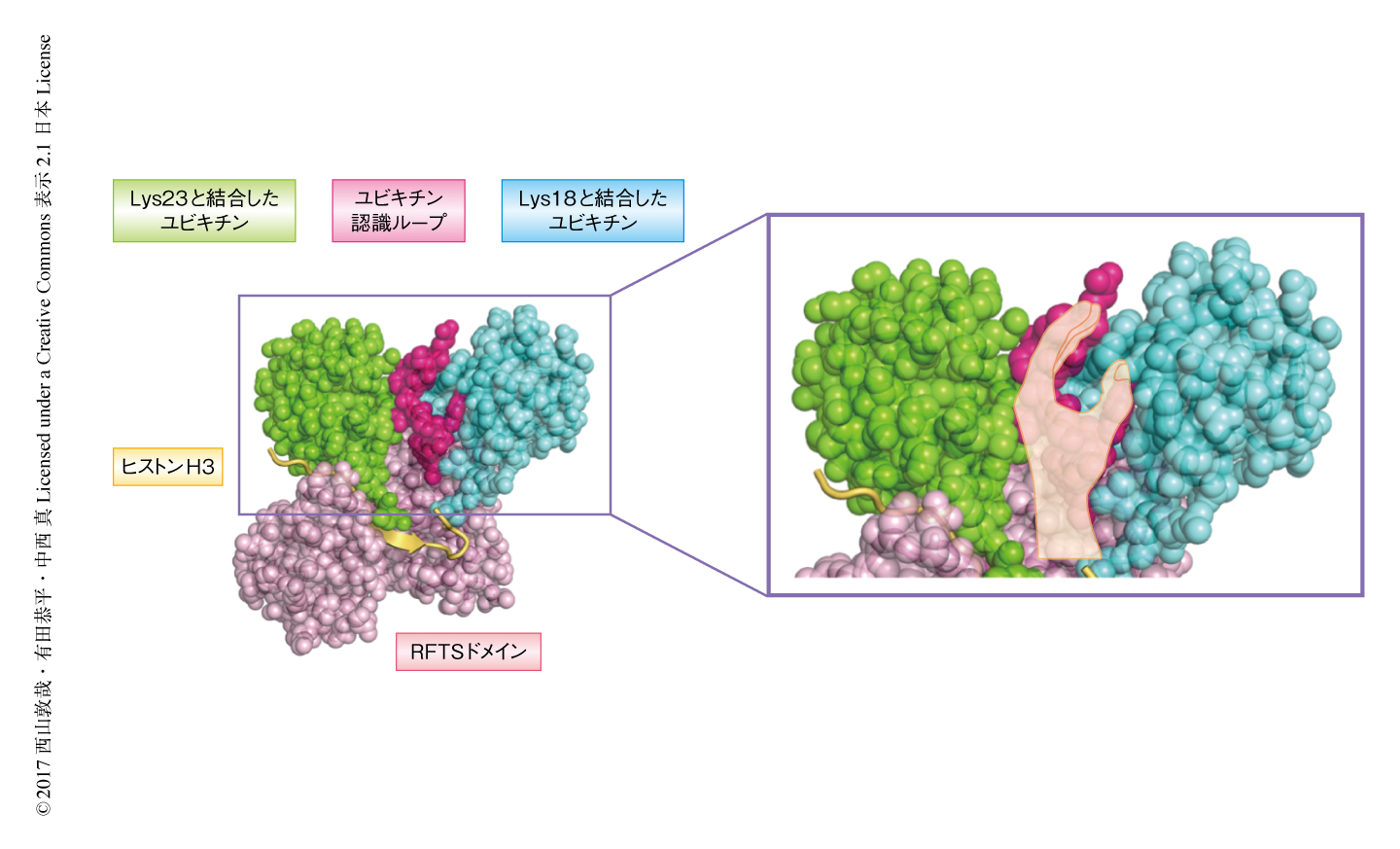
2箇所がモノユビキチン化されたヒストンH3のRFTSドメインによる認識機構について解明するため,Lys18およびLys23がモノユビキチン化されたヒストンH3とRFTSドメインとの複合体についてX線結晶構造解析を行った.得られた立体構造(PDB ID:5WVO)から,2つのユビキチンの親水性の分子表面は,モノユビキチン化されたヒストンH3との結合により構造の誘起されたユビキチン認識ループにより同時に認識されることがわかった.このRFTSドメインのもつユビキチン認識ループは左手のような特徴的なかたちをしており,Lys18と結合したユビキチンを手のひらで,Lys23と結合したユビキチンを手の甲で認識していた(図1).ユビキチンがほかのタンパク質と相互作用するためにはI44パッチという分子表面が重要であるが,Lys18と結合したユビキチンのI44パッチはすでに報告されていたRFTSドメインのモチーフであるUIMと,Lys23と結合したユビキチンのI44パッチはRFTSの新規に同定された疎水性の分子表面により認識されていた.
X線結晶構造解析により示されたユビキチンの認識にかかわるアミノ酸残基の必要性について検討するため,内在性のDNMT1を免疫除去した卵抽出液にユビキチン認識配列に変異を導入した組換えDNMT1変異体をくわえた.その結果,2つのユビキチン認識配列のいずれかに変異を導入したDNMT1変異体は,野生型のDNMT1においてみられたDNAメチル化部位への集積およびDNA維持メチル化能の活性を失っていた.このことから,DNMT1によるヒストンH3と結合した2つのユビキチンの認識がその機能に必要不可欠であることが示された.また,Lys18およびLys23がモノユビキチン化されたヒストンH3のN末端のテイルは2番目から20番目までの広範囲にわたりRFTSドメインと相互作用していた.このことから,DNMT1と2箇所がモノユビキチン化されたH3との相互作用はヒストンの翻訳後修飾により制御される可能性が示唆された.
DNMT1は,通常の状態ではRFTSドメインが触媒ドメインの活性部位に入り込んでおり,自己活性阻害型の立体構造をとることが知られている.事実,in vitroにおいて,DNMT1のDNAメチル化活性は低く抑えられている.ところが,生化学的な実験において,2箇所がモノユビキチン化されたヒストンH3がDNMT1と結合するとDNAメチル化活性が大幅に上昇した.この活性の上昇はヒストンH3やユビキチンを単独でくわえた場合には観察されず,ユビキチン認識部位に変異を導入したDNMT1変異体においてもみられなかった.さらに,分子動力学的な計算により,2箇所がモノユビキチン化されたヒストンH3の結合によりRFTSドメインが触媒ドメインから解離していく最初の過程が再現された.このことから,2箇所がモノユビキチン化されたヒストンH3のRFTSドメインへの結合がDNMT1の自己活性阻害の解除にはたらき,DNMT1をDNAメチル化部位において特異的に活性化することが明らかにされた.
この研究により,UHRF1による2箇所がモノユビキチン化されたヒストンH3を介したDNMT1の制御機構が明らかにされた(図2).ヒストンの修飾とDNAメチル化とのクロストークは以前から注目されており,とくに,ヒストンH3のアセチル化については転写の活性化マークとしてはたらきDNAメチル化とは排他的な関係にあることが知られていた.この研究において得られたモデルは,ヒストンのアセチル化によるユビキチン化の阻害の可能性を示しており,転写活性部位においてDNAメチル化がみられないことをよく説明した.また,転写の抑制的なマークであるヒストンH3のLys9あるいはLys27のメチル化とヒストンH3のユビキチン化との相関も興味深い問題である.
この研究の成果は,DNAメチル化継承の詳細な分子基盤を明らかにした学術的な意義にくわえ,DNAメチル化酵素の新たな阻害剤の開発の推進に大きく寄与する可能性がある.DNMT1のRFTSドメインと2箇所がモノユビキチン化されたヒストンH3との結合を阻害する小分子化合物のスクリーニング系の構築は,今後の重要な課題のひとつになるだろう.
略歴:2000年 東京工業大学大学院生命理学研究科博士課程 修了,京都大学大学院生命科学研究科 ポスドク,フランスInstitute of Human Geneticsポスドク,名古屋市立大学大学院医学研究科 講師を経て,2016年より東京大学医科学研究所 講師.
研究テーマ:DNA維持メチル化の分子機構.
関心事:染色体はどのようにして正確にコピーされるのか.
有田 恭平(Kyohei Arita)
横浜市立大学大学院生命医科学研究科 准教授.
研究室URL:http://www-mls.tsurumi.yokohama-cu.ac.jp/xtal-mls/members/kyouhei/index.html
中西 真(Makoto Nakanishi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/cancer-cell-biology/type1/index.html
© 2017 西山敦哉・有田恭平・中西 真 Licensed under CC 表示 2.1 日本
(1東京大学医科学研究所 癌防御シグナル分野,2横浜市立大学大学院生命医科学研究科 構造生物学研究室)
email:西山敦哉,有田恭平
DOI: 10.7875/first.author.2017.125
Structure of the Dnmt1 reader module complexed with a unique two-mono-ubiquitin mark on histone H3 reveals the basis for DNA methylation maintenance.
Satoshi Ishiyama, Atsuya Nishiyama, Yasushi Saeki, Kei Moritsugu, Daichi Morimoto, Luna Yamaguchi, Naoko Arai, Rumie Matsumura, Toru Kawakami, Yuichi Mishima, Hironobu Hojo, Shintaro Shimamura, Fuyuki Ishikawa, Shoji Tajima, Keiji Tanaka, Mariko Ariyoshi, Masahiro Shirakawa, Mitsunori Ikeguchi, Akinori Kidera, Isao Suetake, Kyohei Arita, Makoto Nakanishi
Molecular Cell, 68, 350-360.e7 (2017)
要 約
DNAメチル化パターンの継承は細胞に固有の遺伝子発現の制御において重要な役割をはたし,維持型DNAメチル化酵素であるDNMT1と,その集積にかかわる片鎖メチル化DNA結合タンパク質であるユビキチンリガーゼUHRF1がその中心としてはたらく.しかし,DNMT1がどのようにしてDNAメチル化部位に集積し,どのような機構により活性化されるのか,その詳細は明らかではなかった.筆者らは,アフリカツメガエルの卵に由来する無細胞系および質量分析法を用いて,UHRF1により2箇所がモノユビキチン化されたヒストンH3がユニークな目印としてはたらき,DNMT1がDNAメチル化部位に集積することを発見した.さらに,DNMT1のRFTSドメインと2箇所がモノユビキチン化されたヒストンH3との複合体のX線結晶構造解析により,DNMT1のもつ新規のモジュールによるユビキチンの認識機構の詳細,および,DNAヘミメチル化部位におけるDNMT1の活性化の機序が明らかにされた.
はじめに
DNAメチル化はヒストンの修飾とともに古くから知られるエピジェネティックな修飾であり,遺伝子発現の制御をはじめさまざまな生命現象において重要な役割をはたす.細胞の増殖にともなうDNAメチル化パターンの継承はその細胞の形質を維持するために不可欠であり,DNAメチル化の維持機構の破綻は異常な発生あるいは分化にくわえ,細胞のがん化や染色体の不安定化をひき起こす原因になる1).
DNAメチル化パターンの継承においては,維持型DNAメチル化酵素DNMT1およびユビキチンリガーゼUHRF1が重要なはたらきをする.UHRF1はDNAの複製ののちに一時的に生じる片鎖メチル化DNAと特異的に結合し2-4),ヒストンH3をユビキチン化する役割を担う5-7).DNMT1はRFTSドメインが触媒ドメインの活性部位に入り込む自己活性阻害の状態にあるが8),DNA複製の際にはユビキチン化されたヒストンH3とRFTSドメインを介し結合することによりDNAメチル化部位に集積する9)(新着論文レビュー でも掲載).そののち,片鎖メチル化DNAを両鎖メチル化DNAに変換することによりDNAメチル化パターンの維持にはたらく10).しかし,この過程において,UHRF1はどのような形状のユビキチン鎖をヒストンH3に結合させるのか,DNMT1はユビキチン化されたヒストンH3をどのように認識するのか,そして,その結合がDNMT1の活性化にどのような役割をもつのかは不明であった.
1.UHRF1はヒストンH3のLys14,Lys18,Lys23をモノユビキチン化する
DNAメチル化パターンの継承の過程について解析するため,その再現の可能なin vitroにおける染色体の複製系であるアフリカツメガエルの卵抽出液を用いた.間期の卵から調製した抽出液に脱ユビキチン化酵素の不可逆的な阻害剤であるユビキチンビニルスルホンをくわえることにより,UHRF1に依存的なヒストンH3のユビキチン化がひき起こされる.ユビキチン化されたヒストンH3を高度に含むクロマチン抽出液を変性処理し,組換えDNMT1を用いて結合実験を行ったところ,2分子のモノユビキチンと結合したヒストンH3がDNMT1と特異的に結合することがわかった.
ヒストンH3のユビキチン化の様式を決定するため,ユビキチン化されたヒストンH3を抗ヒストンH3抗体により免疫沈降し,質量分析法によりユビキチン鎖を絶対定量した11).その結果,ポリユビキチン鎖は全体の5%以下しか存在しなかったことから,ヒストンH3はポリユビキチンにより修飾されるのではなく,複数の部位がモノユビキチン化されることが明らかにされた.また,ヒストンH3のLys14,Lys18,Lys23がモノユビキチン化の標的となることも示された.これは,Lys14,Lys18,Lys23をArgと置換したヒストンH3の変異体がユビキチン化されなかったことと一致した.以上の結果から,UHRF1により2箇所のLysがモノユビキチン化されたヒストンH3が,DNMT1をDNAメチル化部位に集積させる非常にユニークな目印としてはたらくことが示された.
2.DNMT1とモノユビキチン化されたヒストンH3との複合体の結晶構造解析
モノユビキチン化の標的となるLysをCysと置換したヒストンH3とGly76をCysと置換したユビキチンとをジスルフィド結合させることによりモノユビキチン化されたヒストンH3のアナログを作製し,ヒトのDNMT1のRFTSドメインとの複合体を調製した.等温滴定型カロリメトリーを用いた相互作用の解析により,Lys14およびLys18,Lys14およびLys23,Lys18およびLys23の2箇所がモノユビキチン化されたヒストンH3は,いずれもRFTSドメインと非常に強い親和性で結合し,その結合の化学量論比は1対1であることがわかった.RFTSドメインは単独のユビキチンとは結合せず,また,1箇所のみモノユビキチン化されたヒストンH3に対しては1対1の特異的な複合体の形成はみられなかった.
2箇所がモノユビキチン化されたヒストンH3のRFTSドメインによる認識機構について解明するため,Lys18およびLys23がモノユビキチン化されたヒストンH3とRFTSドメインとの複合体についてX線結晶構造解析を行った.得られた立体構造(PDB ID:5WVO)から,2つのユビキチンの親水性の分子表面は,モノユビキチン化されたヒストンH3との結合により構造の誘起されたユビキチン認識ループにより同時に認識されることがわかった.このRFTSドメインのもつユビキチン認識ループは左手のような特徴的なかたちをしており,Lys18と結合したユビキチンを手のひらで,Lys23と結合したユビキチンを手の甲で認識していた(図1).ユビキチンがほかのタンパク質と相互作用するためにはI44パッチという分子表面が重要であるが,Lys18と結合したユビキチンのI44パッチはすでに報告されていたRFTSドメインのモチーフであるUIMと,Lys23と結合したユビキチンのI44パッチはRFTSの新規に同定された疎水性の分子表面により認識されていた.
X線結晶構造解析により示されたユビキチンの認識にかかわるアミノ酸残基の必要性について検討するため,内在性のDNMT1を免疫除去した卵抽出液にユビキチン認識配列に変異を導入した組換えDNMT1変異体をくわえた.その結果,2つのユビキチン認識配列のいずれかに変異を導入したDNMT1変異体は,野生型のDNMT1においてみられたDNAメチル化部位への集積およびDNA維持メチル化能の活性を失っていた.このことから,DNMT1によるヒストンH3と結合した2つのユビキチンの認識がその機能に必要不可欠であることが示された.また,Lys18およびLys23がモノユビキチン化されたヒストンH3のN末端のテイルは2番目から20番目までの広範囲にわたりRFTSドメインと相互作用していた.このことから,DNMT1と2箇所がモノユビキチン化されたH3との相互作用はヒストンの翻訳後修飾により制御される可能性が示唆された.
3.モノユビキチン化されたヒストンH3との結合によりDNMT1の酵素活性は上昇する
DNMT1は,通常の状態ではRFTSドメインが触媒ドメインの活性部位に入り込んでおり,自己活性阻害型の立体構造をとることが知られている.事実,in vitroにおいて,DNMT1のDNAメチル化活性は低く抑えられている.ところが,生化学的な実験において,2箇所がモノユビキチン化されたヒストンH3がDNMT1と結合するとDNAメチル化活性が大幅に上昇した.この活性の上昇はヒストンH3やユビキチンを単独でくわえた場合には観察されず,ユビキチン認識部位に変異を導入したDNMT1変異体においてもみられなかった.さらに,分子動力学的な計算により,2箇所がモノユビキチン化されたヒストンH3の結合によりRFTSドメインが触媒ドメインから解離していく最初の過程が再現された.このことから,2箇所がモノユビキチン化されたヒストンH3のRFTSドメインへの結合がDNMT1の自己活性阻害の解除にはたらき,DNMT1をDNAメチル化部位において特異的に活性化することが明らかにされた.
おわりに
この研究により,UHRF1による2箇所がモノユビキチン化されたヒストンH3を介したDNMT1の制御機構が明らかにされた(図2).ヒストンの修飾とDNAメチル化とのクロストークは以前から注目されており,とくに,ヒストンH3のアセチル化については転写の活性化マークとしてはたらきDNAメチル化とは排他的な関係にあることが知られていた.この研究において得られたモデルは,ヒストンのアセチル化によるユビキチン化の阻害の可能性を示しており,転写活性部位においてDNAメチル化がみられないことをよく説明した.また,転写の抑制的なマークであるヒストンH3のLys9あるいはLys27のメチル化とヒストンH3のユビキチン化との相関も興味深い問題である.
この研究の成果は,DNAメチル化継承の詳細な分子基盤を明らかにした学術的な意義にくわえ,DNAメチル化酵素の新たな阻害剤の開発の推進に大きく寄与する可能性がある.DNMT1のRFTSドメインと2箇所がモノユビキチン化されたヒストンH3との結合を阻害する小分子化合物のスクリーニング系の構築は,今後の重要な課題のひとつになるだろう.
文 献
- Smith, Z. D. & Meissner, A.: DNA methylation: roles in mammalian development. Nat. Rev. Genet., 14, 204-220 (2013)[PubMed]
- Arita, K., Ariyoshi, M., Tochio, H. et al.: Recognition of hemi-methylated DNA by the SRA protein UHRF1 by a base-flipping mechanism. Nature, 455, 818-821 (2008)[PubMed]
- Hashimoto, H., Horton, J. R., Zhang, X. et al.: The SRA domain of UHRF1 flips 5-methylcytosine out of the DNA helix. Nature, 455, 826-829 (2008)[PubMed]
- Avvakumov, G. V., Walker, J. R., Xue, S. et al.: Structural basis for recognition of hemi-methylated DNA by the SRA domain of human UHRF1. Nature, 455, 822-825 (2008)[PubMed]
- Arita, K., Isogai, S., Oda, T. et al.: Recognition of modification status on a histone H3 tail by linked histone reader modules of the epigenetic regulator UHRF1. Proc. Natl. Acad. Sci. USA, 109, 12950-12955 (2012)[PubMed]
- Rothbart, S. B., Dickson, B. M., Ong, M. S. et al.: Multivalent histone engagement by the linked tandem Tudor and PHD domains of UHRF1 is required for the epigenetic inheritance of DNA methylation. Genes Dev., 27, 1288-1298 (2013)[PubMed]
- Citterio, E., Papait, R., Nicassio, F. et al.: Np95 is a histone-binding protein endowed with ubiquitin ligase activity. Mol. Cell. Biol., 24, 2526-2535 (2004)[PubMed]
- Takeshita, K., Suetake, I., Yamashita, E. et al.: Structural insight into maintenance methylation by mouse DNA methyltransferase 1 (Dnmt1). Proc. Natl. Acad. Sci. USA, 108, 9055-9059 (2011)[PubMed]
- Nishiyama, A., Yamaguchi, L., Sharif, J. et al.: Uhrf1-dependent H3K23 ubiquitylation couples maintenance DNA methylation and replication. Nature, 502, 249-253 (2013)[PubMed] [新着論文レビュー]
- Goll, M. G. & Bestor, T. H.: Eukaryotic cytosine methyltransferases. Annu. Rev. Biochem., 74, 481-514 (2005)[PubMed]
- Tsuchiya, H., Tanaka, K. & Saeki, Y.: The parallel reaction monitoring method contributes to a highly sensitive polyubiquitin chain quantification. Biochem. Biophys. Res. Commun., 436, 223-229 (2013)[PubMed]
著者プロフィール
略歴:2000年 東京工業大学大学院生命理学研究科博士課程 修了,京都大学大学院生命科学研究科 ポスドク,フランスInstitute of Human Geneticsポスドク,名古屋市立大学大学院医学研究科 講師を経て,2016年より東京大学医科学研究所 講師.
研究テーマ:DNA維持メチル化の分子機構.
関心事:染色体はどのようにして正確にコピーされるのか.
有田 恭平(Kyohei Arita)
横浜市立大学大学院生命医科学研究科 准教授.
研究室URL:http://www-mls.tsurumi.yokohama-cu.ac.jp/xtal-mls/members/kyouhei/index.html
中西 真(Makoto Nakanishi)
東京大学医科学研究所 教授.
研究室URL:http://www.ims.u-tokyo.ac.jp/cancer-cell-biology/type1/index.html
© 2017 西山敦哉・有田恭平・中西 真 Licensed under CC 表示 2.1 日本