Uhrf1はヒストンH3の23番目のリジン残基のユビキチン化を介しDNA複製と共役した維持DNAメチル化を制御する
西山敦哉・中西 真
(名古屋市立大学大学院医学研究科 細胞生化学分野)
email:西山敦哉,中西 真
DOI: 10.7875/first.author.2013.117
Uhrf1-dependent H3K23 ubiquitylation couples maintenance DNA methylation and replication.
Atsuya Nishiyama, Luna Yamaguchi, Jafar Sharif, Yoshikazu Johmura, Takeshi Kawamura, Keiko Nakanishi, Shintaro Shimamura, Kyohei Arita, Tatsuhiko Kodama, Fuyuki Ishikawa, Haruhiko Koseki, Makoto Nakanishi
Nature, 502, 249-253 (2013)
DNAメチル化はクロマチンの構造制御を介し,転写の制御,発生および分化,ゲノムの安定性の維持に重要な役割をはたす.DNA複製にともないはたらくDNA維持メチル化酵素Dnmt1は,DNA複製ののちに生じたヘミメチル化DNAと特異的に結合するUhrf1に依存してDNAメチル化部位に集積するが,その詳細な分子機構は不明であった.筆者らは,アフリカツメガエルの卵に由来する無細胞系を用いて維持DNAメチル化の過程を試験管内で再現し生化学的な解析を行った.その結果,Uhrf1はDNA複製に依存してヒストンH3の23番目のリジン残基をユビキチン化すること,また,ユビキチン化されたヒストンH3はDnmt1と直接に相互作用することにより,DNAメチル化部位へのDnmt1の集積において重要な役割をはたすことを見い出した.ヒトやマウスの細胞においても同様の結果が得られ,ヒストンH3のユビキチン化を介した維持DNAメチル化の制御が進化的に保存された分子機構であることが示された.
DNAのメチル化はもっともよく知られたエピジェネティックな修飾のひとつであり,その多くはCpG配列のシトシン塩基の5位の炭素にメチル基が付加されることにより生じる.メチル化されたDNAはメチル化DNA結合タンパク質を集積することにより,クロマチンの構造変換を誘導し転写の抑制的な制御において重要な役割をはたす1).
細胞は分化にともなう固有の遺伝子発現パターンをもつことが知られるが,これにDNAメチル化が必須の役割をはたしている.いったん確立したDNAメチル化のパターンは,細胞の増殖にともない娘細胞に正確に伝達される必要がある.この伝達は維持DNAメチル化とよばれる分子機構により制御されており,その破綻は異常な発生および分化,また,ゲノムの不安定化をひき起こす.
メチル化されたDNAはDNA複製にともない片方のDNA鎖のみが一過的にメチル化されたヘミメチル化DNAとなる.これは,DNA複製装置そのものはDNAのメチル化を読み取り新生DNA鎖にメチル基を付加する活性をもたないためである.維持DNAメチル化酵素であるDnmt1は,ヘミメチル化DNAを基質とし新生DNA鎖にメチル基を付加する.Dnmt1のDNAメチル化部位への集積はヘミメチル化DNA結合タンパク質であるUhrf1に依存して起こり2-5),それにはDnmt1のN末端側にあるRFTS(replication foci targeting sequence)領域が必要である6).また,Dnmt1のN末端側にはPCNA(proliferating cell nuclear antigen:増殖細胞核抗原)との結合モチーフも存在するが7),PCNAに結合できない変異Dnmt1もDNAメチル化はほぼ正常に行うことが示唆されており,その生理的な役割はいまだ明らかではない.一方,Uhrf1はヘミメチル化DNAへの結合に必要なSRAドメインにくわえ,RING型ユビキチンリガーゼとしての活性ももつ多機能タンパク質であるが8)(図1a),生理的な基質やDnmt1のRFTS領域との相互作用などは明らかではなかった.
維持DNAメチル化の分子機構を生化学的に解析するため,アフリカツメガエルの卵に由来する無細胞系を用いた実験を行った.アフリカツメガエルの卵から調製した間期の活性をもつ抽出液に,脱膜処理をしたアフリカツメガエルの精子の核をくわえると,DNA複製と共役したクロマチンの形成を試験管内で再現できる.これまでに,この無細胞実験系は細胞周期の進行,DNA複製,細胞周期チェックポイントなどの研究において中心的な役割をはたしてきた9).
まず,この無細胞系において維持DNAメチル化の再現が可能であるかどうか調べた.DNAに付加されるメチル基はS-アデノシルメチオニンから供給される.S-アデノシルメチオニンのメチル基を放射性同位体により標識してアフリカツメガエルの卵抽出液にくわえ,DNA複製ののち,DNAへのメチル基の取り込みを調べた.その結果,DNA複製およびUhrf1に依存的なメチル基の取り込みが観察され,DNA複製に依存したDNAメチル化の再現が可能なことがわかった.この結果と一致するように,DNA複製に依存したDnmt1のクロマチンへの結合が観察され,この結合はUhrf1の免疫除去により完全に抑制された.これらの結果は,アフリカツメガエルの卵に由来する無細胞系において維持DNAメチル化の再現が可能であることを強く示唆した.また,興味深いことに,Uhrf1を免疫除去してもPCNAのクロマチンへの結合には影響がなかったことから,Dnmt1とPCNAとの結合はDnmt1のクロマチンへの結合に対しては必ずしも十分ではないと考えられた.
維持DNAメチル化酵素であるDnmt1をアフリカツメガエルの卵抽出液から免疫除去してその影響を調べた.その結果,Dnmt1の非存在下においては,Uhrf1が高度にクロマチンに蓄積することがわかった.興味深いことに,Uhrf1の蓄積と一致してヒストンH3に移動度の異なるバンドが出現した.このバンドはUhrf1とDnmt1をともに免疫除去した卵抽出液からは検出されず,また,抗ユビキチン抗体により認識されたことから,Uhrf1に依存してユビキチン化をされたヒストンH3であると考えられた.さらに,質量分析によりヒストンH3におけるユビキチン化部位を探索したところ,23番目のリジン残基がユビキチン化の標的となっていることが明らかになった.
ユビキチン化されたヒストンH3の維持DNAメチル化における役割を検討するため,ユビキチン化ヒストンH3に特異的に結合するタンパク質を探索した.クロマチン画分からヒストンH3をDNA分解酵素により可溶化し,特異抗体を用いて免疫沈降した.この免疫沈降物を用いてアフリカツメガエルの卵抽出液においてユビキチン化ヒストンH3と結合するタンパク質を探索したところ,意外なことに,Dnmt1がユビキチン化ヒストンH3と特異的に結合する活性を示した.Dnmt1を結合させた免疫沈降物を用いてもDnmt1はユビキチン化ヒストンH3と結合することが示され,さらに,ファーウェスタンブロット解析でもこれらの結合が直接的であることが確認された.
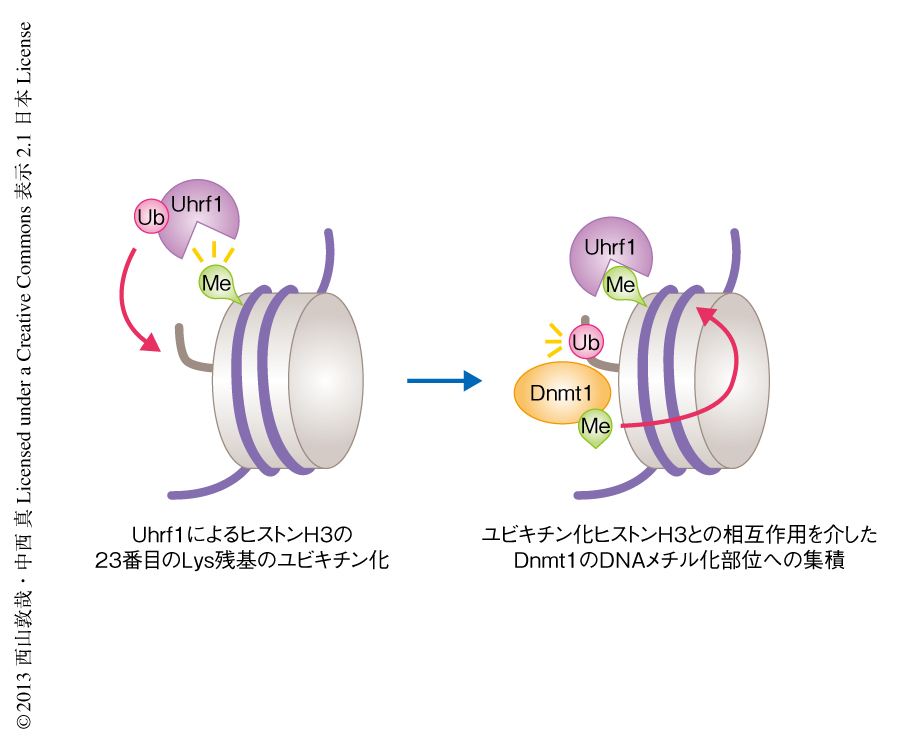
以上の結果から,Uhrf1に依存的にユビキチン化されたヒストンH3が,Dnmt1をDNAメチル化部位に集積する分子標的として機能していることが考えられた(図1b).これまで,Dnmt1のDNAメチル化部位への集積にはそのRFTS領域が必須であると報告されていたため,RFTS領域がユビキチン化ヒストンH3との結合領域になっているかどうか調べた.その結果,RFTS領域の最初の100アミノ酸残基を欠失させた変異Dnmt1はユビキチン化ヒストンH3との結合能を失うことがわかった.これまで機能の不明だったDnmt1のRFTS領域が,ユビキチン化されたヒストンH3との結合ドメインとしてはたらいていることが明らかになった.
哺乳類の細胞を用いた解析を行った.HeLa細胞においてshRNAを用いてDnmt1をノックダウンすると,アフリカツメガエルの卵に由来する抽出液の場合と同様に,DNA複製に特異的にUhrf1に依存的なヒストンH3のユビキチン化が観察された.さらに,23番目のリジン残基をアルギニン残基に置換した変異ヒストンH3を細胞に発現させ,Dnmt1のノックダウンにより誘導されるヒストンH3のユビキチン化について調べたところ,この変異ヒストンH3ではユビキチン化はみられず,哺乳類の細胞においてもUhrf1によるヒストンH3ユビキチン化の標的は23番目のリジン残基であることが確認された.ユビキチンリガーゼ活性を欠失した変異Uhrf1を発現させた細胞ではヒストンH3のユビキチン化は起こらず,Dnmt1のDNA複製部位からの脱局在や,レトロトランスポゾン領域におけるDNAメチル化レベルの低下などがあわせて観察された.これらの結果は,Uhrf1によるヒストンH3のユビキチン化を介しDnmt1がDNAメチル化部位に集積されることが,DNAメチル化の維持において重要であることを示した.
この研究により,維持DNAメチル化の分子機構に,Uhrf1によるヒストンH3の23番目のリジン残基のユビキチン化と,ユビキチン化されたヒストンH3によるDnmt1の集積,という2つの過程が新たにくわわった(図2).ヒストンH3の23番目のリジン残基は主要なアセチル化部位として報告されており10),DNAメチル化と独立して,アセチル化および脱アセチル化による制御をうけている可能性が高い.Uhrf1が直接に結合すると報告されているヒストンH3の9番目のリジン残基のトリメチル化など,そのほかのヒストン修飾とのクロストークも含め,ヒストンH3の23番目のリジン残基の修飾が維持DNAメチル化の制御や発生および分化などにどのようにかかわっているのか,非常に興味深い.
略歴:2000年 東京工業大学大学院生命理学研究科博士課程 修了,同 ポスドク,京都大学大学院生命科学研究科 ポスドク,フランスInstitute of Human Geneticsポスドクを経て,2011年より名古屋市立大学大学院医学研究科 講師.
中西 真(Makoto Nakanishi)
名古屋市立大学大学院医学研究科 教授.
© 2013 西山敦哉・中西 真 Licensed under CC 表示 2.1 日本
(名古屋市立大学大学院医学研究科 細胞生化学分野)
email:西山敦哉,中西 真
DOI: 10.7875/first.author.2013.117
Uhrf1-dependent H3K23 ubiquitylation couples maintenance DNA methylation and replication.
Atsuya Nishiyama, Luna Yamaguchi, Jafar Sharif, Yoshikazu Johmura, Takeshi Kawamura, Keiko Nakanishi, Shintaro Shimamura, Kyohei Arita, Tatsuhiko Kodama, Fuyuki Ishikawa, Haruhiko Koseki, Makoto Nakanishi
Nature, 502, 249-253 (2013)
要 約
DNAメチル化はクロマチンの構造制御を介し,転写の制御,発生および分化,ゲノムの安定性の維持に重要な役割をはたす.DNA複製にともないはたらくDNA維持メチル化酵素Dnmt1は,DNA複製ののちに生じたヘミメチル化DNAと特異的に結合するUhrf1に依存してDNAメチル化部位に集積するが,その詳細な分子機構は不明であった.筆者らは,アフリカツメガエルの卵に由来する無細胞系を用いて維持DNAメチル化の過程を試験管内で再現し生化学的な解析を行った.その結果,Uhrf1はDNA複製に依存してヒストンH3の23番目のリジン残基をユビキチン化すること,また,ユビキチン化されたヒストンH3はDnmt1と直接に相互作用することにより,DNAメチル化部位へのDnmt1の集積において重要な役割をはたすことを見い出した.ヒトやマウスの細胞においても同様の結果が得られ,ヒストンH3のユビキチン化を介した維持DNAメチル化の制御が進化的に保存された分子機構であることが示された.
はじめに
DNAのメチル化はもっともよく知られたエピジェネティックな修飾のひとつであり,その多くはCpG配列のシトシン塩基の5位の炭素にメチル基が付加されることにより生じる.メチル化されたDNAはメチル化DNA結合タンパク質を集積することにより,クロマチンの構造変換を誘導し転写の抑制的な制御において重要な役割をはたす1).
細胞は分化にともなう固有の遺伝子発現パターンをもつことが知られるが,これにDNAメチル化が必須の役割をはたしている.いったん確立したDNAメチル化のパターンは,細胞の増殖にともない娘細胞に正確に伝達される必要がある.この伝達は維持DNAメチル化とよばれる分子機構により制御されており,その破綻は異常な発生および分化,また,ゲノムの不安定化をひき起こす.
メチル化されたDNAはDNA複製にともない片方のDNA鎖のみが一過的にメチル化されたヘミメチル化DNAとなる.これは,DNA複製装置そのものはDNAのメチル化を読み取り新生DNA鎖にメチル基を付加する活性をもたないためである.維持DNAメチル化酵素であるDnmt1は,ヘミメチル化DNAを基質とし新生DNA鎖にメチル基を付加する.Dnmt1のDNAメチル化部位への集積はヘミメチル化DNA結合タンパク質であるUhrf1に依存して起こり2-5),それにはDnmt1のN末端側にあるRFTS(replication foci targeting sequence)領域が必要である6).また,Dnmt1のN末端側にはPCNA(proliferating cell nuclear antigen:増殖細胞核抗原)との結合モチーフも存在するが7),PCNAに結合できない変異Dnmt1もDNAメチル化はほぼ正常に行うことが示唆されており,その生理的な役割はいまだ明らかではない.一方,Uhrf1はヘミメチル化DNAへの結合に必要なSRAドメインにくわえ,RING型ユビキチンリガーゼとしての活性ももつ多機能タンパク質であるが8)(図1a),生理的な基質やDnmt1のRFTS領域との相互作用などは明らかではなかった.
1.アフリカツメガエルの卵に由来する無細胞系を用いた維持DNAメチル化の試験管内での再現
維持DNAメチル化の分子機構を生化学的に解析するため,アフリカツメガエルの卵に由来する無細胞系を用いた実験を行った.アフリカツメガエルの卵から調製した間期の活性をもつ抽出液に,脱膜処理をしたアフリカツメガエルの精子の核をくわえると,DNA複製と共役したクロマチンの形成を試験管内で再現できる.これまでに,この無細胞実験系は細胞周期の進行,DNA複製,細胞周期チェックポイントなどの研究において中心的な役割をはたしてきた9).
まず,この無細胞系において維持DNAメチル化の再現が可能であるかどうか調べた.DNAに付加されるメチル基はS-アデノシルメチオニンから供給される.S-アデノシルメチオニンのメチル基を放射性同位体により標識してアフリカツメガエルの卵抽出液にくわえ,DNA複製ののち,DNAへのメチル基の取り込みを調べた.その結果,DNA複製およびUhrf1に依存的なメチル基の取り込みが観察され,DNA複製に依存したDNAメチル化の再現が可能なことがわかった.この結果と一致するように,DNA複製に依存したDnmt1のクロマチンへの結合が観察され,この結合はUhrf1の免疫除去により完全に抑制された.これらの結果は,アフリカツメガエルの卵に由来する無細胞系において維持DNAメチル化の再現が可能であることを強く示唆した.また,興味深いことに,Uhrf1を免疫除去してもPCNAのクロマチンへの結合には影響がなかったことから,Dnmt1とPCNAとの結合はDnmt1のクロマチンへの結合に対しては必ずしも十分ではないと考えられた.
2.Dnmt1の非存在下ではUhrf1はクロマチンに蓄積しヒストンH3がユビキチン化される
維持DNAメチル化酵素であるDnmt1をアフリカツメガエルの卵抽出液から免疫除去してその影響を調べた.その結果,Dnmt1の非存在下においては,Uhrf1が高度にクロマチンに蓄積することがわかった.興味深いことに,Uhrf1の蓄積と一致してヒストンH3に移動度の異なるバンドが出現した.このバンドはUhrf1とDnmt1をともに免疫除去した卵抽出液からは検出されず,また,抗ユビキチン抗体により認識されたことから,Uhrf1に依存してユビキチン化をされたヒストンH3であると考えられた.さらに,質量分析によりヒストンH3におけるユビキチン化部位を探索したところ,23番目のリジン残基がユビキチン化の標的となっていることが明らかになった.
3.ユビキチン化されたヒストンH3はDnmt1と特異的に結合する
ユビキチン化されたヒストンH3の維持DNAメチル化における役割を検討するため,ユビキチン化ヒストンH3に特異的に結合するタンパク質を探索した.クロマチン画分からヒストンH3をDNA分解酵素により可溶化し,特異抗体を用いて免疫沈降した.この免疫沈降物を用いてアフリカツメガエルの卵抽出液においてユビキチン化ヒストンH3と結合するタンパク質を探索したところ,意外なことに,Dnmt1がユビキチン化ヒストンH3と特異的に結合する活性を示した.Dnmt1を結合させた免疫沈降物を用いてもDnmt1はユビキチン化ヒストンH3と結合することが示され,さらに,ファーウェスタンブロット解析でもこれらの結合が直接的であることが確認された.
4.ユビキチン化されたヒストンH3とDnmt1との結合にはDnmt1のRFTS領域が必要である
以上の結果から,Uhrf1に依存的にユビキチン化されたヒストンH3が,Dnmt1をDNAメチル化部位に集積する分子標的として機能していることが考えられた(図1b).これまで,Dnmt1のDNAメチル化部位への集積にはそのRFTS領域が必須であると報告されていたため,RFTS領域がユビキチン化ヒストンH3との結合領域になっているかどうか調べた.その結果,RFTS領域の最初の100アミノ酸残基を欠失させた変異Dnmt1はユビキチン化ヒストンH3との結合能を失うことがわかった.これまで機能の不明だったDnmt1のRFTS領域が,ユビキチン化されたヒストンH3との結合ドメインとしてはたらいていることが明らかになった.
5.Uhrf1によるヒストンH3のユビキチン化は哺乳類の細胞においても重要である
哺乳類の細胞を用いた解析を行った.HeLa細胞においてshRNAを用いてDnmt1をノックダウンすると,アフリカツメガエルの卵に由来する抽出液の場合と同様に,DNA複製に特異的にUhrf1に依存的なヒストンH3のユビキチン化が観察された.さらに,23番目のリジン残基をアルギニン残基に置換した変異ヒストンH3を細胞に発現させ,Dnmt1のノックダウンにより誘導されるヒストンH3のユビキチン化について調べたところ,この変異ヒストンH3ではユビキチン化はみられず,哺乳類の細胞においてもUhrf1によるヒストンH3ユビキチン化の標的は23番目のリジン残基であることが確認された.ユビキチンリガーゼ活性を欠失した変異Uhrf1を発現させた細胞ではヒストンH3のユビキチン化は起こらず,Dnmt1のDNA複製部位からの脱局在や,レトロトランスポゾン領域におけるDNAメチル化レベルの低下などがあわせて観察された.これらの結果は,Uhrf1によるヒストンH3のユビキチン化を介しDnmt1がDNAメチル化部位に集積されることが,DNAメチル化の維持において重要であることを示した.
おわりに
この研究により,維持DNAメチル化の分子機構に,Uhrf1によるヒストンH3の23番目のリジン残基のユビキチン化と,ユビキチン化されたヒストンH3によるDnmt1の集積,という2つの過程が新たにくわわった(図2).ヒストンH3の23番目のリジン残基は主要なアセチル化部位として報告されており10),DNAメチル化と独立して,アセチル化および脱アセチル化による制御をうけている可能性が高い.Uhrf1が直接に結合すると報告されているヒストンH3の9番目のリジン残基のトリメチル化など,そのほかのヒストン修飾とのクロストークも含め,ヒストンH3の23番目のリジン残基の修飾が維持DNAメチル化の制御や発生および分化などにどのようにかかわっているのか,非常に興味深い.
文 献
- Jones, P. A.: Functions of DNA methylation: islands, start sites, gene bodies and beyond. Nat. Rev. Genet., 13, 484-492 (2012)[PubMed]
- Bostick, M. Kim, J. K., Esteve, P. O. et al.: UHRF1 plays a role in maintaining DNA methylation in mammalian cells. Science, 317, 1760-1764 (2007)[PubMed]
- Sharif, J. Muto, M., Takebayashi, S. et al.: The SRA protein Np95 mediates epigenetic inheritance by recruiting Dnmt1 to methylated DNA. Nature, 450, 908-912 (2007)[PubMed]
- Arita, K., Ariyoshi, M., Tochio, H. et al.: Recognition of hemi-methylated DNA by the SRA protein UHRF1 by a base-flipping mechanism. Nature, 455, 818-821 (2008)[PubMed]
- Hashimoto, H., Horton, J. R., Zhang, X. et al.: The SRA domain of UHRF1 flips 5-methylcytosine out of the DNA helix. Nature, 455, 826-829 (2008)[PubMed]
- Leonhardt, H., Page, A. W., Weier, H. U. et al.: A targeting sequence directs DNA methyltransferase to sites of DNA replication in mammalian nuclei. Cell, 71, 865-873 (1992)[PubMed]
- Chuang, L. S., Ian, H. I., Koh, T. W. et al.: Human DNA-(cytosine-5) methyltransferase-PCNA complex as a target for p21WAF1. Science, 277, 1996-2000 (1997)[PubMed]
- Citterio, E., Papait, R., Nicassio, F. et al.: Np95 is a histone-binding protein endowed with ubiquitin ligase activity. Mol. Cell. Biol., 24, 2526-2535 (2004)[PubMed]
- Blow, J. J. & Laskey, R. A.: Initiation of DNA replication in nuclei and purified DNA by a cell-free extract of Xenopus eggs. Cell, 47, 577-587 (1986)[PubMed]
- Thomas, C. E., Kelleher, N. L. & Mizzen, C. A.: Mass spectrometric characterization of human histone H3: a bird's eye view. J. Proteome Res., 5, 240-247 (2006)[PubMed]
著者プロフィール
略歴:2000年 東京工業大学大学院生命理学研究科博士課程 修了,同 ポスドク,京都大学大学院生命科学研究科 ポスドク,フランスInstitute of Human Geneticsポスドクを経て,2011年より名古屋市立大学大学院医学研究科 講師.
中西 真(Makoto Nakanishi)
名古屋市立大学大学院医学研究科 教授.
© 2013 西山敦哉・中西 真 Licensed under CC 表示 2.1 日本