ダイレクトリプログラミング法によるオルガノイドの形成能をもつマウスおよびヒトの腸前駆細胞の作製
三浦 静・鈴木淳史
(九州大学生体防御医学研究所 器官発生再生学分野)
email:三浦 静,鈴木淳史
DOI: 10.7875/first.author.2017.111
Generation of mouse and human organoid-forming intestinal progenitor cells by direct lineage reprogramming.
Shizuka Miura, Atsushi Suzuki
Cell Stem Cell, 21, 456-471.e5 (2017)
この研究において,筆者らは,iPS細胞をへず直接的に細胞の分化を転換するダイレクトリプログラミング法を用いて,マウスの胎仔線維芽細胞にHnf4α,Foxa3,Gata6,Cdx2という4つの転写因子を導入することにより胎仔の腸前駆細胞と同様の性質をもつ細胞の分化を誘導させることに成功した.この誘導腸前駆細胞は胎仔型オルガノイドを形成し,腸幹細胞を含む成体型オルガノイドへと成長した.分化された腸幹細胞は4種類の腸上皮細胞に分化する多分化能をもち,かつ,長期間にわたり自己と同じ細胞をつくりつづける自己複製能をもっていた.また,これらのオルガノイドを大腸炎のモデルマウスに移植したところ,小腸上皮組織および大腸上皮組織が再構築された.さらに,この4つの転写因子の導入により,ヒトにおいても腸前駆細胞の分化が誘導された.ダイレクトリプログラミング法により作製された腸上皮のオルガノイドは,創薬や移植医療への応用が期待される.
哺乳類の成体の小腸上皮組織は陰窩および絨毛の2つのドメインから構成される.陰窩の底部には自己複製能をもつ腸幹細胞が存在する1).腸幹細胞はパネート細胞,吸収上皮細胞,内分泌細胞,杯細胞に分化し,絨毛の上部へと移動する.一方,胎仔の腸は高い増殖能をもつ細胞を含むが,成体の腸とは異なり陰窩はなく,機能的に分化した細胞も少ない2).
腸幹細胞は,EGF,Noggin,R-spondin1を含むマトリゲルにおける3次元培養により陰窩および絨毛をもつ3次元の組織構造体を形成する.この腸上皮組織様の構造は成体型オルガノイドとよばれ,継代により長期間にわたり培養および維持される3).また,成体型オルガノイドを大腸炎のモデルマウスに移植すると,大腸組織に陰窩および絨毛をもつ小腸上皮組織を再構築する4).一方,胎仔の腸前駆細胞は3次元培養により1層からなる陰窩をもたないオルガノイドを形成する.この球状の胎仔型オルガノイドは外来性のWntの刺激により成体型オルガノイドになるが,継代の途中で外来性のWntを除くことにより成体型オルガノイドへの成長は促進される2).胎仔型オルガノイドは大腸炎のモデルマウスに移植すると障害をうけた大腸上皮組織を再構築する2).これらのことから,腸上皮のオルガノイドは腸疾患の研究や移植医療に有用であると考えられる.しかしながら,腸上皮のオルガノイドの材料となる腸の組織片を成人のドナーや胎児から採取することはむずかしい.
腸組織に由来するオルガノイドの代わりとして,近年,多能性幹細胞を用いて腸上皮のオルガノイドを作製する研究が進められている.多能性幹細胞から作製する場合には,腸上皮細胞のほか間葉系の細胞も同時に作製することが可能であり,実際の腸組織と似た構造体を作製できる5).しかしながら,多能性幹細胞から腸細胞へと分化を誘導するには複雑な工程をへる必要があり作製に時間もかかる.さらに,未分化な細胞が残存していた場合には腫瘍が形成されるリスクがある.
最近の研究により,ダイレクトリプログラミング法という技術を利用して,未分化な状態をへず分化した細胞から直接的にほかの細胞へと分化を転換させることが可能になり,この方法を用いてさまざまな種類の細胞や前駆細胞が作製されるようになった.筆者らも,この方法を利用して誘導肝細胞様細胞の作製に成功している6)(新着論文レビュー でも掲載).しかしながら,ダイレクトリプログラミング法を用いて腸前駆細胞や腸幹細胞を作製できるかどうかは不明であった.ダイレクトリプログラミングにより誘導腸前駆細胞や誘導腸幹細胞を作製できれば,生体の腸細胞や多能性幹細胞から作製した腸幹細胞に代わる新たな材料になる.この研究においては,腸前駆細胞の分化を誘導する転写因子を同定し,マウスの線維芽細胞から腸前駆細胞および腸幹細胞への分化を誘導した.
以前の研究において,筆者らは,マウス胎仔線維芽細胞に2つの転写因子Hnf4αおよびFoxa3を導入することにより肝細胞様細胞の分化を誘導した.肝細胞様細胞の分化の誘導に用いた転写因子は腸上皮細胞においても発現しており,また,マイクロアレイ法による誘導肝細胞様細胞の解析において,腸上皮細胞に特異的ないくつかの遺伝子の発現が確認された.そこで,腸幹細胞のマーカーであるLgr5の発現を可視化できるマウスに由来する胎仔線維芽細胞においてHnf4αおよびFoxa3を導入し,腸幹細胞の維持に必要なEGF,Noggin,R-spondin1にWnt3aおよびCHIR99021をくわえた培地において3次元培養した.その結果,ごく少数の胎仔型オルガノイドが形成されたが,成体型オルガノイドは形成されず,Lgr5を発現するオルガノイドも観察されなかった.このことから,ダイレクトリプログラミング法による腸前駆細胞への分化の誘導には肝細胞様細胞の分化を誘導する転写因子だけでは不十分であり,さらにほかの転写因子が必要であると考えられた.
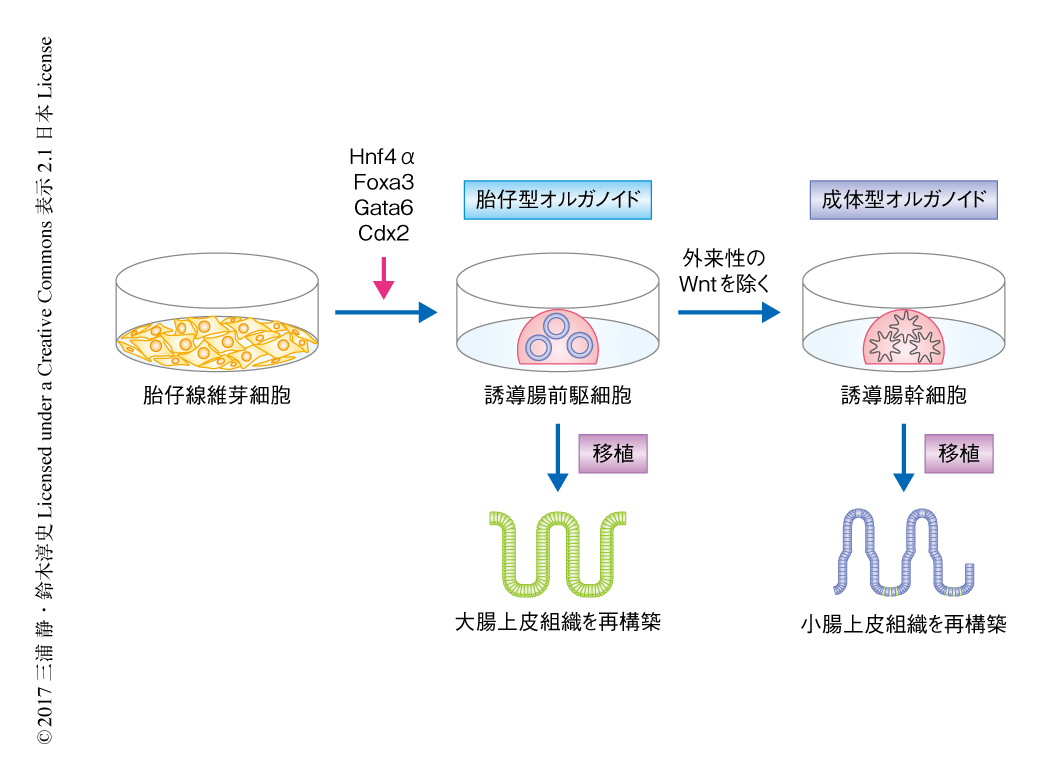
そこで,腸上皮細胞において高発現し腸の形態形成に必要な転写因子であるGata6およびCdx2に着目した.Hnf4αとFoxa3にGata6とCdx2をくわえた4つの転写因子の組合せをマウス胎仔線維芽細胞に導入し3次元培養したところ,胎生13.5日のマウスの腸上皮細胞を単離して培養したときと同様に,胎仔型オルガノイドおよび少数の成体型オルガノイドが形成され,これらはLgr5陽性細胞を含んでいた.腸前駆細胞に由来する胎仔型オルガノイドは継代の途中で外来性のWntの刺激を除くことにより成体型オルガノイドへと成長することが知られている.同様に,4つの転写因子を導入して形成された胎仔型オルガノイドにおいても,継代の途中で外来性のWntの刺激を除いたところ,すべての胎仔型オルガノイドが成体型オルガノイドへと成長した.一方,Gata6を除いた3つの転写因子の組合せにおいては,形成された胎仔型オルガノイドおよび成体型オルガノイドの数は少なく,Lgr5陽性細胞を含むオルガノイドもほとんど観察されなかった.また,Cdx2を除いた3つの転写因子の組合せにおいても胎仔型オルガノイドおよび成体型オルガノイドが形成されたが,それらの数は4つの転写因子により分化を誘導した場合より少なく,Lgr5陽性細胞を含むオルガノイドの数も少なかった.また,継代の途中で外来性のWntのシグナルを除いても胎仔型オルガノイドから成体型オルガノイドへと成長はしなかった.このことから,Gata6およびCdx2はマウス胎仔線維芽細胞からの胎仔型オルガノイドおよび成体型オルガノイドの形成に必要であり,胎仔線維芽細胞からLgr5陽性細胞への転換に重要な役割をはたすことが示唆された.
マウス胎仔線維芽細胞に4つの転写因子を導入して分化を誘導した腸前駆細胞に由来する胎仔型オルガノイドおよび成体型オルガノイドを免疫染色したところ,腸上皮細胞において発現するEカドヘリンおよびKlf5を発現していた.また,マイクロアレイ法により遺伝子の発現を網羅的に解析した結果,腸前駆細胞に由来する胎仔型オルガノイドとよく似た遺伝子発現パターンを示した.このように,マウス胎仔線維芽細胞にHnf4α,Foxa3,Gata6,Cdx2の4つの転写因子を導入することにより腸前駆細胞と同様の性質をもつ誘導腸前駆細胞が作製され(図1),誘導腸前駆細胞から形成された胎仔型オルガノイドおよび成体型オルガノイドは腸前駆細胞に由来する胎仔型オルガノイドおよび成体型オルガノイドとよく似ていた.
継代の途中にWntの刺激を除くことにより成長した誘導腸前駆細胞に由来する成体型オルガノイドの特徴について調べるため,成体の腸の陰窩から作製した成体型オルガノイドと比較した.免疫染色の結果,誘導腸前駆細胞に由来する成体型オルガノイドは,陰窩に由来する成体型オルガノイドと同様に,EカドヘリンやEzrinといった極性マーカーを発現しており上皮細胞の特徴である極性をもつことがわかった.さらに,誘導腸前駆細胞に由来する成体型オルガノイドには,ビリン陽性の吸収上皮細胞,リゾチーム陽性のパネート細胞,chromogranin A陽性の内分泌細胞,Muc2陽性の杯細胞に分化した細胞も存在した.陰窩様の構造には腸幹細胞や腸前駆細胞のマーカーであるSox9やEphB2を発現する細胞が観察され,Ki67陽性の増殖している細胞も確認されたことから,誘導腸前駆細胞に由来する成体型オルガノイドは腸幹細胞を含む可能性が示唆された.
腸幹細胞の特徴である自己複製能について調べた.誘導腸前駆細胞に由来する陰窩様の構造を継代培養し,7日後に成体型オルガノイドおよび陰窩様の構造を計数した結果,成体型オルガノイドの数は播種した陰窩様の構造の数とほぼ同じであり,陰窩様の構造の数は6.4~13.2倍に増加していた.このことから,播種したほとんどの陰窩様の構造から成体型オルガノイドが形成され,かつ,腸幹細胞のマーカーを発現する細胞を含む陰窩様の構造は増殖していることがわかった.以上の結果より,誘導腸前駆細胞から形成された成体型オルガノイドには自己複製の可能な腸幹細胞が含まれることが示され,これを誘導腸幹細胞と名づけた.
障害をうけた大腸に腸前駆細胞を移植すると大腸上皮組織が再構築されることが知られている2).また,腸幹細胞を移植すると大腸組織に陰窩および絨毛をもつ小腸上皮組織が再構築される4).そこで,誘導腸前駆細胞および誘導腸幹細胞が,それぞれ,大腸上皮組織および小腸上皮組織を再構築するかどうか調べた.誘導腸前駆細胞および誘導腸幹細胞をそれぞれ大腸炎のモデルマウスに移植し3カ月後に解析したところ,腸前駆細胞や腸幹細胞と同様に,大腸上皮組織および小腸上皮組織が再構築されていた(図1).誘導腸前駆細胞あるいは誘導腸幹細胞が生着した腸上皮組織においては,ビリン陽性の吸収上皮細胞,chromogranin A陽性の内分泌細胞,Muc2陽性の杯細胞が観察され,陰窩の部分にはSox9やEphB2といった腸幹細胞のマーカーが発現していた.さらに,誘導腸前駆細胞を移植したマウスは胎仔線維芽細胞を移植したマウスよりも体重の回復が速かったことから,誘導腸前駆細胞および誘導腸幹細胞は障害をうけた大腸上皮組織を機能的に再構築することが示された.
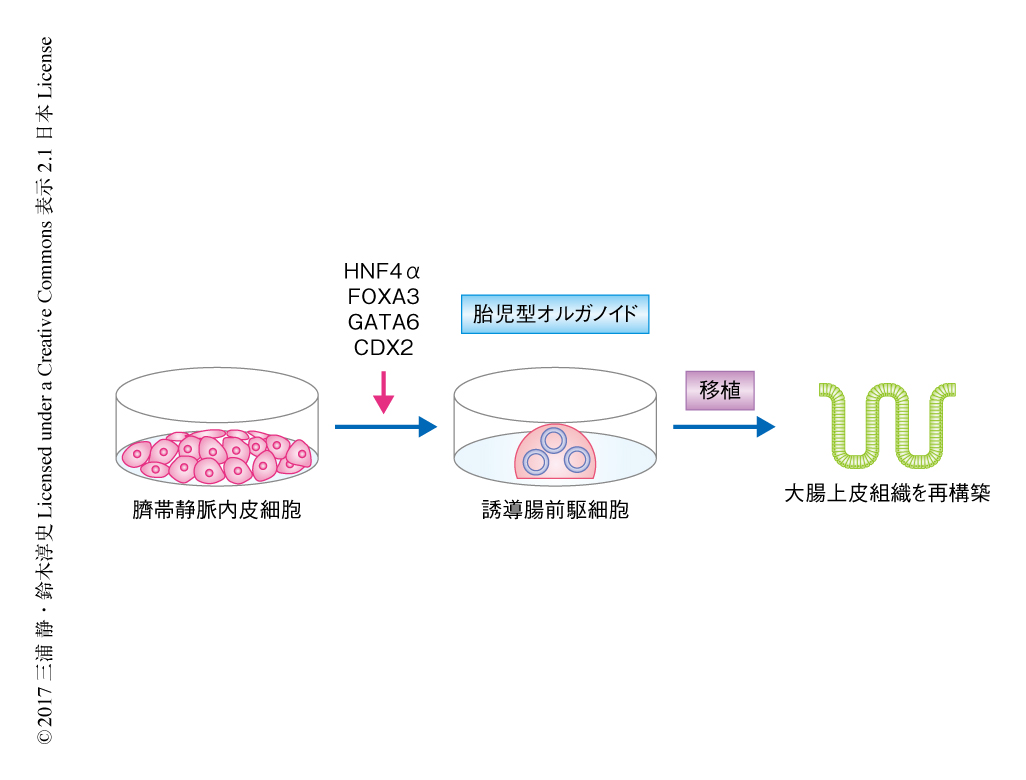
マウスの誘導腸前駆細胞の作製に用いた4つの転写因子をヒトの臍帯静脈内皮細胞に導入することにより,ヒトにおいて腸前駆細胞の分化の誘導を試みた.その結果,ヒトの胎児に由来する腸前駆細胞と同様に胎児型オルガノイドが形成され,3次元培養により少なくとも6カ月にわたり維持された.しかしながら,マウスの腸前駆細胞や誘導腸前駆細胞とは異なり,外来性のWntの刺激を除いてもヒトの誘導腸前駆細胞およびヒトの胎児に由来する腸前駆細胞において成体型オルガノイドは形成されなかった.長期間にわたり培養したヒトの誘導腸前駆細胞に由来する胎児型オルガノイドの性状を解析したところ,ヒトの腸前駆細胞に由来する胎児型オルガノイドと同様に,上皮細胞の特徴である極性をもち,EカドヘリンやKlf5といった腸上皮細胞のマーカーを発現する細胞から構成されていた.さらに,ヒトの誘導腸前駆細胞に由来する胎児型オルガノイドを大腸炎のモデルマウスに移植したところ大腸上皮組織が再構築された.このように,ヒトの臍帯静脈内皮細胞にHnf4α,Foxa3,Gata6,Cdx2の4つの転写因子を導入することにより誘導腸前駆細胞が作製された(図2).
この研究においては,4つの転写因子を組み合わせて導入することにより,マウスの胎仔線維芽細胞やヒトの臍帯静脈内皮細胞を誘導腸前駆細胞へと分化させることに成功した.また,マウスの誘導腸前駆細胞に由来する胎仔型オルガノイドは成体型オルガノイドへと成長し,成体型オルガノイドは誘導腸幹細胞および誘導腸幹細胞から分化した腸上皮細胞から形成されていた.ダイレクトリプログラミング法により腸前駆細胞および腸幹細胞の分化が誘導されたことにより,生体の腸上皮組織や多能性幹細胞に代わる新たな腸上皮オルガノイドの材料の取得が可能になった.今後は,ヒトの胎児型オルガノイドを成体型オルガノイドへと成長させる方法を確立するとともに,成人の細胞からヒトの誘導腸前駆細胞を作製することにより,創薬や移植医療への応用に貢献したいと考えている.
略歴:九州大学大学院医学研究院博士課程 在学中.
研究テーマ:細胞のリプログラミング.肝臓や腸の発生および再生.
抱負:臨床応用にむけてヒトの誘導腸前駆細胞の研究を発展させたい.
鈴木 淳史(Atsushi Suzuki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/orgreg/
© 2017 三浦 静・鈴木淳史 Licensed under CC 表示 2.1 日本
(九州大学生体防御医学研究所 器官発生再生学分野)
email:三浦 静,鈴木淳史
DOI: 10.7875/first.author.2017.111
Generation of mouse and human organoid-forming intestinal progenitor cells by direct lineage reprogramming.
Shizuka Miura, Atsushi Suzuki
Cell Stem Cell, 21, 456-471.e5 (2017)
要 約
この研究において,筆者らは,iPS細胞をへず直接的に細胞の分化を転換するダイレクトリプログラミング法を用いて,マウスの胎仔線維芽細胞にHnf4α,Foxa3,Gata6,Cdx2という4つの転写因子を導入することにより胎仔の腸前駆細胞と同様の性質をもつ細胞の分化を誘導させることに成功した.この誘導腸前駆細胞は胎仔型オルガノイドを形成し,腸幹細胞を含む成体型オルガノイドへと成長した.分化された腸幹細胞は4種類の腸上皮細胞に分化する多分化能をもち,かつ,長期間にわたり自己と同じ細胞をつくりつづける自己複製能をもっていた.また,これらのオルガノイドを大腸炎のモデルマウスに移植したところ,小腸上皮組織および大腸上皮組織が再構築された.さらに,この4つの転写因子の導入により,ヒトにおいても腸前駆細胞の分化が誘導された.ダイレクトリプログラミング法により作製された腸上皮のオルガノイドは,創薬や移植医療への応用が期待される.
はじめに
哺乳類の成体の小腸上皮組織は陰窩および絨毛の2つのドメインから構成される.陰窩の底部には自己複製能をもつ腸幹細胞が存在する1).腸幹細胞はパネート細胞,吸収上皮細胞,内分泌細胞,杯細胞に分化し,絨毛の上部へと移動する.一方,胎仔の腸は高い増殖能をもつ細胞を含むが,成体の腸とは異なり陰窩はなく,機能的に分化した細胞も少ない2).
腸幹細胞は,EGF,Noggin,R-spondin1を含むマトリゲルにおける3次元培養により陰窩および絨毛をもつ3次元の組織構造体を形成する.この腸上皮組織様の構造は成体型オルガノイドとよばれ,継代により長期間にわたり培養および維持される3).また,成体型オルガノイドを大腸炎のモデルマウスに移植すると,大腸組織に陰窩および絨毛をもつ小腸上皮組織を再構築する4).一方,胎仔の腸前駆細胞は3次元培養により1層からなる陰窩をもたないオルガノイドを形成する.この球状の胎仔型オルガノイドは外来性のWntの刺激により成体型オルガノイドになるが,継代の途中で外来性のWntを除くことにより成体型オルガノイドへの成長は促進される2).胎仔型オルガノイドは大腸炎のモデルマウスに移植すると障害をうけた大腸上皮組織を再構築する2).これらのことから,腸上皮のオルガノイドは腸疾患の研究や移植医療に有用であると考えられる.しかしながら,腸上皮のオルガノイドの材料となる腸の組織片を成人のドナーや胎児から採取することはむずかしい.
腸組織に由来するオルガノイドの代わりとして,近年,多能性幹細胞を用いて腸上皮のオルガノイドを作製する研究が進められている.多能性幹細胞から作製する場合には,腸上皮細胞のほか間葉系の細胞も同時に作製することが可能であり,実際の腸組織と似た構造体を作製できる5).しかしながら,多能性幹細胞から腸細胞へと分化を誘導するには複雑な工程をへる必要があり作製に時間もかかる.さらに,未分化な細胞が残存していた場合には腫瘍が形成されるリスクがある.
最近の研究により,ダイレクトリプログラミング法という技術を利用して,未分化な状態をへず分化した細胞から直接的にほかの細胞へと分化を転換させることが可能になり,この方法を用いてさまざまな種類の細胞や前駆細胞が作製されるようになった.筆者らも,この方法を利用して誘導肝細胞様細胞の作製に成功している6)(新着論文レビュー でも掲載).しかしながら,ダイレクトリプログラミング法を用いて腸前駆細胞や腸幹細胞を作製できるかどうかは不明であった.ダイレクトリプログラミングにより誘導腸前駆細胞や誘導腸幹細胞を作製できれば,生体の腸細胞や多能性幹細胞から作製した腸幹細胞に代わる新たな材料になる.この研究においては,腸前駆細胞の分化を誘導する転写因子を同定し,マウスの線維芽細胞から腸前駆細胞および腸幹細胞への分化を誘導した.
1.特定の転写因子を用いてマウスの線維芽細胞から誘導腸前駆細胞を作製する
以前の研究において,筆者らは,マウス胎仔線維芽細胞に2つの転写因子Hnf4αおよびFoxa3を導入することにより肝細胞様細胞の分化を誘導した.肝細胞様細胞の分化の誘導に用いた転写因子は腸上皮細胞においても発現しており,また,マイクロアレイ法による誘導肝細胞様細胞の解析において,腸上皮細胞に特異的ないくつかの遺伝子の発現が確認された.そこで,腸幹細胞のマーカーであるLgr5の発現を可視化できるマウスに由来する胎仔線維芽細胞においてHnf4αおよびFoxa3を導入し,腸幹細胞の維持に必要なEGF,Noggin,R-spondin1にWnt3aおよびCHIR99021をくわえた培地において3次元培養した.その結果,ごく少数の胎仔型オルガノイドが形成されたが,成体型オルガノイドは形成されず,Lgr5を発現するオルガノイドも観察されなかった.このことから,ダイレクトリプログラミング法による腸前駆細胞への分化の誘導には肝細胞様細胞の分化を誘導する転写因子だけでは不十分であり,さらにほかの転写因子が必要であると考えられた.
そこで,腸上皮細胞において高発現し腸の形態形成に必要な転写因子であるGata6およびCdx2に着目した.Hnf4αとFoxa3にGata6とCdx2をくわえた4つの転写因子の組合せをマウス胎仔線維芽細胞に導入し3次元培養したところ,胎生13.5日のマウスの腸上皮細胞を単離して培養したときと同様に,胎仔型オルガノイドおよび少数の成体型オルガノイドが形成され,これらはLgr5陽性細胞を含んでいた.腸前駆細胞に由来する胎仔型オルガノイドは継代の途中で外来性のWntの刺激を除くことにより成体型オルガノイドへと成長することが知られている.同様に,4つの転写因子を導入して形成された胎仔型オルガノイドにおいても,継代の途中で外来性のWntの刺激を除いたところ,すべての胎仔型オルガノイドが成体型オルガノイドへと成長した.一方,Gata6を除いた3つの転写因子の組合せにおいては,形成された胎仔型オルガノイドおよび成体型オルガノイドの数は少なく,Lgr5陽性細胞を含むオルガノイドもほとんど観察されなかった.また,Cdx2を除いた3つの転写因子の組合せにおいても胎仔型オルガノイドおよび成体型オルガノイドが形成されたが,それらの数は4つの転写因子により分化を誘導した場合より少なく,Lgr5陽性細胞を含むオルガノイドの数も少なかった.また,継代の途中で外来性のWntのシグナルを除いても胎仔型オルガノイドから成体型オルガノイドへと成長はしなかった.このことから,Gata6およびCdx2はマウス胎仔線維芽細胞からの胎仔型オルガノイドおよび成体型オルガノイドの形成に必要であり,胎仔線維芽細胞からLgr5陽性細胞への転換に重要な役割をはたすことが示唆された.
マウス胎仔線維芽細胞に4つの転写因子を導入して分化を誘導した腸前駆細胞に由来する胎仔型オルガノイドおよび成体型オルガノイドを免疫染色したところ,腸上皮細胞において発現するEカドヘリンおよびKlf5を発現していた.また,マイクロアレイ法により遺伝子の発現を網羅的に解析した結果,腸前駆細胞に由来する胎仔型オルガノイドとよく似た遺伝子発現パターンを示した.このように,マウス胎仔線維芽細胞にHnf4α,Foxa3,Gata6,Cdx2の4つの転写因子を導入することにより腸前駆細胞と同様の性質をもつ誘導腸前駆細胞が作製され(図1),誘導腸前駆細胞から形成された胎仔型オルガノイドおよび成体型オルガノイドは腸前駆細胞に由来する胎仔型オルガノイドおよび成体型オルガノイドとよく似ていた.
2.誘導腸前駆細胞に由来する成体型オルガノイドの性状の解析
継代の途中にWntの刺激を除くことにより成長した誘導腸前駆細胞に由来する成体型オルガノイドの特徴について調べるため,成体の腸の陰窩から作製した成体型オルガノイドと比較した.免疫染色の結果,誘導腸前駆細胞に由来する成体型オルガノイドは,陰窩に由来する成体型オルガノイドと同様に,EカドヘリンやEzrinといった極性マーカーを発現しており上皮細胞の特徴である極性をもつことがわかった.さらに,誘導腸前駆細胞に由来する成体型オルガノイドには,ビリン陽性の吸収上皮細胞,リゾチーム陽性のパネート細胞,chromogranin A陽性の内分泌細胞,Muc2陽性の杯細胞に分化した細胞も存在した.陰窩様の構造には腸幹細胞や腸前駆細胞のマーカーであるSox9やEphB2を発現する細胞が観察され,Ki67陽性の増殖している細胞も確認されたことから,誘導腸前駆細胞に由来する成体型オルガノイドは腸幹細胞を含む可能性が示唆された.
腸幹細胞の特徴である自己複製能について調べた.誘導腸前駆細胞に由来する陰窩様の構造を継代培養し,7日後に成体型オルガノイドおよび陰窩様の構造を計数した結果,成体型オルガノイドの数は播種した陰窩様の構造の数とほぼ同じであり,陰窩様の構造の数は6.4~13.2倍に増加していた.このことから,播種したほとんどの陰窩様の構造から成体型オルガノイドが形成され,かつ,腸幹細胞のマーカーを発現する細胞を含む陰窩様の構造は増殖していることがわかった.以上の結果より,誘導腸前駆細胞から形成された成体型オルガノイドには自己複製の可能な腸幹細胞が含まれることが示され,これを誘導腸幹細胞と名づけた.
3.誘導腸前駆細胞および誘導腸幹細胞は障害をうけた大腸上皮組織および小腸上皮組織を再構築する
障害をうけた大腸に腸前駆細胞を移植すると大腸上皮組織が再構築されることが知られている2).また,腸幹細胞を移植すると大腸組織に陰窩および絨毛をもつ小腸上皮組織が再構築される4).そこで,誘導腸前駆細胞および誘導腸幹細胞が,それぞれ,大腸上皮組織および小腸上皮組織を再構築するかどうか調べた.誘導腸前駆細胞および誘導腸幹細胞をそれぞれ大腸炎のモデルマウスに移植し3カ月後に解析したところ,腸前駆細胞や腸幹細胞と同様に,大腸上皮組織および小腸上皮組織が再構築されていた(図1).誘導腸前駆細胞あるいは誘導腸幹細胞が生着した腸上皮組織においては,ビリン陽性の吸収上皮細胞,chromogranin A陽性の内分泌細胞,Muc2陽性の杯細胞が観察され,陰窩の部分にはSox9やEphB2といった腸幹細胞のマーカーが発現していた.さらに,誘導腸前駆細胞を移植したマウスは胎仔線維芽細胞を移植したマウスよりも体重の回復が速かったことから,誘導腸前駆細胞および誘導腸幹細胞は障害をうけた大腸上皮組織を機能的に再構築することが示された.
4.ヒトにおける誘導腸前駆細胞の作製
マウスの誘導腸前駆細胞の作製に用いた4つの転写因子をヒトの臍帯静脈内皮細胞に導入することにより,ヒトにおいて腸前駆細胞の分化の誘導を試みた.その結果,ヒトの胎児に由来する腸前駆細胞と同様に胎児型オルガノイドが形成され,3次元培養により少なくとも6カ月にわたり維持された.しかしながら,マウスの腸前駆細胞や誘導腸前駆細胞とは異なり,外来性のWntの刺激を除いてもヒトの誘導腸前駆細胞およびヒトの胎児に由来する腸前駆細胞において成体型オルガノイドは形成されなかった.長期間にわたり培養したヒトの誘導腸前駆細胞に由来する胎児型オルガノイドの性状を解析したところ,ヒトの腸前駆細胞に由来する胎児型オルガノイドと同様に,上皮細胞の特徴である極性をもち,EカドヘリンやKlf5といった腸上皮細胞のマーカーを発現する細胞から構成されていた.さらに,ヒトの誘導腸前駆細胞に由来する胎児型オルガノイドを大腸炎のモデルマウスに移植したところ大腸上皮組織が再構築された.このように,ヒトの臍帯静脈内皮細胞にHnf4α,Foxa3,Gata6,Cdx2の4つの転写因子を導入することにより誘導腸前駆細胞が作製された(図2).
おわりに
この研究においては,4つの転写因子を組み合わせて導入することにより,マウスの胎仔線維芽細胞やヒトの臍帯静脈内皮細胞を誘導腸前駆細胞へと分化させることに成功した.また,マウスの誘導腸前駆細胞に由来する胎仔型オルガノイドは成体型オルガノイドへと成長し,成体型オルガノイドは誘導腸幹細胞および誘導腸幹細胞から分化した腸上皮細胞から形成されていた.ダイレクトリプログラミング法により腸前駆細胞および腸幹細胞の分化が誘導されたことにより,生体の腸上皮組織や多能性幹細胞に代わる新たな腸上皮オルガノイドの材料の取得が可能になった.今後は,ヒトの胎児型オルガノイドを成体型オルガノイドへと成長させる方法を確立するとともに,成人の細胞からヒトの誘導腸前駆細胞を作製することにより,創薬や移植医療への応用に貢献したいと考えている.
文 献
- Baker, N., van Es, J. H., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
- Fordham, R. P., Yui, S., Hannan, N. R. et al.: Transplantation of expanded fetal intestinal progenitors contributes to colon regeneration after injury. Cell Stem Cell, 13, 734-744 (2013)[PubMed]
- Sato, T., Vries, R. G., Snippert, H. J. et al.: Single Lgr5 stem cells build crypt- villus structures in vitro without a mesenchymal niche. Nature, 459, 262-265 (2009)[PubMed]
- Fukuda, M., Mizutani, T., Mochizuki, W. et al.: Small intestinal stem cell identity is maintained with functional Paneth cells in heterotopically grafted epithelium onto the colon. Genes Dev., 28, 1752-1757 (2014)[PubMed]
- Spence, J. R., Mayhew, C. N., Rankin, S. A. et al.: Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature, 470, 105-109 (2011)[PubMed]
- Sekiya, S. & Suzuki, A.: Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors. Nature, 475, 390-393 (2011)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:九州大学大学院医学研究院博士課程 在学中.
研究テーマ:細胞のリプログラミング.肝臓や腸の発生および再生.
抱負:臨床応用にむけてヒトの誘導腸前駆細胞の研究を発展させたい.
鈴木 淳史(Atsushi Suzuki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/orgreg/
© 2017 三浦 静・鈴木淳史 Licensed under CC 表示 2.1 日本