マウスの皮膚細胞から肝細胞を直接作製することに成功
鈴木淳史・関谷明香
(九州大学生体防御医学研究所 器官発生再生学分野)
email:鈴木淳史
DOI: 10.7875/first.author.2011.114
Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors.
Sayaka Sekiya, Atsushi Suzuki
Nature, 475, 390-393 (2011)
われわれのからだを構成する細胞は場所や時間に依存した厳格な運命決定をうけ,それぞれが決まった組織や器官を形成し個体の恒常性を保つようにはたらく.肝臓を構成する肝細胞もその例にもれず,発生期に肝前駆細胞から生まれて肝臓をつくりだす.しかしながら奇妙なことに,肝細胞以外の細胞が特殊な刺激をうけて肝細胞になったり,肝細胞と融合することで肝細胞に変化したりすることがある.これらの現象は,肝細胞以外の細胞を肝細胞に変えることが可能な,肝細胞の運命決定因子の存在を示唆している.この研究では,このような肝細胞の運命を決定する特定のタンパク質を同定し,肝細胞以外の細胞を人為的に肝細胞へと変化させることを試みた.その結果,Hnf4αとFoxa(Foxa1,Foxa2,Foxa3のいずれかひとつ)という肝細胞の分化に関連した2つの転写因子を導入することで,マウス胎仔あるいは成体マウスの皮膚細胞を肝細胞と非常によく似た細胞へと直接に変化させることに成功し,この細胞をiHep細胞(induced hepatocyte-like cell)と名付けた.iHep細胞は肝細胞と同じ形態的および機能的な特徴をもち,肝臓へ移植すると肝細胞として障害をうけた肝臓組織を機能的に再構築することが可能であった.この研究の成果は,肝細胞の運命決定機構の理解や肝疾患に対する新しい治療法の開発に貢献するものと期待される.
肝細胞は肝臓の80%近くをしめる細胞であり,代謝や解毒など重要な役割を担っている.肝細胞は多くの転写因子のはたらきにより発生期に肝前駆細胞から分化するのが普通だが,まれに,障害をうけた膵臓の外分泌細胞や骨髄などに含まれる間葉系幹細胞から分化することがある1,2).また,骨髄移植ののち血液細胞が肝細胞と融合し肝細胞として肝臓組織を構築することもある3,4).これらの事象は,肝細胞以外の細胞を肝細胞に変化させる運命決定因子の存在を示唆しており,ある環境ではそれらが活性化して肝細胞以外の細胞を肝細胞へと変化させているものと考えられる.
最近になって,細胞の周辺環境や遺伝子発現パターンに人為的な操作をくわえることで,その細胞がおかれた分化状態を強制的に変更してまったく別の性質をもった細胞を生み出せることが明らかになった.この現象はダイレクトリプログラミングとよばれ,これまで,皮膚から抽出した線維芽細胞を神経系細胞や血液系細胞などへ直接に変化させることが可能になっている5,6).したがって,肝細胞の運命決定因子を同定することができれば,それらを使って線維芽細胞を肝細胞へと直接に変化させることができるかもしれない.そこでこの研究では,肝細胞の運命決定因子を同定し,皮膚の線維芽細胞から肝細胞を直接作製することを試みた.このようなダイレクトリプログラミング法とは異なり,線維芽細胞の分化状態を白紙にもどすかたちで作製されたのがiPS細胞(人工多能性幹細胞)である7).再生医療の実現にむけた潮流のなかでiPS細胞が重要な位置をしめることはいうまでもないが,iPS細胞そのものには腫瘍形成の危険があり,また,iPS細胞から目的の細胞をねらって分化させることはまだむずかしく,さらなる研究が必要といえる.これに対し,ダイレクトリプログラミング法により線維芽細胞から目的の細胞を直接作製することができれば,iPS細胞のかかえる重要な問題のいくつかを解消することができると考えられる.
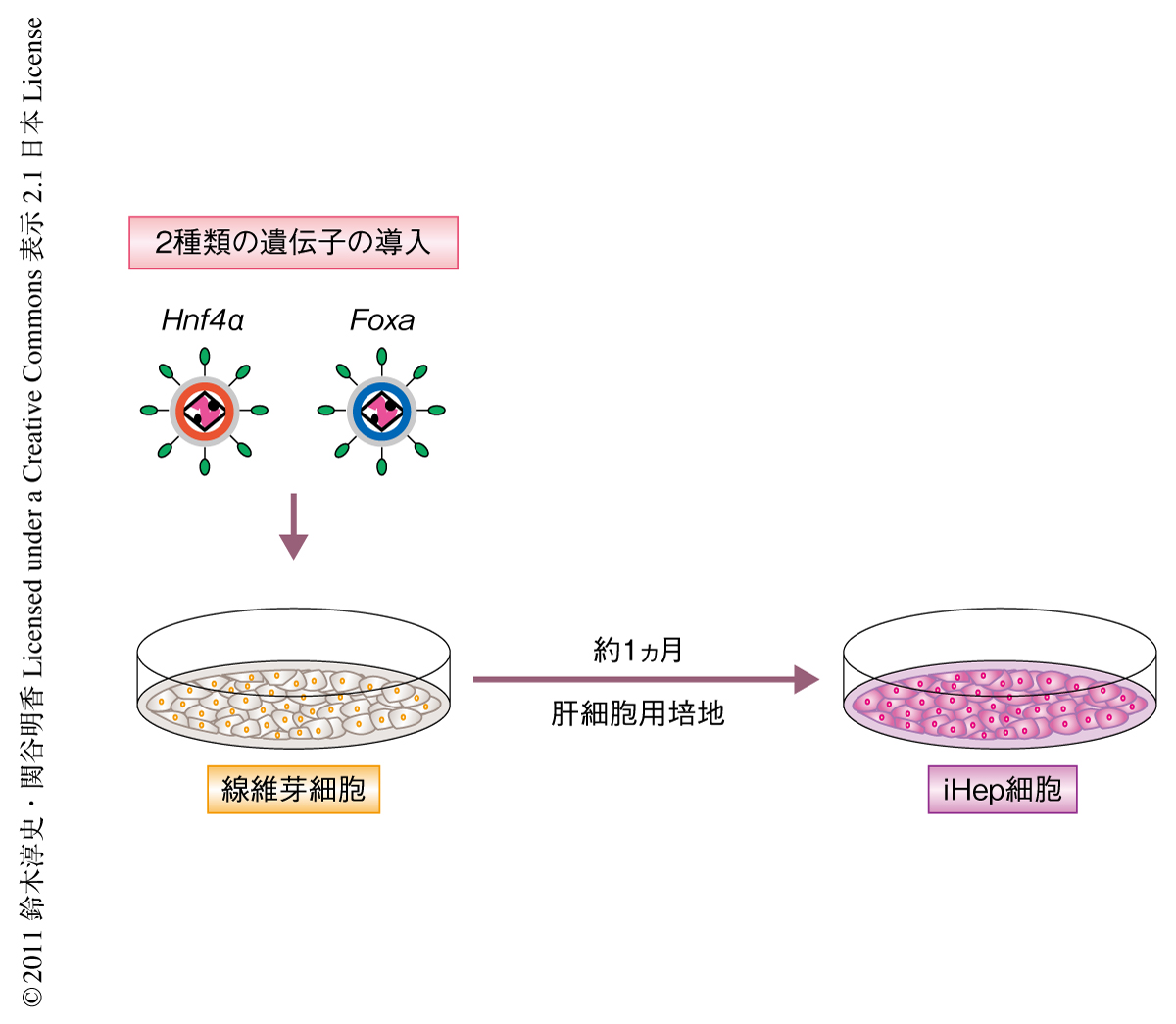
肝細胞の運命決定因子をスクリーニングするために,肝臓の発生過程において肝細胞の分化に関連する12個の転写因子に着目した.レトロウイルスを用いてこれら12因子を同時にマウス胎仔線維芽細胞に導入すると,肝細胞のマーカーであるアルブミンやαフェトプロテイン,および,上皮細胞のマーカーであるEカドヘリンの発現が強く誘導された.そこで,12因子のうち必須のものを抽出するため,12因子からそれぞれ1因子を除いたレトロウイルスを用意して解析を行った.その結果,12因子のうちHnf4αを除いたときのみ肝細胞マーカーの発現誘導が強く阻害されることが判明した.そこで,Hnf4αとそのほかの1因子のあわせて2因子をマウス胎仔線維芽細胞に導入したところ,Hnf4αとFoxa1,Hnf4αとFoxa2,Hnf4αとFoxa3の3つの組合せにおいてのみ,肝細胞マーカーや上皮細胞マーカーの発現が強く誘導された.さらに,これらの2因子を導入したマウス胎仔線維芽細胞をコラーゲンや肝細胞増殖因子とともに培養すると,およそ1カ月後にはマウス胎仔線維芽細胞が上皮様の形態をもつ細胞へと変化することが明らかになり,この細胞をiHep細胞(induced hepatocyte-like cell)と名づけた(図1).この方法では約0.3%のマウス胎仔線維芽細胞がiHep細胞へと変化し,作製されたiHep細胞は正常な核型をもったまま増殖させることが可能であった.
マウス胎仔線維芽細胞から作製されたiHep細胞はそのほとんどがEカドヘリンおよびアルブミンに陽性であった.また,iHep細胞はグリコーゲンの蓄積や低比重リポタンパク質(LDL)の取り込み,アルブミンの分泌,アンモニアの代謝と尿素の合成,シトクロムP450の活性,インドシアニングリーンの取り込みと排出,脂質代謝,薬物代謝など,肝細胞に特有の機能をもっており,肝細胞と同様に細胞のあいだをタイトジャンクションで連結し毛細胆管を形成していた.さらに,iHep細胞には肝機能を発揮する一連の酵素をコードする遺伝子も発現していた.以上から,iHep細胞は肝細胞と同じ形態的および機能的な特徴をもつことが明らかになった.
肝機能不全で死にいたる高チロシン血症モデルマウスの肝臓に対し正常マウスから取得した肝細胞を移植すると,その肝細胞は損傷をうけた肝臓組織を機能的に再構築しマウスの命を救うことができる.そこで,iHep細胞を高チロシン血症モデルマウスの肝臓へ移植し,iHep細胞が肝細胞として機能するかどうかを調べた.その結果,iHep細胞は損傷をうけた高チロシン血症モデルマウスの肝臓組織を再構築し,肝機能を補助することでマウスの致死率を大幅に減少させることができた.このとき,iHep細胞と高チロシン血症モデルマウスの肝細胞とのあいだで細胞融合はみられなかったことから,iHep細胞そのものが肝細胞として機能していたことがわかった.また,iHep細胞は肝臓において増殖し肝組織を再構築するが,移植の2カ月あとには通常の肝細胞と同じく増殖を停止していた.興味深いことに,実験的に肝臓の一部を切除して肝再生を誘導すると,iHep細胞も肝細胞と同様に再生シグナルに応答して増殖を活性化することも判明した.以上から,iHep細胞は生体において肝細胞として成熟し,損傷をうけた肝臓組織を機能的に再構築することが可能であることが証明された.
iHep細胞を用いた治療モデルの可能性を検証するため,高チロシン血症モデルマウスに由来する胎仔線維芽細胞から作製したiHep細胞に対して欠損した遺伝子を導入し,遺伝的な肝機能疾患の治療を行った.そののち,このiHep細胞を高チロシン血症モデルマウスの肝臓に移植したところ,移植したiHep細胞は正常な細胞と同じように損傷をうけた肝臓組織を再構築することが可能であった.この結果は,遺伝的な肝疾患をもつ患者自身の線維芽細胞からiHep細胞を作製し,体外における遺伝子治療をへて肝臓へ移植することで,肝臓を機能的に再生させ治療するという新しい治療モデルを提示している.
以上に述べたように,マウス胎仔線維芽細胞からiHep細胞を作製することに成功したことから,つづいて,成体マウスの皮膚から抽出した線維芽細胞からもiHep細胞の作製を試みた.その結果,マウス胎仔に由来する線維芽細胞と同様に,成体マウスの皮膚から抽出した線維芽細胞に対してもHnf4αとFoxa(Foxa1,Foxa2,Foxa3のいずれかひとつ)を導入することで肝細胞と同じ形態的および機能的な特徴をもつiHep細胞を作製することができた.また,これら成体マウスに由来するiHep細胞は,高チロシン血症モデルマウスの肝臓へ移植することで損傷をうけた肝臓組織を再構築することも可能であった.
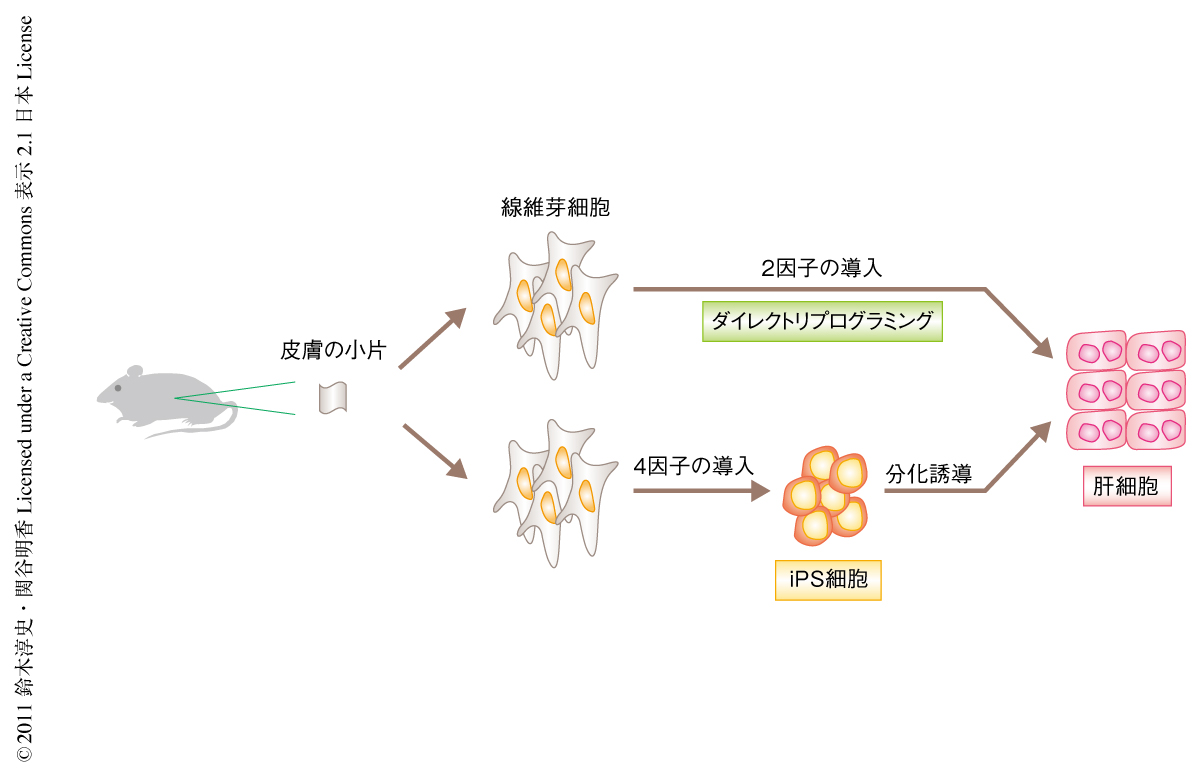
この研究では,たった2つの転写因子を線維芽細胞に発現させるだけで,iPS細胞を経由することなく線維芽細胞から肝細胞を直接作製することに成功した(図2).これら2つの転写因子は肝細胞の運命を決定する“コア転写因子”と考えられ,肝細胞の分化を促す複雑な転写因子ネットワークの根幹に位置するものと考えられる.2つの転写因子が細胞においてどのような変化をひき起こし細胞の運命転換を誘導して肝細胞をつくりだすのか,その分子機構は非常に興味深い.一方,この研究はヒトiHep細胞の作製にむけた基盤となることはいうまでもなく,ヒトでiHep細胞が作製されれば,肝疾患に対する細胞移植や人工肝臓への応用が期待できる.また,創薬研究において薬剤の効果や毒性を評価するためのツールとしてiHep細胞を利用することも十分に考えられる.
略歴:2003年 筑波大学大学院医学研究科 修了,同年 米国Salk Institute for Biological Studiesリサーチアソシエイト,2005年 理化学研究所発生・再生科学総合研究センター 研究員,2007年 九州大学生体防御医学研究所 特任准教授を経て,2011年より同 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:器官の発生や再生と疾患.
抱負:研究ができる喜びを忘れずに,おもしろいと思ってもらえる研究を研究室一丸となってつづけていく.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/orgreg/index.html
関谷 明香(Sayaka Sekiya)
九州大学生体防御医学研究所 テクニカルスタッフ.
© 2011 鈴木淳史・関谷明香 Licensed under CC 表示 2.1 日本
(九州大学生体防御医学研究所 器官発生再生学分野)
email:鈴木淳史
DOI: 10.7875/first.author.2011.114
Direct conversion of mouse fibroblasts to hepatocyte-like cells by defined factors.
Sayaka Sekiya, Atsushi Suzuki
Nature, 475, 390-393 (2011)
要 約
われわれのからだを構成する細胞は場所や時間に依存した厳格な運命決定をうけ,それぞれが決まった組織や器官を形成し個体の恒常性を保つようにはたらく.肝臓を構成する肝細胞もその例にもれず,発生期に肝前駆細胞から生まれて肝臓をつくりだす.しかしながら奇妙なことに,肝細胞以外の細胞が特殊な刺激をうけて肝細胞になったり,肝細胞と融合することで肝細胞に変化したりすることがある.これらの現象は,肝細胞以外の細胞を肝細胞に変えることが可能な,肝細胞の運命決定因子の存在を示唆している.この研究では,このような肝細胞の運命を決定する特定のタンパク質を同定し,肝細胞以外の細胞を人為的に肝細胞へと変化させることを試みた.その結果,Hnf4αとFoxa(Foxa1,Foxa2,Foxa3のいずれかひとつ)という肝細胞の分化に関連した2つの転写因子を導入することで,マウス胎仔あるいは成体マウスの皮膚細胞を肝細胞と非常によく似た細胞へと直接に変化させることに成功し,この細胞をiHep細胞(induced hepatocyte-like cell)と名付けた.iHep細胞は肝細胞と同じ形態的および機能的な特徴をもち,肝臓へ移植すると肝細胞として障害をうけた肝臓組織を機能的に再構築することが可能であった.この研究の成果は,肝細胞の運命決定機構の理解や肝疾患に対する新しい治療法の開発に貢献するものと期待される.
はじめに
肝細胞は肝臓の80%近くをしめる細胞であり,代謝や解毒など重要な役割を担っている.肝細胞は多くの転写因子のはたらきにより発生期に肝前駆細胞から分化するのが普通だが,まれに,障害をうけた膵臓の外分泌細胞や骨髄などに含まれる間葉系幹細胞から分化することがある1,2).また,骨髄移植ののち血液細胞が肝細胞と融合し肝細胞として肝臓組織を構築することもある3,4).これらの事象は,肝細胞以外の細胞を肝細胞に変化させる運命決定因子の存在を示唆しており,ある環境ではそれらが活性化して肝細胞以外の細胞を肝細胞へと変化させているものと考えられる.
最近になって,細胞の周辺環境や遺伝子発現パターンに人為的な操作をくわえることで,その細胞がおかれた分化状態を強制的に変更してまったく別の性質をもった細胞を生み出せることが明らかになった.この現象はダイレクトリプログラミングとよばれ,これまで,皮膚から抽出した線維芽細胞を神経系細胞や血液系細胞などへ直接に変化させることが可能になっている5,6).したがって,肝細胞の運命決定因子を同定することができれば,それらを使って線維芽細胞を肝細胞へと直接に変化させることができるかもしれない.そこでこの研究では,肝細胞の運命決定因子を同定し,皮膚の線維芽細胞から肝細胞を直接作製することを試みた.このようなダイレクトリプログラミング法とは異なり,線維芽細胞の分化状態を白紙にもどすかたちで作製されたのがiPS細胞(人工多能性幹細胞)である7).再生医療の実現にむけた潮流のなかでiPS細胞が重要な位置をしめることはいうまでもないが,iPS細胞そのものには腫瘍形成の危険があり,また,iPS細胞から目的の細胞をねらって分化させることはまだむずかしく,さらなる研究が必要といえる.これに対し,ダイレクトリプログラミング法により線維芽細胞から目的の細胞を直接作製することができれば,iPS細胞のかかえる重要な問題のいくつかを解消することができると考えられる.
1.肝細胞の運命決定因子の探索とマウス胎仔線維芽細胞からのiHep細胞の作製
肝細胞の運命決定因子をスクリーニングするために,肝臓の発生過程において肝細胞の分化に関連する12個の転写因子に着目した.レトロウイルスを用いてこれら12因子を同時にマウス胎仔線維芽細胞に導入すると,肝細胞のマーカーであるアルブミンやαフェトプロテイン,および,上皮細胞のマーカーであるEカドヘリンの発現が強く誘導された.そこで,12因子のうち必須のものを抽出するため,12因子からそれぞれ1因子を除いたレトロウイルスを用意して解析を行った.その結果,12因子のうちHnf4αを除いたときのみ肝細胞マーカーの発現誘導が強く阻害されることが判明した.そこで,Hnf4αとそのほかの1因子のあわせて2因子をマウス胎仔線維芽細胞に導入したところ,Hnf4αとFoxa1,Hnf4αとFoxa2,Hnf4αとFoxa3の3つの組合せにおいてのみ,肝細胞マーカーや上皮細胞マーカーの発現が強く誘導された.さらに,これらの2因子を導入したマウス胎仔線維芽細胞をコラーゲンや肝細胞増殖因子とともに培養すると,およそ1カ月後にはマウス胎仔線維芽細胞が上皮様の形態をもつ細胞へと変化することが明らかになり,この細胞をiHep細胞(induced hepatocyte-like cell)と名づけた(図1).この方法では約0.3%のマウス胎仔線維芽細胞がiHep細胞へと変化し,作製されたiHep細胞は正常な核型をもったまま増殖させることが可能であった.
2.iHep細胞の性状解析
マウス胎仔線維芽細胞から作製されたiHep細胞はそのほとんどがEカドヘリンおよびアルブミンに陽性であった.また,iHep細胞はグリコーゲンの蓄積や低比重リポタンパク質(LDL)の取り込み,アルブミンの分泌,アンモニアの代謝と尿素の合成,シトクロムP450の活性,インドシアニングリーンの取り込みと排出,脂質代謝,薬物代謝など,肝細胞に特有の機能をもっており,肝細胞と同様に細胞のあいだをタイトジャンクションで連結し毛細胆管を形成していた.さらに,iHep細胞には肝機能を発揮する一連の酵素をコードする遺伝子も発現していた.以上から,iHep細胞は肝細胞と同じ形態的および機能的な特徴をもつことが明らかになった.
3.iHep細胞による肝臓組織の再構築と肝機能の補助
肝機能不全で死にいたる高チロシン血症モデルマウスの肝臓に対し正常マウスから取得した肝細胞を移植すると,その肝細胞は損傷をうけた肝臓組織を機能的に再構築しマウスの命を救うことができる.そこで,iHep細胞を高チロシン血症モデルマウスの肝臓へ移植し,iHep細胞が肝細胞として機能するかどうかを調べた.その結果,iHep細胞は損傷をうけた高チロシン血症モデルマウスの肝臓組織を再構築し,肝機能を補助することでマウスの致死率を大幅に減少させることができた.このとき,iHep細胞と高チロシン血症モデルマウスの肝細胞とのあいだで細胞融合はみられなかったことから,iHep細胞そのものが肝細胞として機能していたことがわかった.また,iHep細胞は肝臓において増殖し肝組織を再構築するが,移植の2カ月あとには通常の肝細胞と同じく増殖を停止していた.興味深いことに,実験的に肝臓の一部を切除して肝再生を誘導すると,iHep細胞も肝細胞と同様に再生シグナルに応答して増殖を活性化することも判明した.以上から,iHep細胞は生体において肝細胞として成熟し,損傷をうけた肝臓組織を機能的に再構築することが可能であることが証明された.
4.iHep細胞を用いた遺伝子治療および組織再生のモデル
iHep細胞を用いた治療モデルの可能性を検証するため,高チロシン血症モデルマウスに由来する胎仔線維芽細胞から作製したiHep細胞に対して欠損した遺伝子を導入し,遺伝的な肝機能疾患の治療を行った.そののち,このiHep細胞を高チロシン血症モデルマウスの肝臓に移植したところ,移植したiHep細胞は正常な細胞と同じように損傷をうけた肝臓組織を再構築することが可能であった.この結果は,遺伝的な肝疾患をもつ患者自身の線維芽細胞からiHep細胞を作製し,体外における遺伝子治療をへて肝臓へ移植することで,肝臓を機能的に再生させ治療するという新しい治療モデルを提示している.
5.成体マウスの線維芽細胞からのiHep細胞の作製
以上に述べたように,マウス胎仔線維芽細胞からiHep細胞を作製することに成功したことから,つづいて,成体マウスの皮膚から抽出した線維芽細胞からもiHep細胞の作製を試みた.その結果,マウス胎仔に由来する線維芽細胞と同様に,成体マウスの皮膚から抽出した線維芽細胞に対してもHnf4αとFoxa(Foxa1,Foxa2,Foxa3のいずれかひとつ)を導入することで肝細胞と同じ形態的および機能的な特徴をもつiHep細胞を作製することができた.また,これら成体マウスに由来するiHep細胞は,高チロシン血症モデルマウスの肝臓へ移植することで損傷をうけた肝臓組織を再構築することも可能であった.
おわりに
この研究では,たった2つの転写因子を線維芽細胞に発現させるだけで,iPS細胞を経由することなく線維芽細胞から肝細胞を直接作製することに成功した(図2).これら2つの転写因子は肝細胞の運命を決定する“コア転写因子”と考えられ,肝細胞の分化を促す複雑な転写因子ネットワークの根幹に位置するものと考えられる.2つの転写因子が細胞においてどのような変化をひき起こし細胞の運命転換を誘導して肝細胞をつくりだすのか,その分子機構は非常に興味深い.一方,この研究はヒトiHep細胞の作製にむけた基盤となることはいうまでもなく,ヒトでiHep細胞が作製されれば,肝疾患に対する細胞移植や人工肝臓への応用が期待できる.また,創薬研究において薬剤の効果や毒性を評価するためのツールとしてiHep細胞を利用することも十分に考えられる.
文 献
- Scarpelli, D. G. & Rao, M. S.: Differentiation of regenerating pancreatic cells into hepatocyte-like cells. Proc. Natl. Acad. Sci. USA, 78, 2577-2581 (1981)[PubMed]
- Lee, K. D., Kuo, T. K., Whang-Peng, J. et al.: In vitro hepatic differentiation of human mesenchymal stem cells. Hepatology, 40, 1275-1284 (2004)[PubMed]
- Wang, X., Willenbring, H., Akkari, Y. et al.: Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature, 422, 897-901 (2003)[PubMed]
- Vassilopoulos, G., Wang, P. R. & Russell, D. W.: Transplanted bone marrow regenerates liver by cell fusion. Nature, 422, 901-904 (2003)[PubMed]
- Vierbuchen, T., Ostermeier, A., Pang, Z. P. et al.: Direct conversion of fibroblasts to functional neurons by defined factors. Nature, 463, 1035-1041 (2010)[PubMed]
- Szabo, E., Rampalli, S., Risueno, R. M. et al.: Direct conversion of human fibroblasts to multilineage blood progenitors. Nature, 468, 521-526 (2010)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
著者プロフィール
略歴:2003年 筑波大学大学院医学研究科 修了,同年 米国Salk Institute for Biological Studiesリサーチアソシエイト,2005年 理化学研究所発生・再生科学総合研究センター 研究員,2007年 九州大学生体防御医学研究所 特任准教授を経て,2011年より同 准教授.科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:器官の発生や再生と疾患.
抱負:研究ができる喜びを忘れずに,おもしろいと思ってもらえる研究を研究室一丸となってつづけていく.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/orgreg/index.html
関谷 明香(Sayaka Sekiya)
九州大学生体防御医学研究所 テクニカルスタッフ.
© 2011 鈴木淳史・関谷明香 Licensed under CC 表示 2.1 日本