ケトン食は概日リズムを組織に特異的に再編する
村上真理・Paolo Sassone-Corsi
(米国California大学Irvine校Department of Biological Chemistry)
email:村上真理
DOI: 10.7875/first.author.2017.107
Distinct circadian signatures in liver and gut clocks revealed by ketogenic diet.
Paola Tognini, Mari Murakami, Yu Liu, Kristin L. Eckel-Mahan, John C. Newman, Eric Verdin, Pierre Baldi, Paolo Sassone-Corsi
Cell Metabolism, 26, 523-538.e5 (2017)
近年,代謝物によるエピゲノムの修飾を介した概日時計の制御機構が明らかにされつつあるが,栄養素やその代謝物がさまざまな末梢組織において概日リズムを制御する機構について多くは解明されていない.今回,筆者らは,ケトン食が肝臓および腸管における概日リズムに対しおのおのの組織に特異的に影響をおよぼすことを明らかにした.ケトン食の摂取により肝臓において時計タンパク質BMAL1のリクルートが増強され,下流の時計制御遺伝子の発現が上昇した.さらに,ケトン食の摂取により腸管におけるβヒドロキシ酪酸の濃度の著明な上昇および概日リズムが生じ,その結果,代謝遺伝子におけるヒストン脱アセチル化酵素の活性の抑制および概日リズムが生じた.この研究により,ケトン食が組織に特異的なエピゲノムの制御を介しおのおのの末梢組織において概日リズムを再編し,時空間に適応した生理学的な作用をおよぼすことが明らかにされた.
概日時計はさまざまな生命現象に概日リズムをあたえ,変動する外的な環境に対し個体のリズムを同調させる役割をもつ.ほとんどすべての細胞には概日時計が備わっており自律的に発振する.概日時計の中枢は視床下部の視交叉上核に存在し網膜を介した光の情報がその同調因子となるのに対し,末梢組織の概日時計は食事が最大の同調因子である1).個体や細胞におけるエネルギー代謝は概日リズムや食事の内容に大きな影響をうけており,食事の時間の制限や高脂肪食により主要なエネルギー器官である肝臓においてトランスクリプトームやメタボロームの概日リズムは再編される2,3).
近年,細胞における代謝により生じた種々の代謝物がエピゲノムの制御を介して代謝遺伝子および時計遺伝子の制御に影響をおよぼすことが明らかにされた4).エピゲノム,代謝,概日時計の三者のクロストークにより,生体においてより状況に適応した代謝の環境をつくりだすことが可能になり,このことが恒常性の維持に大きく貢献する.
肝臓および腸管は全身のエネルギー代謝において重要な役割を担うことから,おのおのの概日時計は代謝の制御に大きく寄与すると考えられる.反対に,局所における代謝の環境もまた末梢組織の概日時計を制御すると推測される.それでは,食事の内容によりエネルギー代謝にかたよりを起こした場合,栄養素や代謝物質によるエピゲノムの制御はおのおのの組織における概日リズムを再編するのだろうか.この点を明らかにするため,超高脂肪かつ超低炭水化物食であるケトン食をモデルとして用い,栄養素や代謝物がどのように末梢組織における概日リズムに影響をおよぼすかについて検証した.
ケトン食がおのおのの組織において転写の概日リズムにどのような影響をおよぼすかを明らかにするため,マウスにケトン食あるいは通常食を4週間にわたりあたえ,肝臓および腸管の細胞を4時間ごとに24時間にわたり採取しトランスクリプトームを解析した.概日リズムの解析にはJTK_CYCLE 5) を用いた.
通常食をあたえたマウスと比較すると,ケトン食をあたえたマウスは肝臓において2339個の遺伝子が概日リズムを獲得し,反対に,719個の遺伝子は概日リズムを消失した.801個の遺伝子はケトン食をあたえたマウスおよび通常食をあたえたマウスにおいて概日リズムを示した.一方,ケトン食をあたえたマウスは腸管において785個の遺伝子が概日リズムを獲得,996個の遺伝子が概日リズムを消失し,515個の遺伝子はケトン食をあたえたマウスおよび通常食をあたえたマウスにおいて概日リズムを示した.ケトン食により肝臓のみで概日リズムを示す遺伝子は2724個,腸管のみで概日リズムを示す遺伝子は884個,肝臓および腸管において概日リズムを示す遺伝子は416個であり,概日リズムの位相についても肝臓と腸管とのあいだで差が認められた.ケトン食をあたえたマウスあるいは通常食をあたえたマウスにおいて,おのおの組織に特異的に概日リズムを示した遺伝子に対し遺伝子オントロジーを解析したところ,組織ごとに大きく異なる生物学的な経路がクラスター化され,肝臓あるいは腸管における概日リズムはそれぞれユニークな特徴をもつことが示唆された.これらのことから,ケトン食が組織に特異的に転写の概日リズムを再編することが明らかにされた.
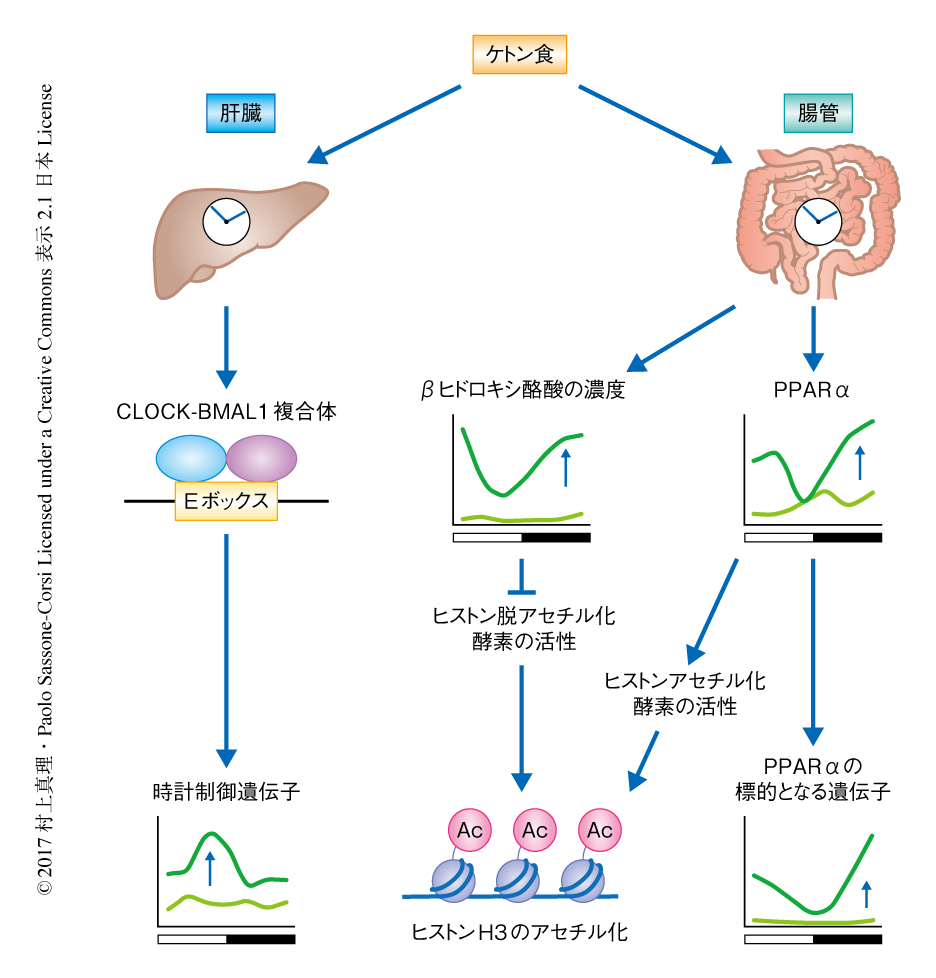
ケトン食により腸管において概日リズムを獲得した遺伝子に対してMotif Map 6) にもとづき転写因子の結合部位を解析したところ,PPARやNF-κBに対する結合モチーフが有意に検出された.一方,ケトン食により肝臓において概日リズムを獲得した遺伝子においてPPARの結合モチーフは検出されず,CLOCK-BMAL1複合体の結合モチーフが有意に検出された.以上のことから,ケトン食の摂取による転写の概日リズムの再編は,異なる転写因子を介し組織に特異的に起こることが示唆された.
概日時計の分子機構は転写因子である複数の時計タンパク質が互いに転写を制御し,1周約24時間のフィードバックループを形成することにより成立する.時計タンパク質はほかの時計遺伝子の転写を制御するのみならず,代謝遺伝子をはじめとする多くの時計制御遺伝子の転写を制御する.ケトン食をあたえたマウスにおける概日リズムの獲得に時計タンパク質が関与するのかどうか調べたところ,通常食をあたえたマウスと比べ,肝臓においてBMAL1の結合配列であるEボックスへのリクルートの増強が認められた.実際に,既報のBMAL1に対するChIP-seq法のデータと照合したところ,ケトン食をあたえたマウスの肝臓において概日リズムを示すBMAL1の標的となる遺伝子の大半は,概日リズムの振幅が増加していた.一方で,腸管においてはケトン食をあたえたマウスと通常食をあたえたマウスとのあいだで時計制御遺伝子の概日リズムの振幅およびBMAL1のリクルートに差は認められなかった.このことは,転写因子の結合部位の解析の結果と合致した.
ケトン食をあたえたマウスの腸管において概日リズムを示す遺伝子にPPARの結合モチーフが有意に検出されたことから,転写因子PPARαとその標的となる遺伝子の概日リズムに着目した.核内受容体であるPPARαは遊離脂肪酸などのリガンドとの結合により活性化し脂質の代謝を制御する転写因子である.核におけるPPARαのレベルはケトン食をあたえたマウスにおいて通常食をあたえたマウスに比べ肝臓および腸管においてともに著明に増加していたが,肝臓あるいは腸管のPPARαの概日リズムには大きな違いが認められた.PPARαの生理的なリガンドである遊離脂肪酸の肝臓あるいは腸管における濃度および概日リズムはおのおのの組織におけるPPARαのレベルと合致した.既報のPPARαの標的となる遺伝子の発現と照合したところ,ケトン食をあたえたマウスの腸管においてはケトン体の生成や脂肪酸の酸化にかかわる多数のPPARαの標的となる遺伝子の発現がPPARαの概日リズムにそった変動を示していた.一方,肝臓においてはPPARαの標的となる遺伝子の概日リズムはさまざまな位相を呈したことから,おのおのの組織に特異的な転写の制御機構の存在が示唆された.
βヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害活性をもつことが報告されたが7)(新着論文レビュー でも掲載),生体においてβヒドロキシ酪酸がどのような生理的な作用をおよぼすのかについてはほとんど明らかにされていない.
PPARαの標的となる遺伝子の組織に特異的な転写機構の違いについて明らかにするため,PPARαの標的となる遺伝子のもつPPAR応答配列において,転写の活性化にかかわるヒストンH3のLys9およびLys14のアセチル化について検討した.ケトン食をあたえたマウスの腸管においては,ヒストンH3のアセチル化はPPARαの標的となる遺伝子の転写の概日リズムにそって通常食をあたえたマウスより著明に高値を示したが,肝臓においてはヒストンH3のアセチル化に概日リズムは認められなかった.
ヒストンH3のアセチル化はヒストンアセチル化酵素およびヒストン脱アセチル化酵素により制御される.リガンドとの結合によりPPARαの標的となる遺伝子にヒストンアセチル化酵素がリクルートされるが8),ヒストンH3のアセチル化を制御するもうひとつの因子として,βヒドロキシ酪酸はPPARαの標的となる遺伝子に対し影響をおよぼすのだろうか.このことについて明らかにするため,βヒドロキシ酪酸の濃度を4時間ごとに24時間にわたり測定したところ,ケトン食をあたえたマウスの血清および腸管において著明な概日リズムが認められた.ヒストン脱アセチル化酵素の活性を測定したところ,ケトン食をあたえたマウスの腸管においてβヒドロキシ酪酸の濃度とヒストン脱アセチル化酵素の活性とのあいだに逆相関の関係が認められた.一方,通常食をあたえたマウスの腸管においてβヒドロキシ酪酸の濃度に概日リズムは認められず,ヒストン脱アセチル化酵素の活性に変動は認められなかった.通常食をあたえたマウスの肝臓におけるβヒドロキシ酪酸の濃度は腸管や血清とは異なる概日リズムを示し,肝臓におけるβヒドロキシ酪酸の濃度,ヒストン脱アセチル化酵素の活性,ヒストンH3のアセチル化のレベルに相関は認められなかった.
βヒドロキシ酪酸がPPARαの標的となる遺伝子の発現やヒストンH3のアセチル化を直接にひき起こすかどうかを確認するため,マウスに1,3-ブタンジオールを4週間にわたりあたえた.1,3-ブタンジオールはβヒドロキシ酪酸の前駆体であり,肝臓において迅速にβヒドロキシ酪酸に変換されるため,内因性のケトン合成経路を介することなくβヒドロキシ酪酸の濃度を上昇させる.その結果,1,3-ブタンジオールをあたえたマウスにおいては通常食をあたえたマウスと比較して肝臓においてPPARαの標的となる遺伝子の発現に有意な上昇は認められなかったのに対し,腸管においてはPPARαの標的となる遺伝子の発現およびそのPPAR応答配列におけるヒストンH3のアセチル化に有意な上昇が認められた.このことから,βヒドロキシ酪酸は腸管に特異的にPPARαの標的となる遺伝子のヒストンH3のアセチル化を制御することが示された.一方,ケトン食に炭水化物をくわえることによりβヒドロキシ酪酸の合成を抑制したところ,腸管においてケトン食の摂取によるPPARαの標的となる遺伝子の発現およびその概日リズムの振幅が著明に抑制されたのに対し,肝臓においてほとんど変化は認められなかった.以上のことから,βヒドロキシ酪酸が組織に特異的にエピゲノムの修飾を制御し概日リズムの再編に関与することが示された.
今回の研究により,特定の食事の内容やその代謝物が組織に特異的に概日リズムを再編することが明らかにされた.肝臓においては時計タンパク質BMAL1のプロモーターへのリクルートが増強されることにより広汎な下流遺伝子において概日リズムの振幅が増加し,腸管においてはβヒドロキシ酪酸によりヒストン脱アセチル化酵素の活性に概日リズムが生じ,それに付随して代謝遺伝子の概日リズムが制御されることが明らかにされた(図1).このように,局所の環境からのシグナルは代謝物の濃度としてリアルタイムに変換され,エピゲノムの修飾を介してすみやかに局所における遺伝子の発現に反映される.生体はその可塑性により体内の環境に対しより効率的かつ精密に適応することが可能になると考えられる.現時点においては,組織に特異的な概日リズムの生じる機構やエピゲノムの制御が特定の遺伝子にのみに関与する機構については不明であり,その解明が今後の重要な課題であろう.
略歴:2011年 大阪大学大学院医学系研究科にて博士号取得,同年 大阪急性期・総合医療センター,2013年 米国California大学Irvine校 ポスドク研究員を経て,2017年より大阪大学大学院医学系研究科 特任助教.
研究テーマ:エネルギー代謝と概日リズム.免疫.
関心事:代謝物とさまざまなシステムとのクロストークを解き明かし,臨床への応用に生かしたい.
Paolo Sassone-Corsi
米国California大学Irvine校 教授.
© 2017 村上真理・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本
(米国California大学Irvine校Department of Biological Chemistry)
email:村上真理
DOI: 10.7875/first.author.2017.107
Distinct circadian signatures in liver and gut clocks revealed by ketogenic diet.
Paola Tognini, Mari Murakami, Yu Liu, Kristin L. Eckel-Mahan, John C. Newman, Eric Verdin, Pierre Baldi, Paolo Sassone-Corsi
Cell Metabolism, 26, 523-538.e5 (2017)
要 約
近年,代謝物によるエピゲノムの修飾を介した概日時計の制御機構が明らかにされつつあるが,栄養素やその代謝物がさまざまな末梢組織において概日リズムを制御する機構について多くは解明されていない.今回,筆者らは,ケトン食が肝臓および腸管における概日リズムに対しおのおのの組織に特異的に影響をおよぼすことを明らかにした.ケトン食の摂取により肝臓において時計タンパク質BMAL1のリクルートが増強され,下流の時計制御遺伝子の発現が上昇した.さらに,ケトン食の摂取により腸管におけるβヒドロキシ酪酸の濃度の著明な上昇および概日リズムが生じ,その結果,代謝遺伝子におけるヒストン脱アセチル化酵素の活性の抑制および概日リズムが生じた.この研究により,ケトン食が組織に特異的なエピゲノムの制御を介しおのおのの末梢組織において概日リズムを再編し,時空間に適応した生理学的な作用をおよぼすことが明らかにされた.
はじめに
概日時計はさまざまな生命現象に概日リズムをあたえ,変動する外的な環境に対し個体のリズムを同調させる役割をもつ.ほとんどすべての細胞には概日時計が備わっており自律的に発振する.概日時計の中枢は視床下部の視交叉上核に存在し網膜を介した光の情報がその同調因子となるのに対し,末梢組織の概日時計は食事が最大の同調因子である1).個体や細胞におけるエネルギー代謝は概日リズムや食事の内容に大きな影響をうけており,食事の時間の制限や高脂肪食により主要なエネルギー器官である肝臓においてトランスクリプトームやメタボロームの概日リズムは再編される2,3).
近年,細胞における代謝により生じた種々の代謝物がエピゲノムの制御を介して代謝遺伝子および時計遺伝子の制御に影響をおよぼすことが明らかにされた4).エピゲノム,代謝,概日時計の三者のクロストークにより,生体においてより状況に適応した代謝の環境をつくりだすことが可能になり,このことが恒常性の維持に大きく貢献する.
肝臓および腸管は全身のエネルギー代謝において重要な役割を担うことから,おのおのの概日時計は代謝の制御に大きく寄与すると考えられる.反対に,局所における代謝の環境もまた末梢組織の概日時計を制御すると推測される.それでは,食事の内容によりエネルギー代謝にかたよりを起こした場合,栄養素や代謝物質によるエピゲノムの制御はおのおのの組織における概日リズムを再編するのだろうか.この点を明らかにするため,超高脂肪かつ超低炭水化物食であるケトン食をモデルとして用い,栄養素や代謝物がどのように末梢組織における概日リズムに影響をおよぼすかについて検証した.
1.ケトン食は転写の概日リズムを組織に特異的に再編する
ケトン食がおのおのの組織において転写の概日リズムにどのような影響をおよぼすかを明らかにするため,マウスにケトン食あるいは通常食を4週間にわたりあたえ,肝臓および腸管の細胞を4時間ごとに24時間にわたり採取しトランスクリプトームを解析した.概日リズムの解析にはJTK_CYCLE 5) を用いた.
通常食をあたえたマウスと比較すると,ケトン食をあたえたマウスは肝臓において2339個の遺伝子が概日リズムを獲得し,反対に,719個の遺伝子は概日リズムを消失した.801個の遺伝子はケトン食をあたえたマウスおよび通常食をあたえたマウスにおいて概日リズムを示した.一方,ケトン食をあたえたマウスは腸管において785個の遺伝子が概日リズムを獲得,996個の遺伝子が概日リズムを消失し,515個の遺伝子はケトン食をあたえたマウスおよび通常食をあたえたマウスにおいて概日リズムを示した.ケトン食により肝臓のみで概日リズムを示す遺伝子は2724個,腸管のみで概日リズムを示す遺伝子は884個,肝臓および腸管において概日リズムを示す遺伝子は416個であり,概日リズムの位相についても肝臓と腸管とのあいだで差が認められた.ケトン食をあたえたマウスあるいは通常食をあたえたマウスにおいて,おのおの組織に特異的に概日リズムを示した遺伝子に対し遺伝子オントロジーを解析したところ,組織ごとに大きく異なる生物学的な経路がクラスター化され,肝臓あるいは腸管における概日リズムはそれぞれユニークな特徴をもつことが示唆された.これらのことから,ケトン食が組織に特異的に転写の概日リズムを再編することが明らかにされた.
ケトン食により腸管において概日リズムを獲得した遺伝子に対してMotif Map 6) にもとづき転写因子の結合部位を解析したところ,PPARやNF-κBに対する結合モチーフが有意に検出された.一方,ケトン食により肝臓において概日リズムを獲得した遺伝子においてPPARの結合モチーフは検出されず,CLOCK-BMAL1複合体の結合モチーフが有意に検出された.以上のことから,ケトン食の摂取による転写の概日リズムの再編は,異なる転写因子を介し組織に特異的に起こることが示唆された.
2.BMAL1の標的となる遺伝子へのリクルートはケトン食により肝臓に特異的に増強される
概日時計の分子機構は転写因子である複数の時計タンパク質が互いに転写を制御し,1周約24時間のフィードバックループを形成することにより成立する.時計タンパク質はほかの時計遺伝子の転写を制御するのみならず,代謝遺伝子をはじめとする多くの時計制御遺伝子の転写を制御する.ケトン食をあたえたマウスにおける概日リズムの獲得に時計タンパク質が関与するのかどうか調べたところ,通常食をあたえたマウスと比べ,肝臓においてBMAL1の結合配列であるEボックスへのリクルートの増強が認められた.実際に,既報のBMAL1に対するChIP-seq法のデータと照合したところ,ケトン食をあたえたマウスの肝臓において概日リズムを示すBMAL1の標的となる遺伝子の大半は,概日リズムの振幅が増加していた.一方で,腸管においてはケトン食をあたえたマウスと通常食をあたえたマウスとのあいだで時計制御遺伝子の概日リズムの振幅およびBMAL1のリクルートに差は認められなかった.このことは,転写因子の結合部位の解析の結果と合致した.
3.ケトン食は腸管に特異的に転写因子PPARαに概日リズムをひき起こす
ケトン食をあたえたマウスの腸管において概日リズムを示す遺伝子にPPARの結合モチーフが有意に検出されたことから,転写因子PPARαとその標的となる遺伝子の概日リズムに着目した.核内受容体であるPPARαは遊離脂肪酸などのリガンドとの結合により活性化し脂質の代謝を制御する転写因子である.核におけるPPARαのレベルはケトン食をあたえたマウスにおいて通常食をあたえたマウスに比べ肝臓および腸管においてともに著明に増加していたが,肝臓あるいは腸管のPPARαの概日リズムには大きな違いが認められた.PPARαの生理的なリガンドである遊離脂肪酸の肝臓あるいは腸管における濃度および概日リズムはおのおのの組織におけるPPARαのレベルと合致した.既報のPPARαの標的となる遺伝子の発現と照合したところ,ケトン食をあたえたマウスの腸管においてはケトン体の生成や脂肪酸の酸化にかかわる多数のPPARαの標的となる遺伝子の発現がPPARαの概日リズムにそった変動を示していた.一方,肝臓においてはPPARαの標的となる遺伝子の概日リズムはさまざまな位相を呈したことから,おのおのの組織に特異的な転写の制御機構の存在が示唆された.
4.ケトン食により生じたβヒドロキシ酪酸によりヒストンH3のアセチル化の概日リズムがひき起こされる
βヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害活性をもつことが報告されたが7)(新着論文レビュー でも掲載),生体においてβヒドロキシ酪酸がどのような生理的な作用をおよぼすのかについてはほとんど明らかにされていない.
PPARαの標的となる遺伝子の組織に特異的な転写機構の違いについて明らかにするため,PPARαの標的となる遺伝子のもつPPAR応答配列において,転写の活性化にかかわるヒストンH3のLys9およびLys14のアセチル化について検討した.ケトン食をあたえたマウスの腸管においては,ヒストンH3のアセチル化はPPARαの標的となる遺伝子の転写の概日リズムにそって通常食をあたえたマウスより著明に高値を示したが,肝臓においてはヒストンH3のアセチル化に概日リズムは認められなかった.
ヒストンH3のアセチル化はヒストンアセチル化酵素およびヒストン脱アセチル化酵素により制御される.リガンドとの結合によりPPARαの標的となる遺伝子にヒストンアセチル化酵素がリクルートされるが8),ヒストンH3のアセチル化を制御するもうひとつの因子として,βヒドロキシ酪酸はPPARαの標的となる遺伝子に対し影響をおよぼすのだろうか.このことについて明らかにするため,βヒドロキシ酪酸の濃度を4時間ごとに24時間にわたり測定したところ,ケトン食をあたえたマウスの血清および腸管において著明な概日リズムが認められた.ヒストン脱アセチル化酵素の活性を測定したところ,ケトン食をあたえたマウスの腸管においてβヒドロキシ酪酸の濃度とヒストン脱アセチル化酵素の活性とのあいだに逆相関の関係が認められた.一方,通常食をあたえたマウスの腸管においてβヒドロキシ酪酸の濃度に概日リズムは認められず,ヒストン脱アセチル化酵素の活性に変動は認められなかった.通常食をあたえたマウスの肝臓におけるβヒドロキシ酪酸の濃度は腸管や血清とは異なる概日リズムを示し,肝臓におけるβヒドロキシ酪酸の濃度,ヒストン脱アセチル化酵素の活性,ヒストンH3のアセチル化のレベルに相関は認められなかった.
βヒドロキシ酪酸がPPARαの標的となる遺伝子の発現やヒストンH3のアセチル化を直接にひき起こすかどうかを確認するため,マウスに1,3-ブタンジオールを4週間にわたりあたえた.1,3-ブタンジオールはβヒドロキシ酪酸の前駆体であり,肝臓において迅速にβヒドロキシ酪酸に変換されるため,内因性のケトン合成経路を介することなくβヒドロキシ酪酸の濃度を上昇させる.その結果,1,3-ブタンジオールをあたえたマウスにおいては通常食をあたえたマウスと比較して肝臓においてPPARαの標的となる遺伝子の発現に有意な上昇は認められなかったのに対し,腸管においてはPPARαの標的となる遺伝子の発現およびそのPPAR応答配列におけるヒストンH3のアセチル化に有意な上昇が認められた.このことから,βヒドロキシ酪酸は腸管に特異的にPPARαの標的となる遺伝子のヒストンH3のアセチル化を制御することが示された.一方,ケトン食に炭水化物をくわえることによりβヒドロキシ酪酸の合成を抑制したところ,腸管においてケトン食の摂取によるPPARαの標的となる遺伝子の発現およびその概日リズムの振幅が著明に抑制されたのに対し,肝臓においてほとんど変化は認められなかった.以上のことから,βヒドロキシ酪酸が組織に特異的にエピゲノムの修飾を制御し概日リズムの再編に関与することが示された.
おわりに
今回の研究により,特定の食事の内容やその代謝物が組織に特異的に概日リズムを再編することが明らかにされた.肝臓においては時計タンパク質BMAL1のプロモーターへのリクルートが増強されることにより広汎な下流遺伝子において概日リズムの振幅が増加し,腸管においてはβヒドロキシ酪酸によりヒストン脱アセチル化酵素の活性に概日リズムが生じ,それに付随して代謝遺伝子の概日リズムが制御されることが明らかにされた(図1).このように,局所の環境からのシグナルは代謝物の濃度としてリアルタイムに変換され,エピゲノムの修飾を介してすみやかに局所における遺伝子の発現に反映される.生体はその可塑性により体内の環境に対しより効率的かつ精密に適応することが可能になると考えられる.現時点においては,組織に特異的な概日リズムの生じる機構やエピゲノムの制御が特定の遺伝子にのみに関与する機構については不明であり,その解明が今後の重要な課題であろう.
文 献
- Vollmers, C., Gill, S., DiTacchio, L. et al.: Time of feeding and the intrinsic circadian clock drive rhythms in hepatic gene expression. Proc. Natl. Acad. Sci. USA, 106, 21453-21458 (2009)[PubMed]
- Hatori, M., Vollmers, C., Zarrinpar, A. et al.: Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice fed a high-fat diet. Cell Metab, 15, 848-860 (2012)[PubMed] [新着論文レビュー]
- Eckel-Mahan, K., Patel, V. R., de Mateo, S. et al.: Reprogramming of the circadian clock by nutritional challenge. Cell, 155, 1464-1478 (2013)[PubMed]
- Katada, S., Imhof, A. & Sassone-Corsi, P.: Connecting threads: epigenetics and metabolism. Cell, 148, 24-28 (2012)[PubMed]
- Hughes, M. E., Hognesch, J. B. & Kornacker, K.: JTK_CYCLE: an efficient nonparametric algorithm for detecting rhythmic components in genome-scale data sets. J. Biol. Rhythms, 25, 372-380 (2010)[PubMed]
- Daily, K., Patel, V. R., Rigor, P. et al.: MotifMap: integrative genome-wide maps of regulatory motif sites for model species. BMC Bioinformatics, 12, 495 (2011)[PubMed]
- Shimazu, T., Hirschey, M. D., Newman, J. et al.: Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science, 339, 211-214 (2013)[PubMed] [新着論文レビュー]
- Viswakarma, N., Jia, Y., Bai, L. et al.: Coactivators in PPAR-regulated gene expression. PPAR Res., 2010, 250126 (2010)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 大阪大学大学院医学系研究科にて博士号取得,同年 大阪急性期・総合医療センター,2013年 米国California大学Irvine校 ポスドク研究員を経て,2017年より大阪大学大学院医学系研究科 特任助教.
研究テーマ:エネルギー代謝と概日リズム.免疫.
関心事:代謝物とさまざまなシステムとのクロストークを解き明かし,臨床への応用に生かしたい.
Paolo Sassone-Corsi
米国California大学Irvine校 教授.
© 2017 村上真理・Paolo Sassone-Corsi Licensed under CC 表示 2.1 日本