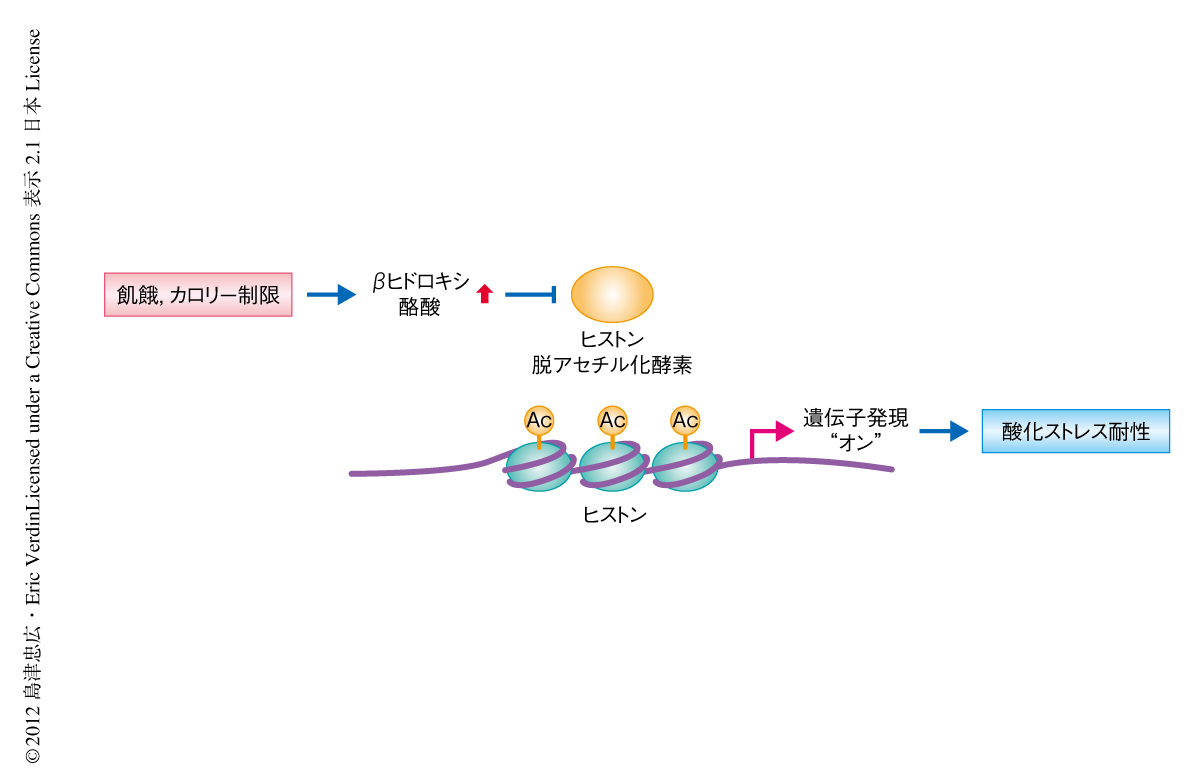
βヒドロキシ酪酸は内在性のヒストン脱アセチル化酵素の阻害剤として酸化ストレスの抑制に寄与する
島津忠広・Eric Verdin
(米国California大学San Francisco校Gladstone Institute of Virology and Immunology)
email:島津忠広
DOI: 10.7875/first.author.2012.158
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor.
Tadahiro Shimazu, Matthew D. Hirschey, John Newman, Wenjuan He, Kotaro Shirakawa, Natacha Le Moan, Carrie A. Grueter, Hyungwook Lim, Laura R. Saunders, Robert D. Stevens, Christopher B. Newgard, Robert V. Farese Jr., Rafael de Cabo, Scott Ulrich, Katerina Akassoglou, Eric Verdin
Science, 339, 211-214 (2013)
アセチルCoAおよびNAD+の濃度はヒストンのアセチル化の状態に影響を及ぼすため,その生体における代謝の状態は遺伝子の転写制御と関連する.この論文において,筆者らは,生体における代謝産物であるβヒドロキシ酪酸がクラスIヒストン脱アセチル化酵素を特異的に阻害することを明らかにした.βヒドロキシ酪酸をマウスへ投与するとヒストンのアセチル化のレベルが上昇したのにくわえ,βヒドロキシ酪酸の蓄積する飢餓状態あるいはカロリーを制限したマウスの組織においてもヒストンのアセチル化のレベルは上昇していた.さらに,βヒドロキシ酪酸によるクラスIヒストン脱アセチル化酵素の阻害は転写状態のグローバルな変化をともない,このなかには,酸化ストレス耐性遺伝子であるFoxo3a遺伝子やMt2遺伝子の発現の上昇も含まれた.βヒドロキシ酪酸の処理によりFoxo3a遺伝子およびMt2のプロモーター領域におけるヒストンのアセチル化が亢進すること,さらに,クラスIヒストン脱アセチル化酵素であるHDAC1あるいはHDAC2のノックダウンはこれらの遺伝子の発現を亢進することが見い出された.以上の現象と一致して,マウスにβヒドロキシ酪酸を投与すると酸化ストレスに対し耐性を示すようになることが明らかになった.
アセチルCoAやNAD+のような生体における代謝産物は,ヒストンアセチル化酵素(histone acetyltransferase:HAT)やヒストン脱アセチル化酵素(histone deacetylase:HDAC)など,ヒストンの修飾をつかさどるエピジェネティックタンパク質の補因子としてはたらくことにより遺伝子の発現に影響をあたえている1).このうち,ヒストンアセチル化酵素の活性は核におけるアセチルCoAの濃度に依存しており2),また,クラスIIIヒストン脱アセチル化酵素(Sirtuinともよばれる)の活性はNAD+の濃度に依存している3).一方で,ヒストン脱アセチル化酵素のそのほかのサブクラス,すなわち,クラスI,クラスII,クラスIVでは,いまのところ,このような内在性の制御因子はみつかっていない.細菌の嫌気性発酵の産物である酪酸は,クラスIヒストン脱アセチル化酵素およびクラスIIヒストン脱アセチル化酵素の阻害剤として古くから知られている.この酪酸は,哺乳類の飢餓状態において重要なエネルギー源となるβヒドロキシ酪酸と化学構造がよく似ている.飢餓状態において肝臓が脂肪酸の酸化を行うようになると血中のβヒドロキシ酪酸の濃度は1~2 mMになり,さらに長期的な飢餓状態では6~8 mM,糖尿病性のケトアシドーシスの患者では25 mM以上に達する.この研究では,このような性質をもつ,すなわち,酪酸に似た代謝産物であり体内に高濃度に存在するβヒドロキシ酪酸が,ヒストン脱アセチル化酵素を阻害するかどうか検証することにした.
HEK293細胞に対しβヒドロキシ酪酸を異なる濃度で処理し,ヒストンH3のアセチル化をその特異的な抗体により検出したところ,濃度に依存的なヒストンの高アセチル化が観察された.一方で,αチューブリンのアセチル化のレベルには影響がなかったことから,βヒドロキシ酪酸はチューブリン脱アセチル化酵素であるHDAC6(クラスIIヒストン脱アセチル化酵素)には作用しないことがわかった.βヒドロキシ酪酸のヒストン脱アセチル化酵素に対する選択性をさらに調べるため,アセチル化ヒストンH3ペプチドを用いたin vitroにおける実験を行い,HDAC1とHDAC2(クラスIヒストン脱アセチル化酵素),および,HDAC4(クラスIIヒストン脱アセチル化酵素)に対する50%阻害濃度(IC50)はおよそ2~5 mMである一方,HDAC6に対する50%阻害濃度はおよそ50 mMであることを見い出した.さらに,チューブリンを基質としたβヒドロキシ酪酸のHDAC6阻害能を検討したところ,βヒドロキシ酪酸はHDAC6に対しては阻害活性を示さないことが明らかになった.βヒドロキシ酪酸が代謝されることによりアセチルCoAの濃度が上昇し,それによりヒストンのアセチル化が亢進する可能性を検証したところ,10 mM以下のβヒドロキシ酪酸の処理ではアセチルCoAの顕著な増加はみられず,また,βヒドロキシ酪酸脱水素酵素をノックダウンしてもヒストンのアセチル化の上昇に差異は認められなかった.ただし,10 mM以上の高濃度のβヒドロキシ酪酸の処理ではβヒドロキシ酪酸脱水素酵素のノックダウンによりヒストンのアセチル化が減少したことから,クラスIヒストン脱アセチル化酵素に対し阻害活性を示す以上の高濃度のβヒドロキシ酪酸は,ヒストンアセチル化酵素の活性化を介したヒストンのアセチル化にも寄与することが示唆された.
マウスにおいてβヒドロキシ酪酸の濃度がヒストンのアセチル化の状態に影響をあたえるかどうかを検討した.24時間飢餓のマウス,カロリーを制限して飼育したマウス,および,βヒドロキシ酪酸を投与したマウスのおのおのについて,血中のβヒドロキシ酪酸の濃度がそれぞれ顕著に(およそ0.6~1.5 mM)上昇していることが判明した.また,それぞれのマウスの組織におけるヒストンのアセチル化の状態を調べたところ,複数の種類の臓器においてアセチル化の状態が変化し,とくに,腎臓においてヒストンのアセチル化が顕著に(およそ2~5倍)亢進していた.さらに,血中のβヒドロキシ酪酸の濃度と腎臓におけるヒストンのアセチル化の状態には強い相関がみられた.このような理由から,以降,βヒドロキシ酪酸によるヒストンのアセチル化を研究するうえで,腎臓に焦点をあてることにした.
ヒストン脱アセチル化酵素の阻害剤によりひき起こされるヒストンのアセチル化は遺伝子発現の亢進あるいは抑制と関連する.そこで,βヒドロキシ酪酸により発現パターンの変化する遺伝子を同定するため,βヒドロキシ酪酸を投与したマウスの腎臓からmRNAを精製しマイクロアレイによる発現解析を行った.その結果,βヒドロキシ酪酸の処理によりFOXO3a転写因子ネットワークを構成する5つの遺伝子,Foxo3a遺伝子,Mt2,Lcn2遺伝子,Lemd3遺伝子,Hbp1遺伝子の発現の上昇していることが判明した.Foxo3a遺伝子は細胞周期の停止や酸化ストレス耐性にかかわる転写因子をコードしており4),また,Mt2も酸化ストレス耐性遺伝子である5).クロマチン免疫沈降法により,Foxo3a遺伝子およびMt2のプロモーター領域におけるヒストンH3の9番目のリジン残基のアセチル化はβヒドロキシ酪酸の処理により亢進することが判明した.また,クラスIヒストン脱アセチル化酵素およびクラスIIヒストン脱アセチル化酵素をそれぞれノックダウンしてFoxo3a遺伝子およびMt2のmRNAの発現量の変化を観察したところ,クラスIヒストン脱アセチル化酵素であるHDAC1およびHDAC2のノックダウンによりこれら遺伝子の発現は顕著に亢進した.さらに,クロマチン免疫沈降法によりHDAC1がFoxo3a遺伝子およびMt2のプロモーター領域にリクルートされていることが明らかになった.以上から,βヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素であるHDAC1やHDAC2を阻害することにより,Foxo3a遺伝子やMt2など酸化ストレス耐性遺伝子のプロモーターにおけるヒストンの高アセチル化をひき起こしていると考えられた.
Mnスーパーオキシドジスムターゼおよびカタラーゼはその遺伝子が転写因子FOXO3aの標的遺伝子であり,また,酸化ストレス耐性に重要な役割をはたしていることが知られている.ウェスタンブロッティング法による解析の結果,マウスの腎臓においてβヒドロキシ酪酸の投与はFOXO3aのみならずMnスーパーオキシドジスムターゼおよびカタラーゼの発現量をタンパク質レベルで顕著に亢進させることがわかった.このことから,βヒドロキシ酪酸は酸化ストレスに対し抵抗性を示す効果があるのではないかとの仮説をもとに実験を行った.タンパク質のカルボニル化は不可逆なタンパク質修飾反応であり,酸化ストレスの指標と考えられる.そこで,あらかじめβヒドロキシ酪酸を投与したマウスに対し,パラコートによる酸化ストレスをあたえたのち腎臓を採取し,組織におけるタンパク質のカルボニル化を検出した.その結果,βヒドロキシ酪酸は酸化ストレスによりひき起こされるタンパク質のカルボニル化を顕著に抑制することをつきとめた.さらに,酸化ストレスの別の指標である脂質の過酸化についても検証したところ,βヒドロキシ酪酸を投与したマウスの腎臓の切片において4-ヒドロキシノネナールの蓄積は顕著に抑制されることが見い出された.以上の観察から,βヒドロキシ酪酸はマウスの腎臓においてパラコートによる酸化ストレスを緩和することが明らかになった.
哺乳類の血中にβヒドロキシ酪酸がmMのオーダーで存在し,ヒストン脱アセチル化酵素を阻害することを示したこの研究は,代謝の状態とエピジェネティックな制御との密接なかかわりを示唆する新たな一例となるだろう(図1).この研究では,βヒドロキシ酪酸がマウスの腎臓においてヒストンのアセチル化および遺伝子発現を制御していることを示したが,そのほかの組織においても同様の制御機構が存在するかどうかは今後の研究に期待したい.
すでに,ショウジョウバエにおいては薬剤あるいは遺伝子操作によるヒストン脱アセチル化酵素の阻害は長寿にかかわることが示されており6,7),ヒトにおいても,ケトン食やカロリー制限による健康効果の一部はβヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害により説明が可能なのかもしれない.
略歴:2007年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国California大学San Francisco校 博士研究員を経て,2011年より理化学研究所基幹研究所 研究員.
研究テーマ:ヒストンの修飾とエピジェネティクス.
関心事:タンパク質の翻訳後修飾,とくに,アセチル化修飾やメチル化修飾がひき起こす生命現象,寿命の制御機構などについて幅広く研究を行っています.
Eric Verdin
米国California大学San Francisco校Senior Investigator.
研究室URL:http://labs.gladstone.ucsf.edu/verdin/
© 2012 島津忠広・Eric Verdin Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校Gladstone Institute of Virology and Immunology)
email:島津忠広
DOI: 10.7875/first.author.2012.158
Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor.
Tadahiro Shimazu, Matthew D. Hirschey, John Newman, Wenjuan He, Kotaro Shirakawa, Natacha Le Moan, Carrie A. Grueter, Hyungwook Lim, Laura R. Saunders, Robert D. Stevens, Christopher B. Newgard, Robert V. Farese Jr., Rafael de Cabo, Scott Ulrich, Katerina Akassoglou, Eric Verdin
Science, 339, 211-214 (2013)
要 約
アセチルCoAおよびNAD+の濃度はヒストンのアセチル化の状態に影響を及ぼすため,その生体における代謝の状態は遺伝子の転写制御と関連する.この論文において,筆者らは,生体における代謝産物であるβヒドロキシ酪酸がクラスIヒストン脱アセチル化酵素を特異的に阻害することを明らかにした.βヒドロキシ酪酸をマウスへ投与するとヒストンのアセチル化のレベルが上昇したのにくわえ,βヒドロキシ酪酸の蓄積する飢餓状態あるいはカロリーを制限したマウスの組織においてもヒストンのアセチル化のレベルは上昇していた.さらに,βヒドロキシ酪酸によるクラスIヒストン脱アセチル化酵素の阻害は転写状態のグローバルな変化をともない,このなかには,酸化ストレス耐性遺伝子であるFoxo3a遺伝子やMt2遺伝子の発現の上昇も含まれた.βヒドロキシ酪酸の処理によりFoxo3a遺伝子およびMt2のプロモーター領域におけるヒストンのアセチル化が亢進すること,さらに,クラスIヒストン脱アセチル化酵素であるHDAC1あるいはHDAC2のノックダウンはこれらの遺伝子の発現を亢進することが見い出された.以上の現象と一致して,マウスにβヒドロキシ酪酸を投与すると酸化ストレスに対し耐性を示すようになることが明らかになった.
はじめに
アセチルCoAやNAD+のような生体における代謝産物は,ヒストンアセチル化酵素(histone acetyltransferase:HAT)やヒストン脱アセチル化酵素(histone deacetylase:HDAC)など,ヒストンの修飾をつかさどるエピジェネティックタンパク質の補因子としてはたらくことにより遺伝子の発現に影響をあたえている1).このうち,ヒストンアセチル化酵素の活性は核におけるアセチルCoAの濃度に依存しており2),また,クラスIIIヒストン脱アセチル化酵素(Sirtuinともよばれる)の活性はNAD+の濃度に依存している3).一方で,ヒストン脱アセチル化酵素のそのほかのサブクラス,すなわち,クラスI,クラスII,クラスIVでは,いまのところ,このような内在性の制御因子はみつかっていない.細菌の嫌気性発酵の産物である酪酸は,クラスIヒストン脱アセチル化酵素およびクラスIIヒストン脱アセチル化酵素の阻害剤として古くから知られている.この酪酸は,哺乳類の飢餓状態において重要なエネルギー源となるβヒドロキシ酪酸と化学構造がよく似ている.飢餓状態において肝臓が脂肪酸の酸化を行うようになると血中のβヒドロキシ酪酸の濃度は1~2 mMになり,さらに長期的な飢餓状態では6~8 mM,糖尿病性のケトアシドーシスの患者では25 mM以上に達する.この研究では,このような性質をもつ,すなわち,酪酸に似た代謝産物であり体内に高濃度に存在するβヒドロキシ酪酸が,ヒストン脱アセチル化酵素を阻害するかどうか検証することにした.
1.βヒドロキシ酪酸はin vitroおよびin vivoにおいてクラスIヒストン脱アセチル化酵素を阻害する
HEK293細胞に対しβヒドロキシ酪酸を異なる濃度で処理し,ヒストンH3のアセチル化をその特異的な抗体により検出したところ,濃度に依存的なヒストンの高アセチル化が観察された.一方で,αチューブリンのアセチル化のレベルには影響がなかったことから,βヒドロキシ酪酸はチューブリン脱アセチル化酵素であるHDAC6(クラスIIヒストン脱アセチル化酵素)には作用しないことがわかった.βヒドロキシ酪酸のヒストン脱アセチル化酵素に対する選択性をさらに調べるため,アセチル化ヒストンH3ペプチドを用いたin vitroにおける実験を行い,HDAC1とHDAC2(クラスIヒストン脱アセチル化酵素),および,HDAC4(クラスIIヒストン脱アセチル化酵素)に対する50%阻害濃度(IC50)はおよそ2~5 mMである一方,HDAC6に対する50%阻害濃度はおよそ50 mMであることを見い出した.さらに,チューブリンを基質としたβヒドロキシ酪酸のHDAC6阻害能を検討したところ,βヒドロキシ酪酸はHDAC6に対しては阻害活性を示さないことが明らかになった.βヒドロキシ酪酸が代謝されることによりアセチルCoAの濃度が上昇し,それによりヒストンのアセチル化が亢進する可能性を検証したところ,10 mM以下のβヒドロキシ酪酸の処理ではアセチルCoAの顕著な増加はみられず,また,βヒドロキシ酪酸脱水素酵素をノックダウンしてもヒストンのアセチル化の上昇に差異は認められなかった.ただし,10 mM以上の高濃度のβヒドロキシ酪酸の処理ではβヒドロキシ酪酸脱水素酵素のノックダウンによりヒストンのアセチル化が減少したことから,クラスIヒストン脱アセチル化酵素に対し阻害活性を示す以上の高濃度のβヒドロキシ酪酸は,ヒストンアセチル化酵素の活性化を介したヒストンのアセチル化にも寄与することが示唆された.
2.食事制限をしたマウスにおける血中のβヒドロキシ酪酸の濃度とヒストンのアセチル化との相関
マウスにおいてβヒドロキシ酪酸の濃度がヒストンのアセチル化の状態に影響をあたえるかどうかを検討した.24時間飢餓のマウス,カロリーを制限して飼育したマウス,および,βヒドロキシ酪酸を投与したマウスのおのおのについて,血中のβヒドロキシ酪酸の濃度がそれぞれ顕著に(およそ0.6~1.5 mM)上昇していることが判明した.また,それぞれのマウスの組織におけるヒストンのアセチル化の状態を調べたところ,複数の種類の臓器においてアセチル化の状態が変化し,とくに,腎臓においてヒストンのアセチル化が顕著に(およそ2~5倍)亢進していた.さらに,血中のβヒドロキシ酪酸の濃度と腎臓におけるヒストンのアセチル化の状態には強い相関がみられた.このような理由から,以降,βヒドロキシ酪酸によるヒストンのアセチル化を研究するうえで,腎臓に焦点をあてることにした.
3.βヒドロキシ酪酸は酸化ストレス耐性遺伝子の発現を亢進させる
ヒストン脱アセチル化酵素の阻害剤によりひき起こされるヒストンのアセチル化は遺伝子発現の亢進あるいは抑制と関連する.そこで,βヒドロキシ酪酸により発現パターンの変化する遺伝子を同定するため,βヒドロキシ酪酸を投与したマウスの腎臓からmRNAを精製しマイクロアレイによる発現解析を行った.その結果,βヒドロキシ酪酸の処理によりFOXO3a転写因子ネットワークを構成する5つの遺伝子,Foxo3a遺伝子,Mt2,Lcn2遺伝子,Lemd3遺伝子,Hbp1遺伝子の発現の上昇していることが判明した.Foxo3a遺伝子は細胞周期の停止や酸化ストレス耐性にかかわる転写因子をコードしており4),また,Mt2も酸化ストレス耐性遺伝子である5).クロマチン免疫沈降法により,Foxo3a遺伝子およびMt2のプロモーター領域におけるヒストンH3の9番目のリジン残基のアセチル化はβヒドロキシ酪酸の処理により亢進することが判明した.また,クラスIヒストン脱アセチル化酵素およびクラスIIヒストン脱アセチル化酵素をそれぞれノックダウンしてFoxo3a遺伝子およびMt2のmRNAの発現量の変化を観察したところ,クラスIヒストン脱アセチル化酵素であるHDAC1およびHDAC2のノックダウンによりこれら遺伝子の発現は顕著に亢進した.さらに,クロマチン免疫沈降法によりHDAC1がFoxo3a遺伝子およびMt2のプロモーター領域にリクルートされていることが明らかになった.以上から,βヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素であるHDAC1やHDAC2を阻害することにより,Foxo3a遺伝子やMt2など酸化ストレス耐性遺伝子のプロモーターにおけるヒストンの高アセチル化をひき起こしていると考えられた.
4.βヒドロキシ酪酸を投与したマウスは酸化ストレスに対し耐性を示す
Mnスーパーオキシドジスムターゼおよびカタラーゼはその遺伝子が転写因子FOXO3aの標的遺伝子であり,また,酸化ストレス耐性に重要な役割をはたしていることが知られている.ウェスタンブロッティング法による解析の結果,マウスの腎臓においてβヒドロキシ酪酸の投与はFOXO3aのみならずMnスーパーオキシドジスムターゼおよびカタラーゼの発現量をタンパク質レベルで顕著に亢進させることがわかった.このことから,βヒドロキシ酪酸は酸化ストレスに対し抵抗性を示す効果があるのではないかとの仮説をもとに実験を行った.タンパク質のカルボニル化は不可逆なタンパク質修飾反応であり,酸化ストレスの指標と考えられる.そこで,あらかじめβヒドロキシ酪酸を投与したマウスに対し,パラコートによる酸化ストレスをあたえたのち腎臓を採取し,組織におけるタンパク質のカルボニル化を検出した.その結果,βヒドロキシ酪酸は酸化ストレスによりひき起こされるタンパク質のカルボニル化を顕著に抑制することをつきとめた.さらに,酸化ストレスの別の指標である脂質の過酸化についても検証したところ,βヒドロキシ酪酸を投与したマウスの腎臓の切片において4-ヒドロキシノネナールの蓄積は顕著に抑制されることが見い出された.以上の観察から,βヒドロキシ酪酸はマウスの腎臓においてパラコートによる酸化ストレスを緩和することが明らかになった.
おわりに
哺乳類の血中にβヒドロキシ酪酸がmMのオーダーで存在し,ヒストン脱アセチル化酵素を阻害することを示したこの研究は,代謝の状態とエピジェネティックな制御との密接なかかわりを示唆する新たな一例となるだろう(図1).この研究では,βヒドロキシ酪酸がマウスの腎臓においてヒストンのアセチル化および遺伝子発現を制御していることを示したが,そのほかの組織においても同様の制御機構が存在するかどうかは今後の研究に期待したい.
すでに,ショウジョウバエにおいては薬剤あるいは遺伝子操作によるヒストン脱アセチル化酵素の阻害は長寿にかかわることが示されており6,7),ヒトにおいても,ケトン食やカロリー制限による健康効果の一部はβヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害により説明が可能なのかもしれない.
文 献
- Ladurner, A. G.: Rheostat control of gene expression by metabolites. Mol. Cell, 24, 1-11 (2006)[PubMed]
- Takahashi, H., McCaffery, J. M., Irizarry, R. A. et al.: Nucleocytosolic acetyl-coenzyme a synthetase is required for histone acetylation and global transcription. Mol. Cell, 23, 207-217 (2006)[PubMed]
- Imai, S., Armstrong, C. M., Kaeberlein, M. et al.: Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase. Nature, 403, 795-800 (2000)[PubMed]
- Kops, G. J., Dansen, T. B., Polderman, P. E. et al.: Forkhead transcription factor FOXO3a protects quiescent cells from oxidative stress. Nature, 419, 316-321 (2002)[PubMed]
- Kawai, K., Liu, S. X., Tyurin, V. A. et al.: Antioxidant and antiapoptotic function of metallothioneins in HL-60 cells challenged with copper nitrilotriacetate. Chem. Res. Toxicol., 13, 1275-1286 (2000)[PubMed]
- Rogina, B., Helfand, S. L., Frankel, S.: Longevity regulation by Drosophila Rpd3 deacetylase and caloric restriction. Science, 298, 1745 (2002)[PubMed]
- Kang, H. L., Benzer, S., Min, K. T.: Life extension in Drosophila by feeding a drug. Proc. Natl. Acad. Sci. USA, 99, 838-843 (2002)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院農学生命科学研究科博士課程 修了,同年 米国California大学San Francisco校 博士研究員を経て,2011年より理化学研究所基幹研究所 研究員.
研究テーマ:ヒストンの修飾とエピジェネティクス.
関心事:タンパク質の翻訳後修飾,とくに,アセチル化修飾やメチル化修飾がひき起こす生命現象,寿命の制御機構などについて幅広く研究を行っています.
Eric Verdin
米国California大学San Francisco校Senior Investigator.
研究室URL:http://labs.gladstone.ucsf.edu/verdin/
© 2012 島津忠広・Eric Verdin Licensed under CC 表示 2.1 日本