細菌Campylobacter jejuniに由来する最小のCas9の結晶構造
山田真理・渡邊裕斗・西増弘志・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:山田真理,渡邊裕斗,西増弘志,濡木 理
DOI: 10.7875/first.author.2017.030
Crystal structure of the minimal Cas9 from Campylobacter jejuni reveals the molecular diversity in the CRISPR-Cas9 systems.
Mari Yamada, Yuto Watanabe, Jonathan S. Gootenberg, Hisato Hirano, F. Ann Ran, Takanori Nakane, Ryuichiro Ishitani, Feng Zhang, Hiroshi Nishimasu, Osamu Nureki
Molecular Cell, 65, 1109-1121.e3 (2017)
CRISPR-Cas系にかかわるRNA依存性エンドヌクレアーゼCas9は,ガイドRNAと複合体を形成し標的となる2本鎖DNAを切断する.近年,Cas9を利用した新規の技術が多く開発され,基礎から応用にいたる幅広い研究分野において利用されている.今回,筆者らは,最小のCas9のひとつである細菌Campylobacter jejuniに由来するCas9の結晶構造をガイドRNAと標的DNAとの複合体として決定した.結晶構造から,C. jejuniに由来するCas9のガイドRNAは三重らせん構造を含む予想外の構造をもつことが明らかにされた.さらに,既知のCas9は非相補鎖の塩基をPAMとして認識するのに対し,C. jejuniに由来するCas9は相補鎖および非相補鎖の両方の塩基と相互作用しNNNVRYMという配列をPAMとして認識していた.今回の結果から,CRISPR-Cas9系における多様性が明らかにされるとともに,新たなゲノム編集ツールの開発の基盤ともなることが期待される.
原核生物のもつCRISPR-Cas(clustered regularly interspaced short palindromic repeat-CRISPR-associated protein)系は外来の核酸に対する獲得免疫機構としてはたらく.II型CRISPR-Cas系においてはRNA依存性エンドヌクレアーゼCas9が2種類のガイドRNA(CRISPR RNA:crRNA,および,trans-activating crRNA:tracrRNA)と複合体を形成し,crRNAと相補的な2本鎖DNAを切断する1).標的となるDNAの認識には,crRNAと標的DNAとのあいだの相補性にくわえ,標的となる配列の近傍に特定の塩基配列(protospacer adjacent motif:PAM)が必要である.約20塩基からなるガイド配列は自由に交換することができ,また,crRNAとtracrRNAとを連結したsingle-guide RNA(sgRNA)も同様に機能する1).したがって,近年,CRISPR-Cas9系は革新的なゲノム編集ツールとしてさまざまな研究分野において利用されている2).
異なる生物種に由来するCas9のアミノ酸配列は多様であり,また,ガイドRNAの配列も異なる.さらに,PAMもCas9により異なる.たとえば,細菌Streptococcus pyogenesに由来するCas9 1) はNGG,細菌Staphylococcus aureusに由来するCas9 3) はNNGRRT(RはA/G),細菌Francisella novicidaに由来するCas9 4)(新着論文レビュー でも掲載)はNGGという配列を,それぞれPAMとして認識する.S. pyogenesに由来するCas9 5-7)(文献7) は新着論文レビュー でも掲載),S. aureusに由来するCas9 8)(新着論文レビュー でも掲載),F. novicidaに由来するCas9 4) の結晶構造から,Cas9はRuvCドメイン,RECドメイン,HNHドメイン,WEDドメイン,PIドメインからなり,RuvCドメインとRECドメインはブリッジへリックスとよばれるArgに富むαへリックスにより連結されていることが明らかにされた.RuvCドメインおよびHNHドメインの2つのヌクレアーゼドメインの構造は高度に保存されている一方,ガイドRNAの認識に関与するRECドメインおよびWEDドメイン,および,PAMの認識に関与するPIドメインは多様な構造をもつ.
細菌Campylobacter jejuniに由来するCas9は984残基からなる最小のCas9のひとつであり,ガイドRNAの配列もほかのCas9とは異なる1).さらに,ほかのCas9はGリッチなPAMを認識するのに対し,C. jejuniに由来するCas9はNNNNACAという配列をPAMとして認識する9).しかし,C. jejuniに由来するCas9がガイドRNAに依存して標的となるDNAを認識し切断する分子機構は不明であった.
先行研究から,C. jejuniに由来するCas9はNNNNACAという配列をPAMとして認識することが示されていたが,PAMに対する特異性は完全には調べられていなかった9).そこで,C. jejuniに由来するCas9,sgRNA,および,16,384(4の7乗)種類のPAMをもつ標的プラスミドライブラリーを用いて,C. jejuniに由来するCas9の認識するPAMについて網羅的に解析した.その結果,C. jejuniに由来するCas9はNNNVRYM(VはA/G/C,RはA/G,YはT/C,MはA/C)という配列をPAMとして認識することが明らかにされた.さらに,in vitroにおける切断実験によりPAMに対する嗜好性が確認された.
C. jejuniに由来するCas9のPAMの認識機構およびDNAの切断機構の解明をめざし,C. jejuniに由来するCas9,sgRNA,標的DNAからなる複合体の結晶構造の解析を試みた.ほかのCas9の結晶化4,7,8) と同様に,核酸の配列や結晶化の条件を検討したが,構造決定に十分な結晶は得られなかった.先行研究から,DNAの切断の際にHNHドメインが構造変化を起こすことが示されており,その柔軟性により結晶化がさまたげられている可能性が考えられた.そこで,HNHドメインを削除したCas9変異体を調製し結晶化の条件を検討したところ,X線を回折する良質の結晶が得られた.最終的に,C. jejuniに由来するCas9変異体,sgRNA,AGAAACCをPAMとして含む標的DNAからなる複合体の結晶構造を2.4Å分解能で決定した(PDB ID:5X2G).
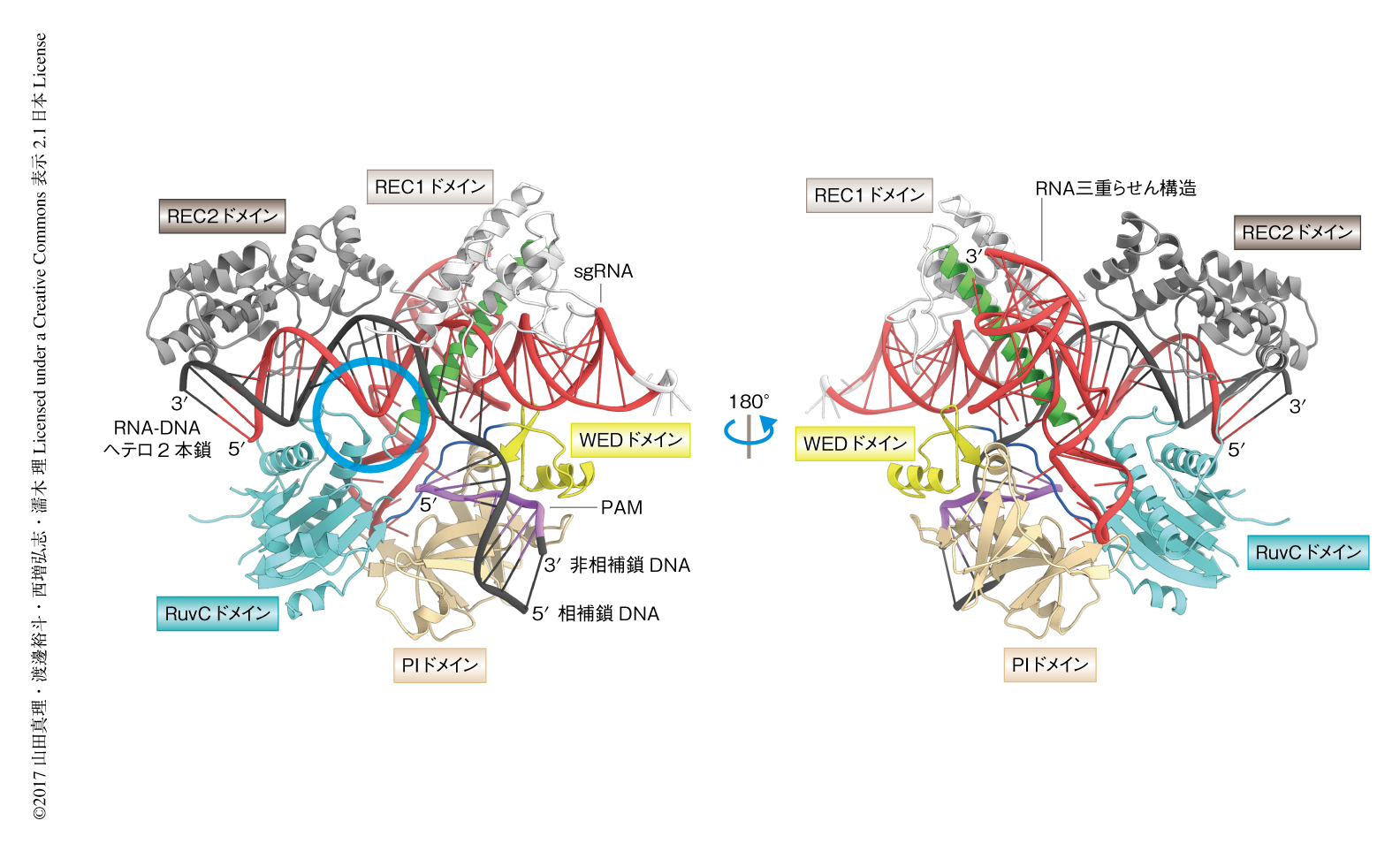
結晶構造から,C. jejuniに由来するCas9はほかのCas9と同様に,RECローブおよびNUCローブの2つのローブから構成されることが明らかにされた(図1).RECローブはREC1ドメインおよびREC2ドメインから構成され,NUCローブはRuvCドメイン,WEDドメイン,PIドメインから構成されていた.RuvCドメインとREC1ドメインはブリッジへリックスにより連結されていた.sgRNAはガイド領域,リピート領域,アンチリピート領域,スカフォールド領域から構成されていた.ガイド領域は相補鎖DNAとRNA-DNAヘテロ2本鎖を形成し,RECローブとNUCローブとのあいだに収容されていた.リピート領域とアンチリピート領域はリピート:アンチリピート2本鎖を形成し,REC1ドメインおよびWEDドメインにより認識されていた.相補鎖DNAと非相補鎖DNAはPAM 2本鎖を形成し,WEDドメインとPIドメインとのあいだに結合していた.
S. pyogenesに由来するCas9とは異なり,C. jejuniに由来するCas9のREC1ドメインおよびPIドメインに挿入領域は存在しなかった.さらに,C. jejuniに由来するCas9はS. aureusに由来するCas9よりも小型のWEDドメインをもっていた.したがって,これらの違いがC. jejuniに由来するCas9の最小化に貢献していると考えられた.
結晶構造から,C. jejuniに由来するCas9のsgRNAのスカフォールド領域はシュードノットを形成していることが明らかにされた(図1).このことは,塩基配列からは予想されていなかった.シュードノットはRNA三重らせん構造により安定化され,RECローブおよびNUCローブと相互作用していた.変異体の解析の結果から,この三重鎖らせん構造はDNAの切断活性に必須であることが確かめられた.ほかのCas9のsgRNAのスカフォールド領域は複数のステムループから構成されている4,7,8).したがって,C. jejuniに由来するCas9のsgRNAはほかのCas9のsgRNAとは構造的に大きく異なっていた.さらに,C. jejuniに由来するCas9のsgRNAの含むRNAらせん三重鎖は,テロメラーゼやリボスイッチの含むRNA三重らせん構造とは異なる新規なものであった.
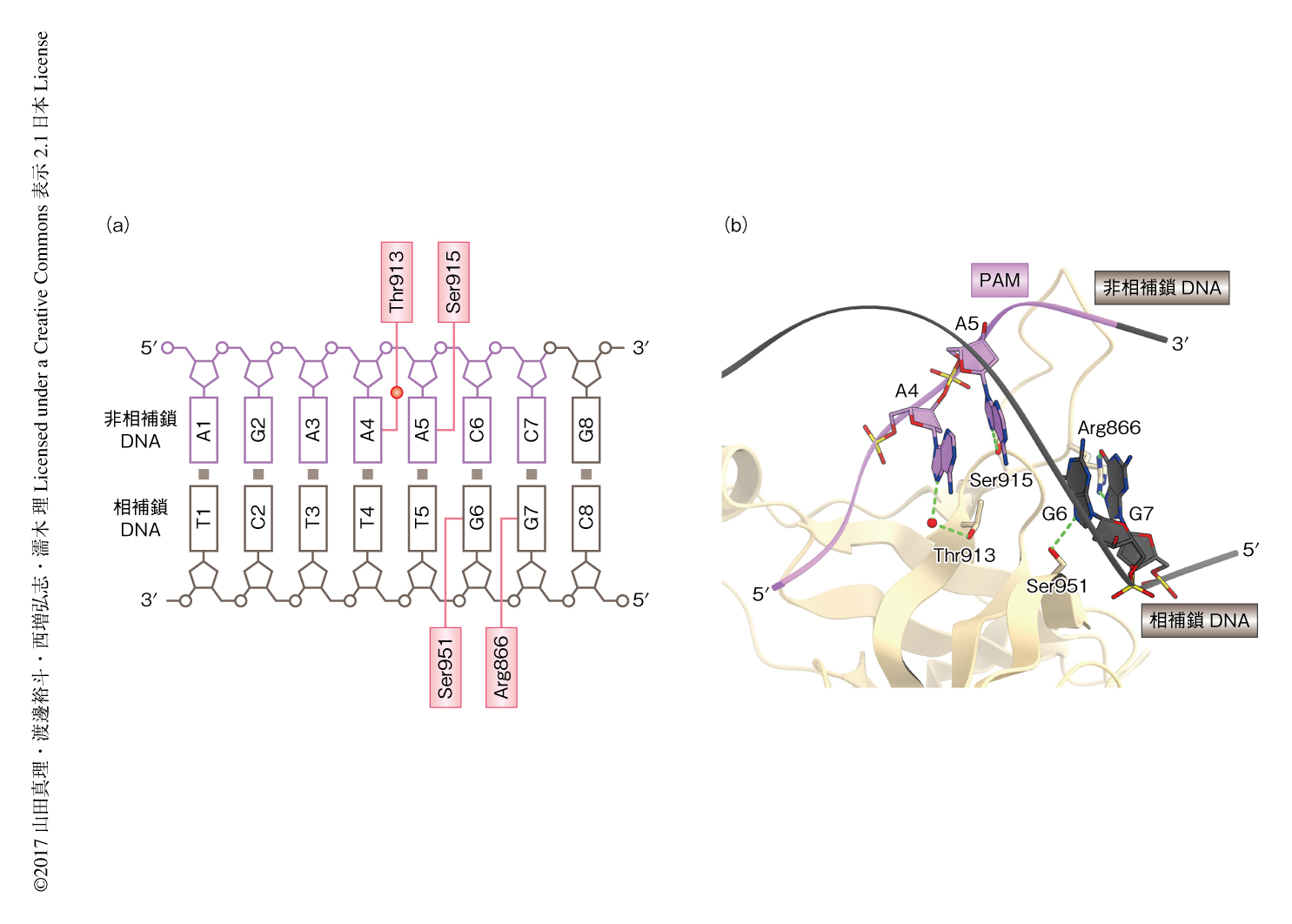
C. jejuniに由来するCas9は非相補鎖のNNNVRYMという配列をPAMとして認識する.結晶構造において,AGAAACCをPAMとして含むPAM 2本鎖はWEDドメインとPIドメインとのあいだに結合していた.結晶構造から,C. jejuniに由来するCas9によるPAMの認識機構が明らかにされた(図2).C. jejuniに由来するCas9はPAMの1番目から3番目の塩基に対し特異性をもたないことと一致して,A1,G2,A3はCas9と相互作用していなかった.一方,非相補鎖のA4のN7はThr913と水分子を介し水素結合していた.モデリングから,T4はThr913と立体障害を起こすことが示唆された.これは,PAMの4番目のV塩基に対する嗜好性と一致した.非相補鎖のA5のN7はSer915と水素結合していた.N7はプリン塩基に共通するため,G5も同様に認識されると考えられた.したがって,PAMの5番目のR塩基に対する特異性が説明された.予想外なことに,非相補鎖のC6はCas9と相互作用していなかった.一方,相補鎖のG6のN7がSer951と水素結合を形成していた.したがって,C. jejuniに由来するCas9は非相補鎖の6番目のY塩基ではなく,相補鎖のR塩基を認識することが明らかにされた.同様に,非相補鎖のC7は認識されておらず,相補鎖のG7がArg866と水素結合していた.さらに,AGAAACAをPAMとして含む結晶構造(PDB ID:5X2H)においては,非相補鎖のA7ではなく相補鎖のT7がArg866と水素結合していた.したがって,C. jejuniに由来するCas9は非相補鎖の7番目のM塩基ではなく,相補鎖のK塩基を認識することが明らかにされた.以上の結果から,非相補鎖に存在する塩基をPAMとして認識する既知のCas9 4,5,8) とは異なり,C. jejuniに由来するCas9は相補鎖および非相補鎖に存在する塩基と相互作用することにより,NNNVRYMという配列をPAMとして認識することが明らかにされた.
今回,決定されたC. jejuniに由来するCas9の結晶構造から,CRISPR-Cas9系におけるガイドRNAおよびPAMの認識機構の予想外の多様性が明らかにされた.C. jejuniに由来するCas9は真核細胞においてDNAの切断活性が弱いためゲノム編集には利用できないと考えられてきた3).しかし,ごく最近,ガイドRNAおよびPAMの配列を検討することによりC. jejuniに由来するCas9を利用したゲノム編集に成功したとの報告がなされた10).小型のC. jejuniに由来するCas9はウイルスベクターへの導入の効率が高いなどの利点があるため,ゲノム編集への応用が期待される.したがって,今回,得られた構造情報は,より有用な小型のCas9改変体の開発の基盤としても期待される.
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:CRISPR-Cas系の構造解析.
抱負:現在の研究室での残り1年を有意義に過ごしたい.
渡邊 裕斗(Yuto Watanabe)
略歴:名古屋大学医学部 在学中.
研究テーマ:CRISPR-Cas9系.大脳の発生におけるメカノセンシングおよび超微形態.
西増 弘志(Hiroshi Nishimasu)
略歴:2007年 東京大学大学院農学生命科学研究科 修了,2013年より東京大学大学院理学系研究科 助教,科学技術振興機構 さきがけ研究者 兼任.
関心事:新しいことに挑戦したい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2017 山田真理・渡邊裕斗・西増弘志・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:山田真理,渡邊裕斗,西増弘志,濡木 理
DOI: 10.7875/first.author.2017.030
Crystal structure of the minimal Cas9 from Campylobacter jejuni reveals the molecular diversity in the CRISPR-Cas9 systems.
Mari Yamada, Yuto Watanabe, Jonathan S. Gootenberg, Hisato Hirano, F. Ann Ran, Takanori Nakane, Ryuichiro Ishitani, Feng Zhang, Hiroshi Nishimasu, Osamu Nureki
Molecular Cell, 65, 1109-1121.e3 (2017)
要 約
CRISPR-Cas系にかかわるRNA依存性エンドヌクレアーゼCas9は,ガイドRNAと複合体を形成し標的となる2本鎖DNAを切断する.近年,Cas9を利用した新規の技術が多く開発され,基礎から応用にいたる幅広い研究分野において利用されている.今回,筆者らは,最小のCas9のひとつである細菌Campylobacter jejuniに由来するCas9の結晶構造をガイドRNAと標的DNAとの複合体として決定した.結晶構造から,C. jejuniに由来するCas9のガイドRNAは三重らせん構造を含む予想外の構造をもつことが明らかにされた.さらに,既知のCas9は非相補鎖の塩基をPAMとして認識するのに対し,C. jejuniに由来するCas9は相補鎖および非相補鎖の両方の塩基と相互作用しNNNVRYMという配列をPAMとして認識していた.今回の結果から,CRISPR-Cas9系における多様性が明らかにされるとともに,新たなゲノム編集ツールの開発の基盤ともなることが期待される.
はじめに
原核生物のもつCRISPR-Cas(clustered regularly interspaced short palindromic repeat-CRISPR-associated protein)系は外来の核酸に対する獲得免疫機構としてはたらく.II型CRISPR-Cas系においてはRNA依存性エンドヌクレアーゼCas9が2種類のガイドRNA(CRISPR RNA:crRNA,および,trans-activating crRNA:tracrRNA)と複合体を形成し,crRNAと相補的な2本鎖DNAを切断する1).標的となるDNAの認識には,crRNAと標的DNAとのあいだの相補性にくわえ,標的となる配列の近傍に特定の塩基配列(protospacer adjacent motif:PAM)が必要である.約20塩基からなるガイド配列は自由に交換することができ,また,crRNAとtracrRNAとを連結したsingle-guide RNA(sgRNA)も同様に機能する1).したがって,近年,CRISPR-Cas9系は革新的なゲノム編集ツールとしてさまざまな研究分野において利用されている2).
異なる生物種に由来するCas9のアミノ酸配列は多様であり,また,ガイドRNAの配列も異なる.さらに,PAMもCas9により異なる.たとえば,細菌Streptococcus pyogenesに由来するCas9 1) はNGG,細菌Staphylococcus aureusに由来するCas9 3) はNNGRRT(RはA/G),細菌Francisella novicidaに由来するCas9 4)(新着論文レビュー でも掲載)はNGGという配列を,それぞれPAMとして認識する.S. pyogenesに由来するCas9 5-7)(文献7) は新着論文レビュー でも掲載),S. aureusに由来するCas9 8)(新着論文レビュー でも掲載),F. novicidaに由来するCas9 4) の結晶構造から,Cas9はRuvCドメイン,RECドメイン,HNHドメイン,WEDドメイン,PIドメインからなり,RuvCドメインとRECドメインはブリッジへリックスとよばれるArgに富むαへリックスにより連結されていることが明らかにされた.RuvCドメインおよびHNHドメインの2つのヌクレアーゼドメインの構造は高度に保存されている一方,ガイドRNAの認識に関与するRECドメインおよびWEDドメイン,および,PAMの認識に関与するPIドメインは多様な構造をもつ.
細菌Campylobacter jejuniに由来するCas9は984残基からなる最小のCas9のひとつであり,ガイドRNAの配列もほかのCas9とは異なる1).さらに,ほかのCas9はGリッチなPAMを認識するのに対し,C. jejuniに由来するCas9はNNNNACAという配列をPAMとして認識する9).しかし,C. jejuniに由来するCas9がガイドRNAに依存して標的となるDNAを認識し切断する分子機構は不明であった.
1.C. jejuniに由来するCas9が認識するPAM
先行研究から,C. jejuniに由来するCas9はNNNNACAという配列をPAMとして認識することが示されていたが,PAMに対する特異性は完全には調べられていなかった9).そこで,C. jejuniに由来するCas9,sgRNA,および,16,384(4の7乗)種類のPAMをもつ標的プラスミドライブラリーを用いて,C. jejuniに由来するCas9の認識するPAMについて網羅的に解析した.その結果,C. jejuniに由来するCas9はNNNVRYM(VはA/G/C,RはA/G,YはT/C,MはA/C)という配列をPAMとして認識することが明らかにされた.さらに,in vitroにおける切断実験によりPAMに対する嗜好性が確認された.
2.C. jejuniに由来するCas9,sgRNA,標的DNAからなる複合体の結晶構造
C. jejuniに由来するCas9のPAMの認識機構およびDNAの切断機構の解明をめざし,C. jejuniに由来するCas9,sgRNA,標的DNAからなる複合体の結晶構造の解析を試みた.ほかのCas9の結晶化4,7,8) と同様に,核酸の配列や結晶化の条件を検討したが,構造決定に十分な結晶は得られなかった.先行研究から,DNAの切断の際にHNHドメインが構造変化を起こすことが示されており,その柔軟性により結晶化がさまたげられている可能性が考えられた.そこで,HNHドメインを削除したCas9変異体を調製し結晶化の条件を検討したところ,X線を回折する良質の結晶が得られた.最終的に,C. jejuniに由来するCas9変異体,sgRNA,AGAAACCをPAMとして含む標的DNAからなる複合体の結晶構造を2.4Å分解能で決定した(PDB ID:5X2G).
結晶構造から,C. jejuniに由来するCas9はほかのCas9と同様に,RECローブおよびNUCローブの2つのローブから構成されることが明らかにされた(図1).RECローブはREC1ドメインおよびREC2ドメインから構成され,NUCローブはRuvCドメイン,WEDドメイン,PIドメインから構成されていた.RuvCドメインとREC1ドメインはブリッジへリックスにより連結されていた.sgRNAはガイド領域,リピート領域,アンチリピート領域,スカフォールド領域から構成されていた.ガイド領域は相補鎖DNAとRNA-DNAヘテロ2本鎖を形成し,RECローブとNUCローブとのあいだに収容されていた.リピート領域とアンチリピート領域はリピート:アンチリピート2本鎖を形成し,REC1ドメインおよびWEDドメインにより認識されていた.相補鎖DNAと非相補鎖DNAはPAM 2本鎖を形成し,WEDドメインとPIドメインとのあいだに結合していた.
S. pyogenesに由来するCas9とは異なり,C. jejuniに由来するCas9のREC1ドメインおよびPIドメインに挿入領域は存在しなかった.さらに,C. jejuniに由来するCas9はS. aureusに由来するCas9よりも小型のWEDドメインをもっていた.したがって,これらの違いがC. jejuniに由来するCas9の最小化に貢献していると考えられた.
3.sgRNAの立体構造
結晶構造から,C. jejuniに由来するCas9のsgRNAのスカフォールド領域はシュードノットを形成していることが明らかにされた(図1).このことは,塩基配列からは予想されていなかった.シュードノットはRNA三重らせん構造により安定化され,RECローブおよびNUCローブと相互作用していた.変異体の解析の結果から,この三重鎖らせん構造はDNAの切断活性に必須であることが確かめられた.ほかのCas9のsgRNAのスカフォールド領域は複数のステムループから構成されている4,7,8).したがって,C. jejuniに由来するCas9のsgRNAはほかのCas9のsgRNAとは構造的に大きく異なっていた.さらに,C. jejuniに由来するCas9のsgRNAの含むRNAらせん三重鎖は,テロメラーゼやリボスイッチの含むRNA三重らせん構造とは異なる新規なものであった.
4.PAMの認識機構
C. jejuniに由来するCas9は非相補鎖のNNNVRYMという配列をPAMとして認識する.結晶構造において,AGAAACCをPAMとして含むPAM 2本鎖はWEDドメインとPIドメインとのあいだに結合していた.結晶構造から,C. jejuniに由来するCas9によるPAMの認識機構が明らかにされた(図2).C. jejuniに由来するCas9はPAMの1番目から3番目の塩基に対し特異性をもたないことと一致して,A1,G2,A3はCas9と相互作用していなかった.一方,非相補鎖のA4のN7はThr913と水分子を介し水素結合していた.モデリングから,T4はThr913と立体障害を起こすことが示唆された.これは,PAMの4番目のV塩基に対する嗜好性と一致した.非相補鎖のA5のN7はSer915と水素結合していた.N7はプリン塩基に共通するため,G5も同様に認識されると考えられた.したがって,PAMの5番目のR塩基に対する特異性が説明された.予想外なことに,非相補鎖のC6はCas9と相互作用していなかった.一方,相補鎖のG6のN7がSer951と水素結合を形成していた.したがって,C. jejuniに由来するCas9は非相補鎖の6番目のY塩基ではなく,相補鎖のR塩基を認識することが明らかにされた.同様に,非相補鎖のC7は認識されておらず,相補鎖のG7がArg866と水素結合していた.さらに,AGAAACAをPAMとして含む結晶構造(PDB ID:5X2H)においては,非相補鎖のA7ではなく相補鎖のT7がArg866と水素結合していた.したがって,C. jejuniに由来するCas9は非相補鎖の7番目のM塩基ではなく,相補鎖のK塩基を認識することが明らかにされた.以上の結果から,非相補鎖に存在する塩基をPAMとして認識する既知のCas9 4,5,8) とは異なり,C. jejuniに由来するCas9は相補鎖および非相補鎖に存在する塩基と相互作用することにより,NNNVRYMという配列をPAMとして認識することが明らかにされた.
おわりに
今回,決定されたC. jejuniに由来するCas9の結晶構造から,CRISPR-Cas9系におけるガイドRNAおよびPAMの認識機構の予想外の多様性が明らかにされた.C. jejuniに由来するCas9は真核細胞においてDNAの切断活性が弱いためゲノム編集には利用できないと考えられてきた3).しかし,ごく最近,ガイドRNAおよびPAMの配列を検討することによりC. jejuniに由来するCas9を利用したゲノム編集に成功したとの報告がなされた10).小型のC. jejuniに由来するCas9はウイルスベクターへの導入の効率が高いなどの利点があるため,ゲノム編集への応用が期待される.したがって,今回,得られた構造情報は,より有用な小型のCas9改変体の開発の基盤としても期待される.
文 献
- Jinek, M., Chylinski, K., Fonfara, I. et al.: A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 337, 816-821 (2012)[PubMed]
- Cong, L., Ran, F. A., Cox, D. et al.: Multiplex genome engineering using CRISPR/Cas systems. Science, 339, 819-823 (2013)[PubMed]
- Ran, F. A., Cong, L., Yan, W. X. et al.: In vivo genome editing using Staphylococcus aureus Cas9. Nature, 520, 186-191 (2015)[PubMed]
- Hirano, H., Gootenberg, J. S., Horii, T. et al.: Structure and engineering of Francisella novicida Cas9. Cell, 164, 950-961 (2016)[PubMed] [新着論文レビュー]
- Anders, C., Niewoehner, O., Duerst, A. et al.: Structural basis of PAM-dependent target DNA recognition by the Cas9 endonuclease. Nature, 513, 569-573 (2014)[PubMed]
- Jinek, M., Jiang, F., Taylor, D. W. et al.: Structures of Cas9 endonucleases reveal RNA-mediated conformational activation. Science, 343, 1247997 (2014)[PubMed]
- Nishimasu, H., Ran, F. A., Hsu, P. D. et al.: Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell, 156, 935-949 (2014)[PubMed] [新着論文レビュー]
- Nishimasu, H., Cong, L., Yan, W. X. et al.: Crystal structure of Staphylococcus aureus Cas9. Cell, 162, 1113-1126 (2015)[PubMed] [新着論文レビュー]
- Fonfara, I., Le Rhun, A., Chylinski, K. et al.: Phylogeny of Cas9 determines functional exchangeability of dual-RNA and Cas9 among orthologous type II CRISPR-Cas systems. Nucleic Acids Res., 42, 2577-2590 (2014)[PubMed]
- Kim, E., Koo, T., Park, S. W. et al.: In vivo genome editing with a small Cas9 orthologue derived from Campylobacter jejuni. Nat. Commun., 8, 14500 (2017)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院理学系研究科博士課程 在学中.
研究テーマ:CRISPR-Cas系の構造解析.
抱負:現在の研究室での残り1年を有意義に過ごしたい.
渡邊 裕斗(Yuto Watanabe)
略歴:名古屋大学医学部 在学中.
研究テーマ:CRISPR-Cas9系.大脳の発生におけるメカノセンシングおよび超微形態.
西増 弘志(Hiroshi Nishimasu)
略歴:2007年 東京大学大学院農学生命科学研究科 修了,2013年より東京大学大学院理学系研究科 助教,科学技術振興機構 さきがけ研究者 兼任.
関心事:新しいことに挑戦したい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2017 山田真理・渡邊裕斗・西増弘志・濡木 理 Licensed under CC 表示 2.1 日本