ATG結合系はオートファゴソーム内膜の分解に重要である
坪山幸太郎・小山-本田郁子・水島 昇
(東京大学大学院医学系研究科 分子生物学分野)
email:坪山幸太郎,小山-本田郁子,水島 昇
DOI: 10.7875/first.author.2016.114
The ATG conjugation systems are important for degradation of the inner autophagosomal membrane.
Kotaro Tsuboyama, Ikuko Koyama-Honda, Yuriko Sakamaki, Masato Koike, Hideaki Morishita, Noboru Mizushima
Science, 354, 1036-1041 (2016)
オートファジーは細胞質におけるタンパク質の分解機構のおもなひとつである.栄養飢餓などによりオートファジーが誘導されると,オートファゴソームとよばれる脂質二重膜により細胞質が取り込まれ,これがリソソームと融合しオートリソソームになる.ATG結合系は,このオートファゴソームの形成の後期の過程において重要と考えられてきた.今回,筆者らは,ATG結合系を欠損した細胞においても,オートファゴソームに局在するSNAREタンパク質であるSTX17陽性のオートファゴソーム様の構造が低効率ながら形成されることを見い出した.これらの構造はリソソームと正常に融合したが,そののちのオートファゴソーム内膜の分解は顕著に遅延した.これらの結果から,ATG結合系はオートリソソームの形成には必須ではないが,オートファゴソームの内膜と外膜の分離にひきつづく内膜の効率的な分解に重要であることが示唆された.
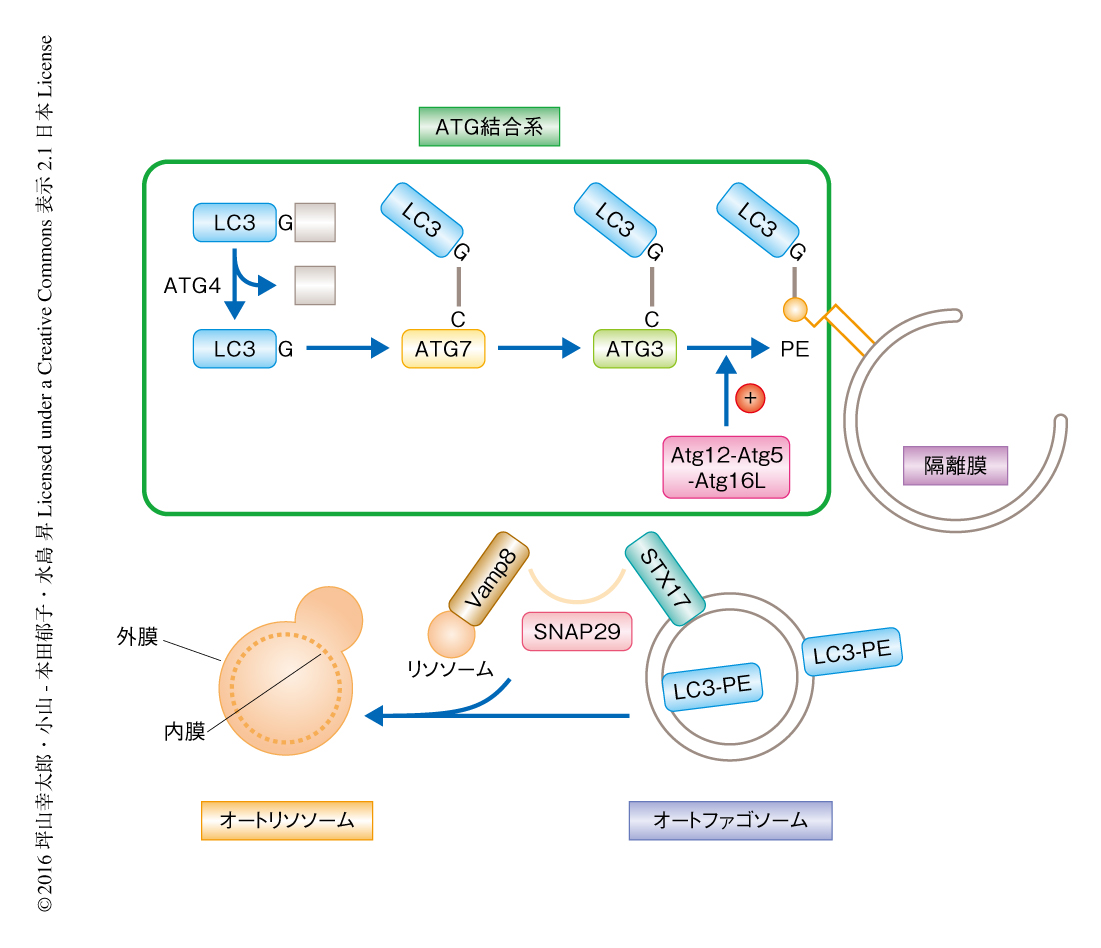
内部に消化酵素を含み細胞におけるタンパク質分解に寄与するリソソームは,およそ半世紀まえに発見された.しかしその当時,分解されるべきタンパク質など細胞質に存在する基質がどのように脂質一重膜を介したリソソームの内部に送り届けられるのかは不明であった.この謎を解き明かしたのがオートファジーである.オートファジーはプロテアソームとならぶ,細胞質におけるタンパク質の分解機構である1-3).隔離膜とよばれる脂質膜の袋状の構造が伸長し細胞質の一部をとりかこむ.脂質膜の端が内膜と外膜とに分離することにより,脂質二重膜からなるオートファゴソームが形成される4).消化酵素を含むリソソームがオートファゴソーム外膜と融合すると,まず,外膜と内膜とのあいだにリソソームの内部の消化酵素が流入し,内膜のみが選択的に分解される.オートファゴソーム内膜の分解により,オートファゴソームに取り込まれた細胞質とリソソームの消化酵素とが出会い細胞質が分解される(図1).オートファジーは細胞質に存在する基質をリソソームの内部に送り届ける機構であることから,このオートファゴソーム内膜の分解という過程はきわめて重要である.
オートファゴソームの形成には,ユビキチン様タンパク質であるATG12およびLC3(出芽酵母においては,ATG8)のATG結合系が重要であることが知られている5)(図1).ATG12およびATG8は,ユビキチン結合系と同様に,ユビキチン活性化酵素様酵素であるATG7,ユビキチン結合酵素様酵素であるATG10およびATG3によりそれぞれ触媒され,共有結合によりATG5およびホスファチジルエタノールアミンと結合する.これらATG結合系を欠損した細胞においては最終産物であるLC3-ホスファチジルエタノールアミン複合体が産生されず,オートリソソームはほとんど観察されないものの,隔離膜や二重膜のオートファゴソーム様の構造が多く観察される6,7).このことから,ATG結合系はオートファゴソームの閉鎖および完成に必要であろうと推測されていた.しかしながら,ATG結合系を欠損した細胞にはオートファゴソームの実用的なマーカータンパク質であるLC3がオートファゴソーム膜に存在しないためこれ以上の解析が進まず,隔離膜がどのような運命をたどるのかは不明であった.この研究においては,近年,筆者らの研究グループが発表した,オートファゴソームに局在するSNAREタンパク質であるSTX17 8)(新着論文レビュー でも掲載)をオートファゴソームのマーカーとして,ATG結合系を欠損した細胞において隔離膜の運命を解析した.
哺乳類細胞におけるオートファゴソームの成熟の過程について調べるため,古典的な隔離膜およびオートファゴソームのマーカーであるLC3と,オートファゴソームに関連するSNAREタンパク質であるSTX17を用いて,野生型の細胞を用いて蛍光により生細胞を観察した.伸張の過程にある隔離膜はおもに楕円状(実際は,3次元の楕円体)で,LC3陽性であったがSTX17陰性であった.そののち,隔離膜が閉鎖してオートファゴソームが正円(実際は,3次元の球)になる前後において,STX17のシグナルが陽性になった.このオートファゴソームの形状の変化は内膜と外膜との分離に起因するのではないかと推測された.
オートファゴソームとリソソームとの融合の過程について観察するため,STX17とリソソームのマーカーであるLAMP1および酸性コンパートメントのマーカーであるLysoTracker Redを用いて同様に生細胞を観察した.STX17がオートファゴソームに局在したのち,小さな複数のLAMP1陽性のリソソームがそこに融合し,オートファゴソームがLAMP1陽性になるようすが観察された.リソソームが融合するタイミングにおいて,LysoTrackerのシグナルがSTX17と重なりリング状に現われた.これは,オートファゴソームの内膜と外膜とのあいだがさきんじて酸性化されるようすを表わす.その約7分後,LysoTrackerのリング状のシグナルは内部の均一なシグナルに変化した.これは,オートファゴソーム内膜が分解され,リソソームの内部の消化酵素がオートファゴソームの内部に注入された過程を示す.その約2分後,STX17はオートファゴソームから解離した.このように,哺乳類細胞におけるオートファゴソームの一生,とくに,これまであまり解析されていなかった成熟の過程が生細胞の観察により示された.
ATG結合系を欠損した細胞においては,現在までオートファゴソームの唯一のマーカーであるLC3-ホスファチジルエタノールアミン複合体がオートファゴソームに局在しないため,隔離膜が形成されたのちの解析は困難であった.そこで,オートファゴソームに関連するSNAREタンパク質であるSTX17をマーカーとして用いたところ,ATG3,ATG5,ATG7といったATG結合系のタンパク質を欠損した細胞において多数のSTX17陽性のオートファゴソーム様の構造が観察された.一方で,オートファジーの上流タンパク質であるATG9,ATG14,FIP200を欠損した細胞においてこれらの構造は観察されなかった.また,野生型の細胞においては通常の培養条件ではSTX17陽性のオートファゴソーム様の構造はほとんど観察されなかったが,ATG結合系を欠損した細胞においては通常の培養条件でもSTX17陽性の構造が多く観察された.
ATG3欠損細胞においてSTX17陽性のオートファゴソーム様の構造はそのSNAREパートナーであるSNAP29とよく共局在し,おおむね正常にLysoTracker陽性になるようすが観察された.このことから,ATG結合系を欠損した細胞において,オートファゴソーム様の構造はSTX17を獲得しリソソームと融合することが示された.
ATG結合系を欠損した細胞におけるオートファジーの活性を再検討するため,CRISPR-Cas9系によるゲノム編集技術を用いて,ATG結合系のタンパク質であるATG3あるいはATG5を欠損した細胞,および,オートファジーの上流タンパク質であるATG9,FIP200を欠損した細胞を作製した.ATG3欠損細胞およびATG5欠損細胞において,リソソームに依存的な長寿命のタンパク質の分解活性,および,p62を対象とする選択的なオートファジーの活性は,オートファジーの上流タンパク質を欠損した細胞と同じ程度に低下していた.
ATG結合系を欠損した細胞において,STX17陽性のオートファゴソーム様の構造は野生型の細胞より2倍ほど多く観察されるにもかかわらずオートファジーの活性は低下していたことから,どの過程が遅延しているかくわしく調べた.ATG5陽性の隔離膜の出現の頻度は野生型の細胞とATG3欠損細胞とで同等であった.また,ATG5陽性の隔離膜からSTX17陽性のオートファゴソーム様の構造への移行率を調べると,野生型の細胞においては90%以上であった一方,ATG3欠損細胞ではおよそ30%であった.このことから,以前から提唱されていたように,ATG結合系はオートファゴソームの完成に重要な役割をはたすことが示唆された.
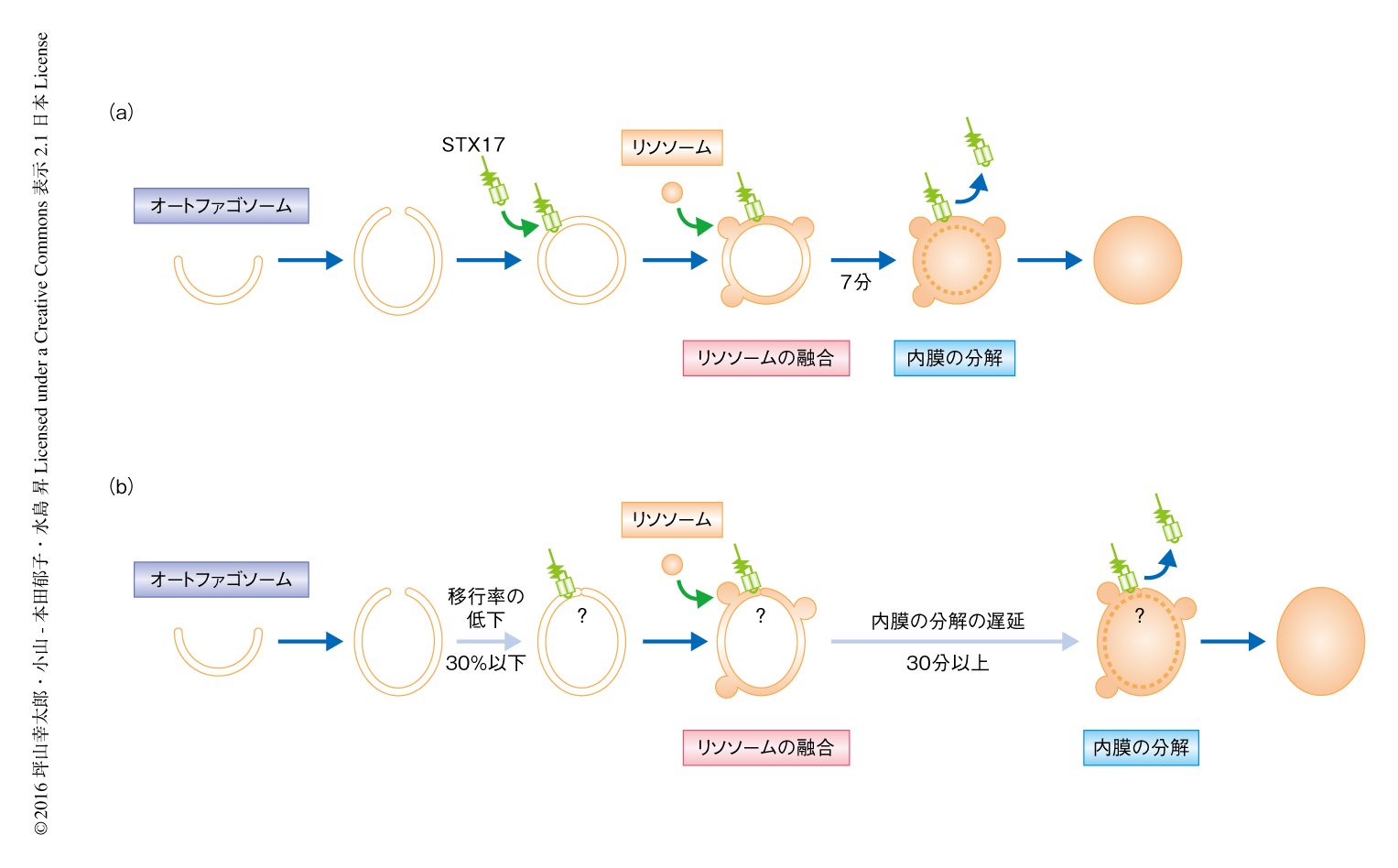
ATG結合系を欠損した細胞においてオートファゴソームが完成したのちの過程を調べるため,STX17とLysoTrackerを用いて生細胞を観察したところ,野生型の細胞では7分程度でおわるオートファゴソーム内膜の分解が,ATG結合系を欠損した細胞においては30分以上と顕著に遅延した.免疫電子顕微鏡による観察では,ATG3欠損細胞において,LAMP1陽性にもかかわらず内膜の残存するオートファゴソームが観察された.オートファゴソーム内膜の分解の遅延はATG5欠損細胞およびATG7欠損細胞においても観察された.
ATG3欠損細胞においてはときおりオートファゴソーム内膜の分解されるようすが観察され,その際には,野生型の細胞と同様にSTX17が解離するようすも観察された.このことから,STX17はオートファゴソーム内膜が残存するかぎり,オートファゴソームに局在することが示唆された.この結果と一致するように,STX17陽性のオートファゴソーム様の構造の寿命は野生型の細胞においては約10分であったが,ATG3欠損細胞においては約1時間であった.このように,STX17陽性のオートファゴソーム様の構造の寿命が長いため,ATG結合系を欠損した細胞においては通常の培養条件でも基底レベルのオートファジーにより形成されたオートファゴソームが長時間にわたり残存するため,多数のSTX17陽性のオートファゴソーム様の構造が観察されると考えられた.
ATG3欠損細胞においては,STX17陽性のオートファゴソーム様の構造の形状はやや楕円状になる傾向があった.外膜と内膜との分離によりオートファゴソームの形状が変化するという仮説が正しければ,ATG3欠損細胞においてはオートファゴソームの形成の最終の過程である外膜と内膜との分離が不十分である可能性がある.実際に,ATG3欠損細胞においては,頻度は低いものの,極端な例ではSTX17陽性のリング状の構造が一過的に開く場合が観察された.
筆者らにより,ATG結合系は,隔離膜からオートファゴソームへの移行,および,オートファゴソーム内膜の分解を効率的にひき起こすために重要であることが示された(図2).前者については,ATG結合系がオートファゴソームの閉鎖に必要であるという過去の知見と一致した.筆者らは,ATG結合系によりひき起こされるオートファゴソームの閉鎖は,オートファゴソームの形状が球状になる過程および効率的なオートファゴソーム内膜の分解には必要であるが,STX17の局在およびリソソームとの融合には必須ではないと考えている.これは,ATG結合系に依存しない別経路があるわけではなく,典型的なオートファジーそのものがATG結合系に非依存的にもわずかに進行しうることを示す.なぜ,ATG結合系がないとオートファゴソーム内膜がリソソームの内部の消化酵素に抵抗性になるかは残された課題である.筆者らは,内側にくびれた膜が切り離されたのちリソソームの内部の消化酵素により効率よく分解されることは,オートファゴソーム内膜にかぎられた現象ではないと考えている.たとえば,エンドソーム膜が内側にくびれてできる多数の小胞を内包する後期エンドソーム(多胞体ともよばれる)や,リソソーム膜が内側にくびれるミクロオートファジーなども,オートファゴソーム内膜と共通の機構により切り離されてリソソームの内部の消化酵素に感受性になる可能性がある.
ATG結合系を欠損した細胞においては,ゆっくりとではあるがオートファゴソーム内膜が分解されオートファゴソームが成熟していたことから,オートファジーの活性はわずかに残存していることが示唆された.ATG9やFIP200といったオートファジーの上流タンパク質を欠損したマウスは胎生致死であるが,ATG3やATG5といったATG結合系のタンパク質を欠損したマウスは出生の直後に死亡するものの出生まではおおむね正常に成熟する9-13) という違いが,このオートファジーの微量の活性から説明される可能性がある.
現在まで,ATG関連タンパク質はもっぱらオートファゴソームの形成において着目されてきたが,その成熟の過程においても重要であることが示された.今後,なぜオートファゴソーム内膜のみが選択的に分解されるのか,また,オートファゴソームの外膜と内膜との分離はどのように起こるのかなどについて,さらに詳細な分子機構の解明が期待される.
略歴:東京大学大学院新領域創成科学研究科博士課程 在籍中.
抱負:光学顕微鏡を用いて細かな分子機構を解明していきたい.
小山-本田郁子(Ikuko Koyama-Honda)
略歴:2002年 名古屋大学大学院理学系研究科博士課程 修了,ERATO-SORST楠見膜組織能プロジェクト 研究員,ICORP膜機構プロジェクト 研究員,東京医科歯科大学大学院医歯学総合研究科 研究員を経て,2012年より東京大学大学院医学系研究科 助教.
抱負:つぎの興味は,オートファゴソームの閉鎖の機構,および,内膜と外膜との分化です.
水島 昇(Noboru Mizushima)
東京大学大学院医学系研究科 教授.
研究室URL:http://square.umin.ac.jp/molbiol/index.html
© 2016 坪山幸太郎・小山-本田郁子・水島 昇 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 分子生物学分野)
email:坪山幸太郎,小山-本田郁子,水島 昇
DOI: 10.7875/first.author.2016.114
The ATG conjugation systems are important for degradation of the inner autophagosomal membrane.
Kotaro Tsuboyama, Ikuko Koyama-Honda, Yuriko Sakamaki, Masato Koike, Hideaki Morishita, Noboru Mizushima
Science, 354, 1036-1041 (2016)
要 約
オートファジーは細胞質におけるタンパク質の分解機構のおもなひとつである.栄養飢餓などによりオートファジーが誘導されると,オートファゴソームとよばれる脂質二重膜により細胞質が取り込まれ,これがリソソームと融合しオートリソソームになる.ATG結合系は,このオートファゴソームの形成の後期の過程において重要と考えられてきた.今回,筆者らは,ATG結合系を欠損した細胞においても,オートファゴソームに局在するSNAREタンパク質であるSTX17陽性のオートファゴソーム様の構造が低効率ながら形成されることを見い出した.これらの構造はリソソームと正常に融合したが,そののちのオートファゴソーム内膜の分解は顕著に遅延した.これらの結果から,ATG結合系はオートリソソームの形成には必須ではないが,オートファゴソームの内膜と外膜の分離にひきつづく内膜の効率的な分解に重要であることが示唆された.
はじめに
内部に消化酵素を含み細胞におけるタンパク質分解に寄与するリソソームは,およそ半世紀まえに発見された.しかしその当時,分解されるべきタンパク質など細胞質に存在する基質がどのように脂質一重膜を介したリソソームの内部に送り届けられるのかは不明であった.この謎を解き明かしたのがオートファジーである.オートファジーはプロテアソームとならぶ,細胞質におけるタンパク質の分解機構である1-3).隔離膜とよばれる脂質膜の袋状の構造が伸長し細胞質の一部をとりかこむ.脂質膜の端が内膜と外膜とに分離することにより,脂質二重膜からなるオートファゴソームが形成される4).消化酵素を含むリソソームがオートファゴソーム外膜と融合すると,まず,外膜と内膜とのあいだにリソソームの内部の消化酵素が流入し,内膜のみが選択的に分解される.オートファゴソーム内膜の分解により,オートファゴソームに取り込まれた細胞質とリソソームの消化酵素とが出会い細胞質が分解される(図1).オートファジーは細胞質に存在する基質をリソソームの内部に送り届ける機構であることから,このオートファゴソーム内膜の分解という過程はきわめて重要である.
オートファゴソームの形成には,ユビキチン様タンパク質であるATG12およびLC3(出芽酵母においては,ATG8)のATG結合系が重要であることが知られている5)(図1).ATG12およびATG8は,ユビキチン結合系と同様に,ユビキチン活性化酵素様酵素であるATG7,ユビキチン結合酵素様酵素であるATG10およびATG3によりそれぞれ触媒され,共有結合によりATG5およびホスファチジルエタノールアミンと結合する.これらATG結合系を欠損した細胞においては最終産物であるLC3-ホスファチジルエタノールアミン複合体が産生されず,オートリソソームはほとんど観察されないものの,隔離膜や二重膜のオートファゴソーム様の構造が多く観察される6,7).このことから,ATG結合系はオートファゴソームの閉鎖および完成に必要であろうと推測されていた.しかしながら,ATG結合系を欠損した細胞にはオートファゴソームの実用的なマーカータンパク質であるLC3がオートファゴソーム膜に存在しないためこれ以上の解析が進まず,隔離膜がどのような運命をたどるのかは不明であった.この研究においては,近年,筆者らの研究グループが発表した,オートファゴソームに局在するSNAREタンパク質であるSTX17 8)(新着論文レビュー でも掲載)をオートファゴソームのマーカーとして,ATG結合系を欠損した細胞において隔離膜の運命を解析した.
1.オートファゴソームの一生
哺乳類細胞におけるオートファゴソームの成熟の過程について調べるため,古典的な隔離膜およびオートファゴソームのマーカーであるLC3と,オートファゴソームに関連するSNAREタンパク質であるSTX17を用いて,野生型の細胞を用いて蛍光により生細胞を観察した.伸張の過程にある隔離膜はおもに楕円状(実際は,3次元の楕円体)で,LC3陽性であったがSTX17陰性であった.そののち,隔離膜が閉鎖してオートファゴソームが正円(実際は,3次元の球)になる前後において,STX17のシグナルが陽性になった.このオートファゴソームの形状の変化は内膜と外膜との分離に起因するのではないかと推測された.
オートファゴソームとリソソームとの融合の過程について観察するため,STX17とリソソームのマーカーであるLAMP1および酸性コンパートメントのマーカーであるLysoTracker Redを用いて同様に生細胞を観察した.STX17がオートファゴソームに局在したのち,小さな複数のLAMP1陽性のリソソームがそこに融合し,オートファゴソームがLAMP1陽性になるようすが観察された.リソソームが融合するタイミングにおいて,LysoTrackerのシグナルがSTX17と重なりリング状に現われた.これは,オートファゴソームの内膜と外膜とのあいだがさきんじて酸性化されるようすを表わす.その約7分後,LysoTrackerのリング状のシグナルは内部の均一なシグナルに変化した.これは,オートファゴソーム内膜が分解され,リソソームの内部の消化酵素がオートファゴソームの内部に注入された過程を示す.その約2分後,STX17はオートファゴソームから解離した.このように,哺乳類細胞におけるオートファゴソームの一生,とくに,これまであまり解析されていなかった成熟の過程が生細胞の観察により示された.
2.ATG結合系を欠損した細胞においてオートファゴソーム様の構造はSTX17を獲得しリソソームと融合する
ATG結合系を欠損した細胞においては,現在までオートファゴソームの唯一のマーカーであるLC3-ホスファチジルエタノールアミン複合体がオートファゴソームに局在しないため,隔離膜が形成されたのちの解析は困難であった.そこで,オートファゴソームに関連するSNAREタンパク質であるSTX17をマーカーとして用いたところ,ATG3,ATG5,ATG7といったATG結合系のタンパク質を欠損した細胞において多数のSTX17陽性のオートファゴソーム様の構造が観察された.一方で,オートファジーの上流タンパク質であるATG9,ATG14,FIP200を欠損した細胞においてこれらの構造は観察されなかった.また,野生型の細胞においては通常の培養条件ではSTX17陽性のオートファゴソーム様の構造はほとんど観察されなかったが,ATG結合系を欠損した細胞においては通常の培養条件でもSTX17陽性の構造が多く観察された.
ATG3欠損細胞においてSTX17陽性のオートファゴソーム様の構造はそのSNAREパートナーであるSNAP29とよく共局在し,おおむね正常にLysoTracker陽性になるようすが観察された.このことから,ATG結合系を欠損した細胞において,オートファゴソーム様の構造はSTX17を獲得しリソソームと融合することが示された.
3.ATG結合系を欠損した細胞においてオートファジーの活性は低下する
ATG結合系を欠損した細胞におけるオートファジーの活性を再検討するため,CRISPR-Cas9系によるゲノム編集技術を用いて,ATG結合系のタンパク質であるATG3あるいはATG5を欠損した細胞,および,オートファジーの上流タンパク質であるATG9,FIP200を欠損した細胞を作製した.ATG3欠損細胞およびATG5欠損細胞において,リソソームに依存的な長寿命のタンパク質の分解活性,および,p62を対象とする選択的なオートファジーの活性は,オートファジーの上流タンパク質を欠損した細胞と同じ程度に低下していた.
4.ATG3欠損細胞においてオートファゴソームの形成は低下する
ATG結合系を欠損した細胞において,STX17陽性のオートファゴソーム様の構造は野生型の細胞より2倍ほど多く観察されるにもかかわらずオートファジーの活性は低下していたことから,どの過程が遅延しているかくわしく調べた.ATG5陽性の隔離膜の出現の頻度は野生型の細胞とATG3欠損細胞とで同等であった.また,ATG5陽性の隔離膜からSTX17陽性のオートファゴソーム様の構造への移行率を調べると,野生型の細胞においては90%以上であった一方,ATG3欠損細胞ではおよそ30%であった.このことから,以前から提唱されていたように,ATG結合系はオートファゴソームの完成に重要な役割をはたすことが示唆された.
5.ATG結合系を欠損した細胞においてオートファゴソーム内膜の分解は遅延する
ATG結合系を欠損した細胞においてオートファゴソームが完成したのちの過程を調べるため,STX17とLysoTrackerを用いて生細胞を観察したところ,野生型の細胞では7分程度でおわるオートファゴソーム内膜の分解が,ATG結合系を欠損した細胞においては30分以上と顕著に遅延した.免疫電子顕微鏡による観察では,ATG3欠損細胞において,LAMP1陽性にもかかわらず内膜の残存するオートファゴソームが観察された.オートファゴソーム内膜の分解の遅延はATG5欠損細胞およびATG7欠損細胞においても観察された.
ATG3欠損細胞においてはときおりオートファゴソーム内膜の分解されるようすが観察され,その際には,野生型の細胞と同様にSTX17が解離するようすも観察された.このことから,STX17はオートファゴソーム内膜が残存するかぎり,オートファゴソームに局在することが示唆された.この結果と一致するように,STX17陽性のオートファゴソーム様の構造の寿命は野生型の細胞においては約10分であったが,ATG3欠損細胞においては約1時間であった.このように,STX17陽性のオートファゴソーム様の構造の寿命が長いため,ATG結合系を欠損した細胞においては通常の培養条件でも基底レベルのオートファジーにより形成されたオートファゴソームが長時間にわたり残存するため,多数のSTX17陽性のオートファゴソーム様の構造が観察されると考えられた.
ATG3欠損細胞においては,STX17陽性のオートファゴソーム様の構造の形状はやや楕円状になる傾向があった.外膜と内膜との分離によりオートファゴソームの形状が変化するという仮説が正しければ,ATG3欠損細胞においてはオートファゴソームの形成の最終の過程である外膜と内膜との分離が不十分である可能性がある.実際に,ATG3欠損細胞においては,頻度は低いものの,極端な例ではSTX17陽性のリング状の構造が一過的に開く場合が観察された.
おわりに
筆者らにより,ATG結合系は,隔離膜からオートファゴソームへの移行,および,オートファゴソーム内膜の分解を効率的にひき起こすために重要であることが示された(図2).前者については,ATG結合系がオートファゴソームの閉鎖に必要であるという過去の知見と一致した.筆者らは,ATG結合系によりひき起こされるオートファゴソームの閉鎖は,オートファゴソームの形状が球状になる過程および効率的なオートファゴソーム内膜の分解には必要であるが,STX17の局在およびリソソームとの融合には必須ではないと考えている.これは,ATG結合系に依存しない別経路があるわけではなく,典型的なオートファジーそのものがATG結合系に非依存的にもわずかに進行しうることを示す.なぜ,ATG結合系がないとオートファゴソーム内膜がリソソームの内部の消化酵素に抵抗性になるかは残された課題である.筆者らは,内側にくびれた膜が切り離されたのちリソソームの内部の消化酵素により効率よく分解されることは,オートファゴソーム内膜にかぎられた現象ではないと考えている.たとえば,エンドソーム膜が内側にくびれてできる多数の小胞を内包する後期エンドソーム(多胞体ともよばれる)や,リソソーム膜が内側にくびれるミクロオートファジーなども,オートファゴソーム内膜と共通の機構により切り離されてリソソームの内部の消化酵素に感受性になる可能性がある.
ATG結合系を欠損した細胞においては,ゆっくりとではあるがオートファゴソーム内膜が分解されオートファゴソームが成熟していたことから,オートファジーの活性はわずかに残存していることが示唆された.ATG9やFIP200といったオートファジーの上流タンパク質を欠損したマウスは胎生致死であるが,ATG3やATG5といったATG結合系のタンパク質を欠損したマウスは出生の直後に死亡するものの出生まではおおむね正常に成熟する9-13) という違いが,このオートファジーの微量の活性から説明される可能性がある.
現在まで,ATG関連タンパク質はもっぱらオートファゴソームの形成において着目されてきたが,その成熟の過程においても重要であることが示された.今後,なぜオートファゴソーム内膜のみが選択的に分解されるのか,また,オートファゴソームの外膜と内膜との分離はどのように起こるのかなどについて,さらに詳細な分子機構の解明が期待される.
文 献
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Lamb, C. A., Yoshimori, T. & Tooze, S. A.: The autophagosome: origins unknown, biogenesis complex. Nat. Rev. Mol. Cell Biol., 14, 759-774 (2013)[PubMed]
- Abada, A. & Elazar, Z.: Getting ready for building: signaling and autophagosome biogenesis. EMBO Rep., 15, 839-852 (2014)[PubMed]
- Knorr, R. L., Lipowsky, R. & Dimova, R.: Autophagosome closure requires membrane scission. Autophagy, 11, 2134-2137 (2015)[PubMed]
- Mizushima, N., Noda, T., Yoshimori, T. et al.: A protein conjugation system essential for autophagy. Nature, 395, 395-398 (1998)[PubMed]
- Sou, Y. S., Waguri, S., Iwata, J. et al.: The Atg8 conjugation system is indispensable for proper development of autophagic isolation membranes in mice. Mol. Biol. Cell, 19, 4762-4775 (2008)[PubMed]
- Kishi-Itakura, C., Koyama-Honda, I., Itakura, E. et al.: Ultrastructural analysis of autophagosome organization using mammalian autophagy-deficient cells. J. Cell Sci., 127, 4089-4102 (2014)[PubMed]
- Itakura, E., Kishi-Itakura, C. & Mizushima, N.: The hairpin-type tail-anchored SNARE syntaxin 17 targets to autophagosomes for fusion with endosomes/lysosomes. Cell, 151, 1256-1269 (2012)[PubMed] [新着論文レビュー]
- Kuma, A., Hatano, M., Matsui, M. et al.: The role of autophagy during the early neonatal starvation period. Nature, 432, 1032-1036 (2004)[PubMed]
- Komatsu, M., Waguri, S., Ueno, T. et al.: Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J. Cell Biol., 169, 425-434 (2005)[PubMed]
- Gan, B., Peng, X., Nagy, T. et al.: Role of FIP200 in cardiac and liver development and its regulation of TNFα and TSC-mTOR signaling pathways. J. Cell Biol., 175, 121-133 (2006)[PubMed]
- Kojima, T., Yamada, T., Akaishi, R. et al.: Role of the Atg9a gene in intrauterine growth and survival of fetal mice. Reprod. Biol., 15, 131-138 (2015)[PubMed]
- Kaizuka, T. & Mizushima, N.: Atg13 is essential for autophagy and cardiac development in mice. Mol. Cell. Biol., 36, 585-595 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院新領域創成科学研究科博士課程 在籍中.
抱負:光学顕微鏡を用いて細かな分子機構を解明していきたい.
小山-本田郁子(Ikuko Koyama-Honda)
略歴:2002年 名古屋大学大学院理学系研究科博士課程 修了,ERATO-SORST楠見膜組織能プロジェクト 研究員,ICORP膜機構プロジェクト 研究員,東京医科歯科大学大学院医歯学総合研究科 研究員を経て,2012年より東京大学大学院医学系研究科 助教.
抱負:つぎの興味は,オートファゴソームの閉鎖の機構,および,内膜と外膜との分化です.
水島 昇(Noboru Mizushima)
東京大学大学院医学系研究科 教授.
研究室URL:http://square.umin.ac.jp/molbiol/index.html
© 2016 坪山幸太郎・小山-本田郁子・水島 昇 Licensed under CC 表示 2.1 日本