Stx17は密接したヘアピン型膜貫通ドメインを介してオートファゴソームの外膜に局在しリソソーム膜との融合にはたらく
板倉英祐・水島 昇
(東京医科歯科大学大学院医歯学総合研究科 細胞生理学分野)
email:水島 昇
DOI: 10.7875/first.author.2012.160
The hairpin-type tail-anchored SNARE Syntaxin 17 targets to autophagosomes for fusion with endosomes/lysosomes.
Eisuke Itakura, Chieko Kishi-Itakura, Noboru Mizushima
Cell, 151, 1256-1269 (2012)
オートファジーは栄養飢餓などにより誘導される,細胞質におけるタンパク質のバルク分解系である.オートファゴソームとよばれる二重膜の構造体により細胞質の一部がとりかこまれ,このオートファゴソームがリソソームと融合することにより,とりかこまれた細胞質タンパク質やオルガネラが分解される.栄養飢餓のときには,ひとつの細胞において1時間あたり数百個のオートファゴソームが出現しては,リソソームと特異的に融合し消えてゆく.しかし,完成したオートファゴソームとリソソームとの特異的な融合においてその分子機構は不明であった.今回,筆者らは,オートファゴソームの外膜に局在するSNAREタンパク質としてStx17を同定し,このStx17のもつ密接したヘアピン型膜貫通ドメインがその局在に必須であることを明らかにした.この結果より,オートファゴソームは完成したのち,その密接したヘアピン型膜貫通ドメインを介してStx17が局在することにより,リソソームとの融合能を得ていることが判明した.
不要なタンパク質は分解されねばならない.約60年前,リソソームが発見され,それからまもなくして,リソソームの内腔は多くの加水分解酵素を含み,タンパク質などの分解を行う場として機能していることが明らかにされた.これはとてもシンプルなしくみであり,分解されるべきタンパク質はリソソームの内腔へと輸送されるということである.しかし,いかにして膜に囲まれたリソソーム内腔へ輸送するかということが問題となる.
オートファジーは細胞質におけるタンパク質のバルク分解系である.隔離膜とよばれる二重膜の構造体が細胞質の一部を囲い込み,膜により細胞質成分を隔離する.この二重膜からなる構造体をオートファゴソームとよぶ.そして,オートファゴソームの外膜がリソソーム膜と融合することにより,オートファゴソームの内容物はリソソームの内腔の加水分解酵素により分解される.オートファジーは細胞質タンパク質だけではなく,ミトコンドリア,ペルオキシソーム,侵入した細菌などの分解にもはたらくことにより,多くの生理的な役割を担っている1,2)(出芽酵母におけるオートファジー研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012 も参照されたい).オートファジーは細胞質成分の分解系であり,同時に,細胞質成分をリソソームへと運ぶ膜輸送系でもある.膜輸送系としての最後のステップはオートファゴソーム外膜がリソソーム膜と特異的に膜融合することである.しかし,なぜオートファゴソームの外膜はリソソーム膜と特異的に融合できるのか,その分子機構は明らかにされていなかった.
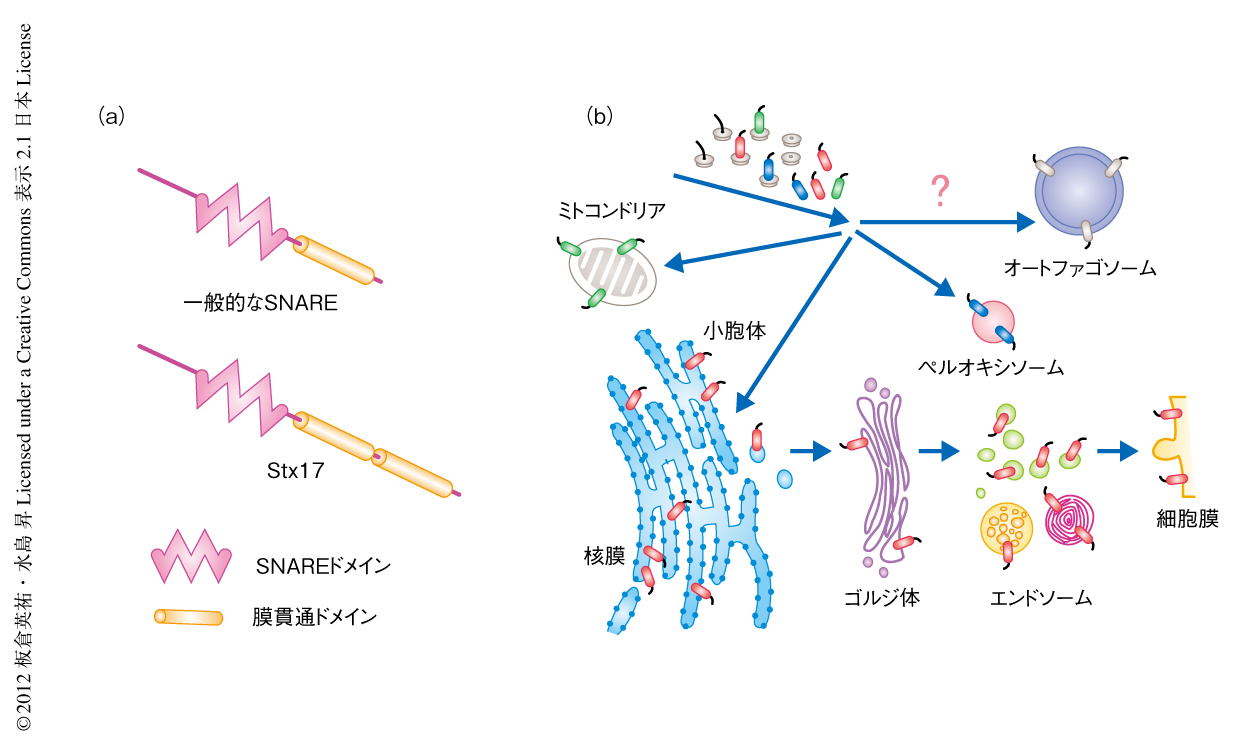
細胞における多くの膜融合はSNARE(soluble NSF attachment protein receptor)タンパク質により仲介される3).SNAREタンパク質は融合する2つの膜の両方に局在し,それぞれのもつコイルドコイル構造をとるSNAREドメインが,あわせて4つ組み合わさることにより膜融合を誘導する.ほとんどのSNAREタンパク質はC末端側に膜貫通ドメインをもち,C末端側が膜にアンカーされるテイルアンカー型タンパク質である(図1a).通常,膜タンパク質が翻訳される際にはリボソームトンネルから露出した疎水性の膜貫通ドメインが認識され,翻訳途中のまま小胞体へと移行する.テイルアンカー型タンパク質は膜貫通ドメインより後ろのC末端側アミノ酸配列が短いため,翻訳途中に膜貫通ドメインがリボソームトンネルから露出されず,翻訳ののちリボソームから放出されて目的の膜へと移行する.テイルアンカー型タンパク質が直接に移行する膜は小胞体膜,ミトコンドリア膜,ペルオキシソーム膜の3つである4)(図1b).実際には,テイルアンカー型タンパク質は核膜,ゴルジ膜,エンドソーム膜,リソソーム膜,細胞膜など,ほぼすべての膜に存在している.これらのテイルアンカー型タンパク質は,小胞体膜に挿入されたのち膜輸送を介し目的の膜へと輸送される.
オートファゴソーム外膜とリソソーム膜との融合にもSNAREタンパク質の関与することが報告されている5).しかし,実際にオートファゴソーム外膜において機能するSNAREタンパク質は同定されておらず,また,オートファゴソーム外膜にタンパク質を供給する分子機構も明らかではなかったため,オートファゴソーム外膜がどのようにSNAREタンパク質を獲得するのかは不明であった.
当初,筆者らは,小胞体においてオートファゴソームが形成されることから,小胞体膜タンパク質とオートファゴソーム形成の解析を行っていた.その過程において,SNAREタンパク質のひとつであるSyntaxin 17(Stx17)がオートファゴソームに局在することを発見した.Stx17は富栄養状態では小胞体とミトコンドリアに局在する.しかし,栄養飢餓状態においてStx17はオートファゴソームのマーカーであるLC3と共局在した.また,免疫電子顕微鏡による観察から,Stx17はオートファゴソームの外膜に局在していることが確認された.SNAREドメインを欠損したStx17においてもオートファゴソームへの局在が認められたことから,Stx17はSNAREドメインを介した膜融合の結果としてオートファゴソームに局在したのではなく,なんらかの分子機構によりオートファゴソーム外膜に局在するようになったと示唆された.
Atg14,Atg16L1,LC3,ULK1,WIPI-1は隔離膜に局在しオートファゴソームの形成にはたらく.オートファゴソームが完成したのち,LC3以外のこれら隔離膜タンパク質はオートファゴソームから離れることが知られている2).意外なことに,Stx17はLC3以外の隔離膜タンパク質とは共局在を示さなかった.さらに,Atg3欠損細胞もしくはAtg5欠損細胞ではオートファゴソームの形成が阻害され中間体である隔離膜が蓄積することが知られているが,Stx17はこれら蓄積した隔離膜にも局在しなかった.Stx17とLC3のどちらがさきにオートファゴソームに局在するのかを調べるためリアルタイムイメージング法による観察を行ったところ,LC3陽性の構造体が現われたのち,Stx17が同じ構造体へと共局在することがわかった.これらのことから,Stx17は形成途中のオートファゴソームには局在せず,完成したオートファゴソームに局在することがわかった.
オートファジーにおけるStx17の役割を明らかにするため,Stx17をノックダウンすることによりStx17がオートファジーに必要かどうか調べた.オートファジーの誘導にともない,LC3はホスファチジルエタノールアミン化されてオートファゴソーム膜に局在し,そののち,リソソームにおいて分解される.しかし,Stx17をノックダウンした細胞にはホスファチジルエタノールアミン化されたLC3が蓄積した.さらに,LC3を蛍光標識した細胞の観察から,Stx17をノックダウンした細胞ではLC3陽性の構造体が多く蓄積していることがわかった.電子顕微鏡による観察から,Stx17をノックダウンした細胞ではオートファゴソームが蓄積していることがわかった.重要なことに,これら蓄積したオートファゴソームの内容物は分解されていなかったことから,Stx17のノックダウンによりオートファゴソームとリソソームとの融合が阻害されていることが示唆された.
さきに述べたように,SNAREタンパク質により仲介される膜融合はあわせて4つのSNAREドメインにより実行される.リソソームのもつSNAREタンパク質であるVAMP8がオートファゴソームとリソソームとの融合に必要であることが報告されていたことから,VAMP8とStx17との結合を免疫沈降により確認した5).その結果,VAMP8とStx17との結合はオートファジーの誘導に依存して増加することがわかった.過去の報告から,Stx17はSNAP-29と結合することが知られていた.SNAP-29はSNAREドメインを2つもち膜貫通ドメインはもたない.実際にStx17とSNAP-29とが結合することを確認し,SNAP-29とStx17とLC3が細胞において同じ構造体に共局在することも観察した.さらに,SNAP-29をノックダウンした細胞においては,Stx17のノックダウンと同様に,ホスファチジルエタノールアミン化されたLC3の蓄積がみられた.これらの結果から,オートファゴソーム外膜に存在するStx17は,リソソーム膜に存在するVAMP8,および,細胞質に存在するSNAP-29と,あわせて4つのSNAREドメインにより複合体を形成し,オートファゴソームとリソソームとの融合に機能していることがわかった.
テイルアンカー型タンパク質は翻訳ののち,小胞体,ミトコンドリア,ペルオキシソームに移行する.この選別には膜貫通ドメインの前後のアミノ酸配列が重要であることが知られている4).実際に,Stx17のもつ膜貫通ドメインの両端を欠損させた場合,小胞体およびミトコンドリアへの局在が抑制された.一方で,オートファゴソームへの局在に影響はなかった.一般的なSNAREタンパク質は1つの膜貫通ドメインをC末端側にもつが,注目すべきことに,Stx17のC末端側には2つの膜貫通ドメインが存在する(図1a).どちらか片方の膜貫通ドメインを欠損させると小胞体,ミトコンドリア,オートファゴソームすべての局在を抑制したことから,2つの膜貫通ドメインがStx17の局在にはたらいていることが示唆された.
細胞膜の厚さは膜貫通ドメインがつくるヘリックスにおいてアミノ酸残基15~20個に相当する.そのため,Stx17のもつ2つの膜貫通ドメインが縦に並んだ場合,その長さは約40アミノ酸残基となり細胞膜に収まることができない.そのため,Stx17の膜貫通ドメインは2つの膜貫通ドメインのあいだで二つ折りとなりヘアピン型の構造をとっているものと予想した.テイルアンカー型タンパク質である小胞体型シトクロムb5のC末端側に糖鎖結合配列をくわえると,C末端側は小胞体の内腔に存在するタンパク質により糖鎖が付加される.しかし,同様の糖鎖結合配列をStx17のC末端側にくわえても糖鎖は付加されなかった.また,Stx17のC末端側には小胞体滞留シグナルであるKKXXモチーフが存在する.このモチーフをもつタンパク質はゴルジ体に輸送されると,細胞質に存在するCOPI複合体により認識され小胞体へと逆行輸送される.Stx17のもつKKXXモチーフに変異をくわえるとゴルジ体にも蓄積するようになったことから,このKKXXモチーフは小胞体滞留シグナルとして機能していることがわかった.これらの結果から,Stx17のC末端側は細胞質側に露出しており,その2つの膜貫通ドメインはヘアピン型の構造を形成していることが示唆された.
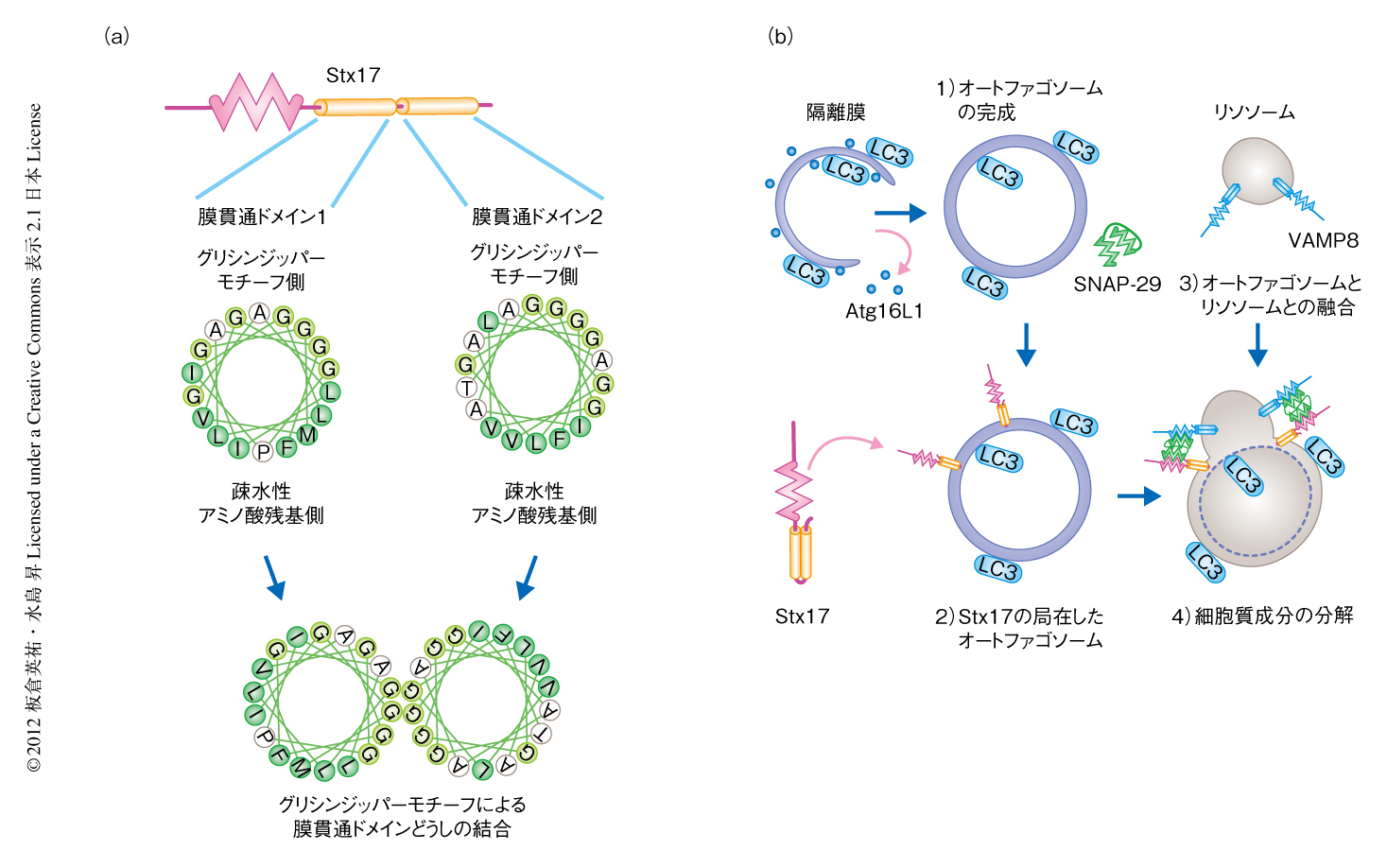
一般に,膜貫通ドメインは主として疎水性アミノ酸残基,とくに,バリン残基,ロイシン残基,イソロイシン残基などからなる.Stxファミリータンパク質の膜貫通ドメインにも疎水性アミノ酸残基が豊富に存在する.しかし,Stx17の膜貫通ドメインは疎水性が高くなく,かつ,グリシン残基が例外的に豊富に存在する.重要なことに,Stx17のグリシン残基は生物間で高く保存されている.さらに,それらグリシン残基がグリシンジッパーモチーフを形成できることが見い出された.グリシン残基が3残基おきに3回以上つづけて出現する配列をグリシンジッパーモチーフとよび,膜貫通ドメインどうしを密接させて結合させることが知られている6)(図2a).Stx17におけるグリシンジッパーモチーフの機能を調べるため,グリシン残基をロイシン残基に置換した変異体を作製したところ,その変異体はオートファゴソームに局在できなくなり,さらに,オートファゴソームとリソソームとの融合にはたらかないことがわかった.一方で,グリシンジッパーモチーフに変異をもつStx17は小胞体あるいはミトコンドリアへの局在に影響はなかった.これらの結果から,グリシンジッパーモチーフにより密接したヘアピン型膜貫通ドメインが,Stx17をオートファゴソーム外膜へ局在させるためにはたらいていることが判明した
今回の研究から,オートファゴソームとリソソームとの特異的な融合の鍵をにぎるタンパク質を同定することができた.そして,それらの結果にもとづき,以下のようなモデルが考えられた(図2b).1)Atgタンパク質のはたらきにより隔離膜が形成される.2)密接したヘアピン型膜貫通ドメインのはたらきにより完成したオートファゴソームの外膜にStx17が局在する.3)Stx17,VAMP8,SNAP-29があわせて4つのSNAREドメインを介して複合体を形成することでオートファゴソーム外膜とリソソーム膜との融合が起こる.4)オートファゴソームの内容物がリソソームのもつ加水分解酵素により分解される.このモデルから,形成途中のオートファゴソームではなく,完成したオートファゴソームが特異的にリソソームと融合できるのか,その答えが導かれた.
オートファゴソームが完成した状態になることがリソソームとの融合能を獲得するため重要であることが今回の結果より示唆された.現在のところ,隔離膜に局在していたAtgタンパク質が離れLC3のみが残ったオートファゴソーム様の構造体が完成したオートファゴソームだと考えられる.じつは,隔離膜に局在したAtgタンパク質がどのように離れるのかはわかっていない.また,隔離膜に存在するホスファチジルイノシトールトリスリン酸はオートファゴソームの完成よりまえに脱リン酸化をうけるという報告もあることから,オートファゴソームが完成したのちのオートファゴソーム外膜は,それ以前の隔離膜とは異なった性質をもつのかもしれない.おそらく,これらの変化に付随して,オートファゴソーム外膜はなんらかの方法によりStx17を認識する機構をもつのだろう.今回の結果を発展させることにより,今後,オートファゴソームの形成とリソソームとの融合について,さらに詳細な分子機構の解明されることが期待される.
略歴:2009年 埼玉大学大学院理工学研究科博士課程 修了,同年 東京医科歯科大学医歯学総合研究科 研究員を経て,2012年より英国MRC Laboratory of Molecular Biology研究員.
研究テーマ:膜タンパク質のターゲッティングと分解の機構.
抱負:16世紀の大航海時代のように,未知なる世界に飛び込み,開拓したい.生命の果てまで.
水島 昇(Noboru Mizushima)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.cellcycle.m.u-tokyo.ac.jp/
© 2012 板倉英祐・水島 昇 Licensed under CC 表示 2.1 日本
(東京医科歯科大学大学院医歯学総合研究科 細胞生理学分野)
email:水島 昇
DOI: 10.7875/first.author.2012.160
The hairpin-type tail-anchored SNARE Syntaxin 17 targets to autophagosomes for fusion with endosomes/lysosomes.
Eisuke Itakura, Chieko Kishi-Itakura, Noboru Mizushima
Cell, 151, 1256-1269 (2012)
要 約
オートファジーは栄養飢餓などにより誘導される,細胞質におけるタンパク質のバルク分解系である.オートファゴソームとよばれる二重膜の構造体により細胞質の一部がとりかこまれ,このオートファゴソームがリソソームと融合することにより,とりかこまれた細胞質タンパク質やオルガネラが分解される.栄養飢餓のときには,ひとつの細胞において1時間あたり数百個のオートファゴソームが出現しては,リソソームと特異的に融合し消えてゆく.しかし,完成したオートファゴソームとリソソームとの特異的な融合においてその分子機構は不明であった.今回,筆者らは,オートファゴソームの外膜に局在するSNAREタンパク質としてStx17を同定し,このStx17のもつ密接したヘアピン型膜貫通ドメインがその局在に必須であることを明らかにした.この結果より,オートファゴソームは完成したのち,その密接したヘアピン型膜貫通ドメインを介してStx17が局在することにより,リソソームとの融合能を得ていることが判明した.
はじめに
不要なタンパク質は分解されねばならない.約60年前,リソソームが発見され,それからまもなくして,リソソームの内腔は多くの加水分解酵素を含み,タンパク質などの分解を行う場として機能していることが明らかにされた.これはとてもシンプルなしくみであり,分解されるべきタンパク質はリソソームの内腔へと輸送されるということである.しかし,いかにして膜に囲まれたリソソーム内腔へ輸送するかということが問題となる.
オートファジーは細胞質におけるタンパク質のバルク分解系である.隔離膜とよばれる二重膜の構造体が細胞質の一部を囲い込み,膜により細胞質成分を隔離する.この二重膜からなる構造体をオートファゴソームとよぶ.そして,オートファゴソームの外膜がリソソーム膜と融合することにより,オートファゴソームの内容物はリソソームの内腔の加水分解酵素により分解される.オートファジーは細胞質タンパク質だけではなく,ミトコンドリア,ペルオキシソーム,侵入した細菌などの分解にもはたらくことにより,多くの生理的な役割を担っている1,2)(出芽酵母におけるオートファジー研究については,荒木保弘・大隅良典, 領域融合レビュー, 1, e005, 2012 も参照されたい).オートファジーは細胞質成分の分解系であり,同時に,細胞質成分をリソソームへと運ぶ膜輸送系でもある.膜輸送系としての最後のステップはオートファゴソーム外膜がリソソーム膜と特異的に膜融合することである.しかし,なぜオートファゴソームの外膜はリソソーム膜と特異的に融合できるのか,その分子機構は明らかにされていなかった.
細胞における多くの膜融合はSNARE(soluble NSF attachment protein receptor)タンパク質により仲介される3).SNAREタンパク質は融合する2つの膜の両方に局在し,それぞれのもつコイルドコイル構造をとるSNAREドメインが,あわせて4つ組み合わさることにより膜融合を誘導する.ほとんどのSNAREタンパク質はC末端側に膜貫通ドメインをもち,C末端側が膜にアンカーされるテイルアンカー型タンパク質である(図1a).通常,膜タンパク質が翻訳される際にはリボソームトンネルから露出した疎水性の膜貫通ドメインが認識され,翻訳途中のまま小胞体へと移行する.テイルアンカー型タンパク質は膜貫通ドメインより後ろのC末端側アミノ酸配列が短いため,翻訳途中に膜貫通ドメインがリボソームトンネルから露出されず,翻訳ののちリボソームから放出されて目的の膜へと移行する.テイルアンカー型タンパク質が直接に移行する膜は小胞体膜,ミトコンドリア膜,ペルオキシソーム膜の3つである4)(図1b).実際には,テイルアンカー型タンパク質は核膜,ゴルジ膜,エンドソーム膜,リソソーム膜,細胞膜など,ほぼすべての膜に存在している.これらのテイルアンカー型タンパク質は,小胞体膜に挿入されたのち膜輸送を介し目的の膜へと輸送される.
オートファゴソーム外膜とリソソーム膜との融合にもSNAREタンパク質の関与することが報告されている5).しかし,実際にオートファゴソーム外膜において機能するSNAREタンパク質は同定されておらず,また,オートファゴソーム外膜にタンパク質を供給する分子機構も明らかではなかったため,オートファゴソーム外膜がどのようにSNAREタンパク質を獲得するのかは不明であった.
1.SNAREタンパク質Stx17はオートファゴソームに局在する
当初,筆者らは,小胞体においてオートファゴソームが形成されることから,小胞体膜タンパク質とオートファゴソーム形成の解析を行っていた.その過程において,SNAREタンパク質のひとつであるSyntaxin 17(Stx17)がオートファゴソームに局在することを発見した.Stx17は富栄養状態では小胞体とミトコンドリアに局在する.しかし,栄養飢餓状態においてStx17はオートファゴソームのマーカーであるLC3と共局在した.また,免疫電子顕微鏡による観察から,Stx17はオートファゴソームの外膜に局在していることが確認された.SNAREドメインを欠損したStx17においてもオートファゴソームへの局在が認められたことから,Stx17はSNAREドメインを介した膜融合の結果としてオートファゴソームに局在したのではなく,なんらかの分子機構によりオートファゴソーム外膜に局在するようになったと示唆された.
2.Stx17は形成途中のオートファゴソームには局在しない
Atg14,Atg16L1,LC3,ULK1,WIPI-1は隔離膜に局在しオートファゴソームの形成にはたらく.オートファゴソームが完成したのち,LC3以外のこれら隔離膜タンパク質はオートファゴソームから離れることが知られている2).意外なことに,Stx17はLC3以外の隔離膜タンパク質とは共局在を示さなかった.さらに,Atg3欠損細胞もしくはAtg5欠損細胞ではオートファゴソームの形成が阻害され中間体である隔離膜が蓄積することが知られているが,Stx17はこれら蓄積した隔離膜にも局在しなかった.Stx17とLC3のどちらがさきにオートファゴソームに局在するのかを調べるためリアルタイムイメージング法による観察を行ったところ,LC3陽性の構造体が現われたのち,Stx17が同じ構造体へと共局在することがわかった.これらのことから,Stx17は形成途中のオートファゴソームには局在せず,完成したオートファゴソームに局在することがわかった.
3.Stx17はオートファゴソームとリソソームとの融合に必須である
オートファジーにおけるStx17の役割を明らかにするため,Stx17をノックダウンすることによりStx17がオートファジーに必要かどうか調べた.オートファジーの誘導にともない,LC3はホスファチジルエタノールアミン化されてオートファゴソーム膜に局在し,そののち,リソソームにおいて分解される.しかし,Stx17をノックダウンした細胞にはホスファチジルエタノールアミン化されたLC3が蓄積した.さらに,LC3を蛍光標識した細胞の観察から,Stx17をノックダウンした細胞ではLC3陽性の構造体が多く蓄積していることがわかった.電子顕微鏡による観察から,Stx17をノックダウンした細胞ではオートファゴソームが蓄積していることがわかった.重要なことに,これら蓄積したオートファゴソームの内容物は分解されていなかったことから,Stx17のノックダウンによりオートファゴソームとリソソームとの融合が阻害されていることが示唆された.
さきに述べたように,SNAREタンパク質により仲介される膜融合はあわせて4つのSNAREドメインにより実行される.リソソームのもつSNAREタンパク質であるVAMP8がオートファゴソームとリソソームとの融合に必要であることが報告されていたことから,VAMP8とStx17との結合を免疫沈降により確認した5).その結果,VAMP8とStx17との結合はオートファジーの誘導に依存して増加することがわかった.過去の報告から,Stx17はSNAP-29と結合することが知られていた.SNAP-29はSNAREドメインを2つもち膜貫通ドメインはもたない.実際にStx17とSNAP-29とが結合することを確認し,SNAP-29とStx17とLC3が細胞において同じ構造体に共局在することも観察した.さらに,SNAP-29をノックダウンした細胞においては,Stx17のノックダウンと同様に,ホスファチジルエタノールアミン化されたLC3の蓄積がみられた.これらの結果から,オートファゴソーム外膜に存在するStx17は,リソソーム膜に存在するVAMP8,および,細胞質に存在するSNAP-29と,あわせて4つのSNAREドメインにより複合体を形成し,オートファゴソームとリソソームとの融合に機能していることがわかった.
4.Stx17の2つの膜貫通ドメインはヘアピン型の構造をとる
テイルアンカー型タンパク質は翻訳ののち,小胞体,ミトコンドリア,ペルオキシソームに移行する.この選別には膜貫通ドメインの前後のアミノ酸配列が重要であることが知られている4).実際に,Stx17のもつ膜貫通ドメインの両端を欠損させた場合,小胞体およびミトコンドリアへの局在が抑制された.一方で,オートファゴソームへの局在に影響はなかった.一般的なSNAREタンパク質は1つの膜貫通ドメインをC末端側にもつが,注目すべきことに,Stx17のC末端側には2つの膜貫通ドメインが存在する(図1a).どちらか片方の膜貫通ドメインを欠損させると小胞体,ミトコンドリア,オートファゴソームすべての局在を抑制したことから,2つの膜貫通ドメインがStx17の局在にはたらいていることが示唆された.
細胞膜の厚さは膜貫通ドメインがつくるヘリックスにおいてアミノ酸残基15~20個に相当する.そのため,Stx17のもつ2つの膜貫通ドメインが縦に並んだ場合,その長さは約40アミノ酸残基となり細胞膜に収まることができない.そのため,Stx17の膜貫通ドメインは2つの膜貫通ドメインのあいだで二つ折りとなりヘアピン型の構造をとっているものと予想した.テイルアンカー型タンパク質である小胞体型シトクロムb5のC末端側に糖鎖結合配列をくわえると,C末端側は小胞体の内腔に存在するタンパク質により糖鎖が付加される.しかし,同様の糖鎖結合配列をStx17のC末端側にくわえても糖鎖は付加されなかった.また,Stx17のC末端側には小胞体滞留シグナルであるKKXXモチーフが存在する.このモチーフをもつタンパク質はゴルジ体に輸送されると,細胞質に存在するCOPI複合体により認識され小胞体へと逆行輸送される.Stx17のもつKKXXモチーフに変異をくわえるとゴルジ体にも蓄積するようになったことから,このKKXXモチーフは小胞体滞留シグナルとして機能していることがわかった.これらの結果から,Stx17のC末端側は細胞質側に露出しており,その2つの膜貫通ドメインはヘアピン型の構造を形成していることが示唆された.
5.グリシンジッパーモチーフにより密接したヘアピン型膜貫通ドメインはStx17のオートファゴソーム外膜への局在に必須である
一般に,膜貫通ドメインは主として疎水性アミノ酸残基,とくに,バリン残基,ロイシン残基,イソロイシン残基などからなる.Stxファミリータンパク質の膜貫通ドメインにも疎水性アミノ酸残基が豊富に存在する.しかし,Stx17の膜貫通ドメインは疎水性が高くなく,かつ,グリシン残基が例外的に豊富に存在する.重要なことに,Stx17のグリシン残基は生物間で高く保存されている.さらに,それらグリシン残基がグリシンジッパーモチーフを形成できることが見い出された.グリシン残基が3残基おきに3回以上つづけて出現する配列をグリシンジッパーモチーフとよび,膜貫通ドメインどうしを密接させて結合させることが知られている6)(図2a).Stx17におけるグリシンジッパーモチーフの機能を調べるため,グリシン残基をロイシン残基に置換した変異体を作製したところ,その変異体はオートファゴソームに局在できなくなり,さらに,オートファゴソームとリソソームとの融合にはたらかないことがわかった.一方で,グリシンジッパーモチーフに変異をもつStx17は小胞体あるいはミトコンドリアへの局在に影響はなかった.これらの結果から,グリシンジッパーモチーフにより密接したヘアピン型膜貫通ドメインが,Stx17をオートファゴソーム外膜へ局在させるためにはたらいていることが判明した
おわりに
今回の研究から,オートファゴソームとリソソームとの特異的な融合の鍵をにぎるタンパク質を同定することができた.そして,それらの結果にもとづき,以下のようなモデルが考えられた(図2b).1)Atgタンパク質のはたらきにより隔離膜が形成される.2)密接したヘアピン型膜貫通ドメインのはたらきにより完成したオートファゴソームの外膜にStx17が局在する.3)Stx17,VAMP8,SNAP-29があわせて4つのSNAREドメインを介して複合体を形成することでオートファゴソーム外膜とリソソーム膜との融合が起こる.4)オートファゴソームの内容物がリソソームのもつ加水分解酵素により分解される.このモデルから,形成途中のオートファゴソームではなく,完成したオートファゴソームが特異的にリソソームと融合できるのか,その答えが導かれた.
オートファゴソームが完成した状態になることがリソソームとの融合能を獲得するため重要であることが今回の結果より示唆された.現在のところ,隔離膜に局在していたAtgタンパク質が離れLC3のみが残ったオートファゴソーム様の構造体が完成したオートファゴソームだと考えられる.じつは,隔離膜に局在したAtgタンパク質がどのように離れるのかはわかっていない.また,隔離膜に存在するホスファチジルイノシトールトリスリン酸はオートファゴソームの完成よりまえに脱リン酸化をうけるという報告もあることから,オートファゴソームが完成したのちのオートファゴソーム外膜は,それ以前の隔離膜とは異なった性質をもつのかもしれない.おそらく,これらの変化に付随して,オートファゴソーム外膜はなんらかの方法によりStx17を認識する機構をもつのだろう.今回の結果を発展させることにより,今後,オートファゴソームの形成とリソソームとの融合について,さらに詳細な分子機構の解明されることが期待される.
文 献
- Mizushima, N. & Komatsu, M.: Autophagy: renovation of cells and tissues. Cell, 147, 728-741 (2011)[PubMed]
- Mizushima, N., Yoshimori, T. & Ohsumi, Y.: The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107-132 (2011)[PubMed]
- Jahn, R. & Scheller, R. H.: SNAREs: engines for membrane fusion. Nat. Rev. Mol. Cell Biol., 7, 631-643 (2006)[PubMed]
- Borgese, N. & Fasana, N.: Targeting pathways of C-tail-anchored proteins. Biochem. Biophys. Acta, 1808, 937-946 (2011)[PubMed]
- Weidberg, H., Shvets, E. & Elazar, Z.: Biogenesis and cargo selectivity of autophagosomes. Annu. Rev. Biochem., 80, 125-156 (2011)[PubMed]
- Kim, S., Jeon, T. J., Oberaj, A. et al.: Transmembrane glycine zippers: physiological and pathological roles in mambrane proteins. Proc. Natl. Acad. Sci. USA, 102, 14278-14283 (2005)[PubMed]
著者プロフィール
略歴:2009年 埼玉大学大学院理工学研究科博士課程 修了,同年 東京医科歯科大学医歯学総合研究科 研究員を経て,2012年より英国MRC Laboratory of Molecular Biology研究員.
研究テーマ:膜タンパク質のターゲッティングと分解の機構.
抱負:16世紀の大航海時代のように,未知なる世界に飛び込み,開拓したい.生命の果てまで.
水島 昇(Noboru Mizushima)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.cellcycle.m.u-tokyo.ac.jp/
© 2012 板倉英祐・水島 昇 Licensed under CC 表示 2.1 日本