Toll様受容体TLR7はグアノシンおよび1本鎖RNAを認識する
張 志寛・大戸梅治・清水敏之
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:大戸梅治,清水敏之
DOI: 10.7875/first.author.2016.108
Structural analysis reveals that Toll-like receptor 7 is a dual receptor for guanosine and single-stranded RNA.
Zhikuan Zhang, Umeharu Ohto, Takuma Shibata, Elena Krayukhina, Masato Taoka, Yoshio Yamauchi, Hiromi Tanji, Toshiaki Isobe, Susumu Uchiyama, Kensuke Miyake, Toshiyuki Shimizu
Immunity, 45, 737-748 (2016)
Toll様受容体のひとつTLR7は自然免疫におけるウイルスに由来する1本鎖RNAの受容体であり,また,グアノシンやイミダゾキノリン誘導体などの低分子リガンドによっても活性化される.これまで,TLR7のリガンドの認識の機構および活性化の機構は不明であった.今回,筆者らは,TLR7,低分子リガンド,1本鎖RNAからなる複合体の構造をX線結晶解析により明らかにした.リガンド結合型のTLR7は活性化型の二量体を形成し,第1結合部位において低分子リガンド,第2結合部位において1本鎖RNAを認識していた.そして,第1結合部位はグアノシンを特異的に認識し,第2結合部位は非末端のUを含む3塩基以上の1本鎖RNAを特異的に認識した.さらに,TLR7が1本鎖RNAおよびグアノシンによる協調的な効果により活性化される機構が明らかにされた.
Toll様受容体(Toll-like receptor:TLR)は1型膜貫通タンパク質であり,自然免疫において病原体のセンサーの役割を担う1).Toll様受容体は細胞外においてリガンドを認識するLRRドメイン,膜貫通領域,細胞内においてシグナル伝達にかかわるTIRドメインから構成され,病原体の分子パターンを認識して自然免疫を活性化する1).ヒトでは10種類のToll様受容体が同定されており,核酸,リポ多糖,リポタンパク質など,それぞれのToll様受容体が特定の分子パターンを認識する2).
エンドソームに局在するTLR7,TLR8,TLR9は相同性が高く,TLR7サブファミリーを構成する3).TLR7はウイルスに由来する1本鎖RNAの受容体として同定され,ウイルスへの感染や全身性エリテマトーデスなどの自己免疫性疾患に関与する4-6).TLR7はグアノシンおよびウリジンに富んだ1本鎖RNAを認識すると考えられているが,一方で,グアノシン,グアノシンのアナログ,イミダゾキノリン誘導体など低分子リガンドによっても活性化される7,8).
近年,筆者らにより,TLR8の結晶構造9-11)(文献9) は新着論文レビュー でも掲載,文献10) は新着論文レビュー でも掲載),および,TLR9の結晶構造が解明された12)(新着論文レビュー でも掲載).そして今回,筆者らは,世界ではじめてTLR7の結晶構造の解析に成功した.
さまざまな生物種のTLR7について検討した結果,サルのTLR7が良好な性状を示した.TLR7ファミリーはLRRドメインのLRR14とLRR15とのあいだにZループとよばれる配列をもち,この切断が活性化に必須である.そこで,Zループの一部をトロンビンの認識配列と置換したサルのTLR7のLRRドメインをショウジョウバエS2細胞において発現させた.実験にはZループを人為的に切断したTLR7を用いた.19塩基のポリU鎖と共結晶化させ,X線結晶構造解析により,TLR7,グアノシン,ポリU鎖からなる複合体の構造を分解能2.5Å(PDB ID:5GMF),TLR7,ロキソリビン,ポリU鎖からなる複合体の構造を分解能2.6Å(PDB ID:5GMG),TLR7とR848との複合体の構造を分解能2.2Å(PDB ID:5GMH)で決定した.
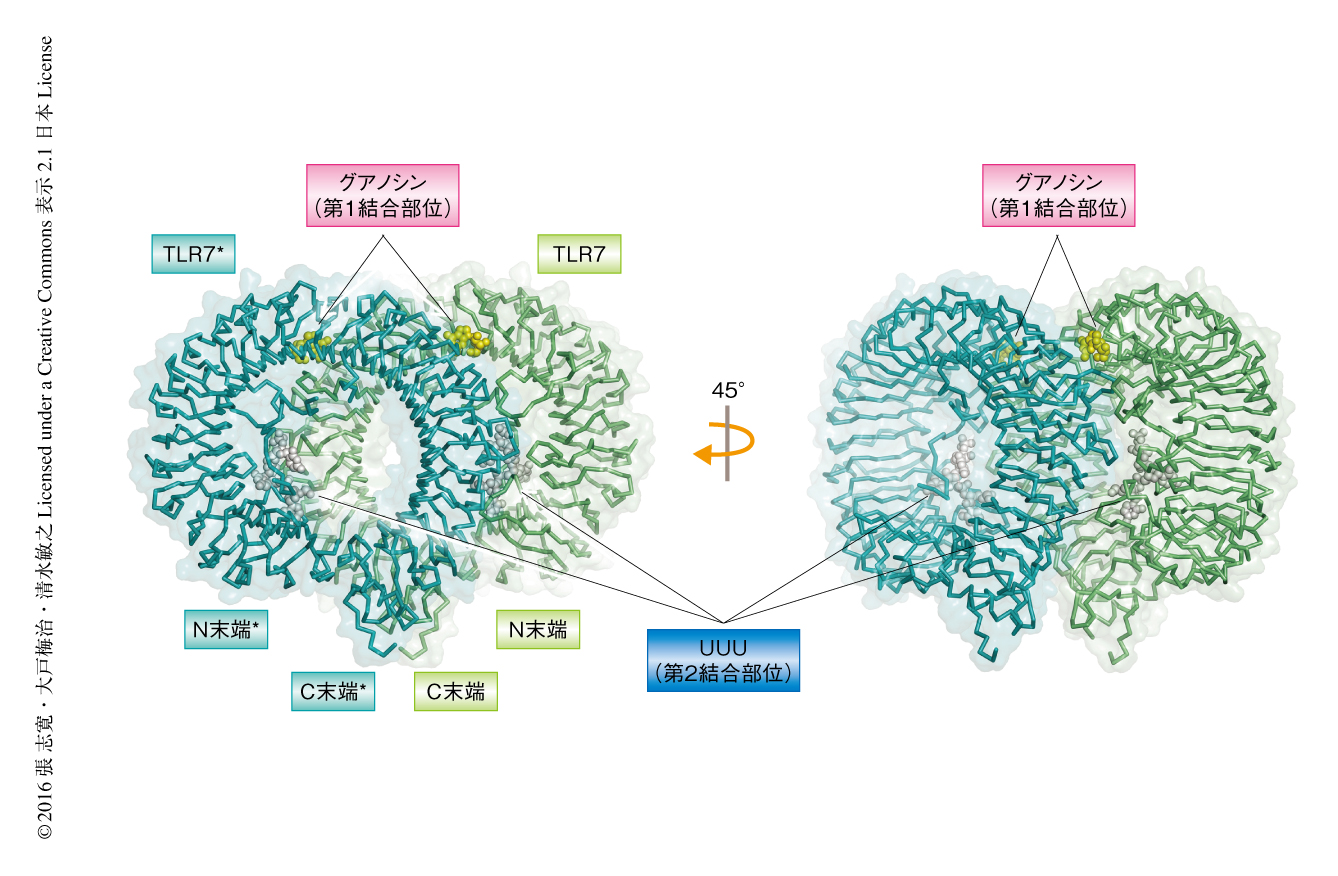
いずれの複合体の構造も,同じくTLR7サブファミリーに属するTLR8およびTLR9の活性化型の構造とほぼ同じ配置をとる活性化型の二量体であった(図1).TLR7,グアノシン,ポリU鎖からなる複合体の構造においては,グアノシンおよびポリU鎖に由来するUUUの電子密度が観察された.グアノシンは二量体の界面に位置する第1結合部位と結合していた.ポリU鎖はドーナツ形のLRRドメインの凹面とZループから形成される二量体の界面に近接する第2結合部位と結合していた.TLR7の第1結合部位はTLR8の低分子リガンドとの結合部位と同じであったが,第2結合部位はTLR8の1本鎖RNAとの結合部位とはまったく異なっていた.TLR7,ロキソリビン,ポリU鎖からなる複合体およびTLR7とR848との複合体においても同様に,ロキソリビンおよびR848が第1結合部位と結合していた.第2結合部位はTLR7,ロキソリビン,ポリU鎖からなる複合体においてはUUUが占有していたが,TLR7とR848との複合体においては占有されていなかった.
TLR7,グアノシン,ポリU鎖からなる複合体の構造において,グアノシンは2つのTLR7分子から構成される第1結合部位により認識されていた.以下,二量体を構成する2つのプロトマーのアミノ酸残基について,一方を無印,もう一方を*で表す.グアノシンの塩基の部分はTyr356,Phe408,Lys432,Thr532*,Asp555*,Leu557*,Ile585*によりかこまれ,Phe408とスタッキング相互作用していた.グアノシンのリボースの部分はTyr264,Phe351,Gln354,Val355,Val381,Leu557*,Ile585*,Thr586*によりかこまれていたが,Thr586*との水素結合だけが観察された.グアノシンのグアニジノ基はLys432との水素結合およびAsp555*との塩橋相互作用により特異的に認識されていた.一方,イミダゾキノリン誘導体であるR848の認識の様式はグアノシンの場合とよく似ていたが,R848の疎水性の置換基が第1結合部位の疎水性ポケットとファンデルワールス相互作用するという大きな違いも認められた.
第1結合部位におけるリガンドに対する特異性を等温滴定カロリメトリー法により調べた.グアノシン,ロキソリビン,R848とTLR7との結合解離定数は,それぞれ,13.5μM,5.6μM,0.49μMと算出された.一方,グアノシン以外のモノヌクレオシドについてはTLR7との結合は確認されなかったことから,TLR7はヌクレオシドのうちグアノシンを特異的に認識し,グアノシンのセンサーとしての機能をもつと考えられた.
第2結合部位はドーナツ型の凹面においてLRRドメインのLRR1~LRR5にわたる範囲とZループにはさまれて存在した.第2結合部位は二量体の界面に近接していたが,二量体の形成に直接には関与していなかった.第2結合部位に存在する3つのジスルフィド結合は1本鎖RNAの認識に重要な役割をはたしていた.とくに,LRRドメインのLRR2のCys98とZループのCys475とのジスルフィド結合はTLR7に特徴的であり,このジスルフィド結合によりZループがLRRドメインの凹面に固定され第2結合部位が安定化されると考えられた.
UUUとTLR7とのあいだにはいくつかの特徴的な相互作用が観察された.中央のUの塩基の部分はArg97,Glu156,Gln181とArg473の側鎖と相互作用し,RNAに特有の2’-OH基がGln181の側鎖およびArg473の主鎖により認識されていた.実際に,TLR7は1本鎖DNA(ポリdU鎖)とは結合せず,この構造的な特徴と一致した.また,TLR7とUUUとの相互作用において,両端のUの認識は緊密ではないため,ほかの塩基も結合する可能性があると考えられた.
さらに,結晶において電子密度が観察されたUUUが19塩基のポリU鎖の一部なのか,あるいは,その分解産物なのかを同定するため,結晶を溶解し液体クロマトグラフィー-質量分析法によりRNAを検出した.その結果,3~5塩基からなるRNAが検出され,結晶化に用いたRNAは検出されなかった.この結果から,結晶において第2結合部位と結合していたのはポリU鎖の分解産物であり,3塩基以上のRNAがTLR7と結合すると結論づけた.
TLR7の活性化における第1結合部位および第2結合部位の重要性について調べるため,第1結合部位あるいは第2結合部位にAlaの置換を導入した変異体の活性をHEK293T細胞を用いたNF-κBレポーターアッセイにより調べた.その結果,第1結合部位の変異体において低分子リガンドおよび1本鎖RNAに対する応答が消失あるいは低下した.一方で,第2結合部位の変異体においては,低分子リガンドに対する応答はそれほど変化しなかったが,1本鎖RNAに対する応答は顕著に低下した.これらの結果から,第1結合部位は低分子リガンドおよび1本鎖RNAの両方の活性化において重要であるが,第2結合部位は1本鎖RNAによる活性化のみにかかわることが示唆された.
1本鎖RNAとTLR7との結合および二量体の形成について詳細に調べた.さまざまな長さのポリU鎖とTLR7の結合について等温滴定カロリメトリー法により調べた結果,6塩基から19塩基のポリU鎖は強く結合することが確認された.さらに,ポリU鎖の存在のもとでのTLR7の会合の状態を超遠心沈降速度法により調べた.6塩基のポリU鎖あるいは9塩基のポリU鎖の存在のもとではTLR7は二量体を形成しなかったことから,ポリU鎖のみでは活性化型の二量体は形成されないことがわかった.12塩基以上の長いポリU鎖の存在のもとでは二量体の形成が観察されたが,これは,1本のRNAに2つのTLR7が非特異的に結合したためと思われた.
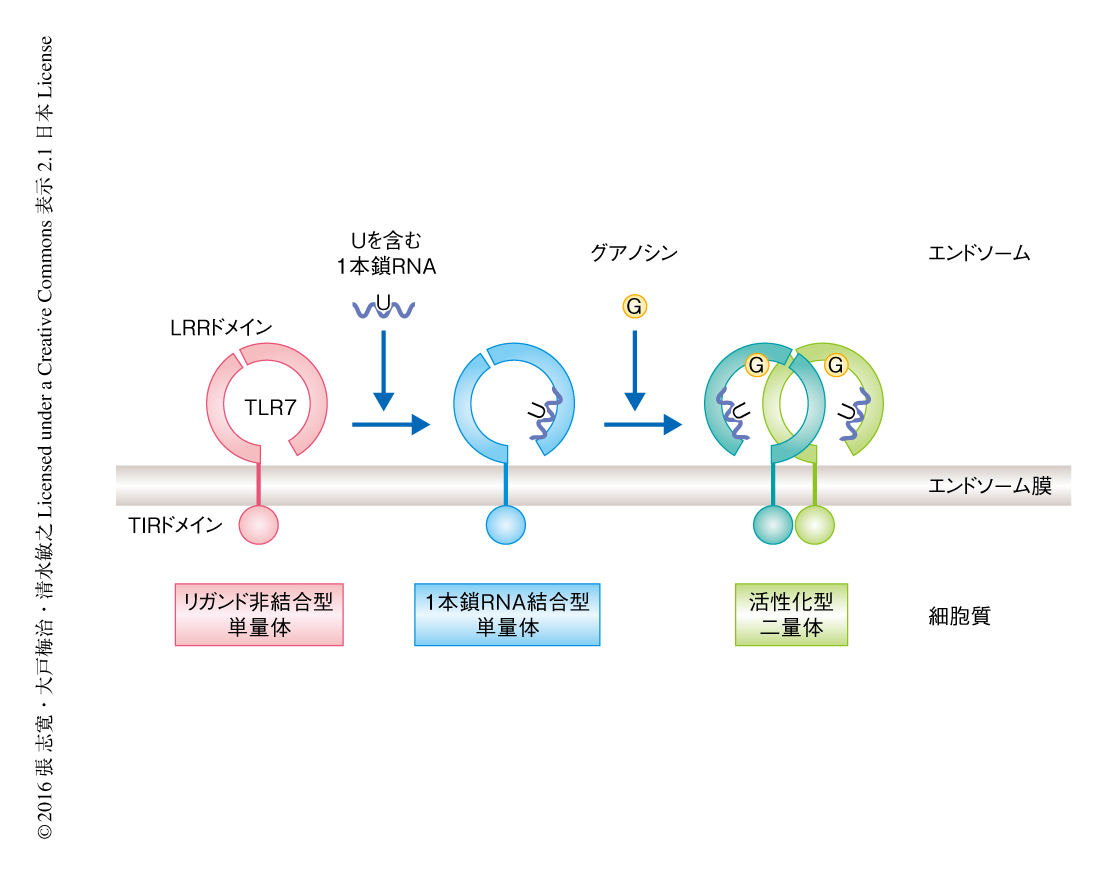
1本鎖RNAの存在のもとではグアノシンとTLR7との結合解離定数は13.5μMから約1μMまで上昇した.この結果から,TLR7は高親和性の1本鎖RNAが第2結合部位と結合したのち,グアノシンが第1結合部位と結合して活性化するという機構が提唱された(図2).グアノシンが単独では第1結合部位との結合は弱いため,第2結合部位の1本鎖RNAとの結合による協調的な効果がTLR7の活性化に必要だと考えられた.
第2結合部位に対するRNAの塩基に対する特異性について調べた.UUUの存在のもとではTLR7とグアノシンとの結合解離定数は3.9μMまで上昇した.この協調的な効果から,TLR7とUUUが結合していることが示された.一方,AAA,GGG,CCCを用いた場合,協調的な効果はまったく観察されなかった.TLR7により特異的に認識されていた中央のUを変えたUCUおよびUGUを用いた場合も協調的な効果はみられなかった.これらの結果から,1本鎖RNAの非末端のUがTLR7との結合に必要であることが明らかにされた.
病原体に由来する核酸が自然免疫を活性化させること,そして,TLR7サブファミリーに属するToll様受容体TLR7,TLR8,TLR9がその認識に重要な役割をはたすことが報告されて以来3),十数年にわたり,TLR7サブファミリーに関して数多くの研究がなされてきた.TLR8およびTLR9にくわえ,TLR7の結晶構造が解析されたことにより,TLR7サブファミリーによる1本鎖核酸の認識の機構の全貌がみえてきた.今回の研究は,TLR7を標的にした創薬において,2つの作用点で活性を制御するという新しい視点を提供するものであり,今後の進展が期待される.
略歴:東京大学大学院薬学系研究科修士課程 在学中.
抱負:新薬の開発に貢献したい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 准教授.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2016 張 志寛・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 蛋白構造生物学教室)
email:大戸梅治,清水敏之
DOI: 10.7875/first.author.2016.108
Structural analysis reveals that Toll-like receptor 7 is a dual receptor for guanosine and single-stranded RNA.
Zhikuan Zhang, Umeharu Ohto, Takuma Shibata, Elena Krayukhina, Masato Taoka, Yoshio Yamauchi, Hiromi Tanji, Toshiaki Isobe, Susumu Uchiyama, Kensuke Miyake, Toshiyuki Shimizu
Immunity, 45, 737-748 (2016)
要 約
Toll様受容体のひとつTLR7は自然免疫におけるウイルスに由来する1本鎖RNAの受容体であり,また,グアノシンやイミダゾキノリン誘導体などの低分子リガンドによっても活性化される.これまで,TLR7のリガンドの認識の機構および活性化の機構は不明であった.今回,筆者らは,TLR7,低分子リガンド,1本鎖RNAからなる複合体の構造をX線結晶解析により明らかにした.リガンド結合型のTLR7は活性化型の二量体を形成し,第1結合部位において低分子リガンド,第2結合部位において1本鎖RNAを認識していた.そして,第1結合部位はグアノシンを特異的に認識し,第2結合部位は非末端のUを含む3塩基以上の1本鎖RNAを特異的に認識した.さらに,TLR7が1本鎖RNAおよびグアノシンによる協調的な効果により活性化される機構が明らかにされた.
はじめに
Toll様受容体(Toll-like receptor:TLR)は1型膜貫通タンパク質であり,自然免疫において病原体のセンサーの役割を担う1).Toll様受容体は細胞外においてリガンドを認識するLRRドメイン,膜貫通領域,細胞内においてシグナル伝達にかかわるTIRドメインから構成され,病原体の分子パターンを認識して自然免疫を活性化する1).ヒトでは10種類のToll様受容体が同定されており,核酸,リポ多糖,リポタンパク質など,それぞれのToll様受容体が特定の分子パターンを認識する2).
エンドソームに局在するTLR7,TLR8,TLR9は相同性が高く,TLR7サブファミリーを構成する3).TLR7はウイルスに由来する1本鎖RNAの受容体として同定され,ウイルスへの感染や全身性エリテマトーデスなどの自己免疫性疾患に関与する4-6).TLR7はグアノシンおよびウリジンに富んだ1本鎖RNAを認識すると考えられているが,一方で,グアノシン,グアノシンのアナログ,イミダゾキノリン誘導体など低分子リガンドによっても活性化される7,8).
近年,筆者らにより,TLR8の結晶構造9-11)(文献9) は新着論文レビュー でも掲載,文献10) は新着論文レビュー でも掲載),および,TLR9の結晶構造が解明された12)(新着論文レビュー でも掲載).そして今回,筆者らは,世界ではじめてTLR7の結晶構造の解析に成功した.
1.TLR7は2つのリガンド結合部位をもつ
さまざまな生物種のTLR7について検討した結果,サルのTLR7が良好な性状を示した.TLR7ファミリーはLRRドメインのLRR14とLRR15とのあいだにZループとよばれる配列をもち,この切断が活性化に必須である.そこで,Zループの一部をトロンビンの認識配列と置換したサルのTLR7のLRRドメインをショウジョウバエS2細胞において発現させた.実験にはZループを人為的に切断したTLR7を用いた.19塩基のポリU鎖と共結晶化させ,X線結晶構造解析により,TLR7,グアノシン,ポリU鎖からなる複合体の構造を分解能2.5Å(PDB ID:5GMF),TLR7,ロキソリビン,ポリU鎖からなる複合体の構造を分解能2.6Å(PDB ID:5GMG),TLR7とR848との複合体の構造を分解能2.2Å(PDB ID:5GMH)で決定した.
いずれの複合体の構造も,同じくTLR7サブファミリーに属するTLR8およびTLR9の活性化型の構造とほぼ同じ配置をとる活性化型の二量体であった(図1).TLR7,グアノシン,ポリU鎖からなる複合体の構造においては,グアノシンおよびポリU鎖に由来するUUUの電子密度が観察された.グアノシンは二量体の界面に位置する第1結合部位と結合していた.ポリU鎖はドーナツ形のLRRドメインの凹面とZループから形成される二量体の界面に近接する第2結合部位と結合していた.TLR7の第1結合部位はTLR8の低分子リガンドとの結合部位と同じであったが,第2結合部位はTLR8の1本鎖RNAとの結合部位とはまったく異なっていた.TLR7,ロキソリビン,ポリU鎖からなる複合体およびTLR7とR848との複合体においても同様に,ロキソリビンおよびR848が第1結合部位と結合していた.第2結合部位はTLR7,ロキソリビン,ポリU鎖からなる複合体においてはUUUが占有していたが,TLR7とR848との複合体においては占有されていなかった.
2.第1結合部位における低分子リガンドの認識およびグアノシンに対する特異性
TLR7,グアノシン,ポリU鎖からなる複合体の構造において,グアノシンは2つのTLR7分子から構成される第1結合部位により認識されていた.以下,二量体を構成する2つのプロトマーのアミノ酸残基について,一方を無印,もう一方を*で表す.グアノシンの塩基の部分はTyr356,Phe408,Lys432,Thr532*,Asp555*,Leu557*,Ile585*によりかこまれ,Phe408とスタッキング相互作用していた.グアノシンのリボースの部分はTyr264,Phe351,Gln354,Val355,Val381,Leu557*,Ile585*,Thr586*によりかこまれていたが,Thr586*との水素結合だけが観察された.グアノシンのグアニジノ基はLys432との水素結合およびAsp555*との塩橋相互作用により特異的に認識されていた.一方,イミダゾキノリン誘導体であるR848の認識の様式はグアノシンの場合とよく似ていたが,R848の疎水性の置換基が第1結合部位の疎水性ポケットとファンデルワールス相互作用するという大きな違いも認められた.
第1結合部位におけるリガンドに対する特異性を等温滴定カロリメトリー法により調べた.グアノシン,ロキソリビン,R848とTLR7との結合解離定数は,それぞれ,13.5μM,5.6μM,0.49μMと算出された.一方,グアノシン以外のモノヌクレオシドについてはTLR7との結合は確認されなかったことから,TLR7はヌクレオシドのうちグアノシンを特異的に認識し,グアノシンのセンサーとしての機能をもつと考えられた.
3.第2結合部位における1本鎖RNAの認識
第2結合部位はドーナツ型の凹面においてLRRドメインのLRR1~LRR5にわたる範囲とZループにはさまれて存在した.第2結合部位は二量体の界面に近接していたが,二量体の形成に直接には関与していなかった.第2結合部位に存在する3つのジスルフィド結合は1本鎖RNAの認識に重要な役割をはたしていた.とくに,LRRドメインのLRR2のCys98とZループのCys475とのジスルフィド結合はTLR7に特徴的であり,このジスルフィド結合によりZループがLRRドメインの凹面に固定され第2結合部位が安定化されると考えられた.
UUUとTLR7とのあいだにはいくつかの特徴的な相互作用が観察された.中央のUの塩基の部分はArg97,Glu156,Gln181とArg473の側鎖と相互作用し,RNAに特有の2’-OH基がGln181の側鎖およびArg473の主鎖により認識されていた.実際に,TLR7は1本鎖DNA(ポリdU鎖)とは結合せず,この構造的な特徴と一致した.また,TLR7とUUUとの相互作用において,両端のUの認識は緊密ではないため,ほかの塩基も結合する可能性があると考えられた.
さらに,結晶において電子密度が観察されたUUUが19塩基のポリU鎖の一部なのか,あるいは,その分解産物なのかを同定するため,結晶を溶解し液体クロマトグラフィー-質量分析法によりRNAを検出した.その結果,3~5塩基からなるRNAが検出され,結晶化に用いたRNAは検出されなかった.この結果から,結晶において第2結合部位と結合していたのはポリU鎖の分解産物であり,3塩基以上のRNAがTLR7と結合すると結論づけた.
4.1本鎖RNAによるTLR7の活性化には第1結合部位および第2結合部位が必要である
TLR7の活性化における第1結合部位および第2結合部位の重要性について調べるため,第1結合部位あるいは第2結合部位にAlaの置換を導入した変異体の活性をHEK293T細胞を用いたNF-κBレポーターアッセイにより調べた.その結果,第1結合部位の変異体において低分子リガンドおよび1本鎖RNAに対する応答が消失あるいは低下した.一方で,第2結合部位の変異体においては,低分子リガンドに対する応答はそれほど変化しなかったが,1本鎖RNAに対する応答は顕著に低下した.これらの結果から,第1結合部位は低分子リガンドおよび1本鎖RNAの両方の活性化において重要であるが,第2結合部位は1本鎖RNAによる活性化のみにかかわることが示唆された.
5.1本鎖RNAとの結合は第1結合部位に対する低分子リガンドの親和性を上昇させる
1本鎖RNAとTLR7との結合および二量体の形成について詳細に調べた.さまざまな長さのポリU鎖とTLR7の結合について等温滴定カロリメトリー法により調べた結果,6塩基から19塩基のポリU鎖は強く結合することが確認された.さらに,ポリU鎖の存在のもとでのTLR7の会合の状態を超遠心沈降速度法により調べた.6塩基のポリU鎖あるいは9塩基のポリU鎖の存在のもとではTLR7は二量体を形成しなかったことから,ポリU鎖のみでは活性化型の二量体は形成されないことがわかった.12塩基以上の長いポリU鎖の存在のもとでは二量体の形成が観察されたが,これは,1本のRNAに2つのTLR7が非特異的に結合したためと思われた.
1本鎖RNAの存在のもとではグアノシンとTLR7との結合解離定数は13.5μMから約1μMまで上昇した.この結果から,TLR7は高親和性の1本鎖RNAが第2結合部位と結合したのち,グアノシンが第1結合部位と結合して活性化するという機構が提唱された(図2).グアノシンが単独では第1結合部位との結合は弱いため,第2結合部位の1本鎖RNAとの結合による協調的な効果がTLR7の活性化に必要だと考えられた.
6.TLR7は非末端のUを含む1本鎖RNAを特異的に認識する
第2結合部位に対するRNAの塩基に対する特異性について調べた.UUUの存在のもとではTLR7とグアノシンとの結合解離定数は3.9μMまで上昇した.この協調的な効果から,TLR7とUUUが結合していることが示された.一方,AAA,GGG,CCCを用いた場合,協調的な効果はまったく観察されなかった.TLR7により特異的に認識されていた中央のUを変えたUCUおよびUGUを用いた場合も協調的な効果はみられなかった.これらの結果から,1本鎖RNAの非末端のUがTLR7との結合に必要であることが明らかにされた.
おわりに
病原体に由来する核酸が自然免疫を活性化させること,そして,TLR7サブファミリーに属するToll様受容体TLR7,TLR8,TLR9がその認識に重要な役割をはたすことが報告されて以来3),十数年にわたり,TLR7サブファミリーに関して数多くの研究がなされてきた.TLR8およびTLR9にくわえ,TLR7の結晶構造が解析されたことにより,TLR7サブファミリーによる1本鎖核酸の認識の機構の全貌がみえてきた.今回の研究は,TLR7を標的にした創薬において,2つの作用点で活性を制御するという新しい視点を提供するものであり,今後の進展が期待される.
文 献
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
- Kawai, T. & Akira S.: Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity, 34, 637-650 (2011)[PubMed]
- Roers, A., Hiller, B. & Hornung, V.: Recognition of endogenous nucleic acids by the innate immune system. Immunity, 44, 739-754 (2016)[PubMed]
- Heil, F., Hemmi, H., Hochrein, H. et al.: Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8. Science, 303, 1526-1529 (2004)[PubMed]
- Takahashi, K., Asabe, S., Wieland, S. et al.: Plasmacytoid dendritic cells sense hepatitis C virus-infected cells, produce interferon, and inhibit infection. Proc. Natl. Acad. Sci. USA, 107, 7431-7436 (2010)[PubMed]
- Santiago-Raber, M. L., Baudino. L. & Izui, S.: Emerging roles of TLR7 and TLR9 in murine SLE. J. Autoimmun., 33, 231-238 (2009)[PubMed]
- Shibata, T., Ohto, U., Nomura, S. et al.: Guanosine and its modified derivatives are endogenous ligands for TLR7. Int. Immunol., 28, 211-222 (2016)[PubMed]
- Hemmi, H., Kaisho, T., Takeuchi, O. et al.: Small anti-viral compounds activate immune cells via the TLR7 MyD88-dependent signaling pathway. Nat. Immunol., 3, 196-200 (2002)[PubMed]
- Tanji, H., Ohto, U., Shibata, T. et al.: Structural reorganization of the Toll-like receptor 8 dimer induced by agonistic ligands. Science, 339, 1426-1429 (2013)[PubMed] [新着論文レビュー]
- Tanji, H., Ohto, U., Shibata, T. et al.: Toll-like receptor 8 senses degradation products of single-stranded RNA. Nat. Struct. Mol. Biol., 22, 109-115 (2015)[PubMed] [新着論文レビュー]
- Tanji, H., Ohto, U., Motoi, Y. et al.: Autoinhibition and relief mechanism by the proteolytic processing of Toll-like receptor 8. Proc. Natl. Acad. Sci. USA, 113, 3012-3017 (2016)[PubMed]
- Ohto, U., Shibata, T., Tanji, H. et al.: Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9. Nature, 520, 702-705 (2015)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:東京大学大学院薬学系研究科修士課程 在学中.
抱負:新薬の開発に貢献したい.
大戸 梅治(Umeharu Ohto)
東京大学大学院薬学系研究科 准教授.
清水 敏之(Toshiyuki Shimizu)
東京大学大学院薬学系研究科 教授.
研究室URL:http://www.f.u-tokyo.ac.jp/~kouzou/
© 2016 張 志寛・大戸梅治・清水敏之 Licensed under CC 表示 2.1 日本