エンドセリン-1との結合によるエンドセリン受容体B型の活性化における構造基盤
志甫谷 渉・西澤知宏・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:志甫谷 渉,西澤知宏,濡木 理
DOI: 10.7875/first.author.2016.096
Activation mechanism of endothelin ETB receptor by endothelin-1.
Wataru Shihoya, Tomohiro Nishizawa, Akiko Okuta, Kazutoshi Tani, Naoshi Dohmae, Yoshinori Fujiyoshi, Osamu Nureki, Tomoko Doi
Nature, 537, 363-368 (2016)
エンドセリン受容体はエンドセリンとよばれるペプチドホルモンにより活性化されるGタンパク質共役受容体であり,体内における血流の制御,体液の水分濃度の調整,細胞増殖などを担い,がん,高血圧,腎臓病に対する創薬の有望な標的でもある.今回,筆者らは,ヒトに由来するエンドセリン受容体B型について,内在性のアゴニストであるエンドセリン-1の結合した初期活性型,および,リガンドの結合していない不活性型の結晶構造を,それぞれ2.8Å分解能および2.5Å分解能で決定した.エンドセリン-1と結合したエンドセリン受容体B型の構造から,複雑な構造をもつエンドセリン-1の結合様式が解明された.さらに,決定された2つの構造の比較により,エンドセリン-1との結合にともないエンドセリン受容体B型に大きな構造変化の起こることが明らかにされ,その活性化の機構について知見が得られた.今回の研究により得られた立体構造の情報は,エンドセリンの受容体を標的とした新規の薬剤の開発に役だつことが期待される.
エンドセリンは1988年に発見された21アミノ酸残基からなるペプチドホルモンであり,生体においてもっとも強力な血管収縮物質のひとつである1).1990年には,細胞膜に存在するエンドセリン受容体A型およびエンドセリン受容体B型が発見された.エンドセリン受容体A型およびエンドセリン受容体B型はともにGタンパク質共役受容体であり,エンドセリンはこれらの受容体を介して細胞内のGiやGqなどGタンパク質を活性化することにより,細胞膜を介しシグナルを伝達する.エンドセリン-1はエンドセリン受容体とみかけのうえで不可逆的に結合し持続的な血圧の上昇にかかわる2).血流の制御のほかにも,神経堤細胞の発生,細胞の増殖,体液の水分濃度の調整など,エンドセリンのかかわるシグナル伝達は多岐にわたる生理現象に関与する3,4).
エンドセリン-1の異常な産生はがん,高血圧,心臓病などさまざまな疾患の原因となるため,その作用を拮抗的に阻害するエンドセリン受容体のアンタゴニストはこうした疾患に対する薬剤として注目されている5).実際に,非選択的なアンタゴニストであるボセンタンは肺動脈性の肺高血圧症に対する治療薬として使われている.さらに,エンドセリン受容体B型に選択的なアゴニストであるエンドセリン-1の誘導体IRL-1620は,腫瘍細胞の血管を拡張させて血流を促進することにより抗がん剤や放射線治療の効能を高めるとされ臨床研究が進められている5).エンドセリンに関する薬理的および医学的な研究は多くなされてきたが,エンドセリンがどのようにエンドセリン受容体と結合しこれを活性化するのか,その分子機構の詳細はまったく不明であった.そのため,エンドセリン受容体を標的とした非ペプチド性のアゴニストや新規のアンタゴニストの開発は停滞しており,エンドセリン受容体の構造の情報が待ち望まれていた.
ヒトに由来する膜タンパク質,とくに,Gタンパク質共役受容体は構造が柔軟かつ不安定であり,ヒトに由来するエンドセリン受容体B型のX線結晶構造解析も困難をきわめた.結晶化の促進のため膜貫通領域ひとつひとつにAlaを導入することにより,安定性の向上した耐熱変異体の作製に成功した6).さらに,構造が柔軟であった細胞内第3ループにT4リゾチームを挿入し脂質キュービック相を利用することにより,エンドセリン受容体B型とエンドセリン-1との複合体の結晶化に成功し,2.8Å分解能で構造を決定した(PDB ID:5GLH).さらに,T4リゾチームを小型T4リゾチーム7) に改変することにより,リガンドと結合していないエンドセリン受容体B型の構造を2.5Å分解能で決定した(PDB ID:5GLI).
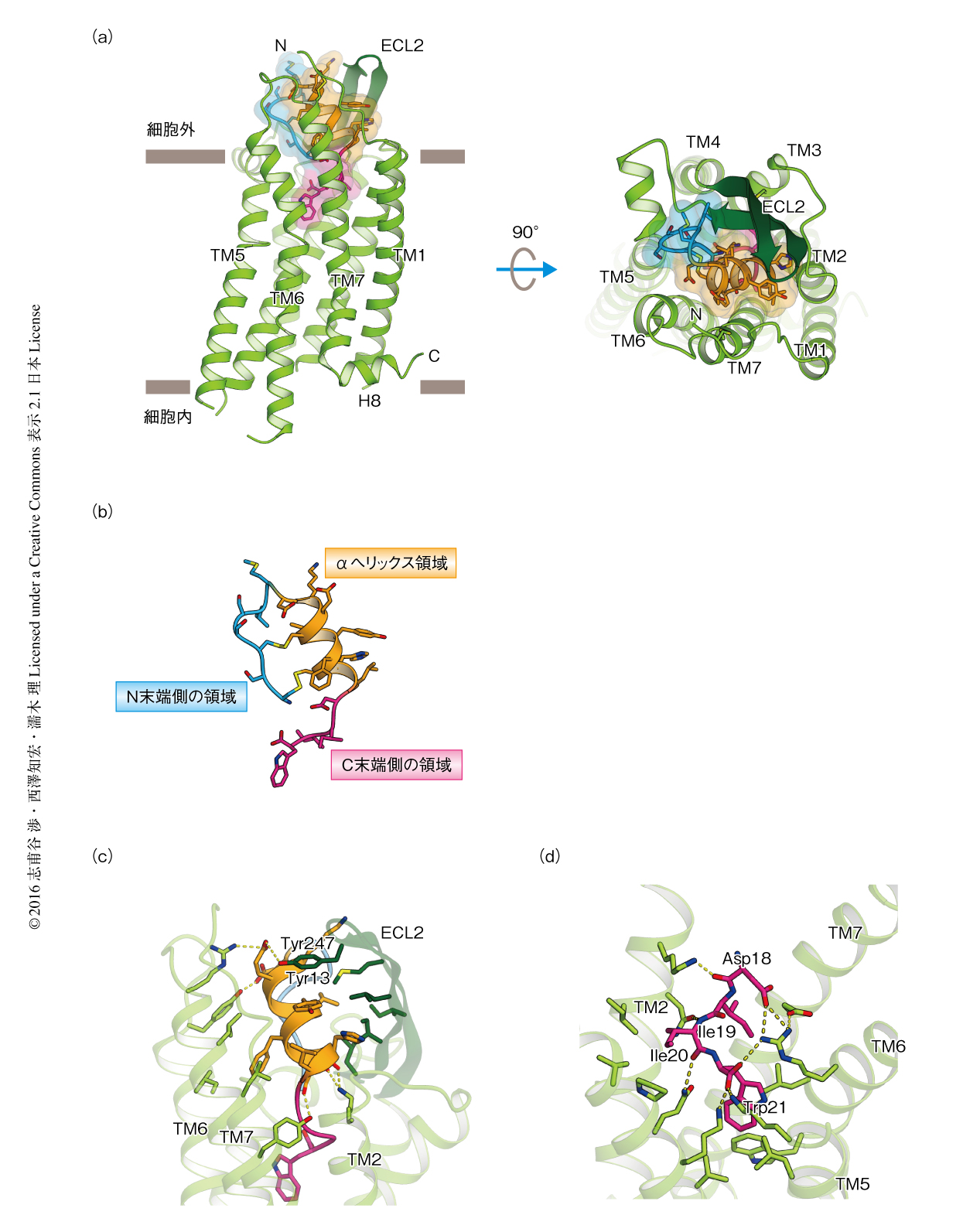
エンドセリン受容体B型は7本の膜貫通へリックスとC末端側にある両親媒性のαへリックスから構成されており,既知のGタンパク質共役受容体の全体構造と類似していた(図1a).N末端は細胞の外側に伸び,膜貫通へリックス7とS-S結合によりつながっていた.細胞外第2ループはペプチド受容性のGタンパク質共役受容体に共通した特徴である大きなβシートを形成していた.エンドセリン-1の認識にはN末端側,細胞外ループ,膜貫通へリックス2~膜貫通へリックス7がかかわり,大きなリガンドとの結合ポケットを形成していた.エンドセリン受容体B型とエンドセリン-1との相互作用の面積は約1500Åで,これまで構造の解析されていたGタンパク質共役受容体のなかでもっとも広範であった.こうした広範な相互作用は,エンドセリン受容体B型に対するエンドセリン-1の非常に高い結合能に寄与すると考えられた.
エンドセリン受容体B型とエンドセリン-1との複合体において,エンドセリン-1は,X線結晶構造解析やNMR法により決定された単体のエンドセリン-1の構造と同様に,Cys1-Cys15とCys3-Cys11の2つの分子内S-S結合により環状化していた(図1b).エンドセリン-1の中央部の8~17番目の残基はαへリックスを形成し,N末端側の1~7番目の残基とS-S結合により結ばれていた.C末端側の18~21番目の残基は伸びた構造をとり,Trp21の側鎖を結合ポケットの中心にむけるかたちでエンドセリン受容体B型に突き刺さるように結合していた.
エンドセリン-1はおもにそのαへリックス領域とC末端側の領域を介してエンドセリン受容体B型と密な相互作用を形成していた.αへリックス領域はおもに疎水性アミノ酸残基からなり,エンドセリン受容体B型の細胞外第2ループとN末端側の領域にはさまれ,広範な分子間相互作用を形成していた(図1c).とくに,細胞外第2ループの長いβシートはαへリックス領域をつつみこみ,エンドセリン受容体B型のTyr247がエンドセリン-1のTyr13とπ-π相互作用を形成することにより上部からふたをしていた.こうした疎水性相互作用にくわえ,αへリックス領域のN末端側およびC末端側はエンドセリン受容体B型と複数の水素結合を形成し,αへリックス領域の配向を決めていた.
エンドセリン-1のC末端側の領域の3つの疎水性アミノ酸残基Ile19,Ile20,Trp21はエンドセリン受容体B型のリガンド結合部位の深くにある疎水性の結合ポケットにはまりこんでいた(図1d).Ile19の主鎖のアミドやカルボニル酸素はエンドセリン受容体B型との水素結合により安定化されていた.エンドセリン-1のC末端のTrp21のカルボキシル基やAsp18の側鎖といった負電荷は,エンドセリン受容体B型の電荷性アミノ酸残基と電荷相補的な相互作用ネットワークを形成していた.過去の研究において,エンドセリン-1のTrp21の置換あるいは削除によりエンドセリン受容体B型との結合能が失われたことから,エンドセリン-1のC末端側の領域とエンドセリン受容体B型との相互作用は結合に必須であると考えられた.
エンドセリン-1との結合にともなうエンドセリン受容体B型の構造変化について明らかにするため,エンドセリン-1と結合したエンドセリン受容体B型とリガンドと結合していないエンドセリン受容体B型の構造を比較した(図2a).エンドセリン受容体B型の細胞質側に大きな構造変化はなかったが,これは,Gタンパク質共役受容体の細胞質側はGタンパク質との結合に応じて大きな構造変化を起こすというほかの構造機能解析の結果と一致しており,エンドセリン-1と結合したエンドセリン受容体B型の構造は完全活性型にいたるまえの初期活性型であることが示唆された.それに対し,エンドセリン受容体B型の細胞外側の結合ポケットにおいてエンドセリン-1との結合にともなう大きな構造変化が観察された(図2b).エンドセリン受容体B型の膜貫通へリックス2,膜貫通へリックス6,膜貫通へリックス7はエンドセリン-1との結合にともないそれぞれ2.6Å,4.1Å,4.9Åほど結合ポケットの内部へと動いていた.エンドセリン-1と直接には相互作用していない膜貫通へリックス1はこれらの膜貫通へリックスの動きと連動して4.4Åほど外側へと動いていた.こうした4本の膜貫通へリックスのダイナミックな動きにより,エンドセリン受容体B型の結合ポケットは開いた状態から閉じた状態になり,エンドセリン-1との強固な相互作用を形成することが明らかにされた.エンドセリン受容体B型とエンドセリン-1とは超安定な複合体を形成することが知られている.エンドセリン受容体B型のダイナミックな構造変化によるエンドセリン-1の認識,および,上部からふたをするような構造が,エンドセリン-1のみかけの不可逆的な結合に寄与すると考えられた.
この構造比較と過去のエンドセリンに対する変異実験の結果より,エンドセリン-1によるエンドセリン受容体B型の活性化の機構が推定された.エンドセリン-1のC末端側の領域の18番目のアミノ酸残基および19番目のアミノ酸残基は,エンドセリン-1のアゴニストとしての活性と密接な相関のあることが知られている8).エンドセリン受容体B型とエンドセリン-1との複合体において,エンドセリン-1のAsp18およびIle19はエンドセリン受容体B型の膜貫通へリックス6~膜貫通へリックス7と相互作用しており(図1c),エンドセリン-1との結合にともなう膜貫通へリックス6~膜貫通へリックス7の内側への動きに重要であった.このことから,エンドセリン-1との結合にともなう膜貫通へリックス6~膜貫通へリックス7の結合ポケットの内側への動きがエンドセリン受容体B型の活性化において重要な過程であることが強く示唆された.
今回の研究は,エンドセリン受容体を標的とする薬剤の開発へ道を切り拓くものである.具体的には,リガンドと結合していないエンドセリン受容体の構造をもとにしたアンタゴニストのin silicoスクリーニングや,エンドセリン-1の部分構造を模倣した小分子アゴニストの開発などである.構造の情報がすぐに創薬に直結するとはいえないものの,エンドセリン受容体を標的とする薬剤の臨床応用はいまだかぎられているため,こうした現状を打開できるのではないかと考えている.
筆者がエンドセリン受容体B型の研究にたずさわってからこの論文を世にだすまで,5年半もかかった.最後に,それまでの紆余曲折について延べる.エンドセリン受容体の構造の研究は20年以上もつづけられてきた.筆者がこのプロジェクトにくわわったときには,エンドセリン受容体B型の耐熱変異体を得ることには成功していたものの,課題は山積みであった.そんななか,脂質キュービック法を用いてチャネルロドプシンの構造解析に成功したという報を聞きつけ9)(新着論文レビュー でも掲載),エンドセリン受容体B型の結晶化につき共同研究することになった.数週間でアンタゴニストとの複合体の結晶が得られ,最初の結晶が得られてから1年半後には構造決定に成功した.ところが,この構造においては,導入したT4リゾチームが形成する結晶パッキングのため非生理的な状態になっていることが示唆された.リガンドの電子密度もまったくみえず,結局,この構造はお蔵入りとなった.なんとか気を取り直し,T4リゾチームとエンドセリン受容体B型とのつなぎ目の残基を変えた改変体をひととおり作製した結果,約4カ月でエンドセリン-1との複合体の構造決定に成功した.
しかし,ここからが本当にたいへんであった.構造の決定から1年後に論文を投稿したところ,査読にもまわらずリジェクトになってしまったのである.そこで,エンドセリン受容体B型とアンタゴニストとの複合体の構造を決定し,エンドセリン-1の認識にともなうエンドセリン受容体B型の構造変化を明らかにしようと決意した.構造解析はさきがみえないが,ほんの一手変えることにより状況が劇的に改善することがある.いろいろと手をつくしていくなか,T4リゾチームを小型T4リゾチームとすると結晶化パッキングや分解能が向上するという報告7) が目にとまった.これを試してみるとペプチド性のアンタゴニストとの共結晶化に成功し,分解能2.3Åという高分解能で構造が決定された.しかし,この構造において結合ポケットの電子密度がはっきりしておらず,またしても解釈に困った.共結晶化の際にリガンドが解離している可能性を考え,無謀にもリガンドを何もくわえずに結晶化を試したところ,まったく同じ構造が得られた.つまり,共結晶化の過程でアンタゴニストは解離していたのであった.奇跡的に,リガンドと結合していないエンドセリン受容体B型の構造が決定された.
それにしても,最初に構造が得られた段階ではっきりしない電子密度に無理やりリガンドをあてはめて議論していた場合,論文として発表しても最終的には撤回せざるをえない状況になっていただろう.研究においては,よいと思われる結果が得られたときこそ,手や頭を動かしつづける重要性を認識した.
略歴:名古屋大学大学院創薬科学研究科博士課程 在学中.
研究テーマ:Gタンパク質共役受容体の構造機能.
抱負:生き残りたい.
西澤 知宏(Tomohiro Nishizawa)
略歴:東京大学理学系研究科 助教,科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:膜タンパク質の構造解析.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2016 志甫谷 渉・西澤知宏・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:志甫谷 渉,西澤知宏,濡木 理
DOI: 10.7875/first.author.2016.096
Activation mechanism of endothelin ETB receptor by endothelin-1.
Wataru Shihoya, Tomohiro Nishizawa, Akiko Okuta, Kazutoshi Tani, Naoshi Dohmae, Yoshinori Fujiyoshi, Osamu Nureki, Tomoko Doi
Nature, 537, 363-368 (2016)
要 約
エンドセリン受容体はエンドセリンとよばれるペプチドホルモンにより活性化されるGタンパク質共役受容体であり,体内における血流の制御,体液の水分濃度の調整,細胞増殖などを担い,がん,高血圧,腎臓病に対する創薬の有望な標的でもある.今回,筆者らは,ヒトに由来するエンドセリン受容体B型について,内在性のアゴニストであるエンドセリン-1の結合した初期活性型,および,リガンドの結合していない不活性型の結晶構造を,それぞれ2.8Å分解能および2.5Å分解能で決定した.エンドセリン-1と結合したエンドセリン受容体B型の構造から,複雑な構造をもつエンドセリン-1の結合様式が解明された.さらに,決定された2つの構造の比較により,エンドセリン-1との結合にともないエンドセリン受容体B型に大きな構造変化の起こることが明らかにされ,その活性化の機構について知見が得られた.今回の研究により得られた立体構造の情報は,エンドセリンの受容体を標的とした新規の薬剤の開発に役だつことが期待される.
はじめに
エンドセリンは1988年に発見された21アミノ酸残基からなるペプチドホルモンであり,生体においてもっとも強力な血管収縮物質のひとつである1).1990年には,細胞膜に存在するエンドセリン受容体A型およびエンドセリン受容体B型が発見された.エンドセリン受容体A型およびエンドセリン受容体B型はともにGタンパク質共役受容体であり,エンドセリンはこれらの受容体を介して細胞内のGiやGqなどGタンパク質を活性化することにより,細胞膜を介しシグナルを伝達する.エンドセリン-1はエンドセリン受容体とみかけのうえで不可逆的に結合し持続的な血圧の上昇にかかわる2).血流の制御のほかにも,神経堤細胞の発生,細胞の増殖,体液の水分濃度の調整など,エンドセリンのかかわるシグナル伝達は多岐にわたる生理現象に関与する3,4).
エンドセリン-1の異常な産生はがん,高血圧,心臓病などさまざまな疾患の原因となるため,その作用を拮抗的に阻害するエンドセリン受容体のアンタゴニストはこうした疾患に対する薬剤として注目されている5).実際に,非選択的なアンタゴニストであるボセンタンは肺動脈性の肺高血圧症に対する治療薬として使われている.さらに,エンドセリン受容体B型に選択的なアゴニストであるエンドセリン-1の誘導体IRL-1620は,腫瘍細胞の血管を拡張させて血流を促進することにより抗がん剤や放射線治療の効能を高めるとされ臨床研究が進められている5).エンドセリンに関する薬理的および医学的な研究は多くなされてきたが,エンドセリンがどのようにエンドセリン受容体と結合しこれを活性化するのか,その分子機構の詳細はまったく不明であった.そのため,エンドセリン受容体を標的とした非ペプチド性のアゴニストや新規のアンタゴニストの開発は停滞しており,エンドセリン受容体の構造の情報が待ち望まれていた.
1.エンドセリン受容体B型の構造の決定
ヒトに由来する膜タンパク質,とくに,Gタンパク質共役受容体は構造が柔軟かつ不安定であり,ヒトに由来するエンドセリン受容体B型のX線結晶構造解析も困難をきわめた.結晶化の促進のため膜貫通領域ひとつひとつにAlaを導入することにより,安定性の向上した耐熱変異体の作製に成功した6).さらに,構造が柔軟であった細胞内第3ループにT4リゾチームを挿入し脂質キュービック相を利用することにより,エンドセリン受容体B型とエンドセリン-1との複合体の結晶化に成功し,2.8Å分解能で構造を決定した(PDB ID:5GLH).さらに,T4リゾチームを小型T4リゾチーム7) に改変することにより,リガンドと結合していないエンドセリン受容体B型の構造を2.5Å分解能で決定した(PDB ID:5GLI).
2.エンドセリン受容体B型の全体構造およびエンドセリン-1との結合様式
エンドセリン受容体B型は7本の膜貫通へリックスとC末端側にある両親媒性のαへリックスから構成されており,既知のGタンパク質共役受容体の全体構造と類似していた(図1a).N末端は細胞の外側に伸び,膜貫通へリックス7とS-S結合によりつながっていた.細胞外第2ループはペプチド受容性のGタンパク質共役受容体に共通した特徴である大きなβシートを形成していた.エンドセリン-1の認識にはN末端側,細胞外ループ,膜貫通へリックス2~膜貫通へリックス7がかかわり,大きなリガンドとの結合ポケットを形成していた.エンドセリン受容体B型とエンドセリン-1との相互作用の面積は約1500Åで,これまで構造の解析されていたGタンパク質共役受容体のなかでもっとも広範であった.こうした広範な相互作用は,エンドセリン受容体B型に対するエンドセリン-1の非常に高い結合能に寄与すると考えられた.
エンドセリン受容体B型とエンドセリン-1との複合体において,エンドセリン-1は,X線結晶構造解析やNMR法により決定された単体のエンドセリン-1の構造と同様に,Cys1-Cys15とCys3-Cys11の2つの分子内S-S結合により環状化していた(図1b).エンドセリン-1の中央部の8~17番目の残基はαへリックスを形成し,N末端側の1~7番目の残基とS-S結合により結ばれていた.C末端側の18~21番目の残基は伸びた構造をとり,Trp21の側鎖を結合ポケットの中心にむけるかたちでエンドセリン受容体B型に突き刺さるように結合していた.
3.エンドセリン受容体B型とエンドセリン-1との相互作用
エンドセリン-1はおもにそのαへリックス領域とC末端側の領域を介してエンドセリン受容体B型と密な相互作用を形成していた.αへリックス領域はおもに疎水性アミノ酸残基からなり,エンドセリン受容体B型の細胞外第2ループとN末端側の領域にはさまれ,広範な分子間相互作用を形成していた(図1c).とくに,細胞外第2ループの長いβシートはαへリックス領域をつつみこみ,エンドセリン受容体B型のTyr247がエンドセリン-1のTyr13とπ-π相互作用を形成することにより上部からふたをしていた.こうした疎水性相互作用にくわえ,αへリックス領域のN末端側およびC末端側はエンドセリン受容体B型と複数の水素結合を形成し,αへリックス領域の配向を決めていた.
エンドセリン-1のC末端側の領域の3つの疎水性アミノ酸残基Ile19,Ile20,Trp21はエンドセリン受容体B型のリガンド結合部位の深くにある疎水性の結合ポケットにはまりこんでいた(図1d).Ile19の主鎖のアミドやカルボニル酸素はエンドセリン受容体B型との水素結合により安定化されていた.エンドセリン-1のC末端のTrp21のカルボキシル基やAsp18の側鎖といった負電荷は,エンドセリン受容体B型の電荷性アミノ酸残基と電荷相補的な相互作用ネットワークを形成していた.過去の研究において,エンドセリン-1のTrp21の置換あるいは削除によりエンドセリン受容体B型との結合能が失われたことから,エンドセリン-1のC末端側の領域とエンドセリン受容体B型との相互作用は結合に必須であると考えられた.
4.エンドセリン-1との結合にともなうエンドセリン受容体B型の構造変化
エンドセリン-1との結合にともなうエンドセリン受容体B型の構造変化について明らかにするため,エンドセリン-1と結合したエンドセリン受容体B型とリガンドと結合していないエンドセリン受容体B型の構造を比較した(図2a).エンドセリン受容体B型の細胞質側に大きな構造変化はなかったが,これは,Gタンパク質共役受容体の細胞質側はGタンパク質との結合に応じて大きな構造変化を起こすというほかの構造機能解析の結果と一致しており,エンドセリン-1と結合したエンドセリン受容体B型の構造は完全活性型にいたるまえの初期活性型であることが示唆された.それに対し,エンドセリン受容体B型の細胞外側の結合ポケットにおいてエンドセリン-1との結合にともなう大きな構造変化が観察された(図2b).エンドセリン受容体B型の膜貫通へリックス2,膜貫通へリックス6,膜貫通へリックス7はエンドセリン-1との結合にともないそれぞれ2.6Å,4.1Å,4.9Åほど結合ポケットの内部へと動いていた.エンドセリン-1と直接には相互作用していない膜貫通へリックス1はこれらの膜貫通へリックスの動きと連動して4.4Åほど外側へと動いていた.こうした4本の膜貫通へリックスのダイナミックな動きにより,エンドセリン受容体B型の結合ポケットは開いた状態から閉じた状態になり,エンドセリン-1との強固な相互作用を形成することが明らかにされた.エンドセリン受容体B型とエンドセリン-1とは超安定な複合体を形成することが知られている.エンドセリン受容体B型のダイナミックな構造変化によるエンドセリン-1の認識,および,上部からふたをするような構造が,エンドセリン-1のみかけの不可逆的な結合に寄与すると考えられた.
この構造比較と過去のエンドセリンに対する変異実験の結果より,エンドセリン-1によるエンドセリン受容体B型の活性化の機構が推定された.エンドセリン-1のC末端側の領域の18番目のアミノ酸残基および19番目のアミノ酸残基は,エンドセリン-1のアゴニストとしての活性と密接な相関のあることが知られている8).エンドセリン受容体B型とエンドセリン-1との複合体において,エンドセリン-1のAsp18およびIle19はエンドセリン受容体B型の膜貫通へリックス6~膜貫通へリックス7と相互作用しており(図1c),エンドセリン-1との結合にともなう膜貫通へリックス6~膜貫通へリックス7の内側への動きに重要であった.このことから,エンドセリン-1との結合にともなう膜貫通へリックス6~膜貫通へリックス7の結合ポケットの内側への動きがエンドセリン受容体B型の活性化において重要な過程であることが強く示唆された.
おわりに
今回の研究は,エンドセリン受容体を標的とする薬剤の開発へ道を切り拓くものである.具体的には,リガンドと結合していないエンドセリン受容体の構造をもとにしたアンタゴニストのin silicoスクリーニングや,エンドセリン-1の部分構造を模倣した小分子アゴニストの開発などである.構造の情報がすぐに創薬に直結するとはいえないものの,エンドセリン受容体を標的とする薬剤の臨床応用はいまだかぎられているため,こうした現状を打開できるのではないかと考えている.
筆者がエンドセリン受容体B型の研究にたずさわってからこの論文を世にだすまで,5年半もかかった.最後に,それまでの紆余曲折について延べる.エンドセリン受容体の構造の研究は20年以上もつづけられてきた.筆者がこのプロジェクトにくわわったときには,エンドセリン受容体B型の耐熱変異体を得ることには成功していたものの,課題は山積みであった.そんななか,脂質キュービック法を用いてチャネルロドプシンの構造解析に成功したという報を聞きつけ9)(新着論文レビュー でも掲載),エンドセリン受容体B型の結晶化につき共同研究することになった.数週間でアンタゴニストとの複合体の結晶が得られ,最初の結晶が得られてから1年半後には構造決定に成功した.ところが,この構造においては,導入したT4リゾチームが形成する結晶パッキングのため非生理的な状態になっていることが示唆された.リガンドの電子密度もまったくみえず,結局,この構造はお蔵入りとなった.なんとか気を取り直し,T4リゾチームとエンドセリン受容体B型とのつなぎ目の残基を変えた改変体をひととおり作製した結果,約4カ月でエンドセリン-1との複合体の構造決定に成功した.
しかし,ここからが本当にたいへんであった.構造の決定から1年後に論文を投稿したところ,査読にもまわらずリジェクトになってしまったのである.そこで,エンドセリン受容体B型とアンタゴニストとの複合体の構造を決定し,エンドセリン-1の認識にともなうエンドセリン受容体B型の構造変化を明らかにしようと決意した.構造解析はさきがみえないが,ほんの一手変えることにより状況が劇的に改善することがある.いろいろと手をつくしていくなか,T4リゾチームを小型T4リゾチームとすると結晶化パッキングや分解能が向上するという報告7) が目にとまった.これを試してみるとペプチド性のアンタゴニストとの共結晶化に成功し,分解能2.3Åという高分解能で構造が決定された.しかし,この構造において結合ポケットの電子密度がはっきりしておらず,またしても解釈に困った.共結晶化の際にリガンドが解離している可能性を考え,無謀にもリガンドを何もくわえずに結晶化を試したところ,まったく同じ構造が得られた.つまり,共結晶化の過程でアンタゴニストは解離していたのであった.奇跡的に,リガンドと結合していないエンドセリン受容体B型の構造が決定された.
それにしても,最初に構造が得られた段階ではっきりしない電子密度に無理やりリガンドをあてはめて議論していた場合,論文として発表しても最終的には撤回せざるをえない状況になっていただろう.研究においては,よいと思われる結果が得られたときこそ,手や頭を動かしつづける重要性を認識した.
文 献
- Yanagisawa, M., Kurihara, H., Kimura, S. et al.: A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature, 332, 411-415 (1988)[PubMed]
- Hilal-Dandan, R., Villegas, S., Gonzalez, A. et al.: The quasi-irreversible nature of endothelin binding and G protein-linked signaling in cardiac myocytes. J. Pharmacol. Exp. Ther., 281, 267-273 (1997)[PubMed]
- Kedzierski, R. M. & Yanagisawa, M.: Endothelin system: the double-edged sword in health and disease. Annu. Rev. Pharmacol. Toxicol., 41, 851-876 (2001)[PubMed]
- Kohan, D. E., Rossi, N. F., Inscho, E. W. et al.: Regulation of blood pressure and salt homeostasis by endothelin. Physiol. Rev., 91, 1-77 (2011)[PubMed]
- Maguire, J. J. & Davenport, A. P.: Endothelin@25: new agonists, antagonists, inhibitors and emerging research frontiers: IUPHAR review 12. Br. J. Pharmacol., 171, 5555-5572 (2014)[PubMed]
- Okuta, A., Tani, K., Nishimura, S. et al.: Thermostabilization of the human endothelin type B receptor. J. Mol. Biol., 428, 2265-2274 (2016)[PubMed]
- Thorsen, T. S., Matt, R., Weis, W. I. et al.: Modified T4 lysozyme fusion proteins facilitate G protein-coupled receptor crystallogenesis. Structure, 22, 1657-1664 (2014)[PubMed]
- Masuda, Y., Sugo, T., Kikuchi, T. et al.: Antagonist activity of [Thr18,γ-methylleucine19]endothelin-1 in human endothelin receptors. Eur. J. Pharmacol., 325, 263-270 (1997)[PubMed]
- Kato, H. E., Zhang, F., Yizhar, O. et al.: Crystal structure of the channelrhodopsin light-gated cation channel. Nature, 482, 369-374 (2012)[PubMed] [新着論文レビュー]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:名古屋大学大学院創薬科学研究科博士課程 在学中.
研究テーマ:Gタンパク質共役受容体の構造機能.
抱負:生き残りたい.
西澤 知宏(Tomohiro Nishizawa)
略歴:東京大学理学系研究科 助教,科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:膜タンパク質の構造解析.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2016 志甫谷 渉・西澤知宏・濡木 理 Licensed under CC 表示 2.1 日本