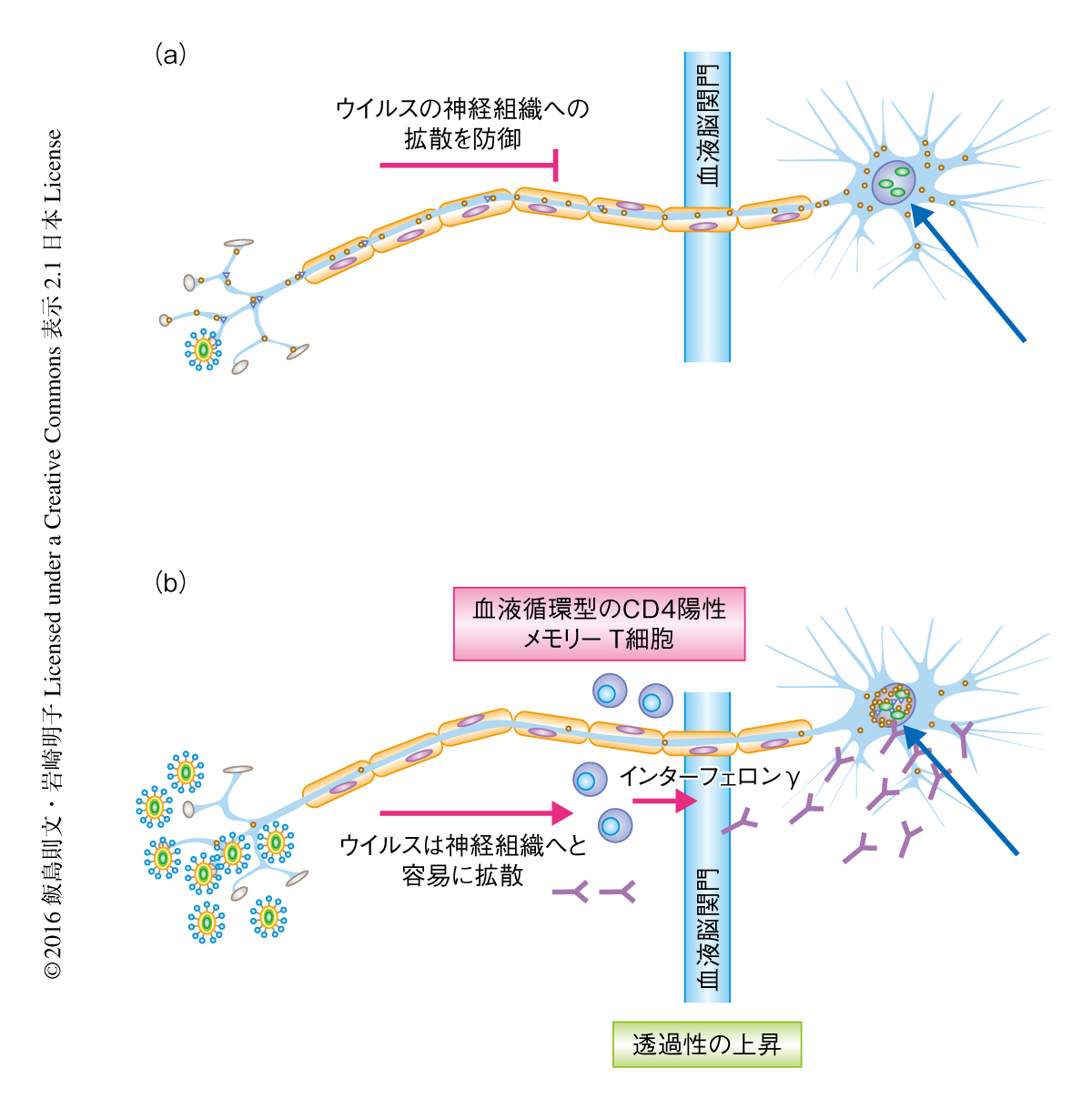
感染防御にはたらく抗ウイルス抗体が神経組織へと移行するにはCD4陽性T細胞のヘルプが必要である
飯島則文・岩崎明子
(米国Yale大学School of Medicine,Department of Immunobiology)
email:飯島則文,岩崎明子
DOI: 10.7875/first.author.2016.061
Access of protective antiviral antibody to neuronal tissues requires CD4 T-cell help.
Norifumi Iijima, Akiko Iwasaki
Nature, 533, 552-556 (2016)
これまで開発の成功したワクチンは,ほぼすべて抗体が作用を示すものである.現在のところ,性感染症を発症する病原体に対するワクチンは一部を除きほとんど効果を示していない.数年前,単純ヘルペスウイルス2型に対するワクチン候補薬は,血中においてワクチン応答が認められたにもかかわらず,感染防御に対しまったく効果を示さないことが報告された.単純ヘルペスウイルス2型は粘膜組織に感染したのち,神経組織に潜伏感染することにより免疫からの監視をのがれ,このような特徴が治療薬の開発を困難にしている.今回,筆者らは,神経組織に侵入したウイルスの複製の阻害には,CD4陽性メモリーT細胞および抗ウイルス抗体が必須であることを明らかにした.さらには,神経組織へとすみやかに移行したCD4陽性メモリーT細胞はインターフェロンγを産生し,血液脳関門における透過性の上昇を介して抗ウイルス抗体の流入を促進しウイルスの複製を抑制することが明らかにされた.
さまざまなワクチンのなかでも,不活性化ワクチンは抗体を中心とした液性免疫を誘導し,予想される症状を軽減して重症化をふせぐ.一方で,病原体を弱毒化した生ワクチンは液性免疫の誘導のみならずT細胞を中心とした強力な細胞性免疫を誘導し,免疫応答が長期間にわたり持続する.しかしながら,現在のところ,弱毒化した病原体の投与による副作用を完全に取り除くことのできない場合がある.性感染症をひき起こす病原体のうち,性器ヘルペスをひき起こす単純ヘルペスウイルス2型は粘膜組織より感染したのち神経組織を上行し神経節に潜伏して再発をくり返す.さらには,ヒト免疫不全ウイルスに感染した患者は,免疫不全と関連して単純ヘルペスウイルス2型の複製および再発の頻度が高くなる1).長年にわたり,単純ヘルペスウイルスに対するワクチンの開発が進められてきたが,数年前に発表されたワクチン候補薬において,血中においてワクチン応答が認められたにもかかわらず,治療の効果はまったく認められなかった2).単純ヘルペスウイルスに対する免疫の制御機構の詳細,とくに,神経組織における免疫の制御機構については不明な点が多く,安全なワクチンを開発するためには神経組織における防御機構のさらなる理解が必要である.
単純ヘルペスウイルス2型に対する防御機構においてはCD4陽性T細胞が非常に重要な役割をはたす3).単純ヘルペスウイルス2型の野生株をマウスの膣に感染させると致死であるが,チミジンキナーゼを欠損した弱毒株を膣に感染させると神経組織におけるウイルスの複製が阻害される一方,特異的かつ強力な防御機構の形成が報告されている4).筆者らは,弱毒株を腟に感染させてから5週間のちに致死量の野生株を再感染させてもウイルスは完全に除去されたことから,腟粘膜の組織に形成される単純ヘルペスウイルス2型に特異的な免疫防御機構の詳細について報告した5)(新着論文レビュー でも掲載)弱毒株を腟に感染させてから5週間のちには膣粘膜の組織に組織常在型のCD4陽性メモリーT細胞を含むメモリーリンパ球クラスターが形成されCD11b陽性マクロファージに依存的に維持され,さらに,致死量の野生株を腟に再感染させると膣粘膜の組織において組織常在型のCD4陽性メモリーT細胞がすみやかに活性化されウイルスは早期に除去された4,5).メモリーリンパ球クラスターが形成されない場合には,ウイルスは容易に腟粘膜の組織から末梢神経を介して神経節へと侵入する.実際のワクチンあるいは治療薬は,経鼻,筋肉内,腹腔内への投与が現実的である.弱毒株を経鼻投与した場合には腟粘膜の組織において特異的な組織常在型のCD4陽性メモリーT細胞はほとんど検出されないが,強力な全身性の免疫記憶が形成される.その場合,ウイルスは神経節へと侵入するが,ウイルスの複製が神経組織において抑制される機構は不明であった.
単純ヘルペスウイルス2型の弱毒株を腟に感染させてから5週間のちに腟粘膜の組織においてメモリーリンパ球クラスターが形成された場合,組織常在型のCD4陽性メモリーT細胞によりすみやかに産生されるインターフェロンγが腟粘膜の組織から神経組織へのウイルスの移行を完全に阻害した5).また,組織常在型のCD4陽性T細胞が存在しない場合,血液循環型のCD4陽性メモリーT細胞のみではウイルスをすみやかに除去することは困難であった5).すなわち,ウイルスは腟粘膜の組織から神経組織へと容易に移行した.そして,血液循環型のCD4陽性メモリーT細胞は腟粘膜の組織のほかの組織においてウイルスの複製の抑制に部分的に貢献することが示唆された.また,B細胞欠損マウスの腟に弱毒株を感染させてから5週間のち,ウイルスを感染させていないマウスと並体結合し,その3週間のちに感染させていないマウスの腟に致死量の野生株を再感染させると,すべてのマウスがウイルスを除去できず致死となった.以前の結果5) も含め,以上の結果から,組織常在型のCD4陽性メモリーT細胞および血液循環型のメモリーCD4陽性T細胞は,異なる組織においてウイルスの感染に対する防御に貢献すること,さらには,血中を循環するB細胞あるいは抗体もウイルスの感染に対し重要な役割をはたすことが明らかにされた.よって,今回の研究においては,血液循環型のCD4陽性メモリーT細胞およびB細胞に依存的な防御機構がどのようにして粘膜へのウイルスの感染に対し機能するのか詳細に調べた.
全身性の免疫記憶の機構を明らかにする目的で,単純ヘルペスウイルス2型の弱毒株を腟粘膜,経鼻,腹腔内に投与することにより免疫し,5~6週間のちに致死量の野生株を腟に再感染させ,ウイルスに対する防御機構について解析した.その結果,腹腔内投与したマウスは15日以内にすべて死亡した.一方,経鼻投与したマウスは30日のちにおいて約50~60%の生存率であった.また,腟粘膜の組織および神経組織におけるウイルスの力価を調べたところ,腟粘膜投与した場合にはウイルスは腟粘膜の組織からすみやかに除去されていたのに対し,経鼻投与あるいは腹腔内投与したマウスにおいては腟粘膜の組織のウイルス力価は弱毒株を投与していないマウスと同じ程度であった.一方で,経鼻投与したマウスの後根神経節においてウイルスは検出されなかったが,腹腔内投与したマウスにおいては高いウイルス力価が検出された.以上の結果から,弱毒株を経鼻投与したマウスの神経組織においては腹腔内投与したマウスと比較して強力な防御機構が誘導されることが示唆された.
野生型のマウスに弱毒株を経鼻投与してから6週間のちに抗CD4抗体あるいは抗インターフェロンγ抗体を処理すると,対照となる抗体を処理したマウスと比較して,生存率がいちじるしく低下し,神経組織においてウイルスの複製がいちじるしく増加した.また,B細胞欠損マウスに経鼻投与した場合も同様の結果になった.一方で,経鼻投与したB細胞欠損マウスの腟に致死量の野生株を再感染させるまえに,弱毒株を免疫したマウスから調製した血清を投与すると,生存率がいちじるしく回復し神経組織におけるウイルスの力価も低下した.以前にほかの研究グループにより,免疫したマウスの血清を投与する実験において同様の結果が示されており6),今回,血中を循環する抗体だけでなく,血液循環型のCD4陽性メモリーT細胞も神経組織におけるウイルスの複製を防御するために重要な役割をはたすことが明らかにされた.
弱毒株を腟粘膜免疫,経鼻免疫,腹腔内免疫してから6週間のちに,血中を循環する単純ヘルペスウイルス2型に特異的な抗体のサブセットの濃度を測定した.その結果,腟粘膜免疫あるいは経鼻免疫した場合,腹腔内免疫した場合と比較して,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットのいちじるしい上昇が認められた.ほかのサブセットにはまったく変化は認められなかった.よって,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットが神経組織における防御機構において重要な役割をはたすことが示唆された.
弱毒株を経鼻免疫して神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度を測定した.その結果,経鼻免疫の6週間のちにおいて,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセット,また,全体の免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットは低濃度であったが,これらのマウスの腟に野生株を再感染させてから6日のちには,神経組織においては単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットだけでなく,全体の免疫グロブリンG2bサブセットおよび免疫グロブリンG2cの濃度もいちじるしく上昇した.一方で,マウスの腟に野生株を再感染させるまえに抗CD4抗体あるいは抗インターフェロンγ抗体を処理した場合には,これらの抗体の濃度は再感染のまえと同じ程度まで低下した.また,免疫していないマウスの腟に野生株を感染させてから6日のちにおいて,これらの抗体の濃度は経鼻免疫したマウスと同じ程度あるいはそれ以下であった.以上の結果から,弱毒株を経鼻免疫したマウスの腟に野生株を再感染させると,神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度が増加すること,さらには,これらの抗体の濃度の増加はCD4陽性T細胞およびインターフェロンγに依存的であることが明らかにされた.これにより,インターフェロンγを産生するCD4陽性メモリーT細胞は神経組織への抗体のアクセスに重要な役割をはたすことが示唆された.
弱毒株を経鼻免疫したマウスの腟に野生株を再感染させたのち,単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が神経組織へと流入するかどうか調べるため,神経組織に局在するCD4陽性メモリーT細胞をフローサイトメトリーにより測定した.その結果,経鼻免疫したマウスの腟に野生株を再感染させて6日のちにおいて,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が非常に多く検出された.一方で,免疫していないマウスの腟に野生株を感染させて6日のちには,とくに後根神経節において,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性T細胞は検出されなかった.以上の結果から,単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が腟への野生株の再感染ののち早期に神経組織へと移行し,インターフェロンγを産生することが明らかにされた.また,T細胞が血液脳関門を通過するためにはT細胞に発現するα4β1インテグリンと内皮細胞に発現するVCAM-1との相互作用が必要であることが知られている.弱毒株を経鼻免疫したマウスの腟に野生株を再感染させて2日のちおよび4日のちに抗α4インテグリン抗体により処理し,再感染の6日のちに神経組織に局在する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞の数を調べたところ,移行するはずのこれらのCD4陽性メモリーT細胞は消失していた.また同時に,神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度を測定したところ,対照となる抗体を処理したマウスと比較して,それらの濃度はいちじるしく低下していた.
神経組織においてCD4陽性メモリーT細胞の産生するインターフェロンγは血中を循環する抗ウイルス抗体をどのようにして透過させるのだろうか? インターフェロンγは内皮細胞に発現するインターフェロンγ受容体と結合することにより,内皮細胞の密着結合を再構築し透過性を上昇させる7).神経組織におけるインターフェロンγを介した血液脳関門における透過性の上昇が抗ウイルス抗体の流入に関与しているかどうか調べるため,血中のアルブミンの神経組織への移行を測定した.その結果,野生株を腟に再感染させて6日のちにおいて,感染のまえと比較して神経組織における血中のアルブミンの濃度の上昇が認められた.また,抗CD4抗体あるいは抗インターフェロンγ抗体を処理した場合,神経組織における血中のアルブミンの濃度は再感染のまえと同じ程度であった.以上の結果から,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が血液脳関門における透過性の上昇を介して単純ヘルペスウイルス2型に特異的な抗体の流入を促進し,神経組織に侵入したウイルスの複製を抑制することが明らかにされた(図1).
今回の研究により,単純ヘルペスウイルス2型が腟に感染したのち,神経組織において複製および増幅するウイルスを抑制するためには,血液循環型のCD4陽性メモリーT細胞および抗ウイルス抗体が必須であることが明らかにされた.また,抗ウイルス抗体が神経組織においてウイルスの複製を抑制するためには,血液循環型のCD4陽性メモリーT細胞の神経組織への移行および血液循環型のCD4陽性メモリーT細胞が産生するインターフェロンγを介した血液脳関門における透過性の上昇が必要であることが明らかにされた.以上の結果から,神経組織における免疫の制御機構を明らかにすることにより,既存の方法では治療することのできない潜伏感染した病原体に対する治療方針に新たな方向性を示すことができると考えられた.
略歴:2004年 北海道大学大学院薬学研究科 修了,同年 米国Yale大学School of Medicineポストドクトラルフェロー,2010年 同Associate Research Scientistを経て,2016年より医薬基盤・健康・栄養研究所 サブプロジェクトリーダー.
研究テーマ:末梢組織における免疫の制御機構および治療法の開発.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of Medicine教授.
© 2016 飯島則文・岩崎明子 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Immunobiology)
email:飯島則文,岩崎明子
DOI: 10.7875/first.author.2016.061
Access of protective antiviral antibody to neuronal tissues requires CD4 T-cell help.
Norifumi Iijima, Akiko Iwasaki
Nature, 533, 552-556 (2016)
要 約
これまで開発の成功したワクチンは,ほぼすべて抗体が作用を示すものである.現在のところ,性感染症を発症する病原体に対するワクチンは一部を除きほとんど効果を示していない.数年前,単純ヘルペスウイルス2型に対するワクチン候補薬は,血中においてワクチン応答が認められたにもかかわらず,感染防御に対しまったく効果を示さないことが報告された.単純ヘルペスウイルス2型は粘膜組織に感染したのち,神経組織に潜伏感染することにより免疫からの監視をのがれ,このような特徴が治療薬の開発を困難にしている.今回,筆者らは,神経組織に侵入したウイルスの複製の阻害には,CD4陽性メモリーT細胞および抗ウイルス抗体が必須であることを明らかにした.さらには,神経組織へとすみやかに移行したCD4陽性メモリーT細胞はインターフェロンγを産生し,血液脳関門における透過性の上昇を介して抗ウイルス抗体の流入を促進しウイルスの複製を抑制することが明らかにされた.
はじめに
さまざまなワクチンのなかでも,不活性化ワクチンは抗体を中心とした液性免疫を誘導し,予想される症状を軽減して重症化をふせぐ.一方で,病原体を弱毒化した生ワクチンは液性免疫の誘導のみならずT細胞を中心とした強力な細胞性免疫を誘導し,免疫応答が長期間にわたり持続する.しかしながら,現在のところ,弱毒化した病原体の投与による副作用を完全に取り除くことのできない場合がある.性感染症をひき起こす病原体のうち,性器ヘルペスをひき起こす単純ヘルペスウイルス2型は粘膜組織より感染したのち神経組織を上行し神経節に潜伏して再発をくり返す.さらには,ヒト免疫不全ウイルスに感染した患者は,免疫不全と関連して単純ヘルペスウイルス2型の複製および再発の頻度が高くなる1).長年にわたり,単純ヘルペスウイルスに対するワクチンの開発が進められてきたが,数年前に発表されたワクチン候補薬において,血中においてワクチン応答が認められたにもかかわらず,治療の効果はまったく認められなかった2).単純ヘルペスウイルスに対する免疫の制御機構の詳細,とくに,神経組織における免疫の制御機構については不明な点が多く,安全なワクチンを開発するためには神経組織における防御機構のさらなる理解が必要である.
単純ヘルペスウイルス2型に対する防御機構においてはCD4陽性T細胞が非常に重要な役割をはたす3).単純ヘルペスウイルス2型の野生株をマウスの膣に感染させると致死であるが,チミジンキナーゼを欠損した弱毒株を膣に感染させると神経組織におけるウイルスの複製が阻害される一方,特異的かつ強力な防御機構の形成が報告されている4).筆者らは,弱毒株を腟に感染させてから5週間のちに致死量の野生株を再感染させてもウイルスは完全に除去されたことから,腟粘膜の組織に形成される単純ヘルペスウイルス2型に特異的な免疫防御機構の詳細について報告した5)(新着論文レビュー でも掲載)弱毒株を腟に感染させてから5週間のちには膣粘膜の組織に組織常在型のCD4陽性メモリーT細胞を含むメモリーリンパ球クラスターが形成されCD11b陽性マクロファージに依存的に維持され,さらに,致死量の野生株を腟に再感染させると膣粘膜の組織において組織常在型のCD4陽性メモリーT細胞がすみやかに活性化されウイルスは早期に除去された4,5).メモリーリンパ球クラスターが形成されない場合には,ウイルスは容易に腟粘膜の組織から末梢神経を介して神経節へと侵入する.実際のワクチンあるいは治療薬は,経鼻,筋肉内,腹腔内への投与が現実的である.弱毒株を経鼻投与した場合には腟粘膜の組織において特異的な組織常在型のCD4陽性メモリーT細胞はほとんど検出されないが,強力な全身性の免疫記憶が形成される.その場合,ウイルスは神経節へと侵入するが,ウイルスの複製が神経組織において抑制される機構は不明であった.
1.単純ヘルペスウイルス2型の感染に対する神経組織における防御機構は血液循環型のCD4陽性T細胞および抗ウイルス抗体を必要とする
単純ヘルペスウイルス2型の弱毒株を腟に感染させてから5週間のちに腟粘膜の組織においてメモリーリンパ球クラスターが形成された場合,組織常在型のCD4陽性メモリーT細胞によりすみやかに産生されるインターフェロンγが腟粘膜の組織から神経組織へのウイルスの移行を完全に阻害した5).また,組織常在型のCD4陽性T細胞が存在しない場合,血液循環型のCD4陽性メモリーT細胞のみではウイルスをすみやかに除去することは困難であった5).すなわち,ウイルスは腟粘膜の組織から神経組織へと容易に移行した.そして,血液循環型のCD4陽性メモリーT細胞は腟粘膜の組織のほかの組織においてウイルスの複製の抑制に部分的に貢献することが示唆された.また,B細胞欠損マウスの腟に弱毒株を感染させてから5週間のち,ウイルスを感染させていないマウスと並体結合し,その3週間のちに感染させていないマウスの腟に致死量の野生株を再感染させると,すべてのマウスがウイルスを除去できず致死となった.以前の結果5) も含め,以上の結果から,組織常在型のCD4陽性メモリーT細胞および血液循環型のメモリーCD4陽性T細胞は,異なる組織においてウイルスの感染に対する防御に貢献すること,さらには,血中を循環するB細胞あるいは抗体もウイルスの感染に対し重要な役割をはたすことが明らかにされた.よって,今回の研究においては,血液循環型のCD4陽性メモリーT細胞およびB細胞に依存的な防御機構がどのようにして粘膜へのウイルスの感染に対し機能するのか詳細に調べた.
全身性の免疫記憶の機構を明らかにする目的で,単純ヘルペスウイルス2型の弱毒株を腟粘膜,経鼻,腹腔内に投与することにより免疫し,5~6週間のちに致死量の野生株を腟に再感染させ,ウイルスに対する防御機構について解析した.その結果,腹腔内投与したマウスは15日以内にすべて死亡した.一方,経鼻投与したマウスは30日のちにおいて約50~60%の生存率であった.また,腟粘膜の組織および神経組織におけるウイルスの力価を調べたところ,腟粘膜投与した場合にはウイルスは腟粘膜の組織からすみやかに除去されていたのに対し,経鼻投与あるいは腹腔内投与したマウスにおいては腟粘膜の組織のウイルス力価は弱毒株を投与していないマウスと同じ程度であった.一方で,経鼻投与したマウスの後根神経節においてウイルスは検出されなかったが,腹腔内投与したマウスにおいては高いウイルス力価が検出された.以上の結果から,弱毒株を経鼻投与したマウスの神経組織においては腹腔内投与したマウスと比較して強力な防御機構が誘導されることが示唆された.
野生型のマウスに弱毒株を経鼻投与してから6週間のちに抗CD4抗体あるいは抗インターフェロンγ抗体を処理すると,対照となる抗体を処理したマウスと比較して,生存率がいちじるしく低下し,神経組織においてウイルスの複製がいちじるしく増加した.また,B細胞欠損マウスに経鼻投与した場合も同様の結果になった.一方で,経鼻投与したB細胞欠損マウスの腟に致死量の野生株を再感染させるまえに,弱毒株を免疫したマウスから調製した血清を投与すると,生存率がいちじるしく回復し神経組織におけるウイルスの力価も低下した.以前にほかの研究グループにより,免疫したマウスの血清を投与する実験において同様の結果が示されており6),今回,血中を循環する抗体だけでなく,血液循環型のCD4陽性メモリーT細胞も神経組織におけるウイルスの複製を防御するために重要な役割をはたすことが明らかにされた.
2.弱毒株の経鼻投与による免疫応答は強い抗体の産生を促す
弱毒株を腟粘膜免疫,経鼻免疫,腹腔内免疫してから6週間のちに,血中を循環する単純ヘルペスウイルス2型に特異的な抗体のサブセットの濃度を測定した.その結果,腟粘膜免疫あるいは経鼻免疫した場合,腹腔内免疫した場合と比較して,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットのいちじるしい上昇が認められた.ほかのサブセットにはまったく変化は認められなかった.よって,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットが神経組織における防御機構において重要な役割をはたすことが示唆された.
3.CD4陽性メモリーT細胞は神経組織への抗体のアクセスに必要である
弱毒株を経鼻免疫して神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度を測定した.その結果,経鼻免疫の6週間のちにおいて,単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセット,また,全体の免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットは低濃度であったが,これらのマウスの腟に野生株を再感染させてから6日のちには,神経組織においては単純ヘルペスウイルス2型に特異的な免疫グロブリンG2bサブセットおよび免疫グロブリンG2cサブセットだけでなく,全体の免疫グロブリンG2bサブセットおよび免疫グロブリンG2cの濃度もいちじるしく上昇した.一方で,マウスの腟に野生株を再感染させるまえに抗CD4抗体あるいは抗インターフェロンγ抗体を処理した場合には,これらの抗体の濃度は再感染のまえと同じ程度まで低下した.また,免疫していないマウスの腟に野生株を感染させてから6日のちにおいて,これらの抗体の濃度は経鼻免疫したマウスと同じ程度あるいはそれ以下であった.以上の結果から,弱毒株を経鼻免疫したマウスの腟に野生株を再感染させると,神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度が増加すること,さらには,これらの抗体の濃度の増加はCD4陽性T細胞およびインターフェロンγに依存的であることが明らかにされた.これにより,インターフェロンγを産生するCD4陽性メモリーT細胞は神経組織への抗体のアクセスに重要な役割をはたすことが示唆された.
4.α4インテグリンに依存的に神経組織に移行するCD4陽性メモリーT細胞は抗体の神経組織へのアクセスに必須である
弱毒株を経鼻免疫したマウスの腟に野生株を再感染させたのち,単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が神経組織へと流入するかどうか調べるため,神経組織に局在するCD4陽性メモリーT細胞をフローサイトメトリーにより測定した.その結果,経鼻免疫したマウスの腟に野生株を再感染させて6日のちにおいて,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が非常に多く検出された.一方で,免疫していないマウスの腟に野生株を感染させて6日のちには,とくに後根神経節において,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性T細胞は検出されなかった.以上の結果から,単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が腟への野生株の再感染ののち早期に神経組織へと移行し,インターフェロンγを産生することが明らかにされた.また,T細胞が血液脳関門を通過するためにはT細胞に発現するα4β1インテグリンと内皮細胞に発現するVCAM-1との相互作用が必要であることが知られている.弱毒株を経鼻免疫したマウスの腟に野生株を再感染させて2日のちおよび4日のちに抗α4インテグリン抗体により処理し,再感染の6日のちに神経組織に局在する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞の数を調べたところ,移行するはずのこれらのCD4陽性メモリーT細胞は消失していた.また同時に,神経組織における単純ヘルペスウイルス2型に特異的な抗体および全体の抗体の濃度を測定したところ,対照となる抗体を処理したマウスと比較して,それらの濃度はいちじるしく低下していた.
神経組織においてCD4陽性メモリーT細胞の産生するインターフェロンγは血中を循環する抗ウイルス抗体をどのようにして透過させるのだろうか? インターフェロンγは内皮細胞に発現するインターフェロンγ受容体と結合することにより,内皮細胞の密着結合を再構築し透過性を上昇させる7).神経組織におけるインターフェロンγを介した血液脳関門における透過性の上昇が抗ウイルス抗体の流入に関与しているかどうか調べるため,血中のアルブミンの神経組織への移行を測定した.その結果,野生株を腟に再感染させて6日のちにおいて,感染のまえと比較して神経組織における血中のアルブミンの濃度の上昇が認められた.また,抗CD4抗体あるいは抗インターフェロンγ抗体を処理した場合,神経組織における血中のアルブミンの濃度は再感染のまえと同じ程度であった.以上の結果から,インターフェロンγを産生する単純ヘルペスウイルス2型に特異的なCD4陽性メモリーT細胞が血液脳関門における透過性の上昇を介して単純ヘルペスウイルス2型に特異的な抗体の流入を促進し,神経組織に侵入したウイルスの複製を抑制することが明らかにされた(図1).
おわりに
今回の研究により,単純ヘルペスウイルス2型が腟に感染したのち,神経組織において複製および増幅するウイルスを抑制するためには,血液循環型のCD4陽性メモリーT細胞および抗ウイルス抗体が必須であることが明らかにされた.また,抗ウイルス抗体が神経組織においてウイルスの複製を抑制するためには,血液循環型のCD4陽性メモリーT細胞の神経組織への移行および血液循環型のCD4陽性メモリーT細胞が産生するインターフェロンγを介した血液脳関門における透過性の上昇が必要であることが明らかにされた.以上の結果から,神経組織における免疫の制御機構を明らかにすることにより,既存の方法では治療することのできない潜伏感染した病原体に対する治療方針に新たな方向性を示すことができると考えられた.
文 献
- Munawwar, A. & Singh, S.: Human herpesviruses as copathogens of HIV infection, their role in HIV transmission, and disease progression J. Lab. Physicians, 8, 5-18 (2016)[PubMed]
- Belshe, R. B., Leone, P. A., Bernstein, D. I. et al.: Efficacy results of a trial of a herpes simplex vaccine. N. Engl. J. Med., 366, 34-43 (2012)[PubMed]
- Milligan, G. N., Bernstein, D. I. & Bourne, N.: T lymphocytes are required for protection of the vaginal mucosae and sensory ganglia of immune mice against reinfection with herpes simplex virus type 2. J. Immunol., 160, 6093-6100 (1998)[PubMed]
- Iijima, N., Linehan, M. M., Zamora, M. et al.: Dendritic cells and B cells maximize mucosal Th1 memory response to herpes simplex virus. J. Exp. Med., 205, 3041-3052 (2008)[PubMed]
- Iijima, N. & Iwasaki, A.: A local macrophage chemokine network sustains protective tissue-resident memory CD4 T cells. Science, 346, 93-98 (2014)[PubMed] [新着論文レビュー]
- Morrison, L. A., Zhu, L. & Thebeau, L. G.: Vaccine-induced serum immunoglobin contributes to protection from herpes simplex virus type 2 genital infection in the presence of immune T cells. J. Virol., 75, 1195-1204 (2001)[PubMed]
- Huynh, H. K. & Dorovini-Zis, K.: Effects of interferon-gamma on primary cultures of human brain microvessel endothelial cells. Am. J. Pathol., 142, 1265-1278 (1993)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2004年 北海道大学大学院薬学研究科 修了,同年 米国Yale大学School of Medicineポストドクトラルフェロー,2010年 同Associate Research Scientistを経て,2016年より医薬基盤・健康・栄養研究所 サブプロジェクトリーダー.
研究テーマ:末梢組織における免疫の制御機構および治療法の開発.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of Medicine教授.
© 2016 飯島則文・岩崎明子 Licensed under CC 表示 2.1 日本