マクロファージの分泌するケモカインによるCD4陽性メモリーT細胞の組織常在性の制御
飯島則文・岩崎明子
(米国Yale大学School of Medicine,Department of Immunobiology)
email:飯島則文,岩崎明子
DOI: 10.7875/first.author.2014.120
A local macrophage chemokine network sustains protective tissue-resident memory CD4 T cells.
Norifumi Iijima, Akiko Iwasaki
Science, 346, 93-98 (2014)
現在,ヒトパピローマウイルスとB型肝炎ウイルスを除き,性感染症を発症する病原体に対するワクチン候補薬には有効な作用はほとんど認められてない.T細胞が病原体に対する生体防御に大きくかかわることが知られているが,組織に局在するT細胞がどのような役割をはたしているのかは不明である.筆者らは,並体結合の技術を用いて,血中に循環しているT細胞と組織に常在するT細胞について,体内に侵入してきた病原体に対する役割を明確に区別することに成功した.性感染症を発症するウイルスのひとつである単純ヘルペス2型ウイルスを感染させたマウスにおいて,膣粘膜の組織にメモリーリンパ球クラスターが形成され,そこにはCD4陽性T細胞,CD8陽性T細胞,また,マクロファージや樹状細胞などの抗原提示細胞の局在することが見い出された.さらには,メモリーリンパ球クラスターにおいてCD4陽性T細胞の近傍にはマクロファージが局在し,ケモカインを分泌するマクロファージがCD4陽性メモリーT細胞の組織における常在性や抗ウイルス作用に対し大きく寄与していることが明らかになった.
われわれヒトは進化とともに,有害な作用をもたらす病原体に対する生体防御機構を複雑にはりめぐらせるようになった.にもかかわらず,種々の重篤な感染症を防ぎ切ることはできないため,これまで,感染症の予防あるいは治療に用いる多くの薬剤が開発され,それらはさまざまな感染症の制圧あるいは抑制に多大な貢献をしてきた.しかしながら,近年,AIDS,高病原性インフルエンザ,SARS,エボラ出血熱など,新興感染症が人類の新たな脅威になっている.また,それら新興感染症の拡大とならび,これまでに抑制された感染症の再発や耐性菌の拡大などが問題になっている.性感染症をひき起こす病原体のなかでも,単純ヘルペス2型ウイルスは性器ヘルペスをひき起こすことが知られ,ウイルスは初回の感染ののち長いあいだ潜伏して再発をくり返す1).とくに新生児では,産道感染によりウイルスの複製が全身性となり致死率の高いことが知られている.さらには,ヒト免疫不全ウイルスに感染した患者では,免疫不全と関連して単純ヘルペス2型ウイルスの複製と再発の頻度の高くなることが知られている2).長年,単純ヘルペス2型ウイルスの予防のためのワクチンの開発が進められてきたが,現在,開発中のワクチン候補薬に治療効果はまったく認められていない3).単純ヘルペス2型ウイルスに対する免疫制御機構の詳細には不明な点が多く,安全な予防あるいは治療的のためのワクチンの開発には感染に対する生体防御機構のさらなる理解が必要であると考えられる.
単純ヘルペス2型ウイルスに対する生体防御機構においては,マウスを用いた研究によりCD4陽性T細胞が非常に重要な役割をはたしていることが明らかになっている4).マウスの膣に単純ヘルペス2型ウイルス野生株を感染させると致死であるが,チミジンキナーゼを欠損した弱毒株を感染させると,神経組織におけるウイルスの複製が阻害される一方で,強力かつ特異的な生体防御機構が形成されることが報告されている5).弱毒株を感染させてから5週間のちに致死量の野生株を再感染させてもウイルスは完全に除去される.筆者らは,これまでの研究において,弱毒株を感染させてから5週間のちには膣粘膜の組織にメモリーリンパ球クラスターが形成されていること,さらに,致死量の野生株を感染させたのち,膣粘膜の組織においてはさまざまな抗原提示細胞がCD4陽性メモリーT細胞をすみやかに活性化しウイルスを除去していることを報告した6).くわえて,ほかのグループからは,単純ヘルペス2型ウイルスに陽性のヒトの臨床検体においても膣粘膜の組織にCD4陽性T細胞がクラスターを形成していることが報告されている7).しかしながら,メモリーリンパ球クラスターはどのような機構により膣粘膜の組織に維持されているのか,CD4陽性メモリーT細胞はどのようにメモリーリンパ球クラスターに集積しているのか,また,再感染ののちにどのようにすみやかにウイルスを除去するのかは明らかではなかった.そこで,並体結合およびレーザーキャプチャーマイクロダイセクションの技術を用いて,この疑問を明らかにすることにした.
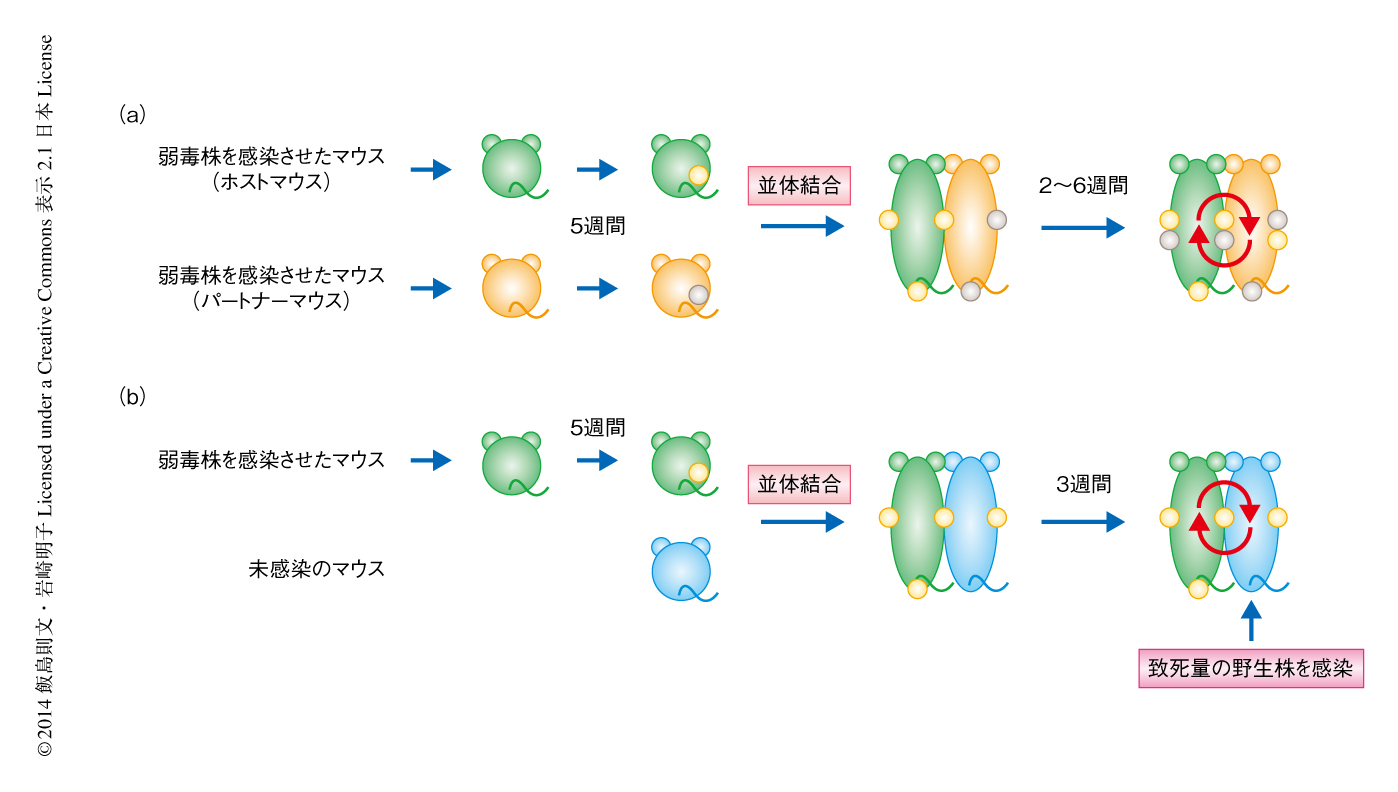
単純ヘルペス2型ウイルス弱毒株を感染させたのち集積するT細胞は組織常在型なのか,あるいは,継続的に循環するT細胞が集積しているのかを明らかにするため,感染から5週間のちにホストとなるマウスとパートナーとなるマウスを並体結合した(図1a).少なくとも結合から3週間のちには,血中を循環するT細胞はホストマウスに由来するものとパートナーマウスに由来するものとがほぼ同じ割合になった.一方で,ホストマウスの膣粘膜の組織に集積したT細胞は,ホストマウスに由来するCD4陽性T細胞およびCD8陽性T細胞が89.4%および87.6%であった.また,ホストマウスに由来する単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞およびCD8陽性T細胞も96.8%および97.0%であった.免疫組織染色により確認したところ,ホストマウスのメモリーリンパ球クラスターは膣の粘膜固有層に局在し,集積したCD4陽性T細胞およびCD8陽性T細胞はほぼホストマウスに由来するT細胞であった.また,パートナーマウスに由来するT細胞がメモリーリンパ球クラスターの周囲を循環していることも明らかになった.
血中を循環するT細胞は,血中において高い濃度を示すスフィンゴシン1-リン酸の受容体である1型スフィンゴシン1-リン酸受容体を発現することにより,所属リンパ節あるいは組織から血中へと移行し血中を循環することが知られている8,9).そこで,膣粘膜の組織の組織切片を作製し,メモリーリンパ球クラスターに集積したCD4陽性T細胞をレーザーキャプチャーマイクロダイセクションにより切り出し1型スフィンゴシン1-リン酸受容体の発現について検討した.その結果,血中を循環する未感染のCD4陽性T細胞と比較して,1型スフィンゴシン1-リン酸受容体の発現のいちじるしい低下が認められた.また,1型スフィンゴシン1-リン酸受容体の発現の制御に関与する転写因子として知られているKLF2も,同様に発現のいちじるしい低下が認められた.一方で,ウイルスの複製を阻害するのに必須であるインターフェロンγの産生を制御する転写因子T-betについては,発現の顕著な上昇が認められた.以上の結果から,1型スフィンゴシン1-リン酸受容体の発現が低くT-betの発現が高い単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞が,組織に常在するかたちで維持されていることが明らかになった.
メモリーリンパ球クラスターに集積したCD4陽性T細胞のもつ抗原特異性を明らかにする目的で,単純ヘルペス2型ウイルス弱毒株を感染させてから5週間のちに膣粘膜の組織の組織切片を作製し,メモリーリンパ球クラスターに集積したCD4陽性T細胞をレーザーキャプチャーマイクロダイセクションにより切り出した.回収したDNAを用いて,T細胞受容体β鎖のシークエンシングによりT細胞受容体β鎖の遺伝子のCDR3領域の配列を解析した.その結果,検出された53クローンのうち1つのクローンが33%をしめた.くわえて,このT細胞受容体β鎖をもつCD4陽性T細胞は未感染のマウスには検出されず,弱毒株を感染させてから5週間のちの所属リンパ節に検出された.さらには,弱毒株を感染させてから5週間のちの膣粘膜の組織から単純ヘルペス2型ウイルスに特異的なTh1細胞を単離してT細胞受容体β鎖を解析したところ,同じT細胞受容体β鎖を発現していることが確認された.その結果,このドミナントなクローンは単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞であると同定することができ,メモリーリンパ球クラスターには特異的な組織常在型のCD4陽性T細胞の集積していることが明らかになった.
メモリーリンパ球クラスターに集積した単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞が長期間にわたり機能を維持しているかどうか明らかにする目的で,マウスを弱毒株により感染させてから5週間のちに,ウイルスを感染させていないマウスと並体結合した(図1b).数週間のち,体循環を共有することにより未感染マウスには感染マウスに由来するメモリーT細胞が循環していた.しかしながら,未感染マウスにはメモリーリンパ球クラスターは存在しなかった.そこで,未感染マウスに致死量の単純ヘルペス2型ウイルス野生株を感染させ,血中を循環するCD4陽性メモリーT細胞のウイルスの除去における役割について検討した.その結果,感染から数日のうちに感染マウスに由来する多量のT細胞が血中から感染部位に流入してきた.それと比較して,特異的なCD4陽性T細胞の流入は遅延し,感染ののち3日から5日を要した.さらには,野生株を再感染させたのち感染マウスどうしを並体結合した場合と比較して,感染マウスと未感染マウスを並体結合した場合の未感染マウスの膣粘膜の組織では,ウイルスの力価がいちじるしく高いことが示された.すなわち,血中を循環するCD4陽性メモリーT細胞のみではウイルスをすみやかに除去することは困難であることが明らかになった.一方で,感染マウスどうしを並体結合したとき,メモリーリンパ球クラスターに組織常在型のCD4陽性T細胞の維持されているパートナーマウスでは,致死量の野生株を再感染させたのちに,感染部位におけるウイルスのすみやかな除去が検出された(図1a).以上の結果から,メモリーリンパ球クラスターに集積した単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞がウイルスをすみやかに除去する機能を長期間にわたり維持していることが明らかになった.
単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞がどのような分子機構により組織常在型のメモリーT細胞として維持されているのかを明らかにする目的で,弱毒株を感染させてから5週間後および12週間後の膣粘膜の組織を用いてマイクロアレイ解析を行った.その結果,感染から5週間後および12週間後の膣粘膜の組織において,ケモカインCCL5およびCXCL9の発現の有意な上昇が認められた.一方で,抗インターフェロンγ抗体による処理によりこれらのケモカインの発現は抑制された.くわえて,免疫組織染色により,CCL5陽性細胞はメモリーリンパ球クラスターにおいてCD4陽性T細胞の近傍に位置することが確認された.また,弱毒株を感染させてから5週間のちには,CD4陽性T細胞およびCD8陽性T細胞はそれらケモカインの受容体であるCCR1,CCR5,CXCR3を発現していた.さらには,抗CCL5抗体による処理ののち,膣粘膜の組織において単純ヘルペス2型ウイルスに特異的なTh1細胞およびCD8陽性T細胞の数は減少すること,抗CXCL9抗体による処理により単純ヘルペス2型ウイルスに特異的なCD8陽性T細胞の数は減少することが確認された.以上の結果から,単純ヘルペス2型ウイルス弱毒株を感染したのち,特異的なT細胞の組織常在性は膣粘膜の組織において継続的に発現するケモカインにより制御されていることが示唆された.
どのような細胞が継続的にケモカインを発現しているのかを明らかにする目的で,単純ヘルペス2型ウイルス弱毒株を感染させてから5週間のちに膣粘膜の組織から細胞浮遊液を調製し,抗CCL5抗体を用いて細胞内染色を行うことによりCCL5陽性細胞を同定した.その結果,CCL5陽性細胞はいくつかの細胞群に分かれたが,自己蛍光の高いCD11b陽性細胞において多くのCCL5陽性細胞が認められた.さらには,自己蛍光の高いCD11b陽性細胞は,マクロファージに特徴的なCD64,F4/80,MerTKの発現の高いことが確認された一方で,樹状細胞に特徴的なCD11cの発現は低いことが確認された.さらには,免疫組織染色によりCCL5陽性細胞がCD11bを発現することが確認された.以上の結果から,ケモカインCCL5を発現するマクロファージが単純ヘルペス2型ウイルスに特異的なT細胞の組織常在性に関与していることが示唆された.現在のところ,弱毒株を感染させてから5週間のちの膣粘膜の組織からはウイルスの複製を示す転写産物やウイルスDNAは検出されておらず,抗原提示細胞がCD4陽性T細胞にウイルス抗原を提示しているかどうかは不明である.
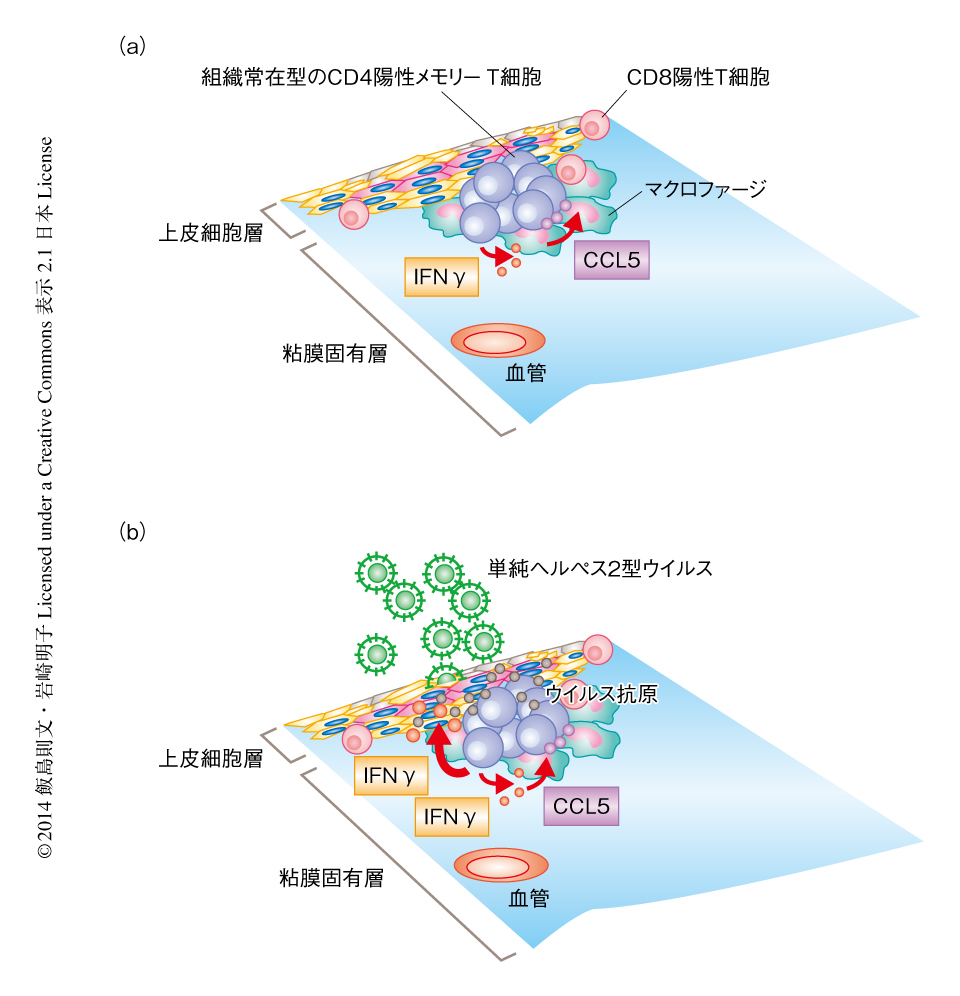
これらのケモカインの発現はインターフェロンγに依存して維持されていることが示唆されたので,弱毒株を感染させてから5週間のちの膣粘膜の組織から細胞浮遊液を調製し,CD4陽性T細胞がインターフェロンγを産生しているかどうかを検討した.その結果,CD4陽性T細胞は低濃度のインターフェロンγを継続的に産生していることが示唆され,この微量かつ継続的なインターフェロンγの産生が膣粘膜の組織においてメモリーリンパ球クラスターのような微小環境の維持に貢献していると考えられた.一方で,そののち致死量の野生株を再感染させると,単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞が高濃度のインターフェロンγを産生し,ウイルスのすみやかな除去に大きく寄与することが示唆された.以上の結果から,マクロファージおよび単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞がメモリーリンパ球クラスターを形成し,マクロファージから産生されるケモカインCCL5およびCD4陽性T細胞から継続的に産生される微量のインターフェロンγによる正のフィードバックにより,特異的なCD4陽性T細胞の組織常在性が制御されていると考えられた(図2).
この研究により,単純ヘルペス2型ウイルスを感染したのち膣粘膜の組織に形成されるメモリーリンパ球クラスターには,組織常在型のCD4陽性メモリーT細胞が集積すること,マクロファージがケモカインCCL5を産生し,特異的なCD4陽性T細胞が継続的に微量のインターフェロンγを産生することによる正のフィードバックにより,CD4陽性T細胞の組織常在性が維持されていることが示唆された.また,単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞は,メモリーリンパ球クラスターにおいてその機能を長期間にわたり維持し,致死量の野生株を再感染させた場合には高濃度のインターフェロンγをすみやかに産生し,膣粘膜の組織におけるウイルスの迅速な除去に大きく貢献すると考えられた.以上の結果は,組織常在型のT細胞を標的としたワクチンの開発に大きく寄与すると推察される.
略歴:2004年 北海道大学大学院薬学研究科 修了,同年 米国Yale大学School of Medicineポストドクトラルフェローを経て,2010年より同Associate Research Scientist.
研究テーマ:末梢組織における免疫の制御機構.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of Medicine教授.
© 2014 飯島則文・岩崎明子 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Immunobiology)
email:飯島則文,岩崎明子
DOI: 10.7875/first.author.2014.120
A local macrophage chemokine network sustains protective tissue-resident memory CD4 T cells.
Norifumi Iijima, Akiko Iwasaki
Science, 346, 93-98 (2014)
要 約
現在,ヒトパピローマウイルスとB型肝炎ウイルスを除き,性感染症を発症する病原体に対するワクチン候補薬には有効な作用はほとんど認められてない.T細胞が病原体に対する生体防御に大きくかかわることが知られているが,組織に局在するT細胞がどのような役割をはたしているのかは不明である.筆者らは,並体結合の技術を用いて,血中に循環しているT細胞と組織に常在するT細胞について,体内に侵入してきた病原体に対する役割を明確に区別することに成功した.性感染症を発症するウイルスのひとつである単純ヘルペス2型ウイルスを感染させたマウスにおいて,膣粘膜の組織にメモリーリンパ球クラスターが形成され,そこにはCD4陽性T細胞,CD8陽性T細胞,また,マクロファージや樹状細胞などの抗原提示細胞の局在することが見い出された.さらには,メモリーリンパ球クラスターにおいてCD4陽性T細胞の近傍にはマクロファージが局在し,ケモカインを分泌するマクロファージがCD4陽性メモリーT細胞の組織における常在性や抗ウイルス作用に対し大きく寄与していることが明らかになった.
はじめに
われわれヒトは進化とともに,有害な作用をもたらす病原体に対する生体防御機構を複雑にはりめぐらせるようになった.にもかかわらず,種々の重篤な感染症を防ぎ切ることはできないため,これまで,感染症の予防あるいは治療に用いる多くの薬剤が開発され,それらはさまざまな感染症の制圧あるいは抑制に多大な貢献をしてきた.しかしながら,近年,AIDS,高病原性インフルエンザ,SARS,エボラ出血熱など,新興感染症が人類の新たな脅威になっている.また,それら新興感染症の拡大とならび,これまでに抑制された感染症の再発や耐性菌の拡大などが問題になっている.性感染症をひき起こす病原体のなかでも,単純ヘルペス2型ウイルスは性器ヘルペスをひき起こすことが知られ,ウイルスは初回の感染ののち長いあいだ潜伏して再発をくり返す1).とくに新生児では,産道感染によりウイルスの複製が全身性となり致死率の高いことが知られている.さらには,ヒト免疫不全ウイルスに感染した患者では,免疫不全と関連して単純ヘルペス2型ウイルスの複製と再発の頻度の高くなることが知られている2).長年,単純ヘルペス2型ウイルスの予防のためのワクチンの開発が進められてきたが,現在,開発中のワクチン候補薬に治療効果はまったく認められていない3).単純ヘルペス2型ウイルスに対する免疫制御機構の詳細には不明な点が多く,安全な予防あるいは治療的のためのワクチンの開発には感染に対する生体防御機構のさらなる理解が必要であると考えられる.
単純ヘルペス2型ウイルスに対する生体防御機構においては,マウスを用いた研究によりCD4陽性T細胞が非常に重要な役割をはたしていることが明らかになっている4).マウスの膣に単純ヘルペス2型ウイルス野生株を感染させると致死であるが,チミジンキナーゼを欠損した弱毒株を感染させると,神経組織におけるウイルスの複製が阻害される一方で,強力かつ特異的な生体防御機構が形成されることが報告されている5).弱毒株を感染させてから5週間のちに致死量の野生株を再感染させてもウイルスは完全に除去される.筆者らは,これまでの研究において,弱毒株を感染させてから5週間のちには膣粘膜の組織にメモリーリンパ球クラスターが形成されていること,さらに,致死量の野生株を感染させたのち,膣粘膜の組織においてはさまざまな抗原提示細胞がCD4陽性メモリーT細胞をすみやかに活性化しウイルスを除去していることを報告した6).くわえて,ほかのグループからは,単純ヘルペス2型ウイルスに陽性のヒトの臨床検体においても膣粘膜の組織にCD4陽性T細胞がクラスターを形成していることが報告されている7).しかしながら,メモリーリンパ球クラスターはどのような機構により膣粘膜の組織に維持されているのか,CD4陽性メモリーT細胞はどのようにメモリーリンパ球クラスターに集積しているのか,また,再感染ののちにどのようにすみやかにウイルスを除去するのかは明らかではなかった.そこで,並体結合およびレーザーキャプチャーマイクロダイセクションの技術を用いて,この疑問を明らかにすることにした.
1.膣粘膜の組織に集積するT細胞は組織常在型である
単純ヘルペス2型ウイルス弱毒株を感染させたのち集積するT細胞は組織常在型なのか,あるいは,継続的に循環するT細胞が集積しているのかを明らかにするため,感染から5週間のちにホストとなるマウスとパートナーとなるマウスを並体結合した(図1a).少なくとも結合から3週間のちには,血中を循環するT細胞はホストマウスに由来するものとパートナーマウスに由来するものとがほぼ同じ割合になった.一方で,ホストマウスの膣粘膜の組織に集積したT細胞は,ホストマウスに由来するCD4陽性T細胞およびCD8陽性T細胞が89.4%および87.6%であった.また,ホストマウスに由来する単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞およびCD8陽性T細胞も96.8%および97.0%であった.免疫組織染色により確認したところ,ホストマウスのメモリーリンパ球クラスターは膣の粘膜固有層に局在し,集積したCD4陽性T細胞およびCD8陽性T細胞はほぼホストマウスに由来するT細胞であった.また,パートナーマウスに由来するT細胞がメモリーリンパ球クラスターの周囲を循環していることも明らかになった.
血中を循環するT細胞は,血中において高い濃度を示すスフィンゴシン1-リン酸の受容体である1型スフィンゴシン1-リン酸受容体を発現することにより,所属リンパ節あるいは組織から血中へと移行し血中を循環することが知られている8,9).そこで,膣粘膜の組織の組織切片を作製し,メモリーリンパ球クラスターに集積したCD4陽性T細胞をレーザーキャプチャーマイクロダイセクションにより切り出し1型スフィンゴシン1-リン酸受容体の発現について検討した.その結果,血中を循環する未感染のCD4陽性T細胞と比較して,1型スフィンゴシン1-リン酸受容体の発現のいちじるしい低下が認められた.また,1型スフィンゴシン1-リン酸受容体の発現の制御に関与する転写因子として知られているKLF2も,同様に発現のいちじるしい低下が認められた.一方で,ウイルスの複製を阻害するのに必須であるインターフェロンγの産生を制御する転写因子T-betについては,発現の顕著な上昇が認められた.以上の結果から,1型スフィンゴシン1-リン酸受容体の発現が低くT-betの発現が高い単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞が,組織に常在するかたちで維持されていることが明らかになった.
2.膣粘膜の組織に局在するメモリーリンパ球クラスターに集積したCD4陽性T細胞のレパートリー
メモリーリンパ球クラスターに集積したCD4陽性T細胞のもつ抗原特異性を明らかにする目的で,単純ヘルペス2型ウイルス弱毒株を感染させてから5週間のちに膣粘膜の組織の組織切片を作製し,メモリーリンパ球クラスターに集積したCD4陽性T細胞をレーザーキャプチャーマイクロダイセクションにより切り出した.回収したDNAを用いて,T細胞受容体β鎖のシークエンシングによりT細胞受容体β鎖の遺伝子のCDR3領域の配列を解析した.その結果,検出された53クローンのうち1つのクローンが33%をしめた.くわえて,このT細胞受容体β鎖をもつCD4陽性T細胞は未感染のマウスには検出されず,弱毒株を感染させてから5週間のちの所属リンパ節に検出された.さらには,弱毒株を感染させてから5週間のちの膣粘膜の組織から単純ヘルペス2型ウイルスに特異的なTh1細胞を単離してT細胞受容体β鎖を解析したところ,同じT細胞受容体β鎖を発現していることが確認された.その結果,このドミナントなクローンは単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞であると同定することができ,メモリーリンパ球クラスターには特異的な組織常在型のCD4陽性T細胞の集積していることが明らかになった.
3.ウイルスの再感染に対する組織常在型のCD4陽性T細胞の役割
メモリーリンパ球クラスターに集積した単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞が長期間にわたり機能を維持しているかどうか明らかにする目的で,マウスを弱毒株により感染させてから5週間のちに,ウイルスを感染させていないマウスと並体結合した(図1b).数週間のち,体循環を共有することにより未感染マウスには感染マウスに由来するメモリーT細胞が循環していた.しかしながら,未感染マウスにはメモリーリンパ球クラスターは存在しなかった.そこで,未感染マウスに致死量の単純ヘルペス2型ウイルス野生株を感染させ,血中を循環するCD4陽性メモリーT細胞のウイルスの除去における役割について検討した.その結果,感染から数日のうちに感染マウスに由来する多量のT細胞が血中から感染部位に流入してきた.それと比較して,特異的なCD4陽性T細胞の流入は遅延し,感染ののち3日から5日を要した.さらには,野生株を再感染させたのち感染マウスどうしを並体結合した場合と比較して,感染マウスと未感染マウスを並体結合した場合の未感染マウスの膣粘膜の組織では,ウイルスの力価がいちじるしく高いことが示された.すなわち,血中を循環するCD4陽性メモリーT細胞のみではウイルスをすみやかに除去することは困難であることが明らかになった.一方で,感染マウスどうしを並体結合したとき,メモリーリンパ球クラスターに組織常在型のCD4陽性T細胞の維持されているパートナーマウスでは,致死量の野生株を再感染させたのちに,感染部位におけるウイルスのすみやかな除去が検出された(図1a).以上の結果から,メモリーリンパ球クラスターに集積した単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞がウイルスをすみやかに除去する機能を長期間にわたり維持していることが明らかになった.
4.メモリーリンパ球クラスターにおいて継続的に発現するタンパク質の探索
単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞がどのような分子機構により組織常在型のメモリーT細胞として維持されているのかを明らかにする目的で,弱毒株を感染させてから5週間後および12週間後の膣粘膜の組織を用いてマイクロアレイ解析を行った.その結果,感染から5週間後および12週間後の膣粘膜の組織において,ケモカインCCL5およびCXCL9の発現の有意な上昇が認められた.一方で,抗インターフェロンγ抗体による処理によりこれらのケモカインの発現は抑制された.くわえて,免疫組織染色により,CCL5陽性細胞はメモリーリンパ球クラスターにおいてCD4陽性T細胞の近傍に位置することが確認された.また,弱毒株を感染させてから5週間のちには,CD4陽性T細胞およびCD8陽性T細胞はそれらケモカインの受容体であるCCR1,CCR5,CXCR3を発現していた.さらには,抗CCL5抗体による処理ののち,膣粘膜の組織において単純ヘルペス2型ウイルスに特異的なTh1細胞およびCD8陽性T細胞の数は減少すること,抗CXCL9抗体による処理により単純ヘルペス2型ウイルスに特異的なCD8陽性T細胞の数は減少することが確認された.以上の結果から,単純ヘルペス2型ウイルス弱毒株を感染したのち,特異的なT細胞の組織常在性は膣粘膜の組織において継続的に発現するケモカインにより制御されていることが示唆された.
5.メモリーリンパ球クラスターの形成が維持される機構
どのような細胞が継続的にケモカインを発現しているのかを明らかにする目的で,単純ヘルペス2型ウイルス弱毒株を感染させてから5週間のちに膣粘膜の組織から細胞浮遊液を調製し,抗CCL5抗体を用いて細胞内染色を行うことによりCCL5陽性細胞を同定した.その結果,CCL5陽性細胞はいくつかの細胞群に分かれたが,自己蛍光の高いCD11b陽性細胞において多くのCCL5陽性細胞が認められた.さらには,自己蛍光の高いCD11b陽性細胞は,マクロファージに特徴的なCD64,F4/80,MerTKの発現の高いことが確認された一方で,樹状細胞に特徴的なCD11cの発現は低いことが確認された.さらには,免疫組織染色によりCCL5陽性細胞がCD11bを発現することが確認された.以上の結果から,ケモカインCCL5を発現するマクロファージが単純ヘルペス2型ウイルスに特異的なT細胞の組織常在性に関与していることが示唆された.現在のところ,弱毒株を感染させてから5週間のちの膣粘膜の組織からはウイルスの複製を示す転写産物やウイルスDNAは検出されておらず,抗原提示細胞がCD4陽性T細胞にウイルス抗原を提示しているかどうかは不明である.
これらのケモカインの発現はインターフェロンγに依存して維持されていることが示唆されたので,弱毒株を感染させてから5週間のちの膣粘膜の組織から細胞浮遊液を調製し,CD4陽性T細胞がインターフェロンγを産生しているかどうかを検討した.その結果,CD4陽性T細胞は低濃度のインターフェロンγを継続的に産生していることが示唆され,この微量かつ継続的なインターフェロンγの産生が膣粘膜の組織においてメモリーリンパ球クラスターのような微小環境の維持に貢献していると考えられた.一方で,そののち致死量の野生株を再感染させると,単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞が高濃度のインターフェロンγを産生し,ウイルスのすみやかな除去に大きく寄与することが示唆された.以上の結果から,マクロファージおよび単純ヘルペス2型ウイルスに特異的なCD4陽性T細胞がメモリーリンパ球クラスターを形成し,マクロファージから産生されるケモカインCCL5およびCD4陽性T細胞から継続的に産生される微量のインターフェロンγによる正のフィードバックにより,特異的なCD4陽性T細胞の組織常在性が制御されていると考えられた(図2).
おわりに
この研究により,単純ヘルペス2型ウイルスを感染したのち膣粘膜の組織に形成されるメモリーリンパ球クラスターには,組織常在型のCD4陽性メモリーT細胞が集積すること,マクロファージがケモカインCCL5を産生し,特異的なCD4陽性T細胞が継続的に微量のインターフェロンγを産生することによる正のフィードバックにより,CD4陽性T細胞の組織常在性が維持されていることが示唆された.また,単純ヘルペス2型ウイルスに特異的な組織常在型のCD4陽性T細胞は,メモリーリンパ球クラスターにおいてその機能を長期間にわたり維持し,致死量の野生株を再感染させた場合には高濃度のインターフェロンγをすみやかに産生し,膣粘膜の組織におけるウイルスの迅速な除去に大きく貢献すると考えられた.以上の結果は,組織常在型のT細胞を標的としたワクチンの開発に大きく寄与すると推察される.
文 献
- Schiffer, J. T. & Corey, L.: Rapid host immune response and viral dynamics in herpes simplex virus-2 infection. Nat. Med., 19, 280-290 (2013)[PubMed]
- Tan, D. H., Murphy, K., Shah, P. et al.: Herpes simplex virus type 2 and HIV disease progression: a systematic review of observational studies. BMC Infect. Dis., 13, 502 (2013)[PubMed]
- Belshe, R. B., Leone, P. A., Bernstein, D. I. et al.: Efficacy results of a trial of a herpes simplex vaccine. N. Engl. J. Med., 366, 34-43 (2012)[PubMed]
- Harandi, A. M., Svennerholm, B., Holmgren, J. et al.: Differential roles of B cells and IFN-γ-secreting CD4+ T cells in innate and adaptive immune control of genital herpes simplex virus type 2 infection in mice. J. Gen. Virol., 82, 845-853 (2001)[PubMed]
- Milligan, G. N., Bernstein, D. I. & Bourne, N.: T lymphocytes are required for protection of the vaginal mucosae and sensory ganglia of immune mice against reinfection with herpes simplex virus type 2. J. Immunol., 160, 6093-6100 (1998)[PubMed]
- Iijima, N., Linehan, M. M., Zamora, M. et al.: Dendritic cells and B cells maximize mucosal Th1 memory response to herpes simplex virus. J. Exp. Med., 205, 3041-3052 (2008)[PubMed]
- Zhu, J., Hladik, F., Woodward, A. et al.: Persistence of HIV-1 receptor-positive cells after HSV-2 reactivation is a potential mechanism for increased HIV-1 acquisition. Nat. Med., 15, 886-892 (2009)[PubMed]
- Matloubian, M., Lo, C. G., Cinamon, G. et al.: Lymphocyte egress from thymus and peripheral lymphoid organs is dependent on S1P receptor 1. Nature, 427, 355-360 (2004)[PubMed]
- Skon, C. N., Lee, J. Y., Anderson, K. G. et al.: Transcriptional downregulation of S1pr1 is required for the establishment of resident memory CD8+ T cells. Nat. Immunol., 14, 1285-1293 (2013)[PubMed]
著者プロフィール
略歴:2004年 北海道大学大学院薬学研究科 修了,同年 米国Yale大学School of Medicineポストドクトラルフェローを経て,2010年より同Associate Research Scientist.
研究テーマ:末梢組織における免疫の制御機構.
岩崎 明子(Akiko Iwasaki)
米国Yale大学School of Medicine教授.
© 2014 飯島則文・岩崎明子 Licensed under CC 表示 2.1 日本