Hoxb5は長期造血幹細胞に特異的に発現する
宮西正憲・James Y. Chen・Irving L. Weissman
(米国Stanford大学School of Medicine,Institute for Stem Cell Biology and Regenerative Medicine)
email:宮西正憲
DOI: 10.7875/first.author.2016.020
Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche.
James Y. Chen, Masanori Miyanishi, Sean K. Wang, Satoshi Yamazaki, Rahul Sinha, Kevin S. Kao, Jun Seita, Debashis Sahoo, Hiromitsu Nakauchi, Irving L. Weissman
Nature, 530, 223-227 (2016)
造血幹細胞はもっとも詳細に研究されている組織幹細胞である.造血幹細胞が同定されて以来,自己複製能,分化,老化,ニッチ,多様性など,多くの生物学的な知見が明らかにされたが,その解析に用いられる技術はきわめて煩雑であるため,その解釈には議論の余地のあるものも少なくない.今回,筆者らは,網羅的な多段階スクリーニングにより,マウスの骨髄においてHoxb5が長期造血幹細胞に特異的に発現することを発見した.Hoxb5遺伝子の内在性のプロモーターのもと蛍光タンパク質を発現するレポーターマウスを用いることにより,Hoxb5陽性の造血幹細胞のみが,1次移植マウスや,とくに2次移植マウスにおいて,長期にわたり再構築能を示すことがわかった.これまで報告された種々の定義による造血幹細胞の画分を再検討したところ,7~35%のみがHoxb5陽性の長期造血幹細胞であり,残りはそれ以外の細胞であった.透明化処理したマウスの骨髄の3次元画像化により,長期造血幹細胞の94%以上はVE-カドヘリン陽性の細胞と直接に接着していることがわかり,このことから血管の周囲は造血幹細胞のほぼ均一なニッチであると考えられた.
造血幹細胞(haematopoietic stem cell:HSC)はおもに骨髄に存在し,自己複製能および多分化能をもつ血液細胞と定義される.マウスの造血幹細胞は,1965年にその存在が提唱され1),1988年に表面抗原に対するモノクローナル抗体およびフローサイトメーターを用いた方法によりはじめて同定された2).当時の造血幹細胞の画分は前駆細胞を含む雑多なものであったが,約30年にわたり,造血幹細胞のさらなる濃縮および単離をめざしさまざまな表面マーカーが提案されてきた.現在では,マウスの骨髄においてはLineage- cKit- Sca-1+ Flk2- CD34-/lo CD150+で定義される画分にすべての機能的な造血幹細胞の存在することが証明されている.しかしながら,いまだこの画分には短期造血幹細胞などが混在しており,これまで,真の造血幹細胞である長期造血幹細胞のみの単離は成功していない.そこで,筆者らは,長期造血幹細胞を高純度で分離する系の確立を最初の目的とした.
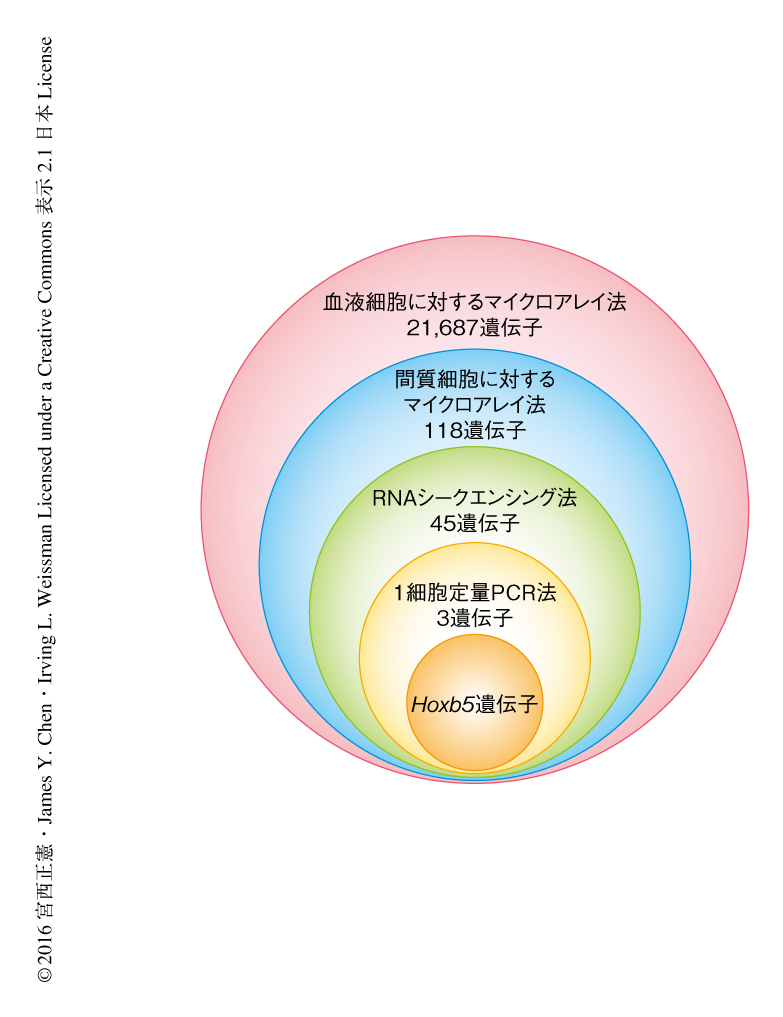
現在,筆者らの研究グループは,Lineage- cKit- Sca-1+ Flk2- CD34-/lo CD150+をもっとも信頼のおける造血幹細胞のマーカーとして用いており,そこに含まれる細胞集団をpHSCと名づけた.まず,骨髄に存在するあらゆる血液細胞において,pHSCのみに発現する遺伝子をスクリーニングした.筆者らの研究室において開発したプラットフォームを用い3),フローサイトメーターにて高純度に分離した28種類の血液細胞の遺伝子発現プロファイルからpHSCのみに発現する遺伝子をパターン検索したところ,118個の遺伝子が該当した.この118個の遺伝子について,レポーターマウスを作製する遺伝子を絞り込むため多段階スクリーニングをした.
骨髄における造血幹細胞の局在を明確にするには,造血幹細胞を除くあらゆる血液細胞のみならず,血管内皮細胞や間質細胞といった非血液細胞の遺伝子発現プロファイルをも考慮する必要があった.そこで,さきの28種類の血液細胞にくわえ,8種類の非血液細胞の遺伝子プロファイルをくわえて新たにパターン検索した.すると,118個の遺伝子のうち73個の遺伝子は非血液細胞に有意に発現が認められ,pHSCのみに発現する候補遺伝子は45個になった.レポーターマウスを作製する際に問題になるのは,実際に蛍光シグナルがフローサイトメーターなどの実験機器により検知できるかどうかが,レポーターマウスを作製し実際に解析するまで予測できないことである.そこで,RNAシークエンシング法によりpHSCおよび多能性前駆細胞における遺伝子の発現を定量的に評価することで,このリスクを軽減することを試みた.指標としてはBmi-1遺伝子を選択した.Bmi-1-EGFPノックインレポーターマウスは,ヘテロマウスにて野生型マウスと比較して造血幹細胞のレベルで10倍のシグナル値をもち,このシグナルはフローサイトメーターにより検出することができる4).すなわち,Bmi-1遺伝子より発現量が多ければフローサイトメーターによりそのシグナルが検知でき,また,発現量が1/10以下ならば検出感度以下であると予想された.pHSCにおけるBmi-1遺伝子の発現量は約20 FPKMであった.この値を指標として,45個の候補遺伝子をスクリーニングしたが,該当する遺伝子はなかった.そこで,レポーターに用いる蛍光タンパク質を至適化し,さらに,ターゲティングコンストラクトにおいて3つの蛍光タンパク質の遺伝子をタンデムにつないだ.これにより,理論的には蛍光強度を3倍に高めることができ,20 FPKMの約1/3の7 FPKMを下限値に再設定しスクリーニングしたところ,3個の遺伝子が候補として残った.さきに述べたように,pHSCには少なくとも長期造血幹細胞と短期造血幹細胞とが混在している.そこで,この3個の遺伝子のなかにpHSCを発現量の観点から2層性に分けうるものがあるかどうかを1細胞定量PCR法を用いて調べた.すると,Hoxb5遺伝子のみが明確に2層性のパターンを示したため,レポーターマウスの作製の第1候補とした(図1).
Hoxb5遺伝子につきレポーターマウスを作製するにあたり,内在性のタンパク質の機能をさまたげないよう,蛍光タンパク質mCherryをHoxb5遺伝子の終止コドンの直前に2A配列を介しタンデムに3つ配列することでターゲティングコンストラクトを作製した.Hoxb5遺伝子の内在性のプロモーターによる蛍光タンパク質の発現の特異度を調べるため,骨髄のpHSC,多能性前駆細胞サブセットA,多能性前駆細胞サブセットB,Flk2陽性前駆細胞,巨核球赤芽球前駆細胞,顆粒球単球前駆細胞,骨髄球系共通前駆細胞,リンパ球系共通前駆細胞,成熟血液細胞(好中球,好酸球,B細胞,T細胞,単球,樹状細胞,NK細胞),末梢血の成熟血液細胞,さらには,骨髄の血管内皮や間質細胞など非血液細胞としてCD45陰性画分について解析した.陰性と陽性との閾値の設定には野生型マウスを用いた.その結果,スクリーニングによる予測どおり,pHSCの約20%のみに特異的に蛍光タンパク質の発現が確認された.
pHSCにおけるHoxb5陽性細胞およびHoxb5陰性細胞の機能の評価のため,Hoxb5陽性pHSCおよびHoxb5陰性pHSCおのおのの画分より10細胞ずつを,2×105個の競合する骨髄細胞とともに,致死量の放射線を照射したホストマウスに移植し,4週間ごとに末梢血における多分化能について評価した.移植ののち,8週目まではHoxb5陽性細胞あるいはHoxb5陰性細胞とも差は認められなかったが,12週目ごろからHoxb5陰性細胞において顆粒球への分化の低下が観察されはじめ,一方で,Hoxb5陽性細胞においては顆粒球への分化は保たれたままであり,16週目においてその差はさらに著明になった.さらに,長期の再構築能を調べるため,1次移植マウスより採取した1×107個の骨髄有核細胞を2次移植したところ,Hoxb5陰性細胞にはほとんど再構築能が観察されなかった一方,Hoxb5陽性細胞は調べた全例においてきわめて高い再構築能を示し,長期造血幹細胞の典型的なパターンを示した.これらの結果は,これまで用いられてきたpHSCの約80%が短期造血幹細胞あるいはさらにその下流の細胞から形成されており,残りの20%にほぼすべての長期造血幹細胞が含まれていることを示した.
2005年のCD150マーカーの発見は,造血幹細胞の濃縮,とくにin situにおける造血幹細胞の同定に大きく貢献した5).過去10年のあいだ,CD150+ CD48- CD41- Lineage-により規定される細胞をin situ HSCとし,さまざまな知見が報告されてきた.また,フローサイトメーターを用いて長期造血幹細胞のみを濃縮する試みとして,いくつかのマーカーが報告された6-8).
しかし,pHSCの約20%のみが長期造血幹細胞としての表現型を呈し,残りの80%は短期造血幹細胞あるいはさらに下流の細胞であることが示されたため,あらためて過去の報告における長期造血幹細胞に対する特異度を評価した.その結果,この10年間に報告された長期造血幹細胞を定義する細胞の約20~35%のみがHoxb5陽性であり,残りは短期造血幹細胞あるいはさらに下流の細胞からの混在が示唆された.さらに,in situ HSCを規定する細胞の90%以上がHoxb5陰性であった.このことは,これまでに明らかにされた造血幹細胞に関する知見を再評価する必要性のあることを示すものであった.
造血幹細胞は骨髄においてニッチとよばれる特殊な環境にてその機能が維持される.これまでに,血管内皮細胞,骨芽細胞,間葉系幹細胞,細網細胞など,多様な細胞がニッチを構成することが報告されている9).また,サイトカインなどさまざまな因子がその機能の維持に重要であることも明らかにされている.しかしながら,長期造血幹細胞の存在の頻度がきわめて低いこと,また,短期造血幹細胞さらには多能性前駆細胞への分化は連続的な変化であることを考慮すると,これまでの報告が本当に長期造血幹細胞に特異的な現象を反映していたかどうかは不明であった.
作製されたレポーターマウスを用いて,単一のカラーによるマウスの脛骨骨髄における長期造血幹細胞の同定を試みた.その際,血管の走行を明らかにするため,抗VE-カドヘリンモノクローナル抗体を静脈に注入した.採取した骨髄をCUBIC透明化技術により処理したのち10),光シート顕微鏡により撮像し,得られた画像を3次元に構築したのち解析した.統計学的な信頼度のため約300個の長期造血幹細胞を解析したが,骨髄における場所による頻度の有意な差は観察されず,長期造血幹細胞は均等に分布していると思われた.しかしながら,VE-カドヘリン陽性の血管内皮細胞との位置関係を調べたところ,94%以上もの長期造血幹細胞は直接に血管内皮細胞と接触していることがわかった.このことは,少なくともVE-Cadカドヘリン陽性の血管内皮細胞が長期造血幹細胞のニッチとしてはたらき,直接に接着することがその機能の維持に重要であることを示唆した.
造血幹細胞は単なる幹細胞としての生物学的な興味のみならず,一生涯にわたる長寿命をもつことからさまざまな遺伝子の異常を蓄積しやすく,白血病などのがん幹細胞との関連性も強く示唆されており,医学的にもきわめて重要である.それゆえ,造血幹細胞の分子機構を理解することはきわめて重要な課題であり,そのためには,まず,長期造血幹細胞のみを高純度に濃縮する技術の確立が必須であった.しかしながら,頻度がきわめて低いこと,10色前後の蛍光色素を用いたフローサイトメーターによる分離あるいは解析がきわめて煩雑であること,造血幹細胞としての機能の解析にマウスへの移植が必須であり長期造血幹細胞であることの評価には少なくとも8カ月もかかることなど,さまざまな要因により造血幹細胞の研究はきわめて難度の高いものであった.
今回,長期造血幹細胞のみに特異的に発現する遺伝子が発見されたことにより,これまで不可能であった長期造血幹細胞と短期造血幹細胞との分離が可能になった.さらに,単一のカラーによるin situにおける長期造血幹細胞の同定が可能になったことにより,長期造血幹細胞のニッチに関するさらなる理解にも貢献することが期待される.また,今回の研究成果における重要な点は,移植を介した後方視的な評価ではなく,Hoxb5陽性の造血幹細胞は長期造血幹細胞,Hoxb5陰性の造血幹細胞は短期造血幹細胞,と定義づけることが可能になったことにある.このことにより,これまでよりはるかに簡便かつ再現性をもってさまざまなスクリーニングに供することが可能になると思われ,のちの分子機構の解明にも大きな役割をはたすものと思われる.
略歴:2009年 京都大学大学院医学研究科博士課程 修了,2011年より米国Stanford大学School of Medicine博士研究員.
研究テーマ:造血幹細胞.
関心事:造血幹細胞の分子機構の解明.
James Y. Chen
米国Stanford大学School of Medicine大学院在学中.
Irving L. Weissman
米国Stanford大学School of Medicine教授.
© 2016 宮西正憲・James Y. Chen・Irving L. Weissman Licensed under CC 表示 2.1 日本
(米国Stanford大学School of Medicine,Institute for Stem Cell Biology and Regenerative Medicine)
email:宮西正憲
DOI: 10.7875/first.author.2016.020
Hoxb5 marks long-term haematopoietic stem cells and reveals a homogenous perivascular niche.
James Y. Chen, Masanori Miyanishi, Sean K. Wang, Satoshi Yamazaki, Rahul Sinha, Kevin S. Kao, Jun Seita, Debashis Sahoo, Hiromitsu Nakauchi, Irving L. Weissman
Nature, 530, 223-227 (2016)
要 約
造血幹細胞はもっとも詳細に研究されている組織幹細胞である.造血幹細胞が同定されて以来,自己複製能,分化,老化,ニッチ,多様性など,多くの生物学的な知見が明らかにされたが,その解析に用いられる技術はきわめて煩雑であるため,その解釈には議論の余地のあるものも少なくない.今回,筆者らは,網羅的な多段階スクリーニングにより,マウスの骨髄においてHoxb5が長期造血幹細胞に特異的に発現することを発見した.Hoxb5遺伝子の内在性のプロモーターのもと蛍光タンパク質を発現するレポーターマウスを用いることにより,Hoxb5陽性の造血幹細胞のみが,1次移植マウスや,とくに2次移植マウスにおいて,長期にわたり再構築能を示すことがわかった.これまで報告された種々の定義による造血幹細胞の画分を再検討したところ,7~35%のみがHoxb5陽性の長期造血幹細胞であり,残りはそれ以外の細胞であった.透明化処理したマウスの骨髄の3次元画像化により,長期造血幹細胞の94%以上はVE-カドヘリン陽性の細胞と直接に接着していることがわかり,このことから血管の周囲は造血幹細胞のほぼ均一なニッチであると考えられた.
はじめに
造血幹細胞(haematopoietic stem cell:HSC)はおもに骨髄に存在し,自己複製能および多分化能をもつ血液細胞と定義される.マウスの造血幹細胞は,1965年にその存在が提唱され1),1988年に表面抗原に対するモノクローナル抗体およびフローサイトメーターを用いた方法によりはじめて同定された2).当時の造血幹細胞の画分は前駆細胞を含む雑多なものであったが,約30年にわたり,造血幹細胞のさらなる濃縮および単離をめざしさまざまな表面マーカーが提案されてきた.現在では,マウスの骨髄においてはLineage- cKit- Sca-1+ Flk2- CD34-/lo CD150+で定義される画分にすべての機能的な造血幹細胞の存在することが証明されている.しかしながら,いまだこの画分には短期造血幹細胞などが混在しており,これまで,真の造血幹細胞である長期造血幹細胞のみの単離は成功していない.そこで,筆者らは,長期造血幹細胞を高純度で分離する系の確立を最初の目的とした.
1.長期造血幹細胞に特異的に発現する候補遺伝子のスクリーニング
現在,筆者らの研究グループは,Lineage- cKit- Sca-1+ Flk2- CD34-/lo CD150+をもっとも信頼のおける造血幹細胞のマーカーとして用いており,そこに含まれる細胞集団をpHSCと名づけた.まず,骨髄に存在するあらゆる血液細胞において,pHSCのみに発現する遺伝子をスクリーニングした.筆者らの研究室において開発したプラットフォームを用い3),フローサイトメーターにて高純度に分離した28種類の血液細胞の遺伝子発現プロファイルからpHSCのみに発現する遺伝子をパターン検索したところ,118個の遺伝子が該当した.この118個の遺伝子について,レポーターマウスを作製する遺伝子を絞り込むため多段階スクリーニングをした.
骨髄における造血幹細胞の局在を明確にするには,造血幹細胞を除くあらゆる血液細胞のみならず,血管内皮細胞や間質細胞といった非血液細胞の遺伝子発現プロファイルをも考慮する必要があった.そこで,さきの28種類の血液細胞にくわえ,8種類の非血液細胞の遺伝子プロファイルをくわえて新たにパターン検索した.すると,118個の遺伝子のうち73個の遺伝子は非血液細胞に有意に発現が認められ,pHSCのみに発現する候補遺伝子は45個になった.レポーターマウスを作製する際に問題になるのは,実際に蛍光シグナルがフローサイトメーターなどの実験機器により検知できるかどうかが,レポーターマウスを作製し実際に解析するまで予測できないことである.そこで,RNAシークエンシング法によりpHSCおよび多能性前駆細胞における遺伝子の発現を定量的に評価することで,このリスクを軽減することを試みた.指標としてはBmi-1遺伝子を選択した.Bmi-1-EGFPノックインレポーターマウスは,ヘテロマウスにて野生型マウスと比較して造血幹細胞のレベルで10倍のシグナル値をもち,このシグナルはフローサイトメーターにより検出することができる4).すなわち,Bmi-1遺伝子より発現量が多ければフローサイトメーターによりそのシグナルが検知でき,また,発現量が1/10以下ならば検出感度以下であると予想された.pHSCにおけるBmi-1遺伝子の発現量は約20 FPKMであった.この値を指標として,45個の候補遺伝子をスクリーニングしたが,該当する遺伝子はなかった.そこで,レポーターに用いる蛍光タンパク質を至適化し,さらに,ターゲティングコンストラクトにおいて3つの蛍光タンパク質の遺伝子をタンデムにつないだ.これにより,理論的には蛍光強度を3倍に高めることができ,20 FPKMの約1/3の7 FPKMを下限値に再設定しスクリーニングしたところ,3個の遺伝子が候補として残った.さきに述べたように,pHSCには少なくとも長期造血幹細胞と短期造血幹細胞とが混在している.そこで,この3個の遺伝子のなかにpHSCを発現量の観点から2層性に分けうるものがあるかどうかを1細胞定量PCR法を用いて調べた.すると,Hoxb5遺伝子のみが明確に2層性のパターンを示したため,レポーターマウスの作製の第1候補とした(図1).
2.Hoxb5は長期造血幹細胞に特異的なマーカーである
Hoxb5遺伝子につきレポーターマウスを作製するにあたり,内在性のタンパク質の機能をさまたげないよう,蛍光タンパク質mCherryをHoxb5遺伝子の終止コドンの直前に2A配列を介しタンデムに3つ配列することでターゲティングコンストラクトを作製した.Hoxb5遺伝子の内在性のプロモーターによる蛍光タンパク質の発現の特異度を調べるため,骨髄のpHSC,多能性前駆細胞サブセットA,多能性前駆細胞サブセットB,Flk2陽性前駆細胞,巨核球赤芽球前駆細胞,顆粒球単球前駆細胞,骨髄球系共通前駆細胞,リンパ球系共通前駆細胞,成熟血液細胞(好中球,好酸球,B細胞,T細胞,単球,樹状細胞,NK細胞),末梢血の成熟血液細胞,さらには,骨髄の血管内皮や間質細胞など非血液細胞としてCD45陰性画分について解析した.陰性と陽性との閾値の設定には野生型マウスを用いた.その結果,スクリーニングによる予測どおり,pHSCの約20%のみに特異的に蛍光タンパク質の発現が確認された.
pHSCにおけるHoxb5陽性細胞およびHoxb5陰性細胞の機能の評価のため,Hoxb5陽性pHSCおよびHoxb5陰性pHSCおのおのの画分より10細胞ずつを,2×105個の競合する骨髄細胞とともに,致死量の放射線を照射したホストマウスに移植し,4週間ごとに末梢血における多分化能について評価した.移植ののち,8週目まではHoxb5陽性細胞あるいはHoxb5陰性細胞とも差は認められなかったが,12週目ごろからHoxb5陰性細胞において顆粒球への分化の低下が観察されはじめ,一方で,Hoxb5陽性細胞においては顆粒球への分化は保たれたままであり,16週目においてその差はさらに著明になった.さらに,長期の再構築能を調べるため,1次移植マウスより採取した1×107個の骨髄有核細胞を2次移植したところ,Hoxb5陰性細胞にはほとんど再構築能が観察されなかった一方,Hoxb5陽性細胞は調べた全例においてきわめて高い再構築能を示し,長期造血幹細胞の典型的なパターンを示した.これらの結果は,これまで用いられてきたpHSCの約80%が短期造血幹細胞あるいはさらにその下流の細胞から形成されており,残りの20%にほぼすべての長期造血幹細胞が含まれていることを示した.
3.これまでの報告との比較
2005年のCD150マーカーの発見は,造血幹細胞の濃縮,とくにin situにおける造血幹細胞の同定に大きく貢献した5).過去10年のあいだ,CD150+ CD48- CD41- Lineage-により規定される細胞をin situ HSCとし,さまざまな知見が報告されてきた.また,フローサイトメーターを用いて長期造血幹細胞のみを濃縮する試みとして,いくつかのマーカーが報告された6-8).
しかし,pHSCの約20%のみが長期造血幹細胞としての表現型を呈し,残りの80%は短期造血幹細胞あるいはさらに下流の細胞であることが示されたため,あらためて過去の報告における長期造血幹細胞に対する特異度を評価した.その結果,この10年間に報告された長期造血幹細胞を定義する細胞の約20~35%のみがHoxb5陽性であり,残りは短期造血幹細胞あるいはさらに下流の細胞からの混在が示唆された.さらに,in situ HSCを規定する細胞の90%以上がHoxb5陰性であった.このことは,これまでに明らかにされた造血幹細胞に関する知見を再評価する必要性のあることを示すものであった.
4.長期造血幹細胞の均一なニッチの同定
造血幹細胞は骨髄においてニッチとよばれる特殊な環境にてその機能が維持される.これまでに,血管内皮細胞,骨芽細胞,間葉系幹細胞,細網細胞など,多様な細胞がニッチを構成することが報告されている9).また,サイトカインなどさまざまな因子がその機能の維持に重要であることも明らかにされている.しかしながら,長期造血幹細胞の存在の頻度がきわめて低いこと,また,短期造血幹細胞さらには多能性前駆細胞への分化は連続的な変化であることを考慮すると,これまでの報告が本当に長期造血幹細胞に特異的な現象を反映していたかどうかは不明であった.
作製されたレポーターマウスを用いて,単一のカラーによるマウスの脛骨骨髄における長期造血幹細胞の同定を試みた.その際,血管の走行を明らかにするため,抗VE-カドヘリンモノクローナル抗体を静脈に注入した.採取した骨髄をCUBIC透明化技術により処理したのち10),光シート顕微鏡により撮像し,得られた画像を3次元に構築したのち解析した.統計学的な信頼度のため約300個の長期造血幹細胞を解析したが,骨髄における場所による頻度の有意な差は観察されず,長期造血幹細胞は均等に分布していると思われた.しかしながら,VE-カドヘリン陽性の血管内皮細胞との位置関係を調べたところ,94%以上もの長期造血幹細胞は直接に血管内皮細胞と接触していることがわかった.このことは,少なくともVE-Cadカドヘリン陽性の血管内皮細胞が長期造血幹細胞のニッチとしてはたらき,直接に接着することがその機能の維持に重要であることを示唆した.
おわりに
造血幹細胞は単なる幹細胞としての生物学的な興味のみならず,一生涯にわたる長寿命をもつことからさまざまな遺伝子の異常を蓄積しやすく,白血病などのがん幹細胞との関連性も強く示唆されており,医学的にもきわめて重要である.それゆえ,造血幹細胞の分子機構を理解することはきわめて重要な課題であり,そのためには,まず,長期造血幹細胞のみを高純度に濃縮する技術の確立が必須であった.しかしながら,頻度がきわめて低いこと,10色前後の蛍光色素を用いたフローサイトメーターによる分離あるいは解析がきわめて煩雑であること,造血幹細胞としての機能の解析にマウスへの移植が必須であり長期造血幹細胞であることの評価には少なくとも8カ月もかかることなど,さまざまな要因により造血幹細胞の研究はきわめて難度の高いものであった.
今回,長期造血幹細胞のみに特異的に発現する遺伝子が発見されたことにより,これまで不可能であった長期造血幹細胞と短期造血幹細胞との分離が可能になった.さらに,単一のカラーによるin situにおける長期造血幹細胞の同定が可能になったことにより,長期造血幹細胞のニッチに関するさらなる理解にも貢献することが期待される.また,今回の研究成果における重要な点は,移植を介した後方視的な評価ではなく,Hoxb5陽性の造血幹細胞は長期造血幹細胞,Hoxb5陰性の造血幹細胞は短期造血幹細胞,と定義づけることが可能になったことにある.このことにより,これまでよりはるかに簡便かつ再現性をもってさまざまなスクリーニングに供することが可能になると思われ,のちの分子機構の解明にも大きな役割をはたすものと思われる.
文 献
- Till, J. E. & McCulloch, E. A.: A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiat. Res., 14, 213-222 (1961)[PubMed]
- Spangrude, G. J., Heimfeld, S. & Weissman, I. L.: Purification and characterization of mouse hematopoietic stem cells. Science, 241, 58-62 (1988)[PubMed]
- Seita, J., Sahoo, D., Rossi, D. J. et al.: Gene expression commons: an open platform for absolute gene expression profiling. PLoS One, 7, 1-11 (2012)[PubMed]
- Hosen, N., Yamane, T., Muijtjens, M. et al.: Bmi-1-green fluorescent protein-knock-in mice reveal the dynamic regulation of bmi-1 expression in normal and leukemic hematopoietic cells. Stem Cells, 25, 1635-1644 (2007)[PubMed]
- Kiel, M. J., Yilmaz, O. H., Iwashita, T. et al.: SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell, 121, 1109-1121 (2005)[PubMed]
- Oguro, H., Ding, L. & Morrison, S. J.: SLAM family markers resolve functionally distinct subpopulations of hematopoietic stem cells and multipotent progenitors. Cell Stem Cell, 13, 102-116 (2013)[PubMed]
- Yamamoto, R., Morita, Y., Ooehara, J. et al.: Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell, 154, 1112-1126 (2013)[PubMed] [新着論文レビュー]
- Fathman, J. W., Fernhoff, N. B., Seita, J. et al.: Upregulation of CD11A on hematopoietic stem cells denotes the loss of long-term reconstitution potential. Stem Cell Reports, 3, 707-715 (2014)[PubMed]
- Morrison, S. J. & Scadden, D. T.: The bone marrow niche for haematopoietic stem cells. Nature, 505, 327-334 (2014)[PubMed]
- Susaki, E. A., Tainaka, K., Perrin, D. et al.: Whole-brain imaging with single-cell resolution using chemical cocktails and computational analysis. Cell, 157, 726-739 (2014)[PubMed]
著者プロフィール
略歴:2009年 京都大学大学院医学研究科博士課程 修了,2011年より米国Stanford大学School of Medicine博士研究員.
研究テーマ:造血幹細胞.
関心事:造血幹細胞の分子機構の解明.
James Y. Chen
米国Stanford大学School of Medicine大学院在学中.
Irving L. Weissman
米国Stanford大学School of Medicine教授.
© 2016 宮西正憲・James Y. Chen・Irving L. Weissman Licensed under CC 表示 2.1 日本