細菌Francisella novicidaに由来するCas9の結晶構造および機能の改変
平野央人・西増弘志・濡木 理
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:平野央人,西増弘志,濡木 理
DOI: 10.7875/first.author.2016.018
Structure and engineering of Francisella novicida Cas9.
Hisato Hirano, Jonathan S. Gootenberg, Takuro, Horii, Omar O. Abudayyeh, Mika Kimura, Patrick D. Hsu, Takanori Nakane, Ryuichiro Ishitani, Izuho Hatada, Feng Zhang, Hiroshi Nishimasu, Osamu Nureki
Cell, 164, 950-961 (2016)
原核生物のもつRNA依存性DNAエンドヌクレアーゼであるCas9は,ゲノムDNAを配列に特異的に切断できることから革新的なゲノム編集のツールとして広く利用されている.しかし,Cas9によるDNAの切断には標的となる配列の近傍にPAMとよばれる特定の塩基配列が必要なため,標的とすることのできる配列に制約が存在するという問題点が残されていた.今回,筆者らは,グラム陰性細菌Francisella novicidaに由来するCas9,ガイドRNA,標的となる2本鎖DNAからなる複合体の結晶構造を決定し,その作動機構を解明した.F. novicidaに由来するCas9と構造が既知のCas9との比較から,Cas9の作動機構における共通性および多様性が明らかにされた.さらに,立体構造にもとづきF. novicidaに由来するCas9のPAMに対する特異性を改変することに成功した.
Cas9は原核生物のCRISPR-Cas獲得免疫機構(CRISPR:clustered regularly interspaced short palindromic repeat,Cas:CRISPR-associated protein)に関与するRNA依存性DNAエンドヌクレアーゼである1).Cas9はcrRNA(CRISPR RNA)およびtracrRNA(trans-activating crRNA)とよばれる2種類のガイドRNAと複合体を形成し,crRNAのガイド配列に相補的な2本鎖DNAを切断する.crRNAとtracrRNAとを人工的に接続したsgRNA(single-guide RNA)も同様に機能する.DNAの切断にはガイド配列と標的となる配列とのあいだの相補性にくわえ,標的配列の近傍にPAM(protospacer adjacent motif)とよばれる特定の塩基配列が存在することが必要である.ガイド配列は任意に変更することができるため,Cas9は革新的なゲノム編集のツールとして瞬く間に普及した2).しかし,標的とすることのできる配列がPAMにより制限されるという課題が残されていた.
異なる生物種に由来するCas9およびガイドRNAには多様性があり,Cas9は特定のガイドRNAとのみ複合体を形成し機能する3,4)(これは,直交性とよばれる).Cas9の認識するPAMの塩基配列も異なる.たとえば,現在,ゲノム編集に広く利用されているStreptococcus pyogenesに由来するCas9はPAMとして5’-NGG-3’(Nは任意の塩基)を認識する一方,Staphylococcus aureusに由来する小型のCas9は5’-NNGRRT-3’(RはAあるいはG)を認識する5).近年,S. pyogenesに由来するCas9およびS. aureusに由来するCas9の結晶構造が決定され,Cas9はRECローブ(RECサブドメインから構成される)とNUCローブ(RuvCドメイン,HNHドメイン,WEDドメイン,PIドメインから構成される)からなり,PAMはPIドメインにより認識されることなどが明らかにされた6-8)(文献7) は,新着論文レビュー でも掲載.文献8) は,新着論文レビュー でも掲載).さらに,立体構造にもとづき,Cas9を利用した転写活性化ツールや誘導型Cas9,高精度Cas9などの新規のツールが開発されている.しかし,PAMにより標的となる配列が制約されるという応用上の問題点は解決されておらず,また,CRISPR-Cas9機構の多様性も完全には解明されていない.
この研究においては,グラム陰性細菌Francisella novicidaに由来するCas9に着目した.F. novicidaに由来するCas9はオーソログのうち最大のもののひとつであり,1629残基からなる(S. pyogenesに由来するCas9は,1368残基からなる).F. novicidaに由来するCas9の認識するPAMの塩基配列は決定されておらず,その作動機構は不明であった.さらに,F. novicidaに由来するCas9を利用したゲノム編集の成功例は報告されておらず,このCas9がゲノム編集に応用できるかどうかは不明だった.
in vitroにおけるDNA切断実験の結果,F. novicidaに由来するCas9はPAMとして5’-NGG-3’を認識し,5’-NGA-3’も弱く認識することが明らかにされた.さらに,F. novicidaに由来するCas9とガイドRNAとの複合体をマウスの受精卵に注入することにより,PAMとして5’-TGR-3’をもつ標的配列のゲノム編集に成功した.以上の結果から,F. novicidaに由来するCas9を用いて,PAMとして5’-NGR-3’をもつ標的配列のゲノム編集が可能であることが示唆された.
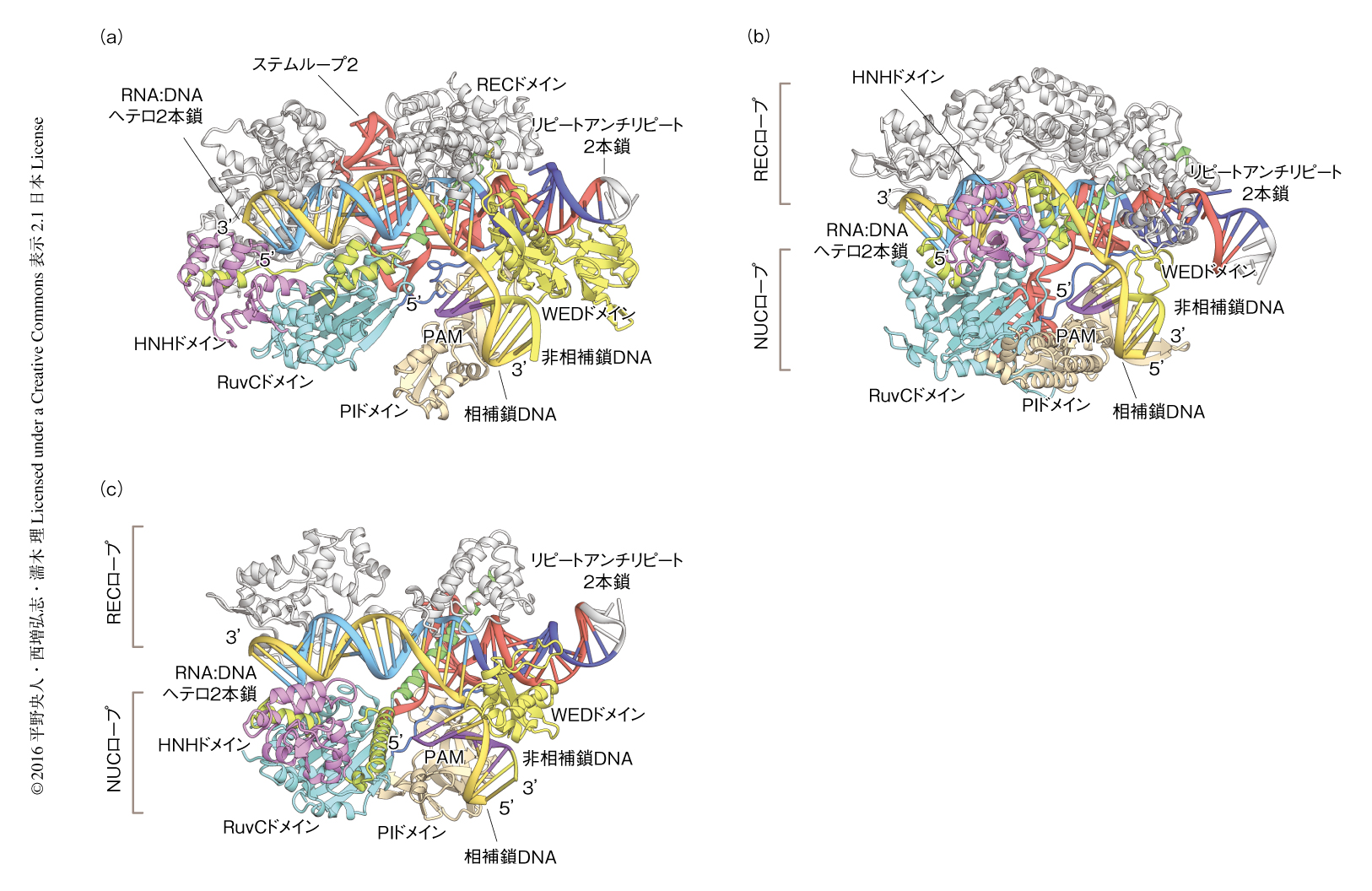
F. novicidaに由来するCas9によるDNAの切断機構を解明するため,F. novicidaに由来するCas9(1~1629残基),sgRNA(94塩基),相補鎖DNA(30塩基),PAM(5’-TGG-3’あるいは5’-TGA-3’)を含む非相補鎖DNA(9塩基)からなる複合体の結晶構造を1.7Å分解能で決定した(PDB ID:5B2O,5B2P)(図1a).F. novicidaに由来するCas9はRuvCドメイン,RECドメイン,HNHドメイン,WEDドメイン,PIドメインの5つのドメイン(RECドメインはREC1~REC3のサブドメインに分けられる)から構成されており,RuvCドメインとRECドメインはブリッジヘリックスにより連結されていた.RuvCドメインおよびHNHドメインはS. pyogenesに由来するCas9やS. aureusに由来するCas9と類似した構造をもつ一方,RECドメインおよびWEDドメインは新規のフォールドをもちガイドRNAと標的DNAの認識に関与していた.
F. novicidaに由来するCas9において,sgRNAのガイド配列は相補鎖DNAとRNA:DNAヘテロ2本鎖を形成し,RuvCドメインとRECドメインのあいだに収容されていた.PAMを含む2本鎖DNAはWEDドメインとPIドメインにより形成される溝に結合していた.sgRNAのガイド配列以外の領域はリピート:アンチリピート2本鎖,ステムループ1,ステムループ2を形成し,おもにRECドメインおよびWEDドメインにより認識されていた.
F. novicidaに由来するCas9において,RNA:DNAヘテロ2本鎖は,その糖-リン酸骨格とブリッジヘリックスおよびRECドメインとのあいだの相互作用を介して配列に非依存的に認識されていた.この構造的な特徴から,F. novicidaに由来するCas9がガイドRNAに依存的に任意のDNA配列を認識できる性質が説明された.とくに,PAMの近傍の約8塩基からなるシード領域はブリッジヘリックスのArgやHisにより強固に認識されていた.これは,シード領域のRNA:DNA塩基対合がDNAの切断に重要であるという結果と一致した9).リピート:アンチリピート2本鎖,ステムループ1,ステムループ2はRECドメインおよびWEDドメインにより特異的に認識されていた.
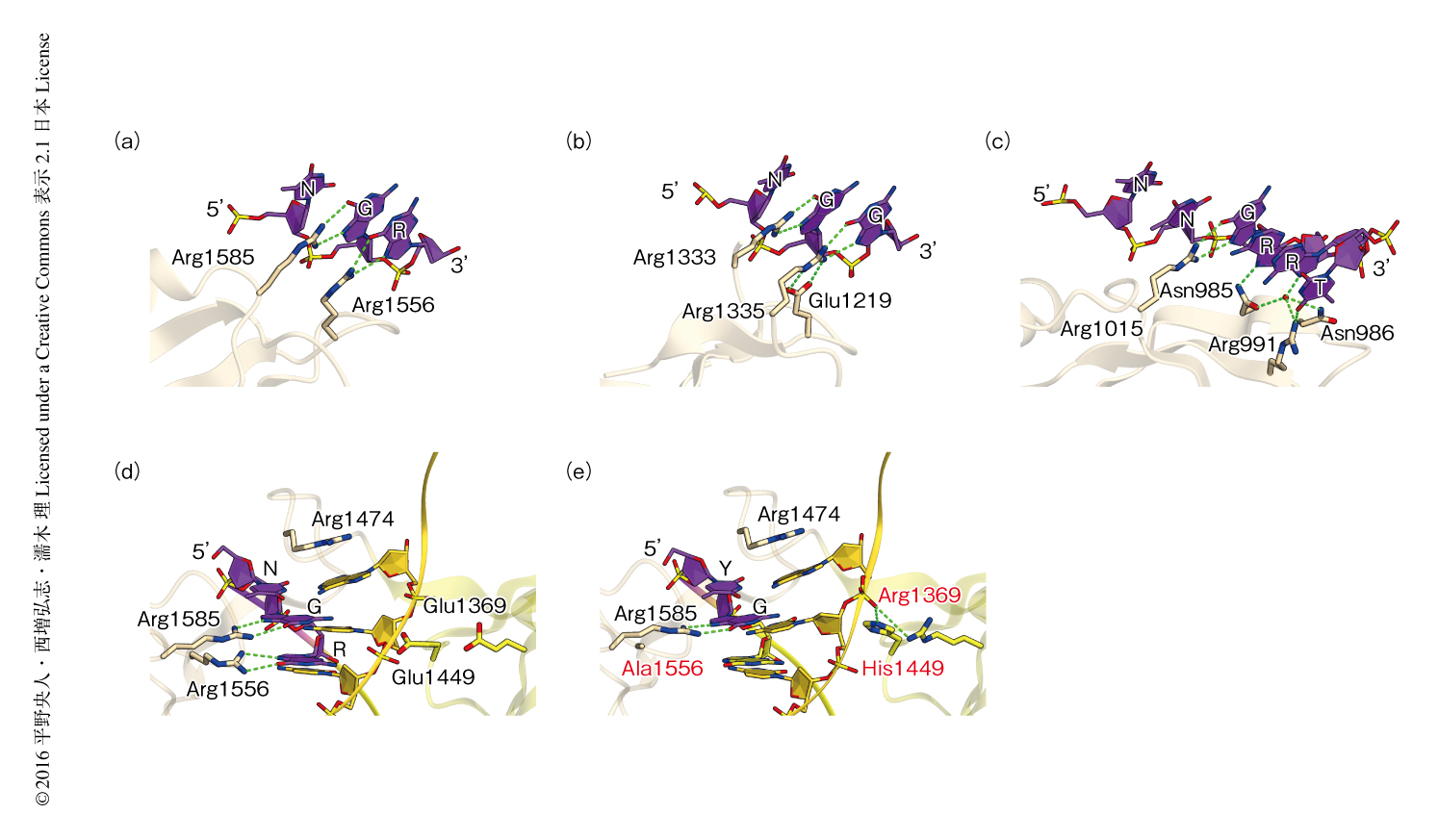
F. novicidaに由来するCas9において,PAM(5’-TGG-3’あるいは5’-TGA-3’)はPIドメインにより認識されていた(図2a).1文字目のTはCas9とは相互作用していなかった一方,2文字目のGはArg1585と2本の水素結合を形成していた.このことから,F. novicidaに由来するCas9のPAMの1文字目,2文字目がそれぞれN,Gであることが説明された.PAMとして5’-TGG-3’をもつ標的2本鎖DNAを含む複合体において3文字目のGはArg1556と2本の水素結合を形成していた一方,PAMとして5’-TGA-3’をもつ標的2本鎖DNAを含む複合体において3文字目のAはArg1556と1本の水素結合を形成していた.これらの構造の違いから,GよりAを好むというPAMの3文字目の嗜好性が説明された.以上の構造的な特徴から,F. novicidaに由来するCas9によるPAMの認識機構が明らかにされた.
S. pyogenesに由来するCas9(図1b,PDB ID:4UN3),S. aureusに由来するCas9(図1c,PDB ID:5CZZ),F. novicidaに由来するCas9(図1a,PDB ID:5B2O)の結晶構造の比較から,CRISPR-Cas9機構における予想以上の多様性が明らかにされた.S. pyogenesに由来するCas9およびS. aureusに由来するCas9において,RuvCドメインとPIドメインはNUCローブを形成し,sgRNAのステムループを認識していた.それに対し,F. novicidaに由来するCas9においてはRuvCドメインとPIドメインは相互作用せず,sgRNAのステムループはRECドメインにより認識されていた.さらに,S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9のRECドメインおよびWEDドメインは異なる構造をもち,sgRNAのリピート:アンチリピート2本鎖をそれぞれ特異的に認識していた.これらの構造の違いはCas9とガイドRNAのあいだの直交性の決定に大きく貢献していた.
S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9のPIドメインは7本のβシートからなる共通のフォールドをもつ一方,異なるアミノ酸残基を用いてそれぞれ異なるPAMを認識していた.F. novicidaに由来するCas9とは異なり,S. pyogenesに由来するCas9はArg1333およびArg1335を用いて5’-NGG-3’を認識する一方(図2b),S. aureusに由来するCas9はAsn985,Asn986,Arg991,Arg1015を用いて5’-NNGRRT-3’を認識していた(図2c).S. pyogenesに由来するCas9のArg1335はGlu1219により固定されることによりPAMの3文字目のGを特異的に認識していたのに対し,F. novicidaに由来するCas9のArg1556は周辺のアミノ酸残基と相互作用せずにPAMの3文字目のRを認識していた.これらの構造の違いから,S. pyogenesに由来するCas9とF. novicidaに由来するCas9のPAMに対する特異性の違いが説明された.
さらに,S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9において,RNA:DNAヘテロ2本鎖はRECドメインとRuvCドメインのあいだに収容されており,RuvCドメインおよびHNHドメインの触媒残基は高度に保存されていた.したがって,DNAの切断機構はCRISPR-Cas9機構において保存されていることが明らかにされた.
F. novicidaに由来するCas9が標的とすることのできる配列を拡張するため,構造情報を利用してPAMに対する特異性の改変を試みた.5’-NGR-3’の3文字目のRを認識するArg1556をAlaに置換し,この置換による相互作用の損失を2本鎖DNAの糖-リン酸骨格とのあいだの新たな相互作用により補填することにより,PAMに対する特異性を5’-NGR-3’から5’-NG-3’へと改変できるのではないかと仮定した.F. novicidaに由来するCas9の複数の変異体を作製しDNA切断活性を評価したところ,野生型のCas9とは異なり,Glu1369をArg,Glu1449をHis,Arg1556をAlaと置換した変異体はPAMとして5’-TGN-3’をもつ標的DNAを切断した.さらに,マウスの受精卵において,この改変型のCas9を用いることによりPAMとして5’-TGN-3’をもつ標的配列のゲノム編集に成功した.これらの結果から,この改変型Cas9はPAMとして5’-NG-3’を認識すると考えられた.しかし,次世代シークエンサーを用いてPAMの塩基配列を網羅的に調べたところ,この改変型Cas9は5’-NG-3’ではなく5’-YG-3’をPAMとして認識することが明らかにされた.
そこで,改変型Cas9によるPAMの認識機構を明らかにするため,改変型Cas9,sgRNA,相補鎖DNA,PAMとして5’-TGG-3’を含む非相補鎖DNAからなる複合体の結晶構造を1.7Å分解能で決定した(PDB ID:5B2Q).予想されたように,Arg1556のAlaへの置換によりPAMの3文字目の認識が消失し,Arg1369およびHis1449は2本鎖DNAのリン酸基と相互作用していた(図2 d,e).PAMの1文字目のTはCas9と相互作用していない一方,相補鎖のAはArg1474とスタッキング相互作用を形成していた.Arg1474はピリミジン塩基よりも大きなプリン塩基と効率的に相互作用することから,PAMの1文字目のYに対する嗜好性が説明された.野生型のCas9においてもArg1474は同様の相互作用を形成していたが,野生型Cas9はPAMの1文字目の要求性を示さなかった.これらの結果から,Arg1369およびHis1449と2本鎖DNAとのあいだの新たな相互作用は,失われたArg1556とPAMの3文字目のRとのあいだの相互作用を完全に補填することができなかったため,改変型Cas9においてPAMの1文字目のYに対する要求性が生じたと考えられた.
今回,F. novicidaに由来するCas9,sgRNA,標的2本鎖DNAからなる複合体の結晶構造を決定し,S. pyogenesに由来するCas9およびS. aureusに由来するCas9の結晶構造と比較することにより,CRISPR-Cas9機構に関する詳細な知見が得られた.今回,得られた知見は,今後の応用研究においても重要な基盤となることが期待される.さらに,この研究において,立体構造にもとづいたCas9のPAMに対する特異性の改変に世界ではじめて成功した.最近,米国の研究グループにより,分子進化的な手法を用いたPAMに対する特異性の改変が報告された10).今後,これら2つの手法を組み合わせることにより,PAMに対する特異性のさらなる改変が可能になるもしれない.
略歴:東京大学大学院理学系研究科修士課程 在学中.
研究テーマ:CRISPR-Cas9機構の構造解析.
抱負:おもしろい研究がしたい.
西増 弘志(Hiroshi Nishimasu)
東京大学大学院理学系研究科 助教.科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:CRISPR-Cas9機構,RNAサイレンシング.
抱負:実験もしたい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2016 平野央人・西増弘志・濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物科学専攻生物化学講座構造生命科学研究室)
email:平野央人,西増弘志,濡木 理
DOI: 10.7875/first.author.2016.018
Structure and engineering of Francisella novicida Cas9.
Hisato Hirano, Jonathan S. Gootenberg, Takuro, Horii, Omar O. Abudayyeh, Mika Kimura, Patrick D. Hsu, Takanori Nakane, Ryuichiro Ishitani, Izuho Hatada, Feng Zhang, Hiroshi Nishimasu, Osamu Nureki
Cell, 164, 950-961 (2016)
要 約
原核生物のもつRNA依存性DNAエンドヌクレアーゼであるCas9は,ゲノムDNAを配列に特異的に切断できることから革新的なゲノム編集のツールとして広く利用されている.しかし,Cas9によるDNAの切断には標的となる配列の近傍にPAMとよばれる特定の塩基配列が必要なため,標的とすることのできる配列に制約が存在するという問題点が残されていた.今回,筆者らは,グラム陰性細菌Francisella novicidaに由来するCas9,ガイドRNA,標的となる2本鎖DNAからなる複合体の結晶構造を決定し,その作動機構を解明した.F. novicidaに由来するCas9と構造が既知のCas9との比較から,Cas9の作動機構における共通性および多様性が明らかにされた.さらに,立体構造にもとづきF. novicidaに由来するCas9のPAMに対する特異性を改変することに成功した.
はじめに
Cas9は原核生物のCRISPR-Cas獲得免疫機構(CRISPR:clustered regularly interspaced short palindromic repeat,Cas:CRISPR-associated protein)に関与するRNA依存性DNAエンドヌクレアーゼである1).Cas9はcrRNA(CRISPR RNA)およびtracrRNA(trans-activating crRNA)とよばれる2種類のガイドRNAと複合体を形成し,crRNAのガイド配列に相補的な2本鎖DNAを切断する.crRNAとtracrRNAとを人工的に接続したsgRNA(single-guide RNA)も同様に機能する.DNAの切断にはガイド配列と標的となる配列とのあいだの相補性にくわえ,標的配列の近傍にPAM(protospacer adjacent motif)とよばれる特定の塩基配列が存在することが必要である.ガイド配列は任意に変更することができるため,Cas9は革新的なゲノム編集のツールとして瞬く間に普及した2).しかし,標的とすることのできる配列がPAMにより制限されるという課題が残されていた.
異なる生物種に由来するCas9およびガイドRNAには多様性があり,Cas9は特定のガイドRNAとのみ複合体を形成し機能する3,4)(これは,直交性とよばれる).Cas9の認識するPAMの塩基配列も異なる.たとえば,現在,ゲノム編集に広く利用されているStreptococcus pyogenesに由来するCas9はPAMとして5’-NGG-3’(Nは任意の塩基)を認識する一方,Staphylococcus aureusに由来する小型のCas9は5’-NNGRRT-3’(RはAあるいはG)を認識する5).近年,S. pyogenesに由来するCas9およびS. aureusに由来するCas9の結晶構造が決定され,Cas9はRECローブ(RECサブドメインから構成される)とNUCローブ(RuvCドメイン,HNHドメイン,WEDドメイン,PIドメインから構成される)からなり,PAMはPIドメインにより認識されることなどが明らかにされた6-8)(文献7) は,新着論文レビュー でも掲載.文献8) は,新着論文レビュー でも掲載).さらに,立体構造にもとづき,Cas9を利用した転写活性化ツールや誘導型Cas9,高精度Cas9などの新規のツールが開発されている.しかし,PAMにより標的となる配列が制約されるという応用上の問題点は解決されておらず,また,CRISPR-Cas9機構の多様性も完全には解明されていない.
この研究においては,グラム陰性細菌Francisella novicidaに由来するCas9に着目した.F. novicidaに由来するCas9はオーソログのうち最大のもののひとつであり,1629残基からなる(S. pyogenesに由来するCas9は,1368残基からなる).F. novicidaに由来するCas9の認識するPAMの塩基配列は決定されておらず,その作動機構は不明であった.さらに,F. novicidaに由来するCas9を利用したゲノム編集の成功例は報告されておらず,このCas9がゲノム編集に応用できるかどうかは不明だった.
1.F. novicidaに由来するCas9の認識するPAMの塩基配列
in vitroにおけるDNA切断実験の結果,F. novicidaに由来するCas9はPAMとして5’-NGG-3’を認識し,5’-NGA-3’も弱く認識することが明らかにされた.さらに,F. novicidaに由来するCas9とガイドRNAとの複合体をマウスの受精卵に注入することにより,PAMとして5’-TGR-3’をもつ標的配列のゲノム編集に成功した.以上の結果から,F. novicidaに由来するCas9を用いて,PAMとして5’-NGR-3’をもつ標的配列のゲノム編集が可能であることが示唆された.
2.F. novicidaに由来するCas9,sgRNA,標的2本鎖DNAからなる複合体の結晶構造
F. novicidaに由来するCas9によるDNAの切断機構を解明するため,F. novicidaに由来するCas9(1~1629残基),sgRNA(94塩基),相補鎖DNA(30塩基),PAM(5’-TGG-3’あるいは5’-TGA-3’)を含む非相補鎖DNA(9塩基)からなる複合体の結晶構造を1.7Å分解能で決定した(PDB ID:5B2O,5B2P)(図1a).F. novicidaに由来するCas9はRuvCドメイン,RECドメイン,HNHドメイン,WEDドメイン,PIドメインの5つのドメイン(RECドメインはREC1~REC3のサブドメインに分けられる)から構成されており,RuvCドメインとRECドメインはブリッジヘリックスにより連結されていた.RuvCドメインおよびHNHドメインはS. pyogenesに由来するCas9やS. aureusに由来するCas9と類似した構造をもつ一方,RECドメインおよびWEDドメインは新規のフォールドをもちガイドRNAと標的DNAの認識に関与していた.
F. novicidaに由来するCas9において,sgRNAのガイド配列は相補鎖DNAとRNA:DNAヘテロ2本鎖を形成し,RuvCドメインとRECドメインのあいだに収容されていた.PAMを含む2本鎖DNAはWEDドメインとPIドメインにより形成される溝に結合していた.sgRNAのガイド配列以外の領域はリピート:アンチリピート2本鎖,ステムループ1,ステムループ2を形成し,おもにRECドメインおよびWEDドメインにより認識されていた.
3.F. novicidaに由来するCas9のRNAに依存的なDNAの認識機構
F. novicidaに由来するCas9において,RNA:DNAヘテロ2本鎖は,その糖-リン酸骨格とブリッジヘリックスおよびRECドメインとのあいだの相互作用を介して配列に非依存的に認識されていた.この構造的な特徴から,F. novicidaに由来するCas9がガイドRNAに依存的に任意のDNA配列を認識できる性質が説明された.とくに,PAMの近傍の約8塩基からなるシード領域はブリッジヘリックスのArgやHisにより強固に認識されていた.これは,シード領域のRNA:DNA塩基対合がDNAの切断に重要であるという結果と一致した9).リピート:アンチリピート2本鎖,ステムループ1,ステムループ2はRECドメインおよびWEDドメインにより特異的に認識されていた.
4.F. novicidaに由来するCas9のPAMの認識機構
F. novicidaに由来するCas9において,PAM(5’-TGG-3’あるいは5’-TGA-3’)はPIドメインにより認識されていた(図2a).1文字目のTはCas9とは相互作用していなかった一方,2文字目のGはArg1585と2本の水素結合を形成していた.このことから,F. novicidaに由来するCas9のPAMの1文字目,2文字目がそれぞれN,Gであることが説明された.PAMとして5’-TGG-3’をもつ標的2本鎖DNAを含む複合体において3文字目のGはArg1556と2本の水素結合を形成していた一方,PAMとして5’-TGA-3’をもつ標的2本鎖DNAを含む複合体において3文字目のAはArg1556と1本の水素結合を形成していた.これらの構造の違いから,GよりAを好むというPAMの3文字目の嗜好性が説明された.以上の構造的な特徴から,F. novicidaに由来するCas9によるPAMの認識機構が明らかにされた.
5.CRISPR-Cas9機構の多様性および共通性
S. pyogenesに由来するCas9(図1b,PDB ID:4UN3),S. aureusに由来するCas9(図1c,PDB ID:5CZZ),F. novicidaに由来するCas9(図1a,PDB ID:5B2O)の結晶構造の比較から,CRISPR-Cas9機構における予想以上の多様性が明らかにされた.S. pyogenesに由来するCas9およびS. aureusに由来するCas9において,RuvCドメインとPIドメインはNUCローブを形成し,sgRNAのステムループを認識していた.それに対し,F. novicidaに由来するCas9においてはRuvCドメインとPIドメインは相互作用せず,sgRNAのステムループはRECドメインにより認識されていた.さらに,S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9のRECドメインおよびWEDドメインは異なる構造をもち,sgRNAのリピート:アンチリピート2本鎖をそれぞれ特異的に認識していた.これらの構造の違いはCas9とガイドRNAのあいだの直交性の決定に大きく貢献していた.
S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9のPIドメインは7本のβシートからなる共通のフォールドをもつ一方,異なるアミノ酸残基を用いてそれぞれ異なるPAMを認識していた.F. novicidaに由来するCas9とは異なり,S. pyogenesに由来するCas9はArg1333およびArg1335を用いて5’-NGG-3’を認識する一方(図2b),S. aureusに由来するCas9はAsn985,Asn986,Arg991,Arg1015を用いて5’-NNGRRT-3’を認識していた(図2c).S. pyogenesに由来するCas9のArg1335はGlu1219により固定されることによりPAMの3文字目のGを特異的に認識していたのに対し,F. novicidaに由来するCas9のArg1556は周辺のアミノ酸残基と相互作用せずにPAMの3文字目のRを認識していた.これらの構造の違いから,S. pyogenesに由来するCas9とF. novicidaに由来するCas9のPAMに対する特異性の違いが説明された.
さらに,S. pyogenesに由来するCas9,S. aureusに由来するCas9,F. novicidaに由来するCas9において,RNA:DNAヘテロ2本鎖はRECドメインとRuvCドメインのあいだに収容されており,RuvCドメインおよびHNHドメインの触媒残基は高度に保存されていた.したがって,DNAの切断機構はCRISPR-Cas9機構において保存されていることが明らかにされた.
6.Cas9のPAMに対する特異性の改変
F. novicidaに由来するCas9が標的とすることのできる配列を拡張するため,構造情報を利用してPAMに対する特異性の改変を試みた.5’-NGR-3’の3文字目のRを認識するArg1556をAlaに置換し,この置換による相互作用の損失を2本鎖DNAの糖-リン酸骨格とのあいだの新たな相互作用により補填することにより,PAMに対する特異性を5’-NGR-3’から5’-NG-3’へと改変できるのではないかと仮定した.F. novicidaに由来するCas9の複数の変異体を作製しDNA切断活性を評価したところ,野生型のCas9とは異なり,Glu1369をArg,Glu1449をHis,Arg1556をAlaと置換した変異体はPAMとして5’-TGN-3’をもつ標的DNAを切断した.さらに,マウスの受精卵において,この改変型のCas9を用いることによりPAMとして5’-TGN-3’をもつ標的配列のゲノム編集に成功した.これらの結果から,この改変型Cas9はPAMとして5’-NG-3’を認識すると考えられた.しかし,次世代シークエンサーを用いてPAMの塩基配列を網羅的に調べたところ,この改変型Cas9は5’-NG-3’ではなく5’-YG-3’をPAMとして認識することが明らかにされた.
そこで,改変型Cas9によるPAMの認識機構を明らかにするため,改変型Cas9,sgRNA,相補鎖DNA,PAMとして5’-TGG-3’を含む非相補鎖DNAからなる複合体の結晶構造を1.7Å分解能で決定した(PDB ID:5B2Q).予想されたように,Arg1556のAlaへの置換によりPAMの3文字目の認識が消失し,Arg1369およびHis1449は2本鎖DNAのリン酸基と相互作用していた(図2 d,e).PAMの1文字目のTはCas9と相互作用していない一方,相補鎖のAはArg1474とスタッキング相互作用を形成していた.Arg1474はピリミジン塩基よりも大きなプリン塩基と効率的に相互作用することから,PAMの1文字目のYに対する嗜好性が説明された.野生型のCas9においてもArg1474は同様の相互作用を形成していたが,野生型Cas9はPAMの1文字目の要求性を示さなかった.これらの結果から,Arg1369およびHis1449と2本鎖DNAとのあいだの新たな相互作用は,失われたArg1556とPAMの3文字目のRとのあいだの相互作用を完全に補填することができなかったため,改変型Cas9においてPAMの1文字目のYに対する要求性が生じたと考えられた.
おわりに
今回,F. novicidaに由来するCas9,sgRNA,標的2本鎖DNAからなる複合体の結晶構造を決定し,S. pyogenesに由来するCas9およびS. aureusに由来するCas9の結晶構造と比較することにより,CRISPR-Cas9機構に関する詳細な知見が得られた.今回,得られた知見は,今後の応用研究においても重要な基盤となることが期待される.さらに,この研究において,立体構造にもとづいたCas9のPAMに対する特異性の改変に世界ではじめて成功した.最近,米国の研究グループにより,分子進化的な手法を用いたPAMに対する特異性の改変が報告された10).今後,これら2つの手法を組み合わせることにより,PAMに対する特異性のさらなる改変が可能になるもしれない.
文 献
- Jinek, M., Chylinski, K., Fonfara, I. et al.: A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 337, 816-821 (2012)[PubMed]
- Cong, L., Ran, F. A., Cox, D. et al.: Multiplex genome engineering using CRISPR/Cas systems. Science, 339, 819-823 (2013)[PubMed]
- Chylinski, K., Le Rhun, A. & Charpentier, E.: The tracrRNA and Cas9 families of type II CRISPR-Cas immunity systems. RNA Biol., 10, 726-737 (2013)[PubMed]
- Fonfara, I., Le Rhun, A., Chylinski, K. et al.: Phylogeny of Cas9 determines functional exchangeability of dual-RNA and Cas9 among orthologous type II CRISPR-Cas systems. Nucleic Acids Res., 42, 2577-2590 (2014)[PubMed]
- Ran, F. A., Cong, L., Yan, W. X. et al.: In vivo genome editing using Staphylococcus aureus Cas9. Nature, 520, 186-191 (2015)[PubMed]
- Anders, C., Niewoehner, O., Duerst, A. et al.: Structural basis of PAM-dependent target DNA recognition by the Cas9 endonuclease. Nature, 513, 569-573 (2014)[PubMed]
- Nishimasu, H., Ran, F. A., Hsu, P. D. et al.: Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell, 156, 935-949 (2014)[PubMed] [新着論文レビュー]
- Nishimasu, H., Cong, L., Yan, W. X. et al.: Crystal structure of Staphylococcus aureus Cas9. Cell, 162, 1113-1126 (2015)[PubMed] [新着論文レビュー]
- Hsu, P. D., Scott, D. A., Weinstein, J. A. et al.: DNA targeting specificity of RNA-guided Cas9 nucleases. Nat. Biotechnol., 31, 827-832 (2013)[PubMed]
- Kleinstiver, B. P., Prew, M. S., Tsai, S. Q. et al.: Engineered CRISPR-Cas9 nucleases with altered PAM specificities. Nature, 523, 481-485 (2015)[PubMed]
著者プロフィール
略歴:東京大学大学院理学系研究科修士課程 在学中.
研究テーマ:CRISPR-Cas9機構の構造解析.
抱負:おもしろい研究がしたい.
西増 弘志(Hiroshi Nishimasu)
東京大学大学院理学系研究科 助教.科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:CRISPR-Cas9機構,RNAサイレンシング.
抱負:実験もしたい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究室URL:http://www.nurekilab.net/
© 2016 平野央人・西増弘志・濡木 理 Licensed under CC 表示 2.1 日本