生化学的な再構成によりみえてきたコヒーシンとDNAとの結合反応および解離反応の機序
村山 泰斗
(英国The Francis Crick Institute,Lincoln’s Inn Fields Laboratory,Chromosome Segregation Laboratory)
email:村山泰斗
DOI: 10.7875/first.author.2016.004
DNA entry into and exit out of the cohesin ring by an interlocking gate mechanism.
Yasuto Murayama, Frank Uhlmann
Cell, 163, 1628-1640 (2015)
生物種のあいだで広く保存されるSMC複合体は染色体の動態の制御において必須の役割をはたす.SMC複合体はSMCサブユニットを中核とした巨大なリング状の構造をとり,リングの内側にとおすかたちでDNAと結合し機能すると考えられている.筆者らは,SMC複合体のひとつで姉妹染色体の接着において機能するコヒーシンとDNAとの結合反応および解離反応を必要最小単位で生化学的に再構成した.一連の解析から,コヒーシンとDNAとの結合および解離は質的に類似した反応であり,補助タンパク質によりそれぞれの反応の方向に誘導されていることが推察された.コヒーシンのSmc3サブユニットのもつ保存されたLysはDNAセンサーとして機能し,コヒーシンとDNAとの結合および解離に必須であった.Waplはヘッド部とScc1サブユニットとのあいだの結合を一時的に解離することによりコヒーシンのリングを開き,コヒーシンとDNAとの解離を促進していた.ローダー複合体はDNAセンサーが露出するようコヒーシンの構造変化を誘発し,コヒーシンとDNAとの結合の方向へと反応を誘導していると考えられた.これらの解析の結果は,SMC複合体とDNAとの結合反応および解離反応のモデルを提唱するとともに,コヒーシンの保存されたLysのアセチル化がいかにして姉妹染色体の接着の形成に寄与するのかを説明しうるものであった.
細胞が分裂し増殖するためには染色体の構造を時空間的に制御する必要がある.染色体はM期に凝縮しその正確な分配を担保する.また,G期においても染色体は機能的および構造的なコンパートメントを形成しており,それらは遺伝子の発現,複製,DNA修復の制御と密接にかかわっている.SMC複合体は細菌からヒトにいたるまで広く保存されており,染色体の構造の制御および分配において必須の役割をはたす1-3).
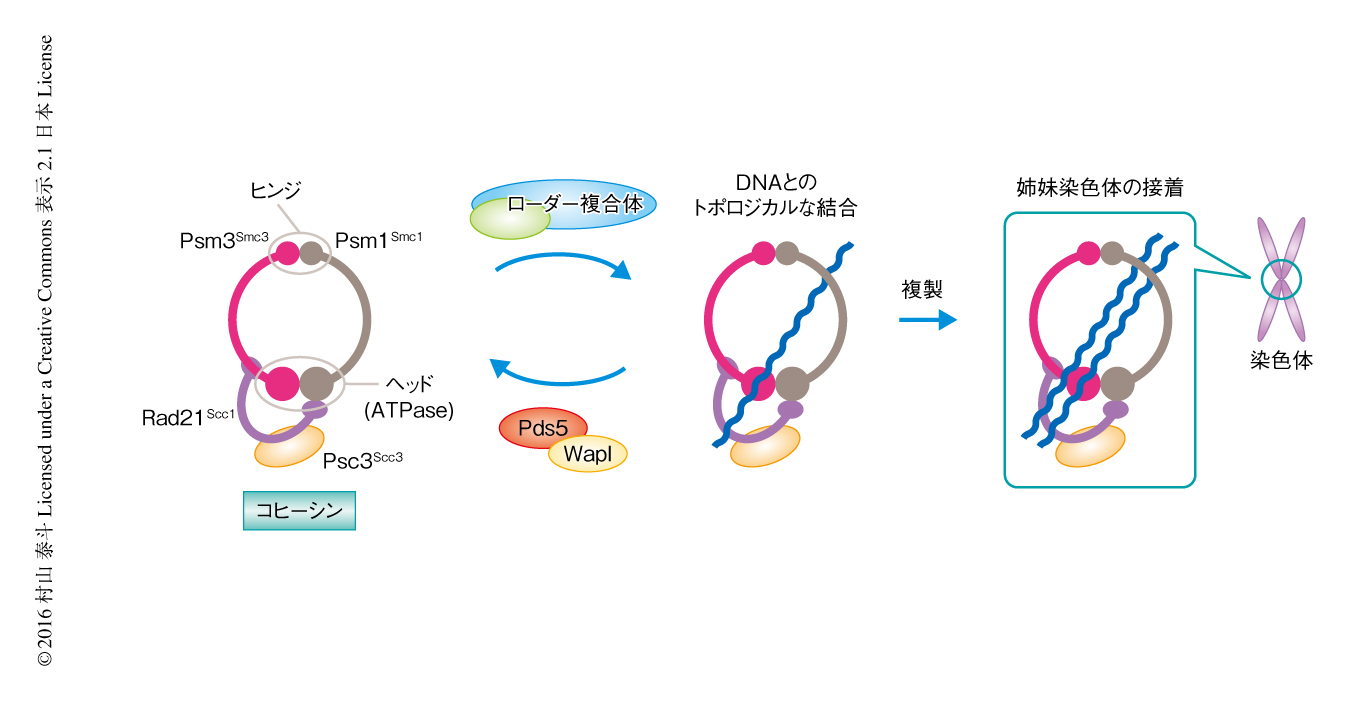
コヒーシンは真核生物のもつSMC複合体のひとつであり,姉妹染色体のあいだの接着を形成する本体として機能する1,3).ほかのSMC複合体と同様に,コヒーシンは長大な構造をしたSMCサブユニット,Smc1サブユニットおよびSmc3サブユニットからなるヘテロ二量体を中心としたリング構造をとる(図1).Smc1サブユニットとSmc3サブユニットはヒンジドメインを介して二量体化し,また,もう一方のヘッドドメインはATPase活性をもちATPとの結合に依存的に会合する.ヘッド部はScc1サブユニットにより架橋され安定したリング構造が形成される.さらに,Scc3サブユニット,Pds5サブユニット,WaplサブユニットがScc1サブユニットを介してヘッド部に結合する.
コヒーシンはそのリング構造の内側にとおすかたちでDNAと結合し,ゴムバンドのようにDNAを束ねて機能すると考えられている.このDNAとのトポロジカルな結合はコヒーシンの機能の中核であるが,その反応の機序は明らかにされていない.筆者らは,以前の研究により,分裂酵母のPsm1Smc1,Psm3Smc3,Rad21Scc1,Psc3Scc3からなるコヒーシン四量体,および,その補助タンパク質であるMis4Scc2およびSsl3Scc4からなるローダー複合体を用い,必要最小単位でコヒーシンとDNAとのトポロジカルな結合反応を再構成した4)(新着論文レビュー でも掲載).今回,この反応系にPds5およびWaplをくわえることにより,コヒーシンとDNAとの結合反応および解離反応を再構成した.この生化学的な解析により,コヒーシンとDNAとの結合反応および解離反応は質的に類似した反応であり,補助タンパク質がその最終的な方向づけをするという反応のモデルがみえてきた.
コヒーシンには非SMCサブユニットとしてPsc3Scc3,Pds5,Waplが存在するが,以前の解析により,Psc3Scc3がコヒーシンとDNAとの結合に必須であることがわかっていた4).残り2つのサブユニットの機能を解析するため,出芽酵母と大腸菌を使用した系においてPds5およびWaplを精製した.これまでの報告のとおり,Pds5とWaplは安定したヘテロ二量体を形成しコヒーシン四量体と物理的に相互作用した.Pds5は染色体においてコヒーシンと安定な複合体を形成すると考えられている5).ローダー複合体の存在のもとでの再構成反応において,Pds5はコヒーシンとDNAとのトポロジカルな結合反応を阻害した.これは,ローダー複合体とPds5がコヒーシンとの結合について競合するためと考えられた.このとき,同時にWaplをくわえるとこの阻害効果は打ち消された.これは,Waplがコヒーシン“ホロ”複合体とDNAとのトポロジカルな結合反応を促進することを意味した.
もともとWaplはコヒーシンとクロマチンとの解離を促進すると考えられていた6-8).そこで,再構成反応の条件を変えてコヒーシンとDNAとの解離反応を解析した.すると,Pds5とWaplの両方を添加するとコヒーシンとDNAがすみやかに解離した.すなわち,WaplはPds5と共役してコヒーシンとDNAとの解離を直接的に促進した.また,Pds5は自然に起こるコヒーシンとDNAとの解離を弱くではあるが抑制していた.おそらく,Pds5はコヒーシンと結合し,その結果としてDNAの解離を抑制することにより,コヒーシンのリングの安定化に寄与していると考えられた.
コヒーシンとDNAとのトポロジカルな結合反応にはコヒーシンのもつATPase活性が必須であった4).そこで,ATPの加水分解を阻害したところコヒーシンとDNAとの解離反応が阻害された.すなわち,ATPの加水分解はコヒーシンとDNAとの解離反応にも必要であった.また,コヒーシンとDNAとの結合反応にはPsc3Scc3が必須であった.コヒーシンとDNAとが結合したのちPsc3Scc3を除去したところ,Pds5およびWaplが存在してもコヒーシンとDNAとの解離はみられなかった.コヒーシンとDNAとの解離反応はATPの加水分解およびPsc3Scc3に依存していたことから,ローダー複合体により促進されるコヒーシンとDNAとの結合反応と非常に類似していると考えられた.
過去の知見により,コヒーシンはPsm3Smc3とRad21Scc1との結合を一時的に解離して染色体から解離すると予測されていた5).そこで,Waplがこの結合を直接に解離させるかどうか検討した.Rad21Scc1は,N末端側がPsm3Smc3のヘッドドメインの直近のコイルドコイル部と,C末端側がPsm1Smc1のヘッドドメインと結合し,N末端側とC末端側とのあいだはフレキシブルなリンカーになっている(図1).まず,Rad21Scc1のリンカー部にTEVプロテアーゼの認識配列を挿入したコヒーシンを作製した.このコヒーシンをPds5およびWaplと反応させたのち,TEVプロテアーゼによりRad21Scc1を切断し免疫沈降により回収した.もし,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を解離するのであれば,Rad21Scc1のN末端側はコヒーシンから解離するため免疫沈降により回収されないはずである.実際に,Pds5-Wapl複合体はATPに依存的にRad21Scc1のN末端側の解離を促進し,これは,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を直接に解離させる証左であった.この開環反応は加水分解されないATPアナログを添加しても同じ程度の効率で起こった.
Psm3Smc3のATPaseドメインはS期において保存されたLysがアセチル化される.このアセチル化は染色体におけるコヒーシンの安定化と関連し,姉妹染色体の接着の形成に必須である9).このアセチル化の意義について解析するため,アセチル化部位であるLys105およびLys106をGlnに置換したアセチル化模倣コヒーシン変異体を作製した.この置換は,細胞レベルにおいてアセチル化を模倣することが報告されている10).コヒーシンとDNAとの結合反応を解析したところ,野生型と比べ反応の効率がいちじるしく低下していた.つまり,このPsm3Smc3のもつ進化的に保存されたLysはコヒーシンとDNAとの結合反応において重要であった.
近年,DNAの修復に機能するSMCサブユニットであるRad50のヘッドドメインとDNAとの共結晶構造が報告されたが,Rad50のDNA結合部位は構造的にコヒーシンにおけるアセチル化部位に相当する部位であった.このことから,Psm3Smc3のもつ保存されたLysはDNAセンサーとして機能しうることが示唆された.この予想と一致して,DNAに依存的なコヒーシンのATPase活性はアセチル化模倣コヒーシン変異体においていちじるしく減弱していた.また,コヒーシンとDNAとの結合反応およびDNAに依存的なコヒーシンのATPase活性はともにPsm3Smc3のLys105およびLys106をGlnと置換することにより段階的に低下したことから,アセチル化の程度により段階的な制御が可能らしい.
Psm3Smc3のLys105をGlnと置換したコヒーシン変異体は弱いながらもDNAと結合したことから,コヒーシンとDNAとの解離反応におけるPsm3Smc3のLys105のアセチル化の効果について検討した.すると,このコヒーシン変異体は野生型のコヒーシンに比べ,Pds5-Wapl複合体によるコヒーシンとDNAとの解離に対し耐性を示した.以上の結果から,Psm3Smc3のLys105およびLys106はDNAセンサーとしてコヒーシンとDNAとの結合反応および解離反応において不可欠であり,そのアセチル化はDNAセンサーとしての機能を無効化しコヒーシンのリングが開かないようにする“鍵”として機能するのではないかと推察された.
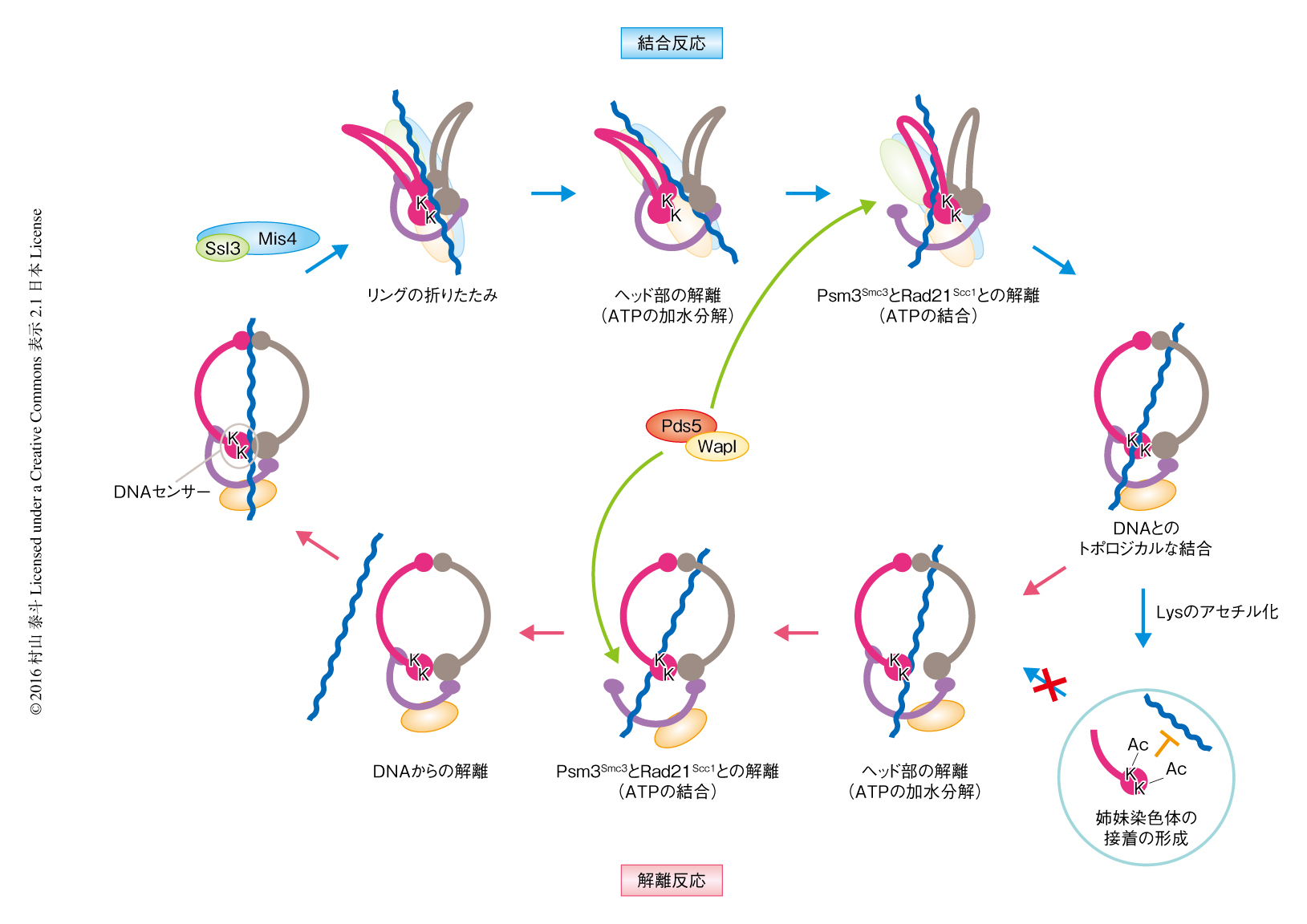
コヒーシンとDNAとの結合反応および解離反応は質的に非常に類似していた.すなわち,1)コヒーシンのもつATPase活性に依存的であること,2)Psc3Scc3が反応に必須であること,3)Psm3Smc3のもつ保存されたLys105およびLys106がDNAセンサーとして機能すること,である.これらをふまえ,コヒーシンとDNAとの動的な結合反応および解離反応の機序が推察された(図2).
コヒーシンのリングはヘッドドメインを境にして,SMCサブユニットの側の空間とヘッド部とRad21Scc1からなる空間とに分けることができ,DNAはSMCサブユニットの側の空間に収容されていると考えられた.コヒーシンとDNAとの解離反応において,DNAはDNAセンサーと接触することにより,ヘッド部におけるATPの加水分解を誘発する.これにより,ヘッドドメインどうしの結合が解離し,DNAがSMCサブユニットの側の空間からヘッド部とRad21Scc1からなる空間へと移動する.解離反応におけるATPase活性はこのDNAの移動に必要なのであろう.つぎに,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を解離させる.この開環にはATPの結合が必要であり,そのため,ヘッドドメインはふたたび結合する.これにより,開環しているPsm3Smc3とRad21Scc1との結合の方向にのみDNAを移動させることが可能になり,この一連の反応によりコヒーシンとDNAは解離する.
コヒーシンとDNAとの結合反応においても,DNAを通過させる素反応は基本的に解離反応と同じであると考えられる.すなわち,DNAはヘッドドメインどうしの結合を通過したのち,Psm3Smc3とRad21Scc1との結合を通過する.このとき,コヒーシンのリングが開いたままだとDNAセンサーとDNAとの接触が困難である.よって,コヒーシンとDNAとの結合反応においては,リングが折れ曲がるようにしてヘッド部とヒンジ部が結合しコヒーシンは大規模な構造変化を起こす.これによりDNAセンサーが露出し,コヒーシンとDNAとの一連の結合反応が開始する.ローダー複合体はこの構造変化を安定に保つことにより,解離反応と同じ素反応により結合反応を誘導するものと予想される.このようなSMCサブユニットの構造変化は原子間力顕微鏡を用いた解析において報告されている11).また,ローダー複合体はコヒーシンのヒンジ部とヘッド部にあるPsc3Scc3と結合することから,コヒーシンのリングを折りたたむような構造変化を促進している可能性が高い.
コヒーシンとDNAとの動的な結合反応および解離反応の再構成からみえてきたのは,結合反応と解離反応が質的に類似していたことであった.これまでの主要なモデルは,コヒーシンはヒンジドメインどうしの結合部位からDNAを導入し,Psm3Smc3とRad21Scc1との結合部位からDNAを放出するというものであった.この場合,結合反応と解離反応は質的に異なるものになると考えられ,同じ素反応により起こるとは考えにくい.また,反応の条件によっては,WaplはコヒーシンとDNAとの結合を促進していたが,このことは,DNAが同じ部位において出入りするという素反応は同じであり,コヒーシンの構造を変えることにより結合反応と解離反応の方向づけをしていると考えると説明がつく.コヒーシンとは別のSMC複合体であるコンデンシンにはローダー複合体にあたるものがみつかっておらず,非SMCサブユニットがSMC複合体と染色体との動的な結合を制御している.コンデンシンの場合も,最初にDNAと接触したときとDNAとトポロジカルに結合したときの構造の違いにより,同じ素反応により結合反応と解離反応の両方が起こると説明することができる.無論,今回の研究は,この結合反応と解離反応の統一モデルを完全に支持するものではない12).しかし,コヒーシン,ひいては,SMC複合体の作用機序を解明するにあたり,今回のモデルは十分に検討に値するだろう.
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,2010年 英国Cancer Research UK London Research Institute博士研究員を経て,2015年より東京工業大学大学院生命理工学研究科 助教.
研究テーマ:SMC複合体の機能.
© 2016 村山 泰斗 Licensed under CC 表示 2.1 日本
(英国The Francis Crick Institute,Lincoln’s Inn Fields Laboratory,Chromosome Segregation Laboratory)
email:村山泰斗
DOI: 10.7875/first.author.2016.004
DNA entry into and exit out of the cohesin ring by an interlocking gate mechanism.
Yasuto Murayama, Frank Uhlmann
Cell, 163, 1628-1640 (2015)
要 約
生物種のあいだで広く保存されるSMC複合体は染色体の動態の制御において必須の役割をはたす.SMC複合体はSMCサブユニットを中核とした巨大なリング状の構造をとり,リングの内側にとおすかたちでDNAと結合し機能すると考えられている.筆者らは,SMC複合体のひとつで姉妹染色体の接着において機能するコヒーシンとDNAとの結合反応および解離反応を必要最小単位で生化学的に再構成した.一連の解析から,コヒーシンとDNAとの結合および解離は質的に類似した反応であり,補助タンパク質によりそれぞれの反応の方向に誘導されていることが推察された.コヒーシンのSmc3サブユニットのもつ保存されたLysはDNAセンサーとして機能し,コヒーシンとDNAとの結合および解離に必須であった.Waplはヘッド部とScc1サブユニットとのあいだの結合を一時的に解離することによりコヒーシンのリングを開き,コヒーシンとDNAとの解離を促進していた.ローダー複合体はDNAセンサーが露出するようコヒーシンの構造変化を誘発し,コヒーシンとDNAとの結合の方向へと反応を誘導していると考えられた.これらの解析の結果は,SMC複合体とDNAとの結合反応および解離反応のモデルを提唱するとともに,コヒーシンの保存されたLysのアセチル化がいかにして姉妹染色体の接着の形成に寄与するのかを説明しうるものであった.
はじめに
細胞が分裂し増殖するためには染色体の構造を時空間的に制御する必要がある.染色体はM期に凝縮しその正確な分配を担保する.また,G期においても染色体は機能的および構造的なコンパートメントを形成しており,それらは遺伝子の発現,複製,DNA修復の制御と密接にかかわっている.SMC複合体は細菌からヒトにいたるまで広く保存されており,染色体の構造の制御および分配において必須の役割をはたす1-3).
コヒーシンは真核生物のもつSMC複合体のひとつであり,姉妹染色体のあいだの接着を形成する本体として機能する1,3).ほかのSMC複合体と同様に,コヒーシンは長大な構造をしたSMCサブユニット,Smc1サブユニットおよびSmc3サブユニットからなるヘテロ二量体を中心としたリング構造をとる(図1).Smc1サブユニットとSmc3サブユニットはヒンジドメインを介して二量体化し,また,もう一方のヘッドドメインはATPase活性をもちATPとの結合に依存的に会合する.ヘッド部はScc1サブユニットにより架橋され安定したリング構造が形成される.さらに,Scc3サブユニット,Pds5サブユニット,WaplサブユニットがScc1サブユニットを介してヘッド部に結合する.
コヒーシンはそのリング構造の内側にとおすかたちでDNAと結合し,ゴムバンドのようにDNAを束ねて機能すると考えられている.このDNAとのトポロジカルな結合はコヒーシンの機能の中核であるが,その反応の機序は明らかにされていない.筆者らは,以前の研究により,分裂酵母のPsm1Smc1,Psm3Smc3,Rad21Scc1,Psc3Scc3からなるコヒーシン四量体,および,その補助タンパク質であるMis4Scc2およびSsl3Scc4からなるローダー複合体を用い,必要最小単位でコヒーシンとDNAとのトポロジカルな結合反応を再構成した4)(新着論文レビュー でも掲載).今回,この反応系にPds5およびWaplをくわえることにより,コヒーシンとDNAとの結合反応および解離反応を再構成した.この生化学的な解析により,コヒーシンとDNAとの結合反応および解離反応は質的に類似した反応であり,補助タンパク質がその最終的な方向づけをするという反応のモデルがみえてきた.
1.WaplはコヒーシンとDNAとの結合を促進する
コヒーシンには非SMCサブユニットとしてPsc3Scc3,Pds5,Waplが存在するが,以前の解析により,Psc3Scc3がコヒーシンとDNAとの結合に必須であることがわかっていた4).残り2つのサブユニットの機能を解析するため,出芽酵母と大腸菌を使用した系においてPds5およびWaplを精製した.これまでの報告のとおり,Pds5とWaplは安定したヘテロ二量体を形成しコヒーシン四量体と物理的に相互作用した.Pds5は染色体においてコヒーシンと安定な複合体を形成すると考えられている5).ローダー複合体の存在のもとでの再構成反応において,Pds5はコヒーシンとDNAとのトポロジカルな結合反応を阻害した.これは,ローダー複合体とPds5がコヒーシンとの結合について競合するためと考えられた.このとき,同時にWaplをくわえるとこの阻害効果は打ち消された.これは,Waplがコヒーシン“ホロ”複合体とDNAとのトポロジカルな結合反応を促進することを意味した.
2.コヒーシンとDNAとの解離反応
もともとWaplはコヒーシンとクロマチンとの解離を促進すると考えられていた6-8).そこで,再構成反応の条件を変えてコヒーシンとDNAとの解離反応を解析した.すると,Pds5とWaplの両方を添加するとコヒーシンとDNAがすみやかに解離した.すなわち,WaplはPds5と共役してコヒーシンとDNAとの解離を直接的に促進した.また,Pds5は自然に起こるコヒーシンとDNAとの解離を弱くではあるが抑制していた.おそらく,Pds5はコヒーシンと結合し,その結果としてDNAの解離を抑制することにより,コヒーシンのリングの安定化に寄与していると考えられた.
コヒーシンとDNAとのトポロジカルな結合反応にはコヒーシンのもつATPase活性が必須であった4).そこで,ATPの加水分解を阻害したところコヒーシンとDNAとの解離反応が阻害された.すなわち,ATPの加水分解はコヒーシンとDNAとの解離反応にも必要であった.また,コヒーシンとDNAとの結合反応にはPsc3Scc3が必須であった.コヒーシンとDNAとが結合したのちPsc3Scc3を除去したところ,Pds5およびWaplが存在してもコヒーシンとDNAとの解離はみられなかった.コヒーシンとDNAとの解離反応はATPの加水分解およびPsc3Scc3に依存していたことから,ローダー複合体により促進されるコヒーシンとDNAとの結合反応と非常に類似していると考えられた.
3.WaplはコヒーシンのPsm3Smc3とRad21Scc1との結合を解離する
過去の知見により,コヒーシンはPsm3Smc3とRad21Scc1との結合を一時的に解離して染色体から解離すると予測されていた5).そこで,Waplがこの結合を直接に解離させるかどうか検討した.Rad21Scc1は,N末端側がPsm3Smc3のヘッドドメインの直近のコイルドコイル部と,C末端側がPsm1Smc1のヘッドドメインと結合し,N末端側とC末端側とのあいだはフレキシブルなリンカーになっている(図1).まず,Rad21Scc1のリンカー部にTEVプロテアーゼの認識配列を挿入したコヒーシンを作製した.このコヒーシンをPds5およびWaplと反応させたのち,TEVプロテアーゼによりRad21Scc1を切断し免疫沈降により回収した.もし,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を解離するのであれば,Rad21Scc1のN末端側はコヒーシンから解離するため免疫沈降により回収されないはずである.実際に,Pds5-Wapl複合体はATPに依存的にRad21Scc1のN末端側の解離を促進し,これは,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を直接に解離させる証左であった.この開環反応は加水分解されないATPアナログを添加しても同じ程度の効率で起こった.
4.Psm3Smc3のもつ保存されたLysはDNAセンサーとして機能する
Psm3Smc3のATPaseドメインはS期において保存されたLysがアセチル化される.このアセチル化は染色体におけるコヒーシンの安定化と関連し,姉妹染色体の接着の形成に必須である9).このアセチル化の意義について解析するため,アセチル化部位であるLys105およびLys106をGlnに置換したアセチル化模倣コヒーシン変異体を作製した.この置換は,細胞レベルにおいてアセチル化を模倣することが報告されている10).コヒーシンとDNAとの結合反応を解析したところ,野生型と比べ反応の効率がいちじるしく低下していた.つまり,このPsm3Smc3のもつ進化的に保存されたLysはコヒーシンとDNAとの結合反応において重要であった.
近年,DNAの修復に機能するSMCサブユニットであるRad50のヘッドドメインとDNAとの共結晶構造が報告されたが,Rad50のDNA結合部位は構造的にコヒーシンにおけるアセチル化部位に相当する部位であった.このことから,Psm3Smc3のもつ保存されたLysはDNAセンサーとして機能しうることが示唆された.この予想と一致して,DNAに依存的なコヒーシンのATPase活性はアセチル化模倣コヒーシン変異体においていちじるしく減弱していた.また,コヒーシンとDNAとの結合反応およびDNAに依存的なコヒーシンのATPase活性はともにPsm3Smc3のLys105およびLys106をGlnと置換することにより段階的に低下したことから,アセチル化の程度により段階的な制御が可能らしい.
Psm3Smc3のLys105をGlnと置換したコヒーシン変異体は弱いながらもDNAと結合したことから,コヒーシンとDNAとの解離反応におけるPsm3Smc3のLys105のアセチル化の効果について検討した.すると,このコヒーシン変異体は野生型のコヒーシンに比べ,Pds5-Wapl複合体によるコヒーシンとDNAとの解離に対し耐性を示した.以上の結果から,Psm3Smc3のLys105およびLys106はDNAセンサーとしてコヒーシンとDNAとの結合反応および解離反応において不可欠であり,そのアセチル化はDNAセンサーとしての機能を無効化しコヒーシンのリングが開かないようにする“鍵”として機能するのではないかと推察された.
5.コヒーシンとDNAとの結合反応および解離反応の統一的なモデル
コヒーシンとDNAとの結合反応および解離反応は質的に非常に類似していた.すなわち,1)コヒーシンのもつATPase活性に依存的であること,2)Psc3Scc3が反応に必須であること,3)Psm3Smc3のもつ保存されたLys105およびLys106がDNAセンサーとして機能すること,である.これらをふまえ,コヒーシンとDNAとの動的な結合反応および解離反応の機序が推察された(図2).
コヒーシンのリングはヘッドドメインを境にして,SMCサブユニットの側の空間とヘッド部とRad21Scc1からなる空間とに分けることができ,DNAはSMCサブユニットの側の空間に収容されていると考えられた.コヒーシンとDNAとの解離反応において,DNAはDNAセンサーと接触することにより,ヘッド部におけるATPの加水分解を誘発する.これにより,ヘッドドメインどうしの結合が解離し,DNAがSMCサブユニットの側の空間からヘッド部とRad21Scc1からなる空間へと移動する.解離反応におけるATPase活性はこのDNAの移動に必要なのであろう.つぎに,Pds5-Wapl複合体がPsm3Smc3とRad21Scc1との結合を解離させる.この開環にはATPの結合が必要であり,そのため,ヘッドドメインはふたたび結合する.これにより,開環しているPsm3Smc3とRad21Scc1との結合の方向にのみDNAを移動させることが可能になり,この一連の反応によりコヒーシンとDNAは解離する.
コヒーシンとDNAとの結合反応においても,DNAを通過させる素反応は基本的に解離反応と同じであると考えられる.すなわち,DNAはヘッドドメインどうしの結合を通過したのち,Psm3Smc3とRad21Scc1との結合を通過する.このとき,コヒーシンのリングが開いたままだとDNAセンサーとDNAとの接触が困難である.よって,コヒーシンとDNAとの結合反応においては,リングが折れ曲がるようにしてヘッド部とヒンジ部が結合しコヒーシンは大規模な構造変化を起こす.これによりDNAセンサーが露出し,コヒーシンとDNAとの一連の結合反応が開始する.ローダー複合体はこの構造変化を安定に保つことにより,解離反応と同じ素反応により結合反応を誘導するものと予想される.このようなSMCサブユニットの構造変化は原子間力顕微鏡を用いた解析において報告されている11).また,ローダー複合体はコヒーシンのヒンジ部とヘッド部にあるPsc3Scc3と結合することから,コヒーシンのリングを折りたたむような構造変化を促進している可能性が高い.
おわりに
コヒーシンとDNAとの動的な結合反応および解離反応の再構成からみえてきたのは,結合反応と解離反応が質的に類似していたことであった.これまでの主要なモデルは,コヒーシンはヒンジドメインどうしの結合部位からDNAを導入し,Psm3Smc3とRad21Scc1との結合部位からDNAを放出するというものであった.この場合,結合反応と解離反応は質的に異なるものになると考えられ,同じ素反応により起こるとは考えにくい.また,反応の条件によっては,WaplはコヒーシンとDNAとの結合を促進していたが,このことは,DNAが同じ部位において出入りするという素反応は同じであり,コヒーシンの構造を変えることにより結合反応と解離反応の方向づけをしていると考えると説明がつく.コヒーシンとは別のSMC複合体であるコンデンシンにはローダー複合体にあたるものがみつかっておらず,非SMCサブユニットがSMC複合体と染色体との動的な結合を制御している.コンデンシンの場合も,最初にDNAと接触したときとDNAとトポロジカルに結合したときの構造の違いにより,同じ素反応により結合反応と解離反応の両方が起こると説明することができる.無論,今回の研究は,この結合反応と解離反応の統一モデルを完全に支持するものではない12).しかし,コヒーシン,ひいては,SMC複合体の作用機序を解明するにあたり,今回のモデルは十分に検討に値するだろう.
文 献
- Nasmyth, K.: Cohesin: a catenase with separate entry and exit gates? Nat. Cell Biol., 13, 1170-1177 (2011)[PubMed]
- Thadani, R., Uhlmann, F. & Heeger, S.: Condensin, chromatin crossbarring and chromosome condensation. Curr. Biol., 22, R1012-R1021 (2012)[PubMed]
- Jeppsson, K., Kanno, T., Shirahige, K. et al.: The maintenance of chromosome structure: positioning and functioning of SMC complexes. Nat. Rev. Mol. Cell Biol., 15, 601-614 (2014)[PubMed]
- Murayama, Y. & Uhlmann, F.: Biochemical reconstitution of topological DNA binding by the cohesin ring. Nature, 505, 367-371 (2014)[PubMed] [新着論文レビュー]
- Chan, K. L., Roig, N. B., Beckouet, F. et al.: Cohesin’s DNA exit gate is distinct from its entrance gate and is regulated by acetylation. Cell, 150, 961-974 (2012)[PubMed]
- Gandhi, R., Gillespie, P. J. & Hirano, T.: Human Wapl is a cohesin-binding protein that promotes sister-chromatid resolution in mitotic prophase. Curr. Biol., 16, 2406-2417 (2006)[PubMed]
- Kueng, S., Hegemann, B., Peters, B. H. et al.: Wapl controls the dynamic association of cohesin with chromatin. Cell, 127, 955-967 (2006)[PubMed]
- Lopez-Serra, L., Lengronne, A., Borges, V. et al.: Budding yeast Wapl controls sister chromatid cohesion maintenance and chromosome condensation. Curr. Biol., 23, 64-69 (2013)[PubMed]
- Rolef Ben-Shahar, T., Heeger, S., Lehane, C. et al.: Eco1-dependent cohesin acetylation during establishment of sister chromatid cohesion. Science, 321, 563-566 (2008)[PubMed]
- Feytout, A., Vaur, S., Genier, S. et al.: Psm3 acetylation on conserved lysine residues is dispensable for viability in fission yeast but contributes to Eso1-mediated sister chromatid cohesion by antagonizing Wpl1. Mol. Cell. Biol., 31, 1771-1786 (2011)[PubMed]
- Yoshimura, S. H., Hizume, K., Murakami, A. et al.: Condensin architecture and interaction with DNA: regulatory non-SMC subunits bind to the head of SMC heterodimer. Curr. Biol., 12, 508-513 (2002)[PubMed]
- Gruber, S., Arumugam, P., Katou, Y. et al.: Evidence that loading of cohesin onto chromosomes involves opening of its SMC hinge. Cell, 127, 523-537 (2006)[PubMed]
著者プロフィール
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,2010年 英国Cancer Research UK London Research Institute博士研究員を経て,2015年より東京工業大学大学院生命理工学研究科 助教.
研究テーマ:SMC複合体の機能.
© 2016 村山 泰斗 Licensed under CC 表示 2.1 日本