コヒーシンのDNAとのトポロジカルな結合の生化学的な再構成
村山 泰斗
(英国Cancer Research UK London Research Institute,Chromosome Segregation Laboratory)
email:村山泰斗
DOI: 10.7875/first.author.2013.162
Biochemical reconstitution of topological DNA binding by the cohesin ring.
Yasuto Murayama, Frank Uhlmann
Nature, 505, 367-371 (2014)
姉妹染色体のあいだの接着は正確な染色体分配において必須である.コヒーシンは巨大なリング状の複合体であり,内側をとおすようなかたちでDNAと結合し,姉妹染色体のあいだを接着すると考えられている.この特殊なDNAとの結合はコヒーシンの機能の中心であるが,その分子機構はほとんど不明であった.筆者らは,コヒーシン,および,そのDNAとの結合に必須の複合体であるローダーを精製し,コヒーシンとDNAとのトポロジカルな結合を必要最小の単位において再構成した.コヒーシンは非常に弱いながらも単体でDNAとのトポロジカルな結合能をもち,ローダーはこの結合を直接的に促進した.ローダーはコヒーシンのリング円周の広域にわたり結合し,その結合はコヒーシンとDNAとの結合の促進に必須であった.この研究は,コヒーシンの生化学的な解析により,コヒーシンとDNAとのトポロジカルな結合の分子機構について新たなモデルを提唱した.
姉妹染色体のあいだの接着は,細胞分裂期に姉妹染色体が微小管により両極に引っ張られるとき張力を生み出す.細胞はこの張力を感知して正確な染色体分配を達成する.リング状の構造をしたコヒーシンは,それ自体のトポロジーを利用してDNAと結合し,姉妹染色体のあいだの接着を形成すると考えられている.近年の解析から,コヒーシンは転写制御やDNA修復にも関与することが示されており,染色体の動態においてさまざまな機能をはたすことがわかってきた1).
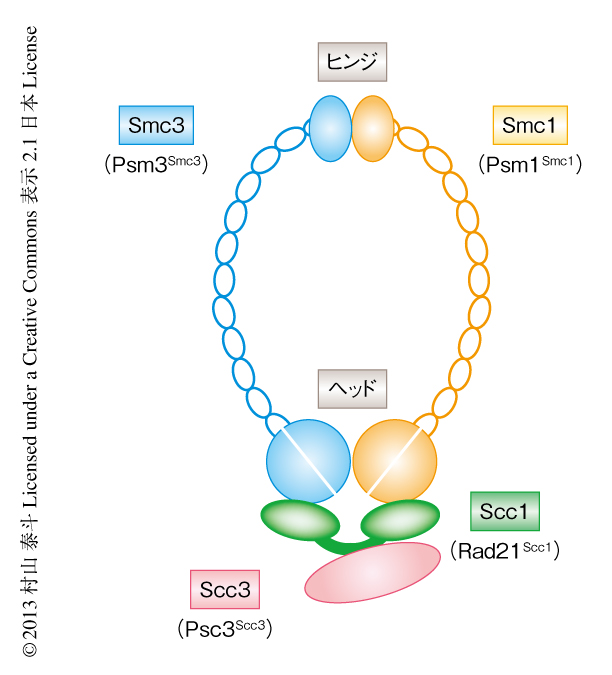
コヒーシンは4つのサブユニットからなり,リング円周の大部分はSmc1サブユニットおよびSmc3サブユニットから形成されている.これらは長大なコイルドコイル領域をもち,球状のヒンジドメインどうし,および,ATPase活性をもつヘッドドメインどうしで結合する.ヘッドドメインどうしの結合はScc1サブユニットとの結合により補強される.Scc3サブユニットはScc1サブユニットと結合する2)(図1).コヒーシンはDNAと結合するまえの段階ですでにリング状の構造をとっているため,一時的にサブユニットのあいだの結合を解離してDNAとトポロジカルに結合するものと考えられる3,4).コヒーシンのDNAへの結合には,それ自体のATPase活性と,Scc2サブユニットおよびScc4サブユニットからなるローダーが必須である5).しかし,コヒーシンのDNAとのトポロジカルな結合の分子機構,および,その細胞における時空間的な制御については不明であった.このような分子機構の解析には生化学的な再構成による実験が必須であり,これまでもさまざまな生物種のコヒーシンを用いて解析がなされてきたが,このDNA結合のin vitroにおける再構成の成功例はなかった6,7).
この研究においては,酵母から精製したタンパク質を用いて,コヒーシンのDNAとのトポロジカルな結合を必要最小の単位において生化学的に再構成することに世界ではじめて成功した.
ローダーは真核生物のあいだで保存されており,いずれの生物種においてもコヒーシンのDNAへの結合に必須である.また,ローダーはコヒーシンと直接に結合することから,コヒーシンのDNAとのトポロジカルな結合を直接的に制御していると予測されていた.分裂酵母のローダーはMis4Scc2サブユニットとSsl3Scc4サブユニットからなる.これらを分裂酵母において過剰に発現させ,解析に必要な量のローダーMis4Scc2-Ssl3Scc4,および,Mis4Scc2サブユニットの精製系を確立した.Mis4Scc2サブユニットにはロイシンジッパーが存在することからDNA結合能が予測された.ゲルシフト法により解析したところ,ローダーは二本鎖DNAと特異的に結合することがわかった.また,Mis4Scc2サブユニットは単体でもローダー複合体と同じ程度の親和性をもって二本鎖DNAと結合することが判明し,ローダーのDNA結合能の大部分はMis4Scc2サブユニットに由来するものであると結論づけた.
出芽酵母のコヒーシンはPsm1Smc1サブユニット,Psm3Smc3サブユニット,Rad21Scc1サブユニット,Psc3Scc3サブユニットからなる.この4つのサブユニットを出芽酵母において過剰に発現させ,精製ののち,これらを用いてコヒーシンのDNAとのトポロジカルな結合のin vitroにおける再構成を試みた.姉妹染色体のあいだに接着が形成されるとき,DNAに結合しているコヒーシンは高濃度の塩により処理しても解離することはない7).この状態では,コヒーシンはDNAとトポロジカルに結合していると考えられている.また,コヒーシンのDNAへの結合は,ATPase活性をもつSmc1サブユニットあるいはSmc3サブユニットのヘッドドメインを破壊すると起こらない.これらの特性から,DNAとトポロジカルに結合したコヒーシンは以下の条件を満たすと考えられた.すなわち,1)高塩濃度による処理に耐性,2)環状のDNAのみに結合,3)ATPに依存的,4)コヒーシンのリング構造に依存,である.この条件を指標としてさまざまな条件検討を行った結果,コヒーシンは非常に弱いながら単体でもDNAとトポロジカルに結合する活性をもつことが判明した.この弱い反応はローダーにより大幅に促進された.また,この結果と一致して,ローダーはDNA存在下においてのみ,コヒーシンのもつATPase活性を促進することがわかった.すなわち,ローダーはコヒーシンのDNAとのトポロジカルな結合を直接的に促進する機能をもっていた.
また,もうひとつ興味深い発見は,ローダーのMis4Scc2サブユニットは単体でもローダーと同様の,コヒーシンとDNAとのトポロジカルな結合の促進能をもつことであった.換言すると,この研究における反応条件において,ローダーのSsl3Scc4サブユニットは不要ということである.一方,この結果と矛盾して,ローダーを構成するMis4Scc2サブユニットおよびSsl3Scc4サブユニットは細胞の生存において必須である.このことは,ローダーは生体においてコヒーシンの活性制御のほかにも必須の機能をもつことを示唆した8).
これまでの研究から,ローダーとコヒーシンとは直接に結合することが報告されていた.精製タンパク質を用いた免疫沈降法によりこの結合を詳細に調べた結果,ローダーはコヒーシンの4つのサブユニットすべてと結合しうることがわかった.なかでも,まず注視されるのはPsc3Scc3サブユニットである.このサブユニットは残りの3つとは異なり,コヒーシンのリング構造を形成するのに必須ではないが,未知の機能をもっている(図1).Psc3Scc3サブユニットを除いたコヒーシンのリング構造を精製し再構成反応を行ったところ,ローダーによるコヒーシンとDNAとのトポロジカルな結合の促進はほとんどみられなかった.ここにさらにPsc3Scc3サブユニットをくわえると,促進はふたたびみられた.すなわちこの結果は,コヒーシンのPsc3Scc3サブユニットは,ローダーがコヒーシンとDNAとのトポロジカルな結合を促進する過程において必須であることを意味した.
免疫沈降法による解析から,ローダーはコヒーシンのサブユニットに対し,Psc3Scc3サブユニット以外とも結合する可能性が示唆されていた.ペプチドアレイ法によりそれぞれのサブユニットの結合部位について同定したところ,ローダーはコヒーシンのリング円周において複数の箇所,しかも,広範囲にわたり結合する可能性が示唆された.コヒーシンのPsm1Smc1サブユニット,Psm3Smc3サブユニット,Psc3Scc3サブユニットにおける結合部位に変異を導入して解析した結果,in vitroにおける再構成および細胞レベルにおける解析の両方で欠陥がみられた.また,ペプチドを用いた競争阻害の解析からも同様の結論が得られた.すなわち,コヒーシンのこれらの部位におけるローダーとの結合は,コヒーシンとDNAとのトポロジカルな結合の促進に重要であることを意味した.
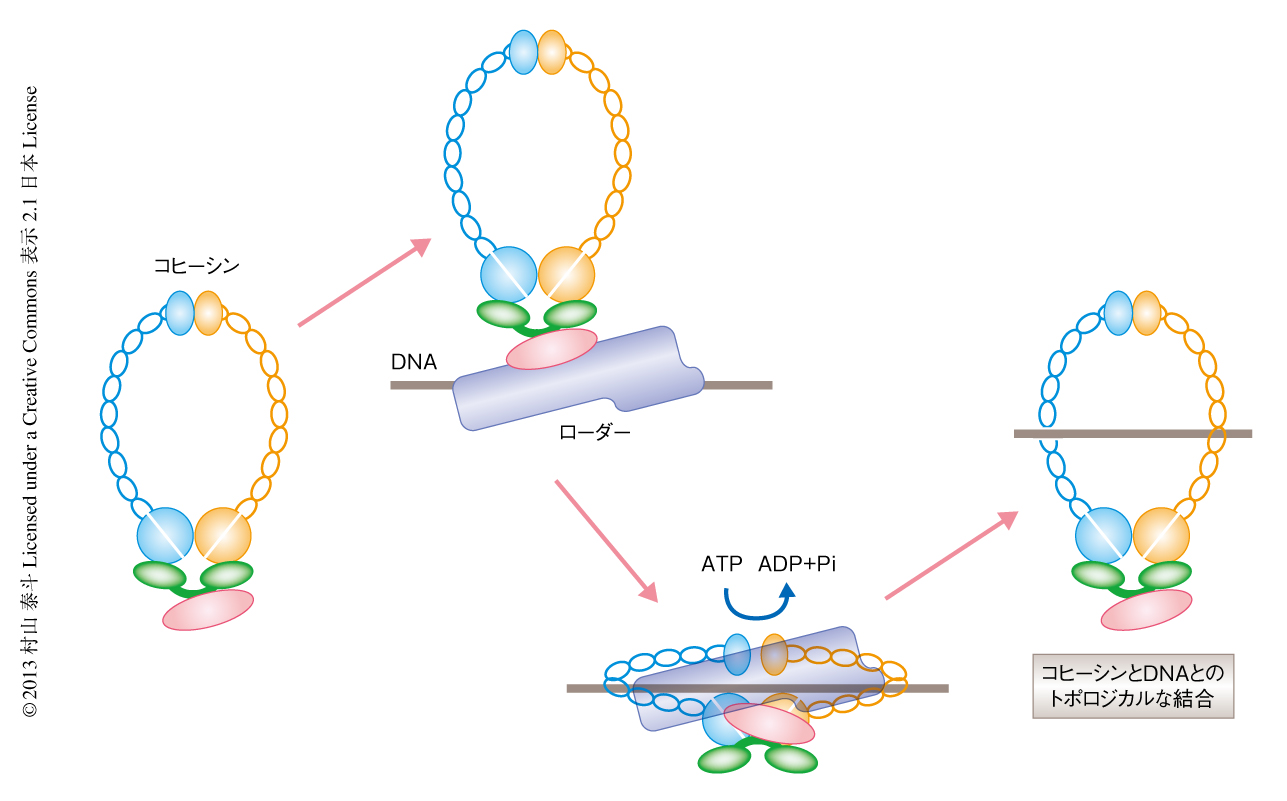
この研究は,ローダーはコヒーシンの複数の箇所に結合し,それがコヒーシンとDNAとのトポロジカルな結合を促進するのに重要であることを示した.以前の知見およびこの結果から,コヒーシンがDNAとトポロジカルに結合をするためにはATPに依存的な構造変化が必要であり,ローダーはコヒーシンの複数の箇所に同時に結合することにより,これを促進するというモデルが考えられた.コヒーシンはDNAとトポロジカルに結合するため,サブユニットのあいだの結合を一時的に解離し,そこからDNAをとおすものと考えられた.出芽酵母における解析は,コヒーシンはヒンジドメインの部分からDNAをとおすことを示唆している.一方,細菌のSmcの解析においては,コヒーシンのヘッドドメインの部分における解離がDNAとのトポロジカルな結合にかかわることが示唆されている1,3).いずれの場合においても,コヒーシンはサブユニットのあいだの結合を解離する必要があり,そのためにエネルギーが供給される必要がある.DNA修復に関与するSmcを含むタンパク質複合体であるMRN複合体は,ATPとの結合に依存して構造変化を起こすと考えられている.コヒーシンも類似したかたちで構造変化を起こすともの考えられた.そして,この長大なリングにATPに依存的な構造変化を効率的に伝える役割をはたすのがローダーであるというモデルが提唱された(図2).コヒーシンのリングの直径はおおよそ30 nmであるが,このモデルにおいて,ローダーはこの物理的な距離をうめる構造をとっているものと考えられた.よって,今後はローダーの構造的な解析が重要になってくるだろう.
コヒーシンのリング構造は10年以上まえの電子顕微鏡を中心とした解析により明らかになった2,4).この構造から提唱されたコヒーシンのモデルは,姉妹染色体のあいだの接着の実体を合理的に説明しうるものであった.しかし,そののちは細胞レベルにおける間接的な解析が中心となり,このモデルの直接的な検証は進んでいなかったのが現状である.この研究は,コヒーシンの中心機能であるDNAとのトポロジカルな結合を,精製タンパク質を用いて直接的に検出したはじめての例である.しかしながら,この研究はコヒーシンの基本的な生化学的な活性について解析したにすぎない.この解析法の応用範囲はきわめて広いと考えられる.たとえば,この解析法を1分子解析や構造解析へと応用していくことにより,コヒーシンとDNAとの結合の分子機構がさらに明らかにされるであろう.また,コヒーシン以外のSmcを含む複合体の解析にも十分に応用が可能である.また,この研究において再構成したのは姉妹染色体のあいだの接着において,きわめて初期の段階のみである.接着の形成はDNA複製も密接にかかわる壮大な機構であることを考慮すれば.コヒーシンにおける分子機構の解析ははじまったばかりである.
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,2010年より英国Cancer Research UK London Research Institute博士研究員.
研究テーマ:姉妹染色体のあいだの接着の形成における分子機構.
© 2013 村山 泰斗 Licensed under CC 表示 2.1 日本
(英国Cancer Research UK London Research Institute,Chromosome Segregation Laboratory)
email:村山泰斗
DOI: 10.7875/first.author.2013.162
Biochemical reconstitution of topological DNA binding by the cohesin ring.
Yasuto Murayama, Frank Uhlmann
Nature, 505, 367-371 (2014)
要 約
姉妹染色体のあいだの接着は正確な染色体分配において必須である.コヒーシンは巨大なリング状の複合体であり,内側をとおすようなかたちでDNAと結合し,姉妹染色体のあいだを接着すると考えられている.この特殊なDNAとの結合はコヒーシンの機能の中心であるが,その分子機構はほとんど不明であった.筆者らは,コヒーシン,および,そのDNAとの結合に必須の複合体であるローダーを精製し,コヒーシンとDNAとのトポロジカルな結合を必要最小の単位において再構成した.コヒーシンは非常に弱いながらも単体でDNAとのトポロジカルな結合能をもち,ローダーはこの結合を直接的に促進した.ローダーはコヒーシンのリング円周の広域にわたり結合し,その結合はコヒーシンとDNAとの結合の促進に必須であった.この研究は,コヒーシンの生化学的な解析により,コヒーシンとDNAとのトポロジカルな結合の分子機構について新たなモデルを提唱した.
はじめに
姉妹染色体のあいだの接着は,細胞分裂期に姉妹染色体が微小管により両極に引っ張られるとき張力を生み出す.細胞はこの張力を感知して正確な染色体分配を達成する.リング状の構造をしたコヒーシンは,それ自体のトポロジーを利用してDNAと結合し,姉妹染色体のあいだの接着を形成すると考えられている.近年の解析から,コヒーシンは転写制御やDNA修復にも関与することが示されており,染色体の動態においてさまざまな機能をはたすことがわかってきた1).
コヒーシンは4つのサブユニットからなり,リング円周の大部分はSmc1サブユニットおよびSmc3サブユニットから形成されている.これらは長大なコイルドコイル領域をもち,球状のヒンジドメインどうし,および,ATPase活性をもつヘッドドメインどうしで結合する.ヘッドドメインどうしの結合はScc1サブユニットとの結合により補強される.Scc3サブユニットはScc1サブユニットと結合する2)(図1).コヒーシンはDNAと結合するまえの段階ですでにリング状の構造をとっているため,一時的にサブユニットのあいだの結合を解離してDNAとトポロジカルに結合するものと考えられる3,4).コヒーシンのDNAへの結合には,それ自体のATPase活性と,Scc2サブユニットおよびScc4サブユニットからなるローダーが必須である5).しかし,コヒーシンのDNAとのトポロジカルな結合の分子機構,および,その細胞における時空間的な制御については不明であった.このような分子機構の解析には生化学的な再構成による実験が必須であり,これまでもさまざまな生物種のコヒーシンを用いて解析がなされてきたが,このDNA結合のin vitroにおける再構成の成功例はなかった6,7).
この研究においては,酵母から精製したタンパク質を用いて,コヒーシンのDNAとのトポロジカルな結合を必要最小の単位において生化学的に再構成することに世界ではじめて成功した.
1.ローダーはDNAとの結合能をもつ
ローダーは真核生物のあいだで保存されており,いずれの生物種においてもコヒーシンのDNAへの結合に必須である.また,ローダーはコヒーシンと直接に結合することから,コヒーシンのDNAとのトポロジカルな結合を直接的に制御していると予測されていた.分裂酵母のローダーはMis4Scc2サブユニットとSsl3Scc4サブユニットからなる.これらを分裂酵母において過剰に発現させ,解析に必要な量のローダーMis4Scc2-Ssl3Scc4,および,Mis4Scc2サブユニットの精製系を確立した.Mis4Scc2サブユニットにはロイシンジッパーが存在することからDNA結合能が予測された.ゲルシフト法により解析したところ,ローダーは二本鎖DNAと特異的に結合することがわかった.また,Mis4Scc2サブユニットは単体でもローダー複合体と同じ程度の親和性をもって二本鎖DNAと結合することが判明し,ローダーのDNA結合能の大部分はMis4Scc2サブユニットに由来するものであると結論づけた.
2.コヒーシンのDNAとのトポロジカルな結合のin vitroにおける再構成
出芽酵母のコヒーシンはPsm1Smc1サブユニット,Psm3Smc3サブユニット,Rad21Scc1サブユニット,Psc3Scc3サブユニットからなる.この4つのサブユニットを出芽酵母において過剰に発現させ,精製ののち,これらを用いてコヒーシンのDNAとのトポロジカルな結合のin vitroにおける再構成を試みた.姉妹染色体のあいだに接着が形成されるとき,DNAに結合しているコヒーシンは高濃度の塩により処理しても解離することはない7).この状態では,コヒーシンはDNAとトポロジカルに結合していると考えられている.また,コヒーシンのDNAへの結合は,ATPase活性をもつSmc1サブユニットあるいはSmc3サブユニットのヘッドドメインを破壊すると起こらない.これらの特性から,DNAとトポロジカルに結合したコヒーシンは以下の条件を満たすと考えられた.すなわち,1)高塩濃度による処理に耐性,2)環状のDNAのみに結合,3)ATPに依存的,4)コヒーシンのリング構造に依存,である.この条件を指標としてさまざまな条件検討を行った結果,コヒーシンは非常に弱いながら単体でもDNAとトポロジカルに結合する活性をもつことが判明した.この弱い反応はローダーにより大幅に促進された.また,この結果と一致して,ローダーはDNA存在下においてのみ,コヒーシンのもつATPase活性を促進することがわかった.すなわち,ローダーはコヒーシンのDNAとのトポロジカルな結合を直接的に促進する機能をもっていた.
また,もうひとつ興味深い発見は,ローダーのMis4Scc2サブユニットは単体でもローダーと同様の,コヒーシンとDNAとのトポロジカルな結合の促進能をもつことであった.換言すると,この研究における反応条件において,ローダーのSsl3Scc4サブユニットは不要ということである.一方,この結果と矛盾して,ローダーを構成するMis4Scc2サブユニットおよびSsl3Scc4サブユニットは細胞の生存において必須である.このことは,ローダーは生体においてコヒーシンの活性制御のほかにも必須の機能をもつことを示唆した8).
3.ローダーとPsc3Scc3サブユニット
これまでの研究から,ローダーとコヒーシンとは直接に結合することが報告されていた.精製タンパク質を用いた免疫沈降法によりこの結合を詳細に調べた結果,ローダーはコヒーシンの4つのサブユニットすべてと結合しうることがわかった.なかでも,まず注視されるのはPsc3Scc3サブユニットである.このサブユニットは残りの3つとは異なり,コヒーシンのリング構造を形成するのに必須ではないが,未知の機能をもっている(図1).Psc3Scc3サブユニットを除いたコヒーシンのリング構造を精製し再構成反応を行ったところ,ローダーによるコヒーシンとDNAとのトポロジカルな結合の促進はほとんどみられなかった.ここにさらにPsc3Scc3サブユニットをくわえると,促進はふたたびみられた.すなわちこの結果は,コヒーシンのPsc3Scc3サブユニットは,ローダーがコヒーシンとDNAとのトポロジカルな結合を促進する過程において必須であることを意味した.
4.ローダーはコヒーシンのリング円周の複数の箇所に結合する
免疫沈降法による解析から,ローダーはコヒーシンのサブユニットに対し,Psc3Scc3サブユニット以外とも結合する可能性が示唆されていた.ペプチドアレイ法によりそれぞれのサブユニットの結合部位について同定したところ,ローダーはコヒーシンのリング円周において複数の箇所,しかも,広範囲にわたり結合する可能性が示唆された.コヒーシンのPsm1Smc1サブユニット,Psm3Smc3サブユニット,Psc3Scc3サブユニットにおける結合部位に変異を導入して解析した結果,in vitroにおける再構成および細胞レベルにおける解析の両方で欠陥がみられた.また,ペプチドを用いた競争阻害の解析からも同様の結論が得られた.すなわち,コヒーシンのこれらの部位におけるローダーとの結合は,コヒーシンとDNAとのトポロジカルな結合の促進に重要であることを意味した.
5.コヒーシンとDNAとのトポロジカルな結合のモデル
この研究は,ローダーはコヒーシンの複数の箇所に結合し,それがコヒーシンとDNAとのトポロジカルな結合を促進するのに重要であることを示した.以前の知見およびこの結果から,コヒーシンがDNAとトポロジカルに結合をするためにはATPに依存的な構造変化が必要であり,ローダーはコヒーシンの複数の箇所に同時に結合することにより,これを促進するというモデルが考えられた.コヒーシンはDNAとトポロジカルに結合するため,サブユニットのあいだの結合を一時的に解離し,そこからDNAをとおすものと考えられた.出芽酵母における解析は,コヒーシンはヒンジドメインの部分からDNAをとおすことを示唆している.一方,細菌のSmcの解析においては,コヒーシンのヘッドドメインの部分における解離がDNAとのトポロジカルな結合にかかわることが示唆されている1,3).いずれの場合においても,コヒーシンはサブユニットのあいだの結合を解離する必要があり,そのためにエネルギーが供給される必要がある.DNA修復に関与するSmcを含むタンパク質複合体であるMRN複合体は,ATPとの結合に依存して構造変化を起こすと考えられている.コヒーシンも類似したかたちで構造変化を起こすともの考えられた.そして,この長大なリングにATPに依存的な構造変化を効率的に伝える役割をはたすのがローダーであるというモデルが提唱された(図2).コヒーシンのリングの直径はおおよそ30 nmであるが,このモデルにおいて,ローダーはこの物理的な距離をうめる構造をとっているものと考えられた.よって,今後はローダーの構造的な解析が重要になってくるだろう.
おわりに
コヒーシンのリング構造は10年以上まえの電子顕微鏡を中心とした解析により明らかになった2,4).この構造から提唱されたコヒーシンのモデルは,姉妹染色体のあいだの接着の実体を合理的に説明しうるものであった.しかし,そののちは細胞レベルにおける間接的な解析が中心となり,このモデルの直接的な検証は進んでいなかったのが現状である.この研究は,コヒーシンの中心機能であるDNAとのトポロジカルな結合を,精製タンパク質を用いて直接的に検出したはじめての例である.しかしながら,この研究はコヒーシンの基本的な生化学的な活性について解析したにすぎない.この解析法の応用範囲はきわめて広いと考えられる.たとえば,この解析法を1分子解析や構造解析へと応用していくことにより,コヒーシンとDNAとの結合の分子機構がさらに明らかにされるであろう.また,コヒーシン以外のSmcを含む複合体の解析にも十分に応用が可能である.また,この研究において再構成したのは姉妹染色体のあいだの接着において,きわめて初期の段階のみである.接着の形成はDNA複製も密接にかかわる壮大な機構であることを考慮すれば.コヒーシンにおける分子機構の解析ははじまったばかりである.
文 献
- Ocampo-Hafalla, M. T. & Uhlmann, F. J.: Cohesin loading and sliding. Cell Sci., 124, 685-691 (2011)[PubMed]
- Haering, C. H., Lowe, J., Hochwagen, A. et al.: Molecular architecture of SMC proteins and the yeast cohesin complex. Mol. Cell, 9, 773-788 (2002)[PubMed]
- Nasmyth, K.: Cohesin: a catenase with separate entry and exit gates? Nat. Cell Biol., 13, 1170-1177 (2011)[PubMed]
- Anderson, D. E., Losada, A., Erickson, H. P. et al.: Condensin and cohesin display different arm conformations with characteristic hinge angles. J. Cell Biol., 156, 419-424 (2002)[PubMed]
- Ciosk, R., Shirayama, M., Shevchenko, A. et al.: Cohesin's binding to chromosomes depends on a separate complex consisting of Scc2 and Scc4 proteins. Mol. Cell, 5, 1-20 (2000)[PubMed]
- Onn, I. & Koshland, D.: In vitro assembly of physiological cohesin/DNA complexes. Proc. Natl. Acad. Sci. USA, 108, 12198-12205 (2011)[PubMed]
- Bermudez, V. P., Farina, A., Higashi, T. L. et al.: In vitro loading of human cohesin on DNA by the human Scc2-Scc4 loader complex. Proc. Natl. Acad. Sci. USA, 109, 9366-9371 (2012)[PubMed]
- Takahashi, T. S., Basu, A., Bermudez, V. et al.: Cdc7-Drf1 kinase links chromosome cohesion to the initiation of DNA replication in Xenopus egg extracts. Genes Dev., 22, 1894-1905 (2008)[PubMed]
著者プロフィール
略歴:2008年 横浜市立大学大学院生命ナノシステム科学研究科 修了,2010年より英国Cancer Research UK London Research Institute博士研究員.
研究テーマ:姉妹染色体のあいだの接着の形成における分子機構.
© 2013 村山 泰斗 Licensed under CC 表示 2.1 日本