先天性眼振の原因遺伝子であるFRMD7遺伝子は方向選択性の神経回路の非対称な発達に必要である
米原 圭祐
(スイスFriedrich Miescher Institute for Biomedical Research,Neural Circuit Laboratories)
email:米原圭祐
DOI: 10.7875/first.author.2015.135
Congenital nystagmus gene FRMD7 is necessary for establishing a neuronal circuit asymmetry for direction selectivity.
Keisuke Yonehara, Michele Fiscella, Antonia Drinnenberg, Federico Esposti, Stuart Trenholm, Jacek Krol, Felix Franke, Brigitte Gross Scherf, Akos Kusnyerik, Jan Müller, Arnold Szabo, Josephine Jüttner, Francisco Cordoba, Ashrithpal Police Reddy, János Németh, Zoltán Zsolt Nagy, Francis Munier, Andreas Hierlemann, Botond Roska
Neuron, 89, 177-193 (2016)
神経回路の空間的な非対称性は重要な役割を担うが,非対称性を生み出す分子機構は不明であった.今回,筆者らは,ヒトの先天性眼振の原因遺伝子であるFRMD7遺伝子がマウスの網膜における方向選択性の神経回路の非対称な形成に必要であることを明らかにした.FRMD7変異マウスはFRMD7変異をもつヒトの先天性眼振の患者と同様に水平方向への視運動性の眼球運動を欠失していた.この表現型は,網膜における水平方向への方向選択性の欠失,および,本来なら水平方向への選択性を示す方向選択性ニューロンへの抑制性の入力の非対称性の欠失をともなっていた.FRMD7の網膜における発現は抑制性のニューロンであるスターバーストアマクリン細胞に特異的に観察された.この研究により,神経疾患の病態生理に対する特定の抑制性のニューロンの関与が示唆された.
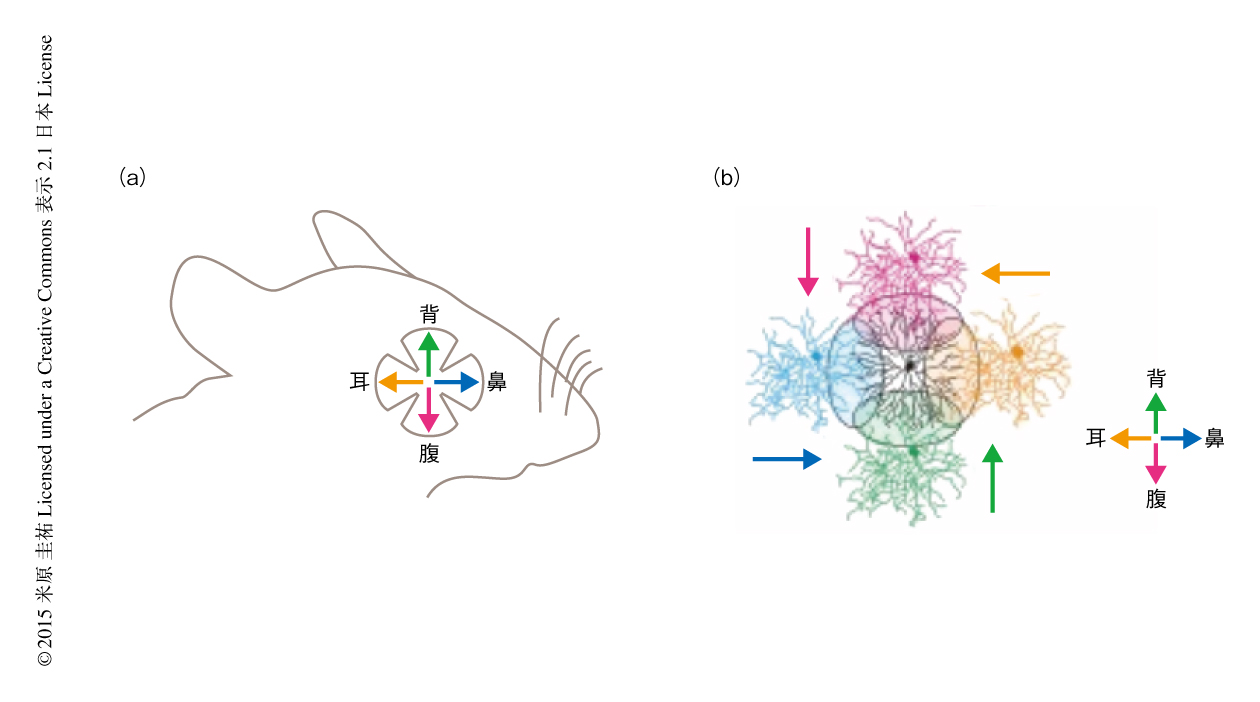
神経結合の空間的な非対称性は神経回路を特徴づける重要な要素である.神経回路の非対称性のおかげで脳は音源の位置,視覚の対象の傾き,動きの方向などの特徴を抽出することができる.ショウジョウバエやマウスの視覚系には,視覚の対象が特定の方向に動いたときに強い反応を示すが,その反対の方向に動いたときにはあまり反応しないニューロンが存在し,これらは方向選択性ニューロンとよばれる.マウスやウサギなど脊椎動物の方向選択性ニューロンは網膜にも存在することが知られており,局所の神経回路の機能および構造を調べるためのモデルとして古くから解析されてきた.網膜の古典的な方向選択性の神経節細胞にはオン-オフ型とオン型とがあり,それぞれには背,腹,鼻,耳の方向のいずれかの動きに反応する4つのタイプがある1)(ただし,オン型は鼻の方向へ反応するタイプを欠くので3つのタイプしかない).オン-オフ型の方向選択性ニューロンは速い動きによく反応し,外側膝状体や上丘に情報を伝達する.一方,オン型の方向選択性ニューロンは視野全体の遅い動きによく反応し,視運動性の眼球運動の中枢である中脳の副視覚系にその情報を伝達する2).視運動性の眼球運動とは,通常,頭がゆっくり回転したときや電車の窓から景色を見ているときに起こる,視野全体のゆっくりとした動きによりひき起こされる像を網膜に安定させるための不随意の眼球運動である.オン型の方向選択性ニューロンから副視覚系への入力がないと視運動性の眼球運動は起こらないと考えられているが,霊長類の網膜にも方向選択性ニューロンが存在するという確かな証拠は得られていない.
方向選択性ニューロンの樹状突起は双極細胞からの方向に非選択的な興奮性の入力3),および,抑制性のニューロンであるスターバーストアマクリン細胞からの方向に選択的な抑制性の入力4) をうける.この方向選択的な抑制性の入力を生じる神経回路の特性のなかでも鍵となるのが,スターバーストアマクリン細胞から方向選択性ニューロンへの空間的に非対称な抑制性のシナプス入力である.スターバーストアマクリン細胞は放射状に神経突起を伸ばし,その神経突起に双極細胞からの入力をうけ,その遠位部からは抑制性の神経伝達物質であるGABAを放出する(実際には,興奮性の神経伝達物質であるアセチルコリンを共放出するが,その意義についてはよくわかっていない).方向選択性ニューロンへの抑制性の入力を担うシナプスの数は,無方向をむくスターバースト細胞の神経突起からは多く,最適方向をむくスターバースト細胞の神経突起からは少ない.つまり,スターバースト細胞はその神経突起の角度に依存して,異なる方向選択性をもつニューロンとシナプスを形成している5)(図1).マウスにおいてスターバースト細胞を遺伝学的に除去すると,網膜の方向選択性および視運動性の眼球運動がともに消失することが知られている6).
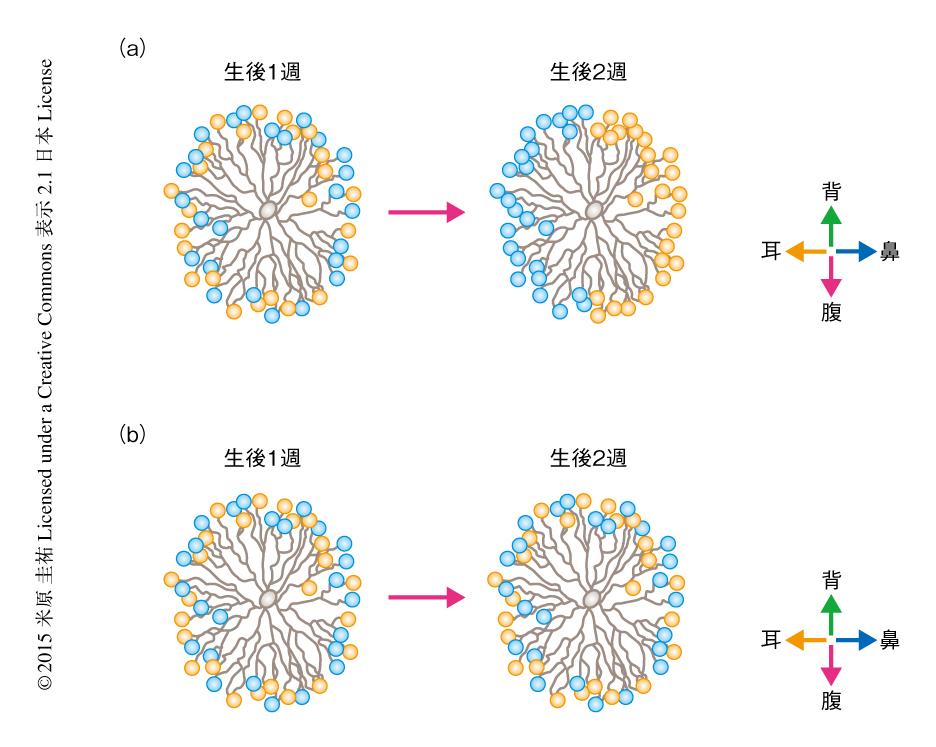
どのような発達の機構が神経突起の角度に依存したシナプスの形成を可能にするのだろうか? 筆者ら,および,ほかの研究グループによる実験から,この神経回路の非対称性はマウスが開眼するまえ,生後1週から生後2週のあいだに視覚の経験に非依存的に形成されることが示された7)(新着論文レビュー でも掲載).また,網膜の自発発火やその波もこの神経回路の発達には必要でないことが示唆された.これらの知見から,決定論的な遺伝子による機構が非対称な神経回路の形成にかかわると考えられていたが,その分子実態は不明であった.
方向選択性の発達にかかわる遺伝子を同定するためには,方向選択性の神経回路の活動に依存するヒトの視覚の機能を阻害する単一遺伝子疾患に着目することが効果的であると考えた.先天性眼振がその例である.先天性眼振は約1500人に1人の割合でみられ,そのうち約70%の症例はX染色体にあるFRMD7遺伝子の変異によりひき起こされる8).FRMD7変異をもつ先天性眼振の患者に観察されるおもな症状は,水平方向への不随意の眼球の振動,および,水平方向への視運動性の眼球運動の欠失であり,垂直方向への眼球運動は正常である.ヒトにおいてFRMD7の発現が網膜および前庭に観察されることは知られていたが,先天性眼振の神経回路の機構については不明であった9).
FRMD7はFERMドメイン含有タンパク質ファミリーに属し,細胞膜と細胞骨格のあいだのシグナル伝達や細胞骨格の再編成に関与することが示唆されてきた.培養細胞においては神経突起の伸張の作用を示す.網膜におけるニューロン種に特異的な発現プロファイリングから,マウスの網膜におけるFRMD7の発現はスターバースト細胞に濃縮されていることがわかっていた10).筆者らは,FRMD7遺伝子のスターバースト細胞における機能の不全が先天性眼振の症状をひき起こす可能性を予想し,FRMD7変異マウスを解析した.
野生型マウスおよびFRMD7変異マウスの頭部を固定し,モニターのうえを動く視覚刺激を提示した際の眼球の動きをビデオカメラで追跡して比較した.野生型マウスは水平方向および垂直方向への視運動性の眼球運動を示したが,FRMD7変異マウスでは水平方向への視運動性の眼球運動が欠失していた.ヒトのFRMD7変異をもつ患者の視運動性の眼球運動を調べると,FRMD7変異マウスと同様に水平方向への視運動性の眼球運動が欠失していた.一方,垂直方向への視運動性の眼球運動はマウスおよびヒトともに正常であった.FRMD7変異マウスにおいてはヒトの患者においてみられた水平方向への眼球の振動が観察されなかった.FRMD7変異マウスにおいて水平方向への突発的な眼球運動は正常に観察されたこと,ヒトの患者においても水平方向への自発的な眼球運動は正常に観察されたことから,FRMD7の変異は眼筋の機能それ自体には影響しないと考えられた.
網膜の方向選択性を調べるため,野生型マウスおよびFRMD7変異マウスから単離した網膜の神経節細胞から多点電極同時記録法を用いて視覚の刺激に対するスパイク応答を記録した.野生型マウスの網膜においては背,腹,鼻,耳の方向への方向選択性の応答が観察された.FRMD7変異マウスの網膜においては水平方向(鼻方向および耳方向)への方向選択性が欠失していたが,垂直方向(背方向および腹方向)への方向選択性は正常であった.オン型およびオン-オフ型のニューロンにおいて水平方向への選択性が欠失していた.水平方向への方向選択性の欠失は開眼の直前および直後の生後13日から生後14日においてすでにみられたことから,FRMD7の機能は神経回路の生後の発達に必要であることが示唆された.
FRMD7変異マウスの網膜において水平方向の方向選択性が失われる機構として,水平方向への方向選択性ニューロンが欠失している可能性,および,水平方向への方向選択性ニューロンは存在しているが方向選択性を失った可能性が考えられた.この疑問に答えるため,おもに水平方向へ選択性をもつニューロンがGFPにより標識されたレポーターマウスをFRMD7変異マウスと交配させ,その網膜を調べた.GFPにより標識されたニューロンの密度はFRMD7変異マウスにおいて変化がなかったことから,水平方向への方向選択性ニューロンは欠失していないことが示唆された.
2光子顕微鏡のもとにパッチクランプ記録法を用いてGFPにより標識されたニューロンからスパイク応答および抑制性シナプス後電流を記録した.FRMD7変異マウスの網膜においては,本来は水平方向への方向選択性を示すオン型およびオン-オフ型のニューロンにおいて方向に非選択的なスパイク応答が観察された.オン型のニューロンはすべての方向へ等しく応答し,オン-オフ型のニューロンはどの方向へも応答しなかったがフラッシュ刺激には応答を示した.さらに,これらのニューロンへの抑制性の入力は空間的な非対称性を欠失し,どの方向に対しても同様な大きさの抑制性の入力をうけていた.オン-オフ型のニューロンがどの方向へも応答しなくなったのは対称的になった抑制性の入力がスパイク応答を抑制するのに十分な大きさに達していたからであると示唆された.
対照実験として,垂直方向へ選択性をもつ方向選択性ニューロンを,軸索の投射部位である副視覚系の内側核に逆行性の蛍光トレーサーを注入することにより標識し,細胞体からスパイク応答および抑制性の入力を記録した.野生型マウスと比較して,FRMD7変異マウスの網膜においてスパイク応答および抑制性の入力の方向選択性に変化はみられなかった.これらの実験から,FRMD7変異マウスでは水平方向へ最適方向をもつ方向選択性ニューロンへの抑制性の入力の非対称性が失われていることが明らかにされた.
FRMD7変異マウスの網膜の大まかな構造,および,スターバースト細胞や方向選択性ニューロンの数や形態に異常はみられなかった.また,FRMD7変異マウスにおける方向選択性ニューロンの軸索の投射パターンには野生型マウスと比較して変化がみられなかったことから,FRMD7変異マウスにおける水平方向への視運動性の眼球運動の欠失は軸索投射の異常ではなく,網膜の水平方向への方向選択性の欠失により説明されると考えられた.
マウスおよび霊長類の網膜におけるFRMD7の発現パターンを調べるため,in situハイブリダイゼーション法および抗FRMD7抗体を作製し免疫染色を行った.マウスにおいて,FRMD7の発現は発達期をつうじてスターバースト細胞の特異的なマーカーであるChATに陽性の細胞に特異的であること,また,その発現は生後3日ごろから観察されることがわかった.マカクサルにおいても,FRMD7を発現する細胞の7割がChAT陽性であり,かつ,ほぼすべてのChAT陽性細胞はFRMD7を発現していた.FRMD7はマウスのスターバースト細胞において細胞体の基部および神経突起に分布が観察されたが,空間的な非対称性は観察されなかった.
この研究により,FRMD7遺伝子はマウスの網膜においてスターバースト細胞から水平方向に最適方向をもつ方向選択性ニューロンへの空間的に非対称な抑制性の入力を形成するのに必須な遺伝子であることが明らかにされた(図2).また,マカクサルの網膜においてもスターバースト細胞の特異的なマーカーであるChATに陽性の細胞がFRMD7を発現していたことから,霊長類においてChAT陽性細胞がマウスのスターバースト細胞と同様の機能をもち,網膜の方向選択性および視運動性の眼球運動の制御にかかわる可能性が予想された.神経回路の結合の空間的な非対称性を制御する新たな分子カスケードの一員としてFRMD7が同定された.
これらの発見により,つぎつぎと新たな疑問がわいてくる.FRMD7はどのような分子機構によりシナプス出力の方向特異性を決定するのだろうか? FRMD7はRhoファミリーGタンパク質の制御を介してアクチン骨格の再編成にかかわるという報告があるが,同様の機構が関与するのだろうか? スターバースト細胞においてFRMD7以外のなんらかの分子,たとえば,シナプス接着分子などが非対称な分布をするのだろうか? スターバースト細胞は何を手がかりにして網膜の背腹鼻耳軸を知るのだろうか? なぜFRMD7変異マウスにおいてはヒトの先天性眼振の患者とは異なり眼球の振動が観察されないのか? マウスとヒトでの眼球運動の制御の神経回路系の違いに起因する理由,あるいは,先天性眼振の2つの症状である眼球の振動と視運動性の眼球運動の欠損とがまったく異なる神経回路の機構により生じている可能性,などが考えられる.今後の研究課題として,これらの分子機構および神経回路の機構に関する疑問に答えていくという方向,および,先天性眼振の治療法を開発するという方向が重要であると考えている.また,この研究は大脳皮質や上丘においてみられる方向選択性,また,方位選択性の基盤となる非対称な神経回路の構造およびその発達の機構を理解するための手がかりとなることも期待される.
略歴:2008年 総合研究大学院大学生命科学研究科 修了,同年 基礎生物学研究所 博士研究員,2009年 スイスFriedrich Miescher Institute for Biomedical Research博士研究員を経て,2015年よりデンマークAarhus大学 グループリーダー.
研究テーマ:視覚の神経回路の機能,構造,発達,疾患.
関心事:個々の網膜細胞タイプから伝達された情報が中枢においてどのように処理されるのか.神経回路の非対称性はどのような分子機構により生じるのか.
© 2015 米原 圭祐 Licensed under CC 表示 2.1 日本
(スイスFriedrich Miescher Institute for Biomedical Research,Neural Circuit Laboratories)
email:米原圭祐
DOI: 10.7875/first.author.2015.135
Congenital nystagmus gene FRMD7 is necessary for establishing a neuronal circuit asymmetry for direction selectivity.
Keisuke Yonehara, Michele Fiscella, Antonia Drinnenberg, Federico Esposti, Stuart Trenholm, Jacek Krol, Felix Franke, Brigitte Gross Scherf, Akos Kusnyerik, Jan Müller, Arnold Szabo, Josephine Jüttner, Francisco Cordoba, Ashrithpal Police Reddy, János Németh, Zoltán Zsolt Nagy, Francis Munier, Andreas Hierlemann, Botond Roska
Neuron, 89, 177-193 (2016)
要 約
神経回路の空間的な非対称性は重要な役割を担うが,非対称性を生み出す分子機構は不明であった.今回,筆者らは,ヒトの先天性眼振の原因遺伝子であるFRMD7遺伝子がマウスの網膜における方向選択性の神経回路の非対称な形成に必要であることを明らかにした.FRMD7変異マウスはFRMD7変異をもつヒトの先天性眼振の患者と同様に水平方向への視運動性の眼球運動を欠失していた.この表現型は,網膜における水平方向への方向選択性の欠失,および,本来なら水平方向への選択性を示す方向選択性ニューロンへの抑制性の入力の非対称性の欠失をともなっていた.FRMD7の網膜における発現は抑制性のニューロンであるスターバーストアマクリン細胞に特異的に観察された.この研究により,神経疾患の病態生理に対する特定の抑制性のニューロンの関与が示唆された.
はじめに
神経結合の空間的な非対称性は神経回路を特徴づける重要な要素である.神経回路の非対称性のおかげで脳は音源の位置,視覚の対象の傾き,動きの方向などの特徴を抽出することができる.ショウジョウバエやマウスの視覚系には,視覚の対象が特定の方向に動いたときに強い反応を示すが,その反対の方向に動いたときにはあまり反応しないニューロンが存在し,これらは方向選択性ニューロンとよばれる.マウスやウサギなど脊椎動物の方向選択性ニューロンは網膜にも存在することが知られており,局所の神経回路の機能および構造を調べるためのモデルとして古くから解析されてきた.網膜の古典的な方向選択性の神経節細胞にはオン-オフ型とオン型とがあり,それぞれには背,腹,鼻,耳の方向のいずれかの動きに反応する4つのタイプがある1)(ただし,オン型は鼻の方向へ反応するタイプを欠くので3つのタイプしかない).オン-オフ型の方向選択性ニューロンは速い動きによく反応し,外側膝状体や上丘に情報を伝達する.一方,オン型の方向選択性ニューロンは視野全体の遅い動きによく反応し,視運動性の眼球運動の中枢である中脳の副視覚系にその情報を伝達する2).視運動性の眼球運動とは,通常,頭がゆっくり回転したときや電車の窓から景色を見ているときに起こる,視野全体のゆっくりとした動きによりひき起こされる像を網膜に安定させるための不随意の眼球運動である.オン型の方向選択性ニューロンから副視覚系への入力がないと視運動性の眼球運動は起こらないと考えられているが,霊長類の網膜にも方向選択性ニューロンが存在するという確かな証拠は得られていない.
方向選択性ニューロンの樹状突起は双極細胞からの方向に非選択的な興奮性の入力3),および,抑制性のニューロンであるスターバーストアマクリン細胞からの方向に選択的な抑制性の入力4) をうける.この方向選択的な抑制性の入力を生じる神経回路の特性のなかでも鍵となるのが,スターバーストアマクリン細胞から方向選択性ニューロンへの空間的に非対称な抑制性のシナプス入力である.スターバーストアマクリン細胞は放射状に神経突起を伸ばし,その神経突起に双極細胞からの入力をうけ,その遠位部からは抑制性の神経伝達物質であるGABAを放出する(実際には,興奮性の神経伝達物質であるアセチルコリンを共放出するが,その意義についてはよくわかっていない).方向選択性ニューロンへの抑制性の入力を担うシナプスの数は,無方向をむくスターバースト細胞の神経突起からは多く,最適方向をむくスターバースト細胞の神経突起からは少ない.つまり,スターバースト細胞はその神経突起の角度に依存して,異なる方向選択性をもつニューロンとシナプスを形成している5)(図1).マウスにおいてスターバースト細胞を遺伝学的に除去すると,網膜の方向選択性および視運動性の眼球運動がともに消失することが知られている6).
どのような発達の機構が神経突起の角度に依存したシナプスの形成を可能にするのだろうか? 筆者ら,および,ほかの研究グループによる実験から,この神経回路の非対称性はマウスが開眼するまえ,生後1週から生後2週のあいだに視覚の経験に非依存的に形成されることが示された7)(新着論文レビュー でも掲載).また,網膜の自発発火やその波もこの神経回路の発達には必要でないことが示唆された.これらの知見から,決定論的な遺伝子による機構が非対称な神経回路の形成にかかわると考えられていたが,その分子実態は不明であった.
方向選択性の発達にかかわる遺伝子を同定するためには,方向選択性の神経回路の活動に依存するヒトの視覚の機能を阻害する単一遺伝子疾患に着目することが効果的であると考えた.先天性眼振がその例である.先天性眼振は約1500人に1人の割合でみられ,そのうち約70%の症例はX染色体にあるFRMD7遺伝子の変異によりひき起こされる8).FRMD7変異をもつ先天性眼振の患者に観察されるおもな症状は,水平方向への不随意の眼球の振動,および,水平方向への視運動性の眼球運動の欠失であり,垂直方向への眼球運動は正常である.ヒトにおいてFRMD7の発現が網膜および前庭に観察されることは知られていたが,先天性眼振の神経回路の機構については不明であった9).
FRMD7はFERMドメイン含有タンパク質ファミリーに属し,細胞膜と細胞骨格のあいだのシグナル伝達や細胞骨格の再編成に関与することが示唆されてきた.培養細胞においては神経突起の伸張の作用を示す.網膜におけるニューロン種に特異的な発現プロファイリングから,マウスの網膜におけるFRMD7の発現はスターバースト細胞に濃縮されていることがわかっていた10).筆者らは,FRMD7遺伝子のスターバースト細胞における機能の不全が先天性眼振の症状をひき起こす可能性を予想し,FRMD7変異マウスを解析した.
1.FRMD7変異マウスでは水平方向への視運動性の眼球運動が欠失している
野生型マウスおよびFRMD7変異マウスの頭部を固定し,モニターのうえを動く視覚刺激を提示した際の眼球の動きをビデオカメラで追跡して比較した.野生型マウスは水平方向および垂直方向への視運動性の眼球運動を示したが,FRMD7変異マウスでは水平方向への視運動性の眼球運動が欠失していた.ヒトのFRMD7変異をもつ患者の視運動性の眼球運動を調べると,FRMD7変異マウスと同様に水平方向への視運動性の眼球運動が欠失していた.一方,垂直方向への視運動性の眼球運動はマウスおよびヒトともに正常であった.FRMD7変異マウスにおいてはヒトの患者においてみられた水平方向への眼球の振動が観察されなかった.FRMD7変異マウスにおいて水平方向への突発的な眼球運動は正常に観察されたこと,ヒトの患者においても水平方向への自発的な眼球運動は正常に観察されたことから,FRMD7の変異は眼筋の機能それ自体には影響しないと考えられた.
2.FRMD7変異マウスの網膜においては水平方向への方向選択性が欠失している
網膜の方向選択性を調べるため,野生型マウスおよびFRMD7変異マウスから単離した網膜の神経節細胞から多点電極同時記録法を用いて視覚の刺激に対するスパイク応答を記録した.野生型マウスの網膜においては背,腹,鼻,耳の方向への方向選択性の応答が観察された.FRMD7変異マウスの網膜においては水平方向(鼻方向および耳方向)への方向選択性が欠失していたが,垂直方向(背方向および腹方向)への方向選択性は正常であった.オン型およびオン-オフ型のニューロンにおいて水平方向への選択性が欠失していた.水平方向への方向選択性の欠失は開眼の直前および直後の生後13日から生後14日においてすでにみられたことから,FRMD7の機能は神経回路の生後の発達に必要であることが示唆された.
3.FRMD7変異マウスでは水平方向へ最適方向をもつ方向選択性ニューロンへの抑制性の入力の非対称性が失われている
FRMD7変異マウスの網膜において水平方向の方向選択性が失われる機構として,水平方向への方向選択性ニューロンが欠失している可能性,および,水平方向への方向選択性ニューロンは存在しているが方向選択性を失った可能性が考えられた.この疑問に答えるため,おもに水平方向へ選択性をもつニューロンがGFPにより標識されたレポーターマウスをFRMD7変異マウスと交配させ,その網膜を調べた.GFPにより標識されたニューロンの密度はFRMD7変異マウスにおいて変化がなかったことから,水平方向への方向選択性ニューロンは欠失していないことが示唆された.
2光子顕微鏡のもとにパッチクランプ記録法を用いてGFPにより標識されたニューロンからスパイク応答および抑制性シナプス後電流を記録した.FRMD7変異マウスの網膜においては,本来は水平方向への方向選択性を示すオン型およびオン-オフ型のニューロンにおいて方向に非選択的なスパイク応答が観察された.オン型のニューロンはすべての方向へ等しく応答し,オン-オフ型のニューロンはどの方向へも応答しなかったがフラッシュ刺激には応答を示した.さらに,これらのニューロンへの抑制性の入力は空間的な非対称性を欠失し,どの方向に対しても同様な大きさの抑制性の入力をうけていた.オン-オフ型のニューロンがどの方向へも応答しなくなったのは対称的になった抑制性の入力がスパイク応答を抑制するのに十分な大きさに達していたからであると示唆された.
対照実験として,垂直方向へ選択性をもつ方向選択性ニューロンを,軸索の投射部位である副視覚系の内側核に逆行性の蛍光トレーサーを注入することにより標識し,細胞体からスパイク応答および抑制性の入力を記録した.野生型マウスと比較して,FRMD7変異マウスの網膜においてスパイク応答および抑制性の入力の方向選択性に変化はみられなかった.これらの実験から,FRMD7変異マウスでは水平方向へ最適方向をもつ方向選択性ニューロンへの抑制性の入力の非対称性が失われていることが明らかにされた.
FRMD7変異マウスの網膜の大まかな構造,および,スターバースト細胞や方向選択性ニューロンの数や形態に異常はみられなかった.また,FRMD7変異マウスにおける方向選択性ニューロンの軸索の投射パターンには野生型マウスと比較して変化がみられなかったことから,FRMD7変異マウスにおける水平方向への視運動性の眼球運動の欠失は軸索投射の異常ではなく,網膜の水平方向への方向選択性の欠失により説明されると考えられた.
4.FRMD7はマウスおよび霊長類の網膜においてスターバースト細胞のマーカーに陽性の細胞において発現する
マウスおよび霊長類の網膜におけるFRMD7の発現パターンを調べるため,in situハイブリダイゼーション法および抗FRMD7抗体を作製し免疫染色を行った.マウスにおいて,FRMD7の発現は発達期をつうじてスターバースト細胞の特異的なマーカーであるChATに陽性の細胞に特異的であること,また,その発現は生後3日ごろから観察されることがわかった.マカクサルにおいても,FRMD7を発現する細胞の7割がChAT陽性であり,かつ,ほぼすべてのChAT陽性細胞はFRMD7を発現していた.FRMD7はマウスのスターバースト細胞において細胞体の基部および神経突起に分布が観察されたが,空間的な非対称性は観察されなかった.
おわりに
この研究により,FRMD7遺伝子はマウスの網膜においてスターバースト細胞から水平方向に最適方向をもつ方向選択性ニューロンへの空間的に非対称な抑制性の入力を形成するのに必須な遺伝子であることが明らかにされた(図2).また,マカクサルの網膜においてもスターバースト細胞の特異的なマーカーであるChATに陽性の細胞がFRMD7を発現していたことから,霊長類においてChAT陽性細胞がマウスのスターバースト細胞と同様の機能をもち,網膜の方向選択性および視運動性の眼球運動の制御にかかわる可能性が予想された.神経回路の結合の空間的な非対称性を制御する新たな分子カスケードの一員としてFRMD7が同定された.
これらの発見により,つぎつぎと新たな疑問がわいてくる.FRMD7はどのような分子機構によりシナプス出力の方向特異性を決定するのだろうか? FRMD7はRhoファミリーGタンパク質の制御を介してアクチン骨格の再編成にかかわるという報告があるが,同様の機構が関与するのだろうか? スターバースト細胞においてFRMD7以外のなんらかの分子,たとえば,シナプス接着分子などが非対称な分布をするのだろうか? スターバースト細胞は何を手がかりにして網膜の背腹鼻耳軸を知るのだろうか? なぜFRMD7変異マウスにおいてはヒトの先天性眼振の患者とは異なり眼球の振動が観察されないのか? マウスとヒトでの眼球運動の制御の神経回路系の違いに起因する理由,あるいは,先天性眼振の2つの症状である眼球の振動と視運動性の眼球運動の欠損とがまったく異なる神経回路の機構により生じている可能性,などが考えられる.今後の研究課題として,これらの分子機構および神経回路の機構に関する疑問に答えていくという方向,および,先天性眼振の治療法を開発するという方向が重要であると考えている.また,この研究は大脳皮質や上丘においてみられる方向選択性,また,方位選択性の基盤となる非対称な神経回路の構造およびその発達の機構を理解するための手がかりとなることも期待される.
文 献
- Sanes, J. R. & Masland, R. H.: The types of retinal ganglion cells: current status and implications for neuronal classification. Annu. Rev. Neurosci., 38, 221-246 (2015)[PubMed]
- Yonehara, K., Ishikane, H., Sakuta, H. et al.: Identification of retinal ganglion cells and their projections involved in central transmission of information about upward and downward image motion. PloS One, 4, e4320 (2009)[PubMed]
- Yonehara, K., Farrow, K., Ghanem, A. et al.: The first stage of cardinal direction selectivity is localized to the dendrites of retinal ganglion cells. Neuron, 79, 1078-1085 (2013)[PubMed]
- Fried, S. I., Munch, T. A. & Werblin, F. S.: Mechanisms and circuitry underlying directional selectivity in the retina. Nature, 420, 411-414 (2002)[PubMed]
- Briggman, K. L., Helmstaedter, M. & Denk, W.: Wiring specificity in the direction-selectivity circuit of the retina. Nature, 471, 183-188 (2011)[PubMed]
- Yoshida, K., Watanabe, D., Ishikane, H. et al.: A key role of starburst amacrine cells in originating retinal directional selectivity and optokinetic eye movement. Neuron, 30, 771-780 (2001)[PubMed]
- Yonehara, K., Balint, K., Noda, M. et al.: Spatially asymmetric reorganization of inhibition establishes a motion-sensitive circuit. Nature, 469, 407-410 (2011)[PubMed] [新着論文レビュー]
- Tarpey, P., Thomas, S., Sarvananthan, N. et al.: Mutations in FRMD7, a newly identified member of the FERM family, cause X-linked idiopathic congenital nystagmus. Nat. Genet., 38, 1242-1244 (2006)[PubMed]
- Thomas, M. G., Crosier, M., Lindsay, S. et al.: The clinical and molecular genetic features of idiopathic infantile periodic alternating nystagmus. Brain, 134, 892-902 (2011)[PubMed]
- Siegert, S., Cabuy, E., Scherf, B. G. et al.: Transcriptional code and disease map for adult retinal cell types. Nat. Neurosci., 15, 487-495, S1-S2 (2012)[PubMed]
著者プロフィール
略歴:2008年 総合研究大学院大学生命科学研究科 修了,同年 基礎生物学研究所 博士研究員,2009年 スイスFriedrich Miescher Institute for Biomedical Research博士研究員を経て,2015年よりデンマークAarhus大学 グループリーダー.
研究テーマ:視覚の神経回路の機能,構造,発達,疾患.
関心事:個々の網膜細胞タイプから伝達された情報が中枢においてどのように処理されるのか.神経回路の非対称性はどのような分子機構により生じるのか.
© 2015 米原 圭祐 Licensed under CC 表示 2.1 日本