宿主の免疫系は腸管において病原タンパク質を発現した細菌の選択的な排除を誘導する
鎌田信彦・坂本 啓・Gabriel Núñez
(米国Michigan大学Medical School,Department of Internal Medicine,Division of Gastroenterology)
email:鎌田信彦
DOI: 10.7875/first.author.2015.065
Humoral immunity in the gut selectively targets phenotypically virulent attaching-and-effacing bacteria for intraluminal elimination.
Nobuhiko Kamada, Kei Sakamoto, Sang-Uk Seo, Melody Y. Zeng, Yun-Gi Kim, Marilia Cascalho, Bruce A. Vallance, José L. Puente, Gabriel Núñez
Cell Host & Microbe, 17, 617-627 (2015)
病原タンパク質は病原細菌の感染の成立に必須であり,病原タンパク質を発現しない病原細菌は腸内常在細菌と同様に無害で感染を惹起できない.この研究においては,病原性大腸菌のマウスモデルであるCitrobacter rodentium感染モデルを用い,宿主の免疫系が病原細菌の無害化に関与することを示した.腸管において,C. rodentiumは病原タンパク質を発現する病原型の亜群と病原タンパク質を発現しない非病原型の亜群の性質の異なる集団として存在する.感染により誘導される抗体はC. rodentiumの病原タンパク質を特異的に認識し病原型の亜群のみを標識する.抗体により標識された病原型の亜群は腸管の管腔へと遊走した好中球により選択的に貪食され排除される.一方で,非病原型の亜群は抗体により認識されず宿主の免疫系による排除をうけない.しかしながら,非病原型の亜群は腸内常在細菌により競合的に排除される.以上の結果より,腸管感染症においては,宿主の獲得免疫(抗体の産生),宿主の自然免疫(好中球による貪食),腸内常在細菌が協調し,病原細菌の腸管からの排除を制御することが明らかにされた.
近年の研究により,消化管における病原細菌の排除に腸内常在細菌が必須の役割をはたすることが明らかにされてきた1,2).腸内常在細菌は病原細菌との直接的な競合や宿主の免疫系を介した間接的な感染防御機構により腸管からの病原細菌の排除を促進する2).一方で,病原細菌は病原タンパク質を介した腸管における局在の変化などの機構を介して腸内常在細菌による競合を回避する2).最近の筆者らの研究により,病原細菌は感染の初期には病原タンパク質を介した機構を用いて腸内常在細菌による競合的な排除からのがれているが,感染の後期には病原タンパク質の発現が低下し,結果として腸内常在細菌との競合に打ち勝てず腸管から排除されることが明らかにされた1)(新着論文レビュー でも掲載).しかしながら,この感染の時期による病原タンパク質の制御機序については不明であった.この研究においては,病原タンパク質の発現制御の機序に注目し,腸管に感染したときの病原タンパク質の発現と,宿主の免疫系および腸内常在細菌との関係について検討した.
病原細菌Citrobacter rodentiumはヒトの腸管病原性/腸管出血性大腸菌に類似したマウスの腸管病原細菌で,感染すると腸管の粘膜に接着して増殖し大腸炎をひき起こす1).C. rodentiumはヒトの病原性大腸菌と同様に,LEE遺伝子とよばれる一連の病原性タンパク質をコードする遺伝子をもつ3).LEE遺伝子はIII型分泌装置や細胞接着分子などをコードしており,C. rodentiumの病原性に必須である.LEE遺伝子の発現はLerにより制御されており,ler遺伝子の発現によりすべてのLEE遺伝子の発現が誘導される3).以前に筆者らは,Lerにより発現の制御される病原タンパク質が腸内常在細菌との競合に必須であることを報告した.C. rodentiumはLerを発現することにより腸内常在細菌に打ち勝ち,腸管に定着して増殖する1).一方で,感染の後期になると病原タンパク質の発現は低下し,結果として,腸内常在細菌が優勢になりC. rodentiumは腸管から競合的に排除される1).すなわち,病原タンパク質の発現量により病原細菌と腸内常在細菌との力関係が変化し,感染の成立あるいは競合的な排除が規定されていると考えられる.
いったいどういった分子機構により病原タンパク質の発現は制御されているのだろうか? これまでの報告により,C. rodentiumの排除において宿主の獲得免疫が重要であることがわかっていた4,5).そこで,宿主により誘導される病原細菌に特異的な免疫応答が病原タンパク質の制御に関与するという仮説をたてた.この仮説を証明するため,まず,獲得免疫を欠くRag-1欠損マウスにC. rodentiumを感染させ病原タンパク質の発現を解析した.野生型のマウスではC. rodentiumは感染の初期には腸管に定着し増殖するが,徐々に排除されはじめ,感染の後期には検出されなくなる1).この病原細菌の腸管からの排除のキネティクスと一致して,C. rodentiumのLerの発現は感染の初期には高いが感染の後期には有意に低下していた.一方で,Rag-1欠損マウスにおいては野生型のマウスに認められた感染の後期におけるLerの発現の低下は認められなかった.結果として,病原性を維持したC. rodentiumは腸内常在細菌による競合的な排除をうけず,感染の後期においても腸管に存在しつづけ,最終的にマウスは感染により死亡した.以上の結果より,宿主の獲得免疫は病原タンパク質の発現を制御し,腸内常在細菌による競合的な排除を補助していることが示唆された.
宿主の感染防御に宿主のB細胞による免疫応答,とくに,抗体の産生が重要な役割をはたしていることはC. rodentiumを含む多くの病原細菌の感染において報告されていた.そこで,C. rodentiumの感染により産生の誘導される抗体に着目し,抗体による病原タンパク質の制御機構について検討した.C. rodentiumに感染したのちの抗体の産生について検討したところ,感染の後期に腸管においてC. rodentiumに特異的な免疫グロブリンGおよび免疫グロブリンAが産生されることがわかった.このC. rodentiumに特異的な抗体の産生の重要性を確認するため,病原細菌に対し抗体の産生を誘導できないQMマウスを用い6),C. rodentiumに感染したのちの抗体の産生および病原タンパク質の発現の制御について検討した.QMマウスは感染の後期においてもC. rodentiumに特異的な抗体の産生が認められず,それと一致して,病原タンパク質の発現の低下,および,腸管からの排除も障害されていた.以上の結果より,C. rodentiumが感染したときに産生の誘導される抗体が病原タンパク質の発現の制御に関与する可能性が示唆された.
C. rodentiumに特異的な抗体はいったいどのような機序により病原タンパク質の発現を制御しているのだろうか? 腸管における抗体のC. rodentiumに対する結合をフローサイトメトリーにより確認したところ,宿主の獲得免疫の誘導と一致して,腸管においてC. rodentiumに免疫グロブリンGが結合していることがわかった.免疫グロブリンGの結合は獲得免疫が誘導されるまえの感染の早期には認められないが,獲得免疫が誘導されはじめるころから著明に認められ,感染の後期には80%以上のC. rodentiumに免疫グロブリンGが結合していた.一方で,腸管を含む粘膜組織においてもっとも優勢な抗体サブタイプである免疫グロブリンAの結合は認められなかった.誘導された免疫グロブリンGの抗原特異性を確認するため,イムノブロットの手法を用いて免疫グロブリンGの認識する抗原について検討した.野生型のC. rodentium,ler遺伝子を欠損したC. rodentium,および,各種の腸内常在細菌の抗原をポリアクリルアミドゲルにて電気泳動し,C. rodentiumに感染したときに誘導される血中の免疫グロブリンGおよび腸管の免疫グロブリンGにより検出した.その結果,免疫グロブリンGは野生型C. rodentiumにのみ強く結合し,ler遺伝子を欠損したC. rodentium,あるいは,ほかの腸内常在細菌とは結合しなかった.すなわち,感染のときに誘導される免疫グロブリンGはC. rodentiumのler遺伝子により制御される病原タンパク質を特異的に認識すると考えられた.
免疫グロブリンGの結合がC. rodentiumの増殖や病原タンパク質の発現を直接的に制御する可能性について検討した.C. rodentiumは細胞培養用の培地において培養することにより増殖とともにler遺伝子を発現する.その培地にC. rodentiumに感染したマウスから精製した免疫グロブリンGをくわえたところ,C. rodentiumに結合したものの増殖やler遺伝子の発現には影響をあたえなかった.すなわち,免疫グロブリンGの結合は病原細菌の増殖や遺伝子発現を直接的に制御しているわけではないと考えられた.
病原タンパク質に特異的な免疫グロブリンGの結合はどういう機序により病原タンパク質の発現を低下させているのだろうか? 近年の報告により,消化管に感染する病原細菌は均一な性質の集団ではなく,異なる性質を示す亜集団により構成されていることがわかってきた7,8).たとえば,サルモネラ菌に感染した場合,腸管に侵入したサルモネラ菌は病原タンパク質を一律に発現しているのではなく,病原タンパク質を発現し感染をひき起こす“病原型”の亜群と,病原タンパク質の発現を欠き無害な腸内常在細菌のようにふるまう“非病原型”の亜群として存在する8).非病原型の亜群は炎症の誘導それ自体には関与しないが,病原型の亜群が炎症を惹起すると同時に増殖する.非病原型の亜群は病原タンパク質の発現に対する対価(余分なエネルギー)を必要としないため,病原型の亜群よりも増殖の速度が速い.このため,炎症が惹起されると非病原型の亜群がいち早く増殖し,競合する腸内常在細菌や変異した病原細菌(生体においては,病原細菌が変異し病原性を失うことがある)の増殖を抑え,遅れて増殖してくる病原型の亜群のための環境を整える8).すなわち,病原細菌の感染においては,腸管における病原細菌の性質的な多様性が感染の成立に重要であるといえる.
実際に,C. rodentiumの感染においても多様な亜群が存在するのだろうか? その可能性を検討するため,腸管において異なる場所に局在するC. rodentiumを回収しler遺伝子の発現を解析した.その結果,腸管粘膜の近傍に存在するC. rodentiumは管腔に存在しているC. rodentiumと比べler遺伝子の発現が著明に亢進していた.すなわち,C. rodentiumの感染においても,腸管においてはC. rodentiumは病原型の亜群と非病原型の亜群として存在することが明らかにされた.
これらの病原型の亜群と非病原型の亜群はどのようにして宿主の免疫機構により認識され腸管からの排除されるのだろうか? 病原型の亜群と非病原型の亜群の主たる違いは病原タンパク質の発現であることから,感染により産生の誘導される病原タンパク質に特異的な免疫グロブリンGが病原型の亜群の選択的な排除を誘導していると考えた.この仮説を証明するため,無菌マウスに病原型のC. rodentium(野生株)と非病原型のC. rodentium(ler遺伝子欠損株)を共感染させ,in vivoにおける選択的な免疫グロブリンGの結合および腸管からの排除について検討した.その結果,抗体の産生が十分に誘導される感染の後期には,病原型のC. rodentiumには免疫グロブリンGの著明な結合が認められたのに対し,非病原型のC. rodentiumには免疫グロブリンGは結合していなかった.また,無菌マウスにおける病原型と非病原型の定着の比率を検討したところ,野生型の(抗体の産生が誘導される)マウスでは感染の初期と感染の後期では病原型の比率が優位に低下することがわかった.すなわち,病原型の亜群が感染の後期では選択的に減少していると考えられた.一方で,獲得免疫を欠くRag-1欠損マウスでは感染の後期においてむしろ病原型の比率が高くなっていた.これはRag-1欠損マウスでは病原タンパク質に対する抗体が産生されないため,病原型の亜群の選択的な抑制ができないことに起因していると考えられた.
免疫グロブリンGの結合がどのように病原型の亜群の選択的な排除に関与しているのか検討した.抗体は抗原に結合することにより抗原をオプソニン化し食細胞による貪食を促進することはよく知られている.そこで,免疫グロブリンGの結合が病原型の亜群の食細胞による選択的な貪食を誘導するかどうか検討した.マウスの腹腔にチオグリコレートを注入することにより腹腔に好中球を遊走させ,つづいて,病原型のC. rodentium(野生株)と非病原型のC. rodentium(ler遺伝子欠損株)を同時に腹腔に移入した.そののち,腹腔から好中球を回収し,好中球に貪食されたC. rodentiumを計数した.その結果,C. rodentiumに感染していないマウスにおいては病原型のC. rodentiumと非病原型のC. rodentiumの貪食に有意な差は認められなかったが,C. rodentiumに感染したマウスにおいて病原型のC. rodentiumの好中球による貪食は有意に増加し,非病原のC. rodentiumの貪食に変化はなかった.また,C. rodentiumに感染していないマウスあるいは感染したマウスの血清にて前培養することにより免疫グロブリンGを結合させたC. rodentiumを未感染のマウスに移入したところ,感染マウスの血清での前培養により病原型のC. rodentiumの好中球による貪食は有意に増加した一方,非病原型のC. rodentiumは感染マウスに由来する免疫グロブリンGと前培養しても好中球による貪食は促進されなかった.以上の結果より,病原タンパク質に特異的な免疫グロブリンGの結合は好中球による貪食を促進することが示唆された.
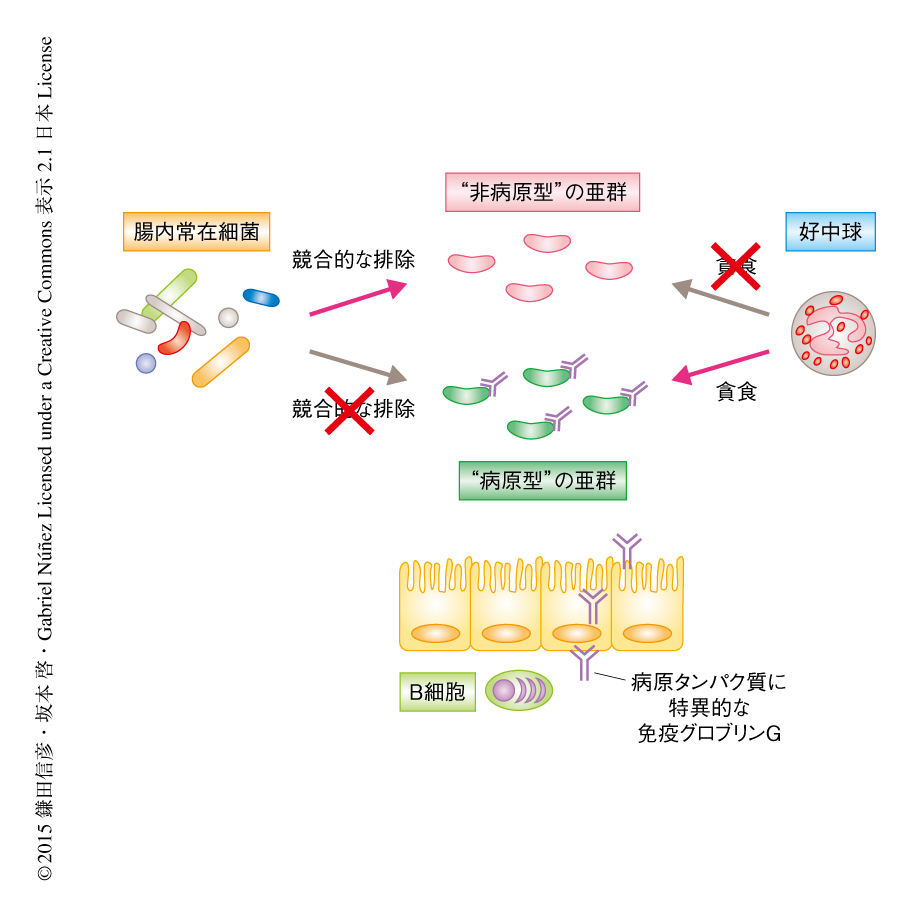
C. rodentiumに感染したマウスにおいては,通常では認められない,好中球の腸管腔への遊走が誘導されていることがわかった.また,腸管腔に遊走した好中球はC. rodentiumを捕捉していた.好中球を欠損したマウスにおいて病原タンパク質に特異的な抗体の産生は正常に認められたが,好中球の腸管腔への遊走を欠くため病原型のC. rodentiumの排除を誘導できず,結果として,病原タンパク質の発現は低下せず最終的にマウスは感染により死亡した.以上の結果より,感染の後期においては宿主の免疫応答により誘導された病原タンパク質に特異的な免疫グロブリンGが病原型の亜群を標識し,好中球による選択的な排除を促進していることが示唆された.この病原型の亜群の選択的な排除により,感染の後期には非病原型の亜群が多数となり,その結果,病原タンパク質の発現が低下する(病原遺伝子の発現が低下するのではなく,病原型の亜群の比率が低下する)と考えられた.感染の後期に多数となった非病原型の亜群は免疫グロブリンGに認識されないため,宿主の免疫応答(好中球)による排除はうけないが,代わりに,病原タンパク質の発現を欠いているため腸内常在細菌による競合を回避できず,宿主の免疫応答に非依存的に(腸内常在細菌に依存的に)腸管から排除される(図1).
病原細菌は消化管における感染を成立させるため多くの戦略を駆使している.病原タンパク質の発現量の変化も腸管における増殖での優位性を得るためのひとつの方法であると考えられる.一方で,宿主免疫はこの病原細菌の複雑な感染戦略を打ち破るために腸内常在細菌と協調して対抗策を打ちだしている.今回の報告により,古くから知られている抗体によるオプソニン化がどのように病原細菌の感染戦略を打ち破るのかが,病原細菌の病原タンパク質,宿主の獲得免疫(抗体の産生),宿主の自然免疫(好中球による貪食),腸内常在細菌の複雑にからみあった視点から明らかにされた.この知見は,今後の感染症の病態の解明や新規の治療法の開発において重要な足がかりとなることが期待される.
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年 慶應義塾大学医学部 助教,2009年 米国Michigan大学Medical SchoolにてResearch Fellowを経て,2013年より同Assistant Professor.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫および腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能について明らかにし,感染症や炎症性腸疾患の病態の解明,また,新規の治療法の開発に貢献したい.
坂本 啓(Kei Sakamoto)
米国Michigan大学Medical School研究員.
Gabriel Núñez
米国Michigan大学Medical SchoolにてProfessor.
© 2015 鎌田信彦・坂本 啓・Gabriel Núñez Licensed under CC 表示 2.1 日本
(米国Michigan大学Medical School,Department of Internal Medicine,Division of Gastroenterology)
email:鎌田信彦
DOI: 10.7875/first.author.2015.065
Humoral immunity in the gut selectively targets phenotypically virulent attaching-and-effacing bacteria for intraluminal elimination.
Nobuhiko Kamada, Kei Sakamoto, Sang-Uk Seo, Melody Y. Zeng, Yun-Gi Kim, Marilia Cascalho, Bruce A. Vallance, José L. Puente, Gabriel Núñez
Cell Host & Microbe, 17, 617-627 (2015)
要 約
病原タンパク質は病原細菌の感染の成立に必須であり,病原タンパク質を発現しない病原細菌は腸内常在細菌と同様に無害で感染を惹起できない.この研究においては,病原性大腸菌のマウスモデルであるCitrobacter rodentium感染モデルを用い,宿主の免疫系が病原細菌の無害化に関与することを示した.腸管において,C. rodentiumは病原タンパク質を発現する病原型の亜群と病原タンパク質を発現しない非病原型の亜群の性質の異なる集団として存在する.感染により誘導される抗体はC. rodentiumの病原タンパク質を特異的に認識し病原型の亜群のみを標識する.抗体により標識された病原型の亜群は腸管の管腔へと遊走した好中球により選択的に貪食され排除される.一方で,非病原型の亜群は抗体により認識されず宿主の免疫系による排除をうけない.しかしながら,非病原型の亜群は腸内常在細菌により競合的に排除される.以上の結果より,腸管感染症においては,宿主の獲得免疫(抗体の産生),宿主の自然免疫(好中球による貪食),腸内常在細菌が協調し,病原細菌の腸管からの排除を制御することが明らかにされた.
はじめに
近年の研究により,消化管における病原細菌の排除に腸内常在細菌が必須の役割をはたすることが明らかにされてきた1,2).腸内常在細菌は病原細菌との直接的な競合や宿主の免疫系を介した間接的な感染防御機構により腸管からの病原細菌の排除を促進する2).一方で,病原細菌は病原タンパク質を介した腸管における局在の変化などの機構を介して腸内常在細菌による競合を回避する2).最近の筆者らの研究により,病原細菌は感染の初期には病原タンパク質を介した機構を用いて腸内常在細菌による競合的な排除からのがれているが,感染の後期には病原タンパク質の発現が低下し,結果として腸内常在細菌との競合に打ち勝てず腸管から排除されることが明らかにされた1)(新着論文レビュー でも掲載).しかしながら,この感染の時期による病原タンパク質の制御機序については不明であった.この研究においては,病原タンパク質の発現制御の機序に注目し,腸管に感染したときの病原タンパク質の発現と,宿主の免疫系および腸内常在細菌との関係について検討した.
1.宿主の獲得免疫は病原細菌の病原タンパク質の発現を制御する
病原細菌Citrobacter rodentiumはヒトの腸管病原性/腸管出血性大腸菌に類似したマウスの腸管病原細菌で,感染すると腸管の粘膜に接着して増殖し大腸炎をひき起こす1).C. rodentiumはヒトの病原性大腸菌と同様に,LEE遺伝子とよばれる一連の病原性タンパク質をコードする遺伝子をもつ3).LEE遺伝子はIII型分泌装置や細胞接着分子などをコードしており,C. rodentiumの病原性に必須である.LEE遺伝子の発現はLerにより制御されており,ler遺伝子の発現によりすべてのLEE遺伝子の発現が誘導される3).以前に筆者らは,Lerにより発現の制御される病原タンパク質が腸内常在細菌との競合に必須であることを報告した.C. rodentiumはLerを発現することにより腸内常在細菌に打ち勝ち,腸管に定着して増殖する1).一方で,感染の後期になると病原タンパク質の発現は低下し,結果として,腸内常在細菌が優勢になりC. rodentiumは腸管から競合的に排除される1).すなわち,病原タンパク質の発現量により病原細菌と腸内常在細菌との力関係が変化し,感染の成立あるいは競合的な排除が規定されていると考えられる.
いったいどういった分子機構により病原タンパク質の発現は制御されているのだろうか? これまでの報告により,C. rodentiumの排除において宿主の獲得免疫が重要であることがわかっていた4,5).そこで,宿主により誘導される病原細菌に特異的な免疫応答が病原タンパク質の制御に関与するという仮説をたてた.この仮説を証明するため,まず,獲得免疫を欠くRag-1欠損マウスにC. rodentiumを感染させ病原タンパク質の発現を解析した.野生型のマウスではC. rodentiumは感染の初期には腸管に定着し増殖するが,徐々に排除されはじめ,感染の後期には検出されなくなる1).この病原細菌の腸管からの排除のキネティクスと一致して,C. rodentiumのLerの発現は感染の初期には高いが感染の後期には有意に低下していた.一方で,Rag-1欠損マウスにおいては野生型のマウスに認められた感染の後期におけるLerの発現の低下は認められなかった.結果として,病原性を維持したC. rodentiumは腸内常在細菌による競合的な排除をうけず,感染の後期においても腸管に存在しつづけ,最終的にマウスは感染により死亡した.以上の結果より,宿主の獲得免疫は病原タンパク質の発現を制御し,腸内常在細菌による競合的な排除を補助していることが示唆された.
2.感染の後期には病原タンパク質に特異的な抗体が産生される
宿主の感染防御に宿主のB細胞による免疫応答,とくに,抗体の産生が重要な役割をはたしていることはC. rodentiumを含む多くの病原細菌の感染において報告されていた.そこで,C. rodentiumの感染により産生の誘導される抗体に着目し,抗体による病原タンパク質の制御機構について検討した.C. rodentiumに感染したのちの抗体の産生について検討したところ,感染の後期に腸管においてC. rodentiumに特異的な免疫グロブリンGおよび免疫グロブリンAが産生されることがわかった.このC. rodentiumに特異的な抗体の産生の重要性を確認するため,病原細菌に対し抗体の産生を誘導できないQMマウスを用い6),C. rodentiumに感染したのちの抗体の産生および病原タンパク質の発現の制御について検討した.QMマウスは感染の後期においてもC. rodentiumに特異的な抗体の産生が認められず,それと一致して,病原タンパク質の発現の低下,および,腸管からの排除も障害されていた.以上の結果より,C. rodentiumが感染したときに産生の誘導される抗体が病原タンパク質の発現の制御に関与する可能性が示唆された.
C. rodentiumに特異的な抗体はいったいどのような機序により病原タンパク質の発現を制御しているのだろうか? 腸管における抗体のC. rodentiumに対する結合をフローサイトメトリーにより確認したところ,宿主の獲得免疫の誘導と一致して,腸管においてC. rodentiumに免疫グロブリンGが結合していることがわかった.免疫グロブリンGの結合は獲得免疫が誘導されるまえの感染の早期には認められないが,獲得免疫が誘導されはじめるころから著明に認められ,感染の後期には80%以上のC. rodentiumに免疫グロブリンGが結合していた.一方で,腸管を含む粘膜組織においてもっとも優勢な抗体サブタイプである免疫グロブリンAの結合は認められなかった.誘導された免疫グロブリンGの抗原特異性を確認するため,イムノブロットの手法を用いて免疫グロブリンGの認識する抗原について検討した.野生型のC. rodentium,ler遺伝子を欠損したC. rodentium,および,各種の腸内常在細菌の抗原をポリアクリルアミドゲルにて電気泳動し,C. rodentiumに感染したときに誘導される血中の免疫グロブリンGおよび腸管の免疫グロブリンGにより検出した.その結果,免疫グロブリンGは野生型C. rodentiumにのみ強く結合し,ler遺伝子を欠損したC. rodentium,あるいは,ほかの腸内常在細菌とは結合しなかった.すなわち,感染のときに誘導される免疫グロブリンGはC. rodentiumのler遺伝子により制御される病原タンパク質を特異的に認識すると考えられた.
3.C. rodentiumは腸管において病原型の亜群あるいは非病原型の亜群として存在する
免疫グロブリンGの結合がC. rodentiumの増殖や病原タンパク質の発現を直接的に制御する可能性について検討した.C. rodentiumは細胞培養用の培地において培養することにより増殖とともにler遺伝子を発現する.その培地にC. rodentiumに感染したマウスから精製した免疫グロブリンGをくわえたところ,C. rodentiumに結合したものの増殖やler遺伝子の発現には影響をあたえなかった.すなわち,免疫グロブリンGの結合は病原細菌の増殖や遺伝子発現を直接的に制御しているわけではないと考えられた.
病原タンパク質に特異的な免疫グロブリンGの結合はどういう機序により病原タンパク質の発現を低下させているのだろうか? 近年の報告により,消化管に感染する病原細菌は均一な性質の集団ではなく,異なる性質を示す亜集団により構成されていることがわかってきた7,8).たとえば,サルモネラ菌に感染した場合,腸管に侵入したサルモネラ菌は病原タンパク質を一律に発現しているのではなく,病原タンパク質を発現し感染をひき起こす“病原型”の亜群と,病原タンパク質の発現を欠き無害な腸内常在細菌のようにふるまう“非病原型”の亜群として存在する8).非病原型の亜群は炎症の誘導それ自体には関与しないが,病原型の亜群が炎症を惹起すると同時に増殖する.非病原型の亜群は病原タンパク質の発現に対する対価(余分なエネルギー)を必要としないため,病原型の亜群よりも増殖の速度が速い.このため,炎症が惹起されると非病原型の亜群がいち早く増殖し,競合する腸内常在細菌や変異した病原細菌(生体においては,病原細菌が変異し病原性を失うことがある)の増殖を抑え,遅れて増殖してくる病原型の亜群のための環境を整える8).すなわち,病原細菌の感染においては,腸管における病原細菌の性質的な多様性が感染の成立に重要であるといえる.
実際に,C. rodentiumの感染においても多様な亜群が存在するのだろうか? その可能性を検討するため,腸管において異なる場所に局在するC. rodentiumを回収しler遺伝子の発現を解析した.その結果,腸管粘膜の近傍に存在するC. rodentiumは管腔に存在しているC. rodentiumと比べler遺伝子の発現が著明に亢進していた.すなわち,C. rodentiumの感染においても,腸管においてはC. rodentiumは病原型の亜群と非病原型の亜群として存在することが明らかにされた.
4.病原タンパク質に特異的な抗体の結合は病原型の亜群の選択的な排除を誘導する
これらの病原型の亜群と非病原型の亜群はどのようにして宿主の免疫機構により認識され腸管からの排除されるのだろうか? 病原型の亜群と非病原型の亜群の主たる違いは病原タンパク質の発現であることから,感染により産生の誘導される病原タンパク質に特異的な免疫グロブリンGが病原型の亜群の選択的な排除を誘導していると考えた.この仮説を証明するため,無菌マウスに病原型のC. rodentium(野生株)と非病原型のC. rodentium(ler遺伝子欠損株)を共感染させ,in vivoにおける選択的な免疫グロブリンGの結合および腸管からの排除について検討した.その結果,抗体の産生が十分に誘導される感染の後期には,病原型のC. rodentiumには免疫グロブリンGの著明な結合が認められたのに対し,非病原型のC. rodentiumには免疫グロブリンGは結合していなかった.また,無菌マウスにおける病原型と非病原型の定着の比率を検討したところ,野生型の(抗体の産生が誘導される)マウスでは感染の初期と感染の後期では病原型の比率が優位に低下することがわかった.すなわち,病原型の亜群が感染の後期では選択的に減少していると考えられた.一方で,獲得免疫を欠くRag-1欠損マウスでは感染の後期においてむしろ病原型の比率が高くなっていた.これはRag-1欠損マウスでは病原タンパク質に対する抗体が産生されないため,病原型の亜群の選択的な抑制ができないことに起因していると考えられた.
免疫グロブリンGの結合がどのように病原型の亜群の選択的な排除に関与しているのか検討した.抗体は抗原に結合することにより抗原をオプソニン化し食細胞による貪食を促進することはよく知られている.そこで,免疫グロブリンGの結合が病原型の亜群の食細胞による選択的な貪食を誘導するかどうか検討した.マウスの腹腔にチオグリコレートを注入することにより腹腔に好中球を遊走させ,つづいて,病原型のC. rodentium(野生株)と非病原型のC. rodentium(ler遺伝子欠損株)を同時に腹腔に移入した.そののち,腹腔から好中球を回収し,好中球に貪食されたC. rodentiumを計数した.その結果,C. rodentiumに感染していないマウスにおいては病原型のC. rodentiumと非病原型のC. rodentiumの貪食に有意な差は認められなかったが,C. rodentiumに感染したマウスにおいて病原型のC. rodentiumの好中球による貪食は有意に増加し,非病原のC. rodentiumの貪食に変化はなかった.また,C. rodentiumに感染していないマウスあるいは感染したマウスの血清にて前培養することにより免疫グロブリンGを結合させたC. rodentiumを未感染のマウスに移入したところ,感染マウスの血清での前培養により病原型のC. rodentiumの好中球による貪食は有意に増加した一方,非病原型のC. rodentiumは感染マウスに由来する免疫グロブリンGと前培養しても好中球による貪食は促進されなかった.以上の結果より,病原タンパク質に特異的な免疫グロブリンGの結合は好中球による貪食を促進することが示唆された.
C. rodentiumに感染したマウスにおいては,通常では認められない,好中球の腸管腔への遊走が誘導されていることがわかった.また,腸管腔に遊走した好中球はC. rodentiumを捕捉していた.好中球を欠損したマウスにおいて病原タンパク質に特異的な抗体の産生は正常に認められたが,好中球の腸管腔への遊走を欠くため病原型のC. rodentiumの排除を誘導できず,結果として,病原タンパク質の発現は低下せず最終的にマウスは感染により死亡した.以上の結果より,感染の後期においては宿主の免疫応答により誘導された病原タンパク質に特異的な免疫グロブリンGが病原型の亜群を標識し,好中球による選択的な排除を促進していることが示唆された.この病原型の亜群の選択的な排除により,感染の後期には非病原型の亜群が多数となり,その結果,病原タンパク質の発現が低下する(病原遺伝子の発現が低下するのではなく,病原型の亜群の比率が低下する)と考えられた.感染の後期に多数となった非病原型の亜群は免疫グロブリンGに認識されないため,宿主の免疫応答(好中球)による排除はうけないが,代わりに,病原タンパク質の発現を欠いているため腸内常在細菌による競合を回避できず,宿主の免疫応答に非依存的に(腸内常在細菌に依存的に)腸管から排除される(図1).
おわりに
病原細菌は消化管における感染を成立させるため多くの戦略を駆使している.病原タンパク質の発現量の変化も腸管における増殖での優位性を得るためのひとつの方法であると考えられる.一方で,宿主免疫はこの病原細菌の複雑な感染戦略を打ち破るために腸内常在細菌と協調して対抗策を打ちだしている.今回の報告により,古くから知られている抗体によるオプソニン化がどのように病原細菌の感染戦略を打ち破るのかが,病原細菌の病原タンパク質,宿主の獲得免疫(抗体の産生),宿主の自然免疫(好中球による貪食),腸内常在細菌の複雑にからみあった視点から明らかにされた.この知見は,今後の感染症の病態の解明や新規の治療法の開発において重要な足がかりとなることが期待される.
文 献
- Kamada, N., Kim, Y. G., Sham, H. P. et al.: Regulated virulence controls the ability of a pathogen to compete with the gut microbiota. Science, 336, 1325-1329 (2012)[PubMed] [新着論文レビュー]
- Kamada, N., Chen, G. Y., Inohara. N. et al.: Control of pathogens and pathobionts by the gut microbiota. Nat. Immunol., 14, 685-690 (2013)[PubMed]
- Deng, W., Puente, J. L., Gruenheid, S. et al.: Dissecting virulence: systematic and functional analyses of a pathogenicity island. Proc. Natl. Acad. Sci. USA, 101, 3597-3602 (2004)[PubMed]
- Bry, L. & Brenner, M. B.: Critical role of T cell-dependent serum antibody, but not the gut-associated lymphoid tissue, for surviving acute mucosal infection with Citrobacter rodentium, an attaching and effacing pathogen. J. Immunol., 172, 433-441 (2004)[PubMed]
- Maaser, C., Housley, M. P., Iimura, M. et al.: Clearance of Citrobacter rodentium requires B cells but not secretory immunoglobulin A (IgA) or IgM antibodies. Infect. Immun., 72, 3315-3324 (2004)[PubMed]
- Cascalho, M., Ma, A., Lee, S. et al.: A quasi-monoclonal mouse. Science, 272, 1649-1652 (1996)[PubMed]
- Marteyn, B., West, N. P., Browning, D. F. et al.: Modulation of Shigella virulence in response to available oxygen in vivo. Nature, 465, 355-358 (2010)[PubMed]
- Diard, M., Garcia, V., Maier, L. et al.: Stabilization of cooperative virulence by the expression of an avirulent phenotype. Nature, 494, 353-356 (2013)[PubMed]
著者プロフィール
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年 慶應義塾大学医学部 助教,2009年 米国Michigan大学Medical SchoolにてResearch Fellowを経て,2013年より同Assistant Professor.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫および腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能について明らかにし,感染症や炎症性腸疾患の病態の解明,また,新規の治療法の開発に貢献したい.
坂本 啓(Kei Sakamoto)
米国Michigan大学Medical School研究員.
Gabriel Núñez
米国Michigan大学Medical SchoolにてProfessor.
© 2015 鎌田信彦・坂本 啓・Gabriel Núñez Licensed under CC 表示 2.1 日本