病原細菌の発現する病原因子は腸管に常在する細菌との競合を制御する
鎌田信彦・Gabriel Núñez
(米国Michigan大学Medical School,Department of Pathology)
email:鎌田信彦
DOI: 10.7875/first.author.2012.059
Regulated virulence controls the ability of a pathogen to compete with the gut microbiota.
Nobuhiko Kamada, Yun-Gi Kim, Ho Pan Sham, Bruce A. Vallance, José L. Puente, Eric C. Martens, Gabriel Núñez
Science, 336, 1325-1329 (2012)
腸管感染症において腸内に常在する細菌は感染防御に重要な役割をはたしていると考えられている.一方で,病原細菌は腸内常在細菌による防御反応を回避し腸管において増殖する必要がある.この病原細菌と腸内常在細菌との攻防が病原細菌の感染と排除とのバランスを規定している.この研究は,病原細菌が病原因子の発現を介し腸管における局在を変化させ,腸内常在細菌による競合的な排除を回避し感染を成立させていることを明らかにした.病原性大腸菌のマウスにおけるモデルであるCitrobacter rodentiumは,病原因子を介し腸管上皮細胞に定着する.腸内常在細菌は腸管腔の側に局在しており,病原細菌は腸内常在細菌とのニッチの違いにより競合をまぬがれる.一方で,感染の後期には病原細菌における病原因子の発現は低下し,病原細菌は腸内常在細菌の定着している腸管腔の側へと移動する.腸管腔に局在した病原細菌は栄養要求性の類似する腸内常在細菌により腸管から競合的に排除される.以上の結果より,腸管感染症における病原細菌と腸内常在細菌との競合機構の一端が明らかになった.
病原細菌はさまざまな病原因子を介して宿主に定着,増殖し炎症を惹起する.宿主は病原細菌に対し各種の免疫反応を誘導することでその排除を誘導する.すなわち,病原細菌のもつ病原性と宿主のもつ免疫反応との攻防が感染あるいは排除を規定していると考えられる.一方,消化管には多数の腸内細菌が常在しており,病原細菌・宿主免疫・腸内常在細菌の三者が複雑にからみあいながら感染あるいは排除を制御している.しかしながら,腸内常在細菌がいかにして病原細菌の排除にかかわっているのかについては不明な点が多い.この研究は,腸管への感染における腸内常在細菌と病原細菌との競合機構に着目し,腸内常在細菌の腸管感染症における役割について検討した.
ヒトを含むすべての哺乳動物の消化管には100兆個にもおよぶ多数の腸内細菌が常在している.これら腸内常在細菌は難溶解性の多糖の分解やビタミンの合成など栄養素の代謝,パイエル板などの消化管に特異的なリンパ組織の発達,免疫グロブリンA産生B細胞やTh17細胞など消化管に特徴的な免疫細胞の分化において,重要な役割をはたしていることが知られている.腸内常在細菌に依存して発達する腸管に特異的な免疫機能は,腸管に感染した細菌の排除や炎症性腸疾患などの疾患の病態に深く関与していると考えられる1).また,腸内常在細菌はこれら腸管に特異的な免疫誘導を介した機構のほかにも,病原細菌と直接的に競合し増殖を阻害しうると考えられている1).しかしながら,この競合機構についてはいまだよくわかっていない.そこで,腸内細菌をもたない無菌マウスを用い,病原細菌の感染における腸内常在細菌の役割について検討した.
この研究に用いた病原細菌Citrobacter rodentiumは,ヒト腸管病原性/腸管出血性大腸菌に類似したマウスの腸管病原細菌で,腸管の粘膜に接着,増殖し大腸炎をひき起こす.C. rodentiumは腸内細菌を保持するSPFマウス(特定の病原細菌をもたないマウス)において,感染ののち10日ごろまで腸管において著明に増殖し,軟便,腸管の肥厚,マクロファージや好中球などの炎症性の細胞浸潤など,大腸炎の症状を呈する2).感染から2週間が経過すると腸管におけるC. rodentiumの数は減少しはじめ,感染から3週間のちには糞便からC. rodentiumは検出できなくなり大腸炎の症状も治まる.すなわち,宿主における病原細菌の排除は完了していた.腸内細菌を欠く無菌マウスにおいても,C. rodentiumは腸管において著明に増殖し,感染ののち10日ごろにはSPFマウスと同様の大腸炎の症状を呈した.しかしながら,無菌マウスでは感染から2週間が経過したのちにも糞便におけるC. rodentiumの数は保たれており,病原細菌の排除は認められなかった.以上の結果より,腸内常在細菌は腸管において病原細菌の排除に必須であることが示唆された.
ここでひとつの疑問がもちあがる.無菌マウスは病原細菌の排除ができず,腸管においてつねに高いC. rodentiumの数が維持されている.しかしながら,無菌マウスはこの病原細菌の持続感染により命を落とすことはない.これはいったいどういうことなのだろうか? 興味深いことに,感染のち3週間を経過した無菌マウスでは,腸管においてC. rodentiumの数は維持されているにもかかわらず,腸管の肥厚や炎症細胞の浸潤といった炎症の所見は消失していることがわかった.これはすなわち,感染の後期においてC. rodentiumはその病原性を失い,非病原性の腸内常在細菌のようにふるまっていることを示していた.
病原細菌が非病原性の腸内常在細菌に変化することが実際に起こるのだろうか? この疑問に答えるため,病原細菌のもつ“病原因子”(virulence factor)に着目した.病原因子とはその名のとおり病原細菌のみに発現する因子で,宿主細胞への接着や炎症の誘導にかかわるタンパク質である.C. rodentiumはヒト病原性大腸菌と同様に,LEE(locus of enterocyte effacement)遺伝子とよばれる一連の病原因子をコードする遺伝子をもつ.LEE遺伝子はIII型分泌装置や接着分子などのタンパク質をコードしておりC. rodentiumの病原性に必須のものである.LEE遺伝子はグローバルな制御タンパク質であるLerによりその発現が制御されており,ler遺伝子の発現によりすべてのLEE遺伝子の発現が誘導される3,4).
実際に,ler遺伝子の発現を欠くler欠損変異株ではC. rodentiumの病原性は失われておりSPFマウスには感染しなかった.一方で,ler欠損変異株は無菌マウスの腸管においては野生型のC. rodentiumと同様に増殖することができた.この結果は,LEE遺伝子にコードされLerにより制御される病原因子は,腸管における増殖そのものには必要ないが,SPFマウスの腸管における増殖,すなわち,腸内常在細菌との競合には必要である可能性を示唆していた.また,ler欠損変異株は無菌マウスの腸管では正常に増殖することができたが,非病原性の腸内常在細菌と同様に,腸管の炎症を惹起することはなかった.すなわち,病原因子の発現は病原細菌の腸内常在細菌との競合のみならず,宿主への炎症の誘導にも必須であった.
では,無菌マウスにおけるC. rodentiumの感染後期における病原性の消失は,病原因子の発現の低下により説明できるのだろうか? 定量PCR法およびler遺伝子レポーター株を用いて,感染ののちの病原因子の発現(ler遺伝子の発現)を検討した.その結果,予想どおり,感染初期(感染1週ごろ)にはC. rodentiumは病原因子を発現しているが,感染後期(感染2週以降)では病原因子の発現は減弱していることが明らかになった.興味深いことに,この病原因子の発現の低下は一過性のものであり,感染後期の無菌マウスの糞便から病原因子の発現の低下したC. rodentiumを回収して新しいマウスに感染させると,再度,病原因子は発現し実際に腸炎を誘導した.現時点で,この病原因子の発現制御機構は明らかになっていないが,宿主免疫や腸内常在細菌からの分泌因子を介した防御反応とも考えられる一方,病原細菌が宿主から宿主へと移っていくための戦略としても的を射ている.
ler遺伝子により制御される病原因子の発現はSPFマウスの腸管における増殖,すなわち,腸内常在細菌との競合に必要であると考えられた.これは,SPFマウスにおけるC. rodentiumの増殖から排除と病原因子の発現とのキネティクスが一致していることからも強く支持された.すなわち,SPFマウスの腸管において,感染初期にはC. rodentiumは病原因子を発現し腸内常在細菌と競合して増殖する.しかしながら,感染後期ではC. rodentiumの病原因子の発現は低下し,その結果,腸内常在細菌との競合能を失い排除される.この仮説を証明するため,C. rodentiumを感染させた無菌マウスを,感染初期(感染から3日目)および感染後期(感染から21日目)において,SPFマウスのもつ腸内常在細菌を移入することにより通常化し,病原因子の発現と腸内常在細菌との競合の関係を検討した.その結果,病原因子を発現する感染初期では腸内常在細菌を移入しても腸管におけるC. rodentiumの数に変化はなかったのに対し,感染後期では腸内常在細菌の移入ののちC. rodentiumはすみやかに腸管から排除された.以上の結果より,病原因子の発現は腸内常在細菌との競合に必須であることが示唆された.
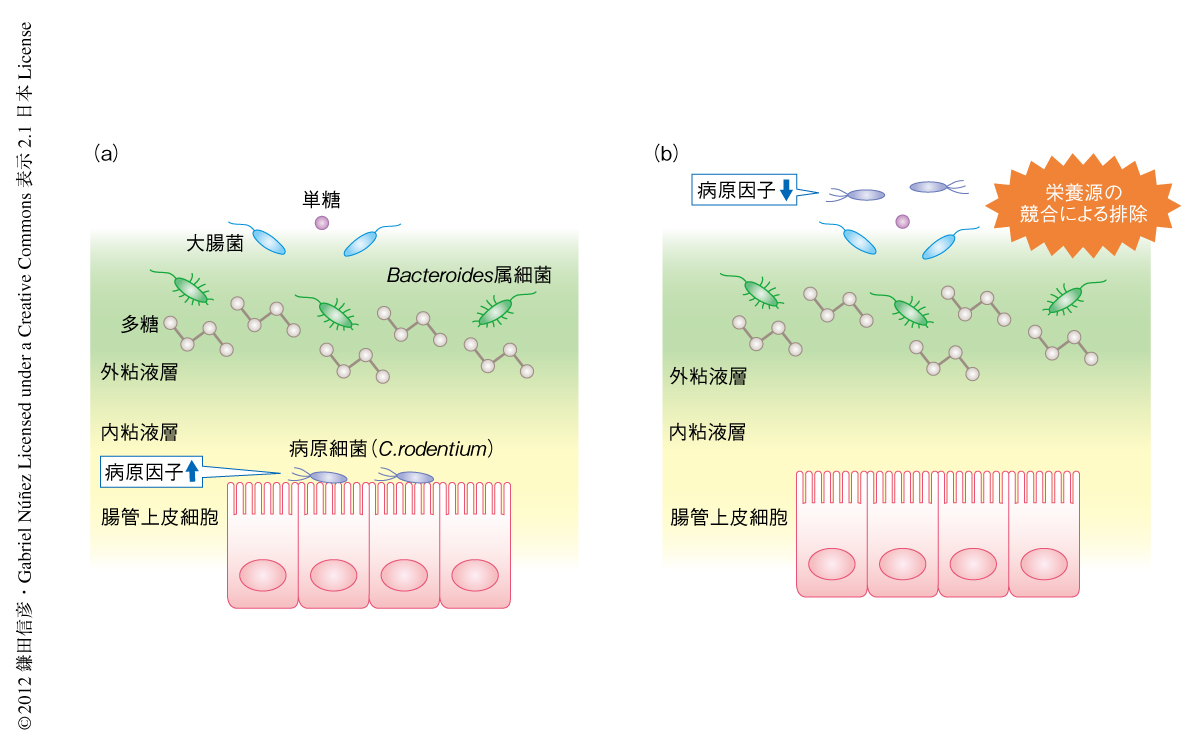
では,病原細菌は病原因子を発現することで,腸内常在細菌による競合的な排除からどのようにのがれているのだろうか? 可能性のひとつは,病原細菌は腸内常在細菌とは異なる場所に生息することにより腸内常在細菌との直接的な競合を回避していることである.実際に,多くの腸管感染性の病原細菌は宿主の上皮細胞に接着することが報告されている5).一方で,腸内常在細菌の多くは腸管上皮細胞からは粘液層により遠く隔てられた腸管腔の側,外粘膜層のちかくに局在していることが知られている6).この点を明らかにするため,感染初期および感染後期での無菌マウスの腸管におけるC. rodentiumの局在について解析を行なった.蛍光in situハイブリダイゼーション法および電子顕微鏡を用いた解析により,感染初期にはC. rodentiumは宿主の腸管上皮細胞に強固に付着して存在しているが,感染後期には腸管上皮細胞には接着しておらず,外粘液層から腸管腔へと局在は変化していることが明らかになった.また,ler欠損変異株は感染初期においても腸管上皮細胞には接着しておらず腸管腔に局在していた.また実際に,感染初期および感染後期での無菌マウスの糞便におけるC. rodentiumの数,および,腸管に接着したC. rodentiumの数を測定した結果,糞便におけるC. rodentiumの数には変化はないにもかかわらず,腸管に接着したC. rodentiumの数は感染初期に比べ感染後期で著明に減少していた.
これらの結果より,病原因子の発現は病原細菌の腸管上皮細胞への接着を介した腸内常在細菌からの競合の回避を誘導し,また,その発現の低下により病原細菌は腸内常在細菌の存在する腸管腔の側へと移動し,腸内常在細菌による競合的な排除をうけることが示唆された.
腸内常在細菌は病原因子の発現を低下させ腸管腔の側へと移動したC. rodentiumを競合的に排除する.しかしながら,すべての腸内常在細菌が一様に病原細菌と競合しうるとは考えにくい.そこで,特定の腸内常在細菌に着目し病原細菌との競合能について検討を行った.無菌マウスにC. rodentiumを感染させ,病原因子の発現の低下した3週間ののち,正常なマウスの腸管から単離した非病原性の腸内常在細菌である大腸菌,および,2種のBacteroides属細菌(Bacteroides thetaiotaomicronとBacteroides vulgatus)をそれぞれ移入した.大腸菌はC. rodentiumと非常に類似した細菌であり,Bacteroides属細菌はマウスの腸管における最優勢な細菌である.C. rodentiumの感染から3週間のちの無菌マウスに大腸菌を移入すると,大腸菌は腸管において増殖し,C. rodentiumは腸管から競合的に排除された.一方で,Bacteroides属細菌を移入しても腸管におけるC. rodentiumの数は減少せず,むしろ,増加した.以上の結果より,腸内常在細菌のすべてが病原細菌と競合する能力をもつわけではなく,Bacteroides属細菌のように,むしろ細菌どうしの共生関係において病原細菌を増殖させる役割をはたしている種もあると考えられた.
なぜ大腸菌のみがC. rodentiumと競合しうるのだろうか? 大腸菌とC. rodentiumは同じγプロテオバクテリアに分類される細菌であり,病原性の有無を除けば非常によく似た性質をもつと考えられた.このことから,大腸菌とC. rodentiumとは栄養(“食”)や腸管での局在(“場所”)といった腸管における増殖あるいは生存に必須の要素において共通のものを嗜好しており,その結果,この要求性の類似により腸管において競合するのではないかという仮説をたてた.この仮説の真偽を明らかにするため,おのおのの細菌のもつ糖代謝能に着目した.糖類は宿主のみならず,腸内常在細菌にとっても重要な栄養素である.宿主は食事を介して植物あるいは動物に由来する多くの多糖類を摂取しているが,その多くに対し分解酵素をもっておらず,そのままのかたちでは消化し吸収することができない.腸内常在細菌はそれら難分解性の多糖を消化し,宿主が利用可能な単糖類へと変換する.また,腸内常在細菌も単糖類を栄養源として利用し増殖する.興味深いことに,腸内常在細菌のすべてが多糖を分解できるわけではなく,ある種の細菌が多糖を分解して単糖を合成し,また別の種の細菌がその単糖を利用する,といった腸内常在細菌どうしの共生関係が腸内常在細菌のバランスを規定している7).
C. rodentiumおよび大腸菌のもつ糖代謝能について検討した結果,ともに,単糖類を栄養源とし増殖することはできるが多糖類の分解能を欠き,その結果,多糖類のみを含有する培地では多糖類を栄養源とすることができず増殖できなかった.一方,2種のBacteroides属細菌は単糖類を栄養源として増殖できるが多糖類の分解能ももっており,多糖類のみを含有する培地でも増殖が可能であった.つまり,C. rodentiumとの競合能をもつ腸内常在細菌である大腸菌はC. rodentiumと類似した栄養要求性を示し,C. rodentiumとの競合能を欠く腸内常在細菌であるBacteroides属細菌はC. rodentiumとは異なる栄養要求性を示した.以上の結果より,糖代謝能の違いに起因する異なる栄養要求性が腸内常在細菌と病原細菌との競合能を規定していることが示唆された.さらに,おもに多糖類を炭素源として含有する通常のマウス用の餌から,多糖類を含まず炭素源として二糖であるスクロースのみを含有する餌に切り替えることで,多糖類を含む食餌では競合しなかったBacteroides属細菌も,このかぎられた炭素源(C. rodentiumと共通する栄養源)のみの特殊な環境ではC. rodentiumと競合しうることが確認された.この結果は,大腸菌のもつC. rodentiumとの競合能は,単純な“場所”の奪い合いによるものではなく,共通する“食”をめぐり病原細菌と腸内常在細菌とが競合していることを強く示唆していた.
この研究により,病原細菌が腸内常在細菌との競合をいかに回避するのか(病原因子を介した腸管における局在の違い),また,腸内常在細菌がどのような機構により病原細菌と競合するのか(栄養源が共通することによる競合)という,腸管における病原細菌の感染および排除の機構が明らかになった(図1).これらの結果は,病原因子を標的とした新しい感染性細菌に対する治療法や,病原細菌との競合能をもつプロバイオティクスや特定の腸内常在細菌を選択的に増殖させるプレバイオティクスなど感染症の治療戦略,また,腸内細菌叢の乱れが関与する炎症性腸疾患などの疾患の病態解明において,重要な足がかりとなることが期待される.
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年より慶應義塾大学医学部 助教,2009年より米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫と腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能を明らかにし,感染症や炎症性腸疾患の病態解明および新規の治療法の開発に貢献したい.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 鎌田信彦・Gabriel Núñez Licensed under CC 表示 2.1 日本
(米国Michigan大学Medical School,Department of Pathology)
email:鎌田信彦
DOI: 10.7875/first.author.2012.059
Regulated virulence controls the ability of a pathogen to compete with the gut microbiota.
Nobuhiko Kamada, Yun-Gi Kim, Ho Pan Sham, Bruce A. Vallance, José L. Puente, Eric C. Martens, Gabriel Núñez
Science, 336, 1325-1329 (2012)
要 約
腸管感染症において腸内に常在する細菌は感染防御に重要な役割をはたしていると考えられている.一方で,病原細菌は腸内常在細菌による防御反応を回避し腸管において増殖する必要がある.この病原細菌と腸内常在細菌との攻防が病原細菌の感染と排除とのバランスを規定している.この研究は,病原細菌が病原因子の発現を介し腸管における局在を変化させ,腸内常在細菌による競合的な排除を回避し感染を成立させていることを明らかにした.病原性大腸菌のマウスにおけるモデルであるCitrobacter rodentiumは,病原因子を介し腸管上皮細胞に定着する.腸内常在細菌は腸管腔の側に局在しており,病原細菌は腸内常在細菌とのニッチの違いにより競合をまぬがれる.一方で,感染の後期には病原細菌における病原因子の発現は低下し,病原細菌は腸内常在細菌の定着している腸管腔の側へと移動する.腸管腔に局在した病原細菌は栄養要求性の類似する腸内常在細菌により腸管から競合的に排除される.以上の結果より,腸管感染症における病原細菌と腸内常在細菌との競合機構の一端が明らかになった.
はじめに
病原細菌はさまざまな病原因子を介して宿主に定着,増殖し炎症を惹起する.宿主は病原細菌に対し各種の免疫反応を誘導することでその排除を誘導する.すなわち,病原細菌のもつ病原性と宿主のもつ免疫反応との攻防が感染あるいは排除を規定していると考えられる.一方,消化管には多数の腸内細菌が常在しており,病原細菌・宿主免疫・腸内常在細菌の三者が複雑にからみあいながら感染あるいは排除を制御している.しかしながら,腸内常在細菌がいかにして病原細菌の排除にかかわっているのかについては不明な点が多い.この研究は,腸管への感染における腸内常在細菌と病原細菌との競合機構に着目し,腸内常在細菌の腸管感染症における役割について検討した.
1.腸内に常在する細菌は病原細菌の排除に必須である
ヒトを含むすべての哺乳動物の消化管には100兆個にもおよぶ多数の腸内細菌が常在している.これら腸内常在細菌は難溶解性の多糖の分解やビタミンの合成など栄養素の代謝,パイエル板などの消化管に特異的なリンパ組織の発達,免疫グロブリンA産生B細胞やTh17細胞など消化管に特徴的な免疫細胞の分化において,重要な役割をはたしていることが知られている.腸内常在細菌に依存して発達する腸管に特異的な免疫機能は,腸管に感染した細菌の排除や炎症性腸疾患などの疾患の病態に深く関与していると考えられる1).また,腸内常在細菌はこれら腸管に特異的な免疫誘導を介した機構のほかにも,病原細菌と直接的に競合し増殖を阻害しうると考えられている1).しかしながら,この競合機構についてはいまだよくわかっていない.そこで,腸内細菌をもたない無菌マウスを用い,病原細菌の感染における腸内常在細菌の役割について検討した.
この研究に用いた病原細菌Citrobacter rodentiumは,ヒト腸管病原性/腸管出血性大腸菌に類似したマウスの腸管病原細菌で,腸管の粘膜に接着,増殖し大腸炎をひき起こす.C. rodentiumは腸内細菌を保持するSPFマウス(特定の病原細菌をもたないマウス)において,感染ののち10日ごろまで腸管において著明に増殖し,軟便,腸管の肥厚,マクロファージや好中球などの炎症性の細胞浸潤など,大腸炎の症状を呈する2).感染から2週間が経過すると腸管におけるC. rodentiumの数は減少しはじめ,感染から3週間のちには糞便からC. rodentiumは検出できなくなり大腸炎の症状も治まる.すなわち,宿主における病原細菌の排除は完了していた.腸内細菌を欠く無菌マウスにおいても,C. rodentiumは腸管において著明に増殖し,感染ののち10日ごろにはSPFマウスと同様の大腸炎の症状を呈した.しかしながら,無菌マウスでは感染から2週間が経過したのちにも糞便におけるC. rodentiumの数は保たれており,病原細菌の排除は認められなかった.以上の結果より,腸内常在細菌は腸管において病原細菌の排除に必須であることが示唆された.
2.病原細菌における病原因子の発現は感染の後期において低下する
ここでひとつの疑問がもちあがる.無菌マウスは病原細菌の排除ができず,腸管においてつねに高いC. rodentiumの数が維持されている.しかしながら,無菌マウスはこの病原細菌の持続感染により命を落とすことはない.これはいったいどういうことなのだろうか? 興味深いことに,感染のち3週間を経過した無菌マウスでは,腸管においてC. rodentiumの数は維持されているにもかかわらず,腸管の肥厚や炎症細胞の浸潤といった炎症の所見は消失していることがわかった.これはすなわち,感染の後期においてC. rodentiumはその病原性を失い,非病原性の腸内常在細菌のようにふるまっていることを示していた.
病原細菌が非病原性の腸内常在細菌に変化することが実際に起こるのだろうか? この疑問に答えるため,病原細菌のもつ“病原因子”(virulence factor)に着目した.病原因子とはその名のとおり病原細菌のみに発現する因子で,宿主細胞への接着や炎症の誘導にかかわるタンパク質である.C. rodentiumはヒト病原性大腸菌と同様に,LEE(locus of enterocyte effacement)遺伝子とよばれる一連の病原因子をコードする遺伝子をもつ.LEE遺伝子はIII型分泌装置や接着分子などのタンパク質をコードしておりC. rodentiumの病原性に必須のものである.LEE遺伝子はグローバルな制御タンパク質であるLerによりその発現が制御されており,ler遺伝子の発現によりすべてのLEE遺伝子の発現が誘導される3,4).
実際に,ler遺伝子の発現を欠くler欠損変異株ではC. rodentiumの病原性は失われておりSPFマウスには感染しなかった.一方で,ler欠損変異株は無菌マウスの腸管においては野生型のC. rodentiumと同様に増殖することができた.この結果は,LEE遺伝子にコードされLerにより制御される病原因子は,腸管における増殖そのものには必要ないが,SPFマウスの腸管における増殖,すなわち,腸内常在細菌との競合には必要である可能性を示唆していた.また,ler欠損変異株は無菌マウスの腸管では正常に増殖することができたが,非病原性の腸内常在細菌と同様に,腸管の炎症を惹起することはなかった.すなわち,病原因子の発現は病原細菌の腸内常在細菌との競合のみならず,宿主への炎症の誘導にも必須であった.
では,無菌マウスにおけるC. rodentiumの感染後期における病原性の消失は,病原因子の発現の低下により説明できるのだろうか? 定量PCR法およびler遺伝子レポーター株を用いて,感染ののちの病原因子の発現(ler遺伝子の発現)を検討した.その結果,予想どおり,感染初期(感染1週ごろ)にはC. rodentiumは病原因子を発現しているが,感染後期(感染2週以降)では病原因子の発現は減弱していることが明らかになった.興味深いことに,この病原因子の発現の低下は一過性のものであり,感染後期の無菌マウスの糞便から病原因子の発現の低下したC. rodentiumを回収して新しいマウスに感染させると,再度,病原因子は発現し実際に腸炎を誘導した.現時点で,この病原因子の発現制御機構は明らかになっていないが,宿主免疫や腸内常在細菌からの分泌因子を介した防御反応とも考えられる一方,病原細菌が宿主から宿主へと移っていくための戦略としても的を射ている.
3.病原細菌の病原因子を介した腸管における局在の変化が腸内常在細菌との競合に必須である
ler遺伝子により制御される病原因子の発現はSPFマウスの腸管における増殖,すなわち,腸内常在細菌との競合に必要であると考えられた.これは,SPFマウスにおけるC. rodentiumの増殖から排除と病原因子の発現とのキネティクスが一致していることからも強く支持された.すなわち,SPFマウスの腸管において,感染初期にはC. rodentiumは病原因子を発現し腸内常在細菌と競合して増殖する.しかしながら,感染後期ではC. rodentiumの病原因子の発現は低下し,その結果,腸内常在細菌との競合能を失い排除される.この仮説を証明するため,C. rodentiumを感染させた無菌マウスを,感染初期(感染から3日目)および感染後期(感染から21日目)において,SPFマウスのもつ腸内常在細菌を移入することにより通常化し,病原因子の発現と腸内常在細菌との競合の関係を検討した.その結果,病原因子を発現する感染初期では腸内常在細菌を移入しても腸管におけるC. rodentiumの数に変化はなかったのに対し,感染後期では腸内常在細菌の移入ののちC. rodentiumはすみやかに腸管から排除された.以上の結果より,病原因子の発現は腸内常在細菌との競合に必須であることが示唆された.
では,病原細菌は病原因子を発現することで,腸内常在細菌による競合的な排除からどのようにのがれているのだろうか? 可能性のひとつは,病原細菌は腸内常在細菌とは異なる場所に生息することにより腸内常在細菌との直接的な競合を回避していることである.実際に,多くの腸管感染性の病原細菌は宿主の上皮細胞に接着することが報告されている5).一方で,腸内常在細菌の多くは腸管上皮細胞からは粘液層により遠く隔てられた腸管腔の側,外粘膜層のちかくに局在していることが知られている6).この点を明らかにするため,感染初期および感染後期での無菌マウスの腸管におけるC. rodentiumの局在について解析を行なった.蛍光in situハイブリダイゼーション法および電子顕微鏡を用いた解析により,感染初期にはC. rodentiumは宿主の腸管上皮細胞に強固に付着して存在しているが,感染後期には腸管上皮細胞には接着しておらず,外粘液層から腸管腔へと局在は変化していることが明らかになった.また,ler欠損変異株は感染初期においても腸管上皮細胞には接着しておらず腸管腔に局在していた.また実際に,感染初期および感染後期での無菌マウスの糞便におけるC. rodentiumの数,および,腸管に接着したC. rodentiumの数を測定した結果,糞便におけるC. rodentiumの数には変化はないにもかかわらず,腸管に接着したC. rodentiumの数は感染初期に比べ感染後期で著明に減少していた.
これらの結果より,病原因子の発現は病原細菌の腸管上皮細胞への接着を介した腸内常在細菌からの競合の回避を誘導し,また,その発現の低下により病原細菌は腸内常在細菌の存在する腸管腔の側へと移動し,腸内常在細菌による競合的な排除をうけることが示唆された.
4.細菌の糖代謝能が腸内常在細菌の病原細菌との競合能を規定する
腸内常在細菌は病原因子の発現を低下させ腸管腔の側へと移動したC. rodentiumを競合的に排除する.しかしながら,すべての腸内常在細菌が一様に病原細菌と競合しうるとは考えにくい.そこで,特定の腸内常在細菌に着目し病原細菌との競合能について検討を行った.無菌マウスにC. rodentiumを感染させ,病原因子の発現の低下した3週間ののち,正常なマウスの腸管から単離した非病原性の腸内常在細菌である大腸菌,および,2種のBacteroides属細菌(Bacteroides thetaiotaomicronとBacteroides vulgatus)をそれぞれ移入した.大腸菌はC. rodentiumと非常に類似した細菌であり,Bacteroides属細菌はマウスの腸管における最優勢な細菌である.C. rodentiumの感染から3週間のちの無菌マウスに大腸菌を移入すると,大腸菌は腸管において増殖し,C. rodentiumは腸管から競合的に排除された.一方で,Bacteroides属細菌を移入しても腸管におけるC. rodentiumの数は減少せず,むしろ,増加した.以上の結果より,腸内常在細菌のすべてが病原細菌と競合する能力をもつわけではなく,Bacteroides属細菌のように,むしろ細菌どうしの共生関係において病原細菌を増殖させる役割をはたしている種もあると考えられた.
なぜ大腸菌のみがC. rodentiumと競合しうるのだろうか? 大腸菌とC. rodentiumは同じγプロテオバクテリアに分類される細菌であり,病原性の有無を除けば非常によく似た性質をもつと考えられた.このことから,大腸菌とC. rodentiumとは栄養(“食”)や腸管での局在(“場所”)といった腸管における増殖あるいは生存に必須の要素において共通のものを嗜好しており,その結果,この要求性の類似により腸管において競合するのではないかという仮説をたてた.この仮説の真偽を明らかにするため,おのおのの細菌のもつ糖代謝能に着目した.糖類は宿主のみならず,腸内常在細菌にとっても重要な栄養素である.宿主は食事を介して植物あるいは動物に由来する多くの多糖類を摂取しているが,その多くに対し分解酵素をもっておらず,そのままのかたちでは消化し吸収することができない.腸内常在細菌はそれら難分解性の多糖を消化し,宿主が利用可能な単糖類へと変換する.また,腸内常在細菌も単糖類を栄養源として利用し増殖する.興味深いことに,腸内常在細菌のすべてが多糖を分解できるわけではなく,ある種の細菌が多糖を分解して単糖を合成し,また別の種の細菌がその単糖を利用する,といった腸内常在細菌どうしの共生関係が腸内常在細菌のバランスを規定している7).
C. rodentiumおよび大腸菌のもつ糖代謝能について検討した結果,ともに,単糖類を栄養源とし増殖することはできるが多糖類の分解能を欠き,その結果,多糖類のみを含有する培地では多糖類を栄養源とすることができず増殖できなかった.一方,2種のBacteroides属細菌は単糖類を栄養源として増殖できるが多糖類の分解能ももっており,多糖類のみを含有する培地でも増殖が可能であった.つまり,C. rodentiumとの競合能をもつ腸内常在細菌である大腸菌はC. rodentiumと類似した栄養要求性を示し,C. rodentiumとの競合能を欠く腸内常在細菌であるBacteroides属細菌はC. rodentiumとは異なる栄養要求性を示した.以上の結果より,糖代謝能の違いに起因する異なる栄養要求性が腸内常在細菌と病原細菌との競合能を規定していることが示唆された.さらに,おもに多糖類を炭素源として含有する通常のマウス用の餌から,多糖類を含まず炭素源として二糖であるスクロースのみを含有する餌に切り替えることで,多糖類を含む食餌では競合しなかったBacteroides属細菌も,このかぎられた炭素源(C. rodentiumと共通する栄養源)のみの特殊な環境ではC. rodentiumと競合しうることが確認された.この結果は,大腸菌のもつC. rodentiumとの競合能は,単純な“場所”の奪い合いによるものではなく,共通する“食”をめぐり病原細菌と腸内常在細菌とが競合していることを強く示唆していた.
おわりに
この研究により,病原細菌が腸内常在細菌との競合をいかに回避するのか(病原因子を介した腸管における局在の違い),また,腸内常在細菌がどのような機構により病原細菌と競合するのか(栄養源が共通することによる競合)という,腸管における病原細菌の感染および排除の機構が明らかになった(図1).これらの結果は,病原因子を標的とした新しい感染性細菌に対する治療法や,病原細菌との競合能をもつプロバイオティクスや特定の腸内常在細菌を選択的に増殖させるプレバイオティクスなど感染症の治療戦略,また,腸内細菌叢の乱れが関与する炎症性腸疾患などの疾患の病態解明において,重要な足がかりとなることが期待される.
文 献
- Littman, D. R. & Pamer, E. G.: Role of the commensal microbiota in normal and pathogenic host immune responses. Cell Host Microbe, 10, 311-323 (2011)[PubMed]
- Mundy, R., MacDonald, T. T., Dougan, G. et al.: Citrobacter rodentium of mice and man. Cell Microbiol., 7, 1697-1706 (2005)[PubMed]
- Deng, W., Li, Y., Vallance, B. A. et al.: Locus of enterocyte effacement from Citrobacter rodentium: sequence analysis and evidence for horizontal transfer among attaching and effacing pathogens. Infect. Immun., 69, 6323-6335 (2001)[PubMed]
- Deng, W., Puente, J. L., Gruenheid, S. et al.: Dissecting virulence: systematic and functional analyses of a pathogenicity island. Proc. Natl. Acad. Sci. USA, 101, 3597-3602 (2004)[PubMed]
- Bergstrom, K. S., Kissoon-Singh, V., Gibson, D. L. et al.: Muc2 protects against lethal infectious colitis by disassociating pathogenic and commensal bacteria from the colonic mucosa. PLoS Pathog., 6, e1000902 (2010)[PubMed]
- Vaishnava, S., Yamamoto, M., Severson, K. M. et al.: The antibacterial lectin RegIIIγ promotes the spatial segregation of microbiota and host in the intestine. Science, 334, 255-258 (2011)[PubMed]
- Koropatkin, N. M., Cameron, E. A. & Martens, E. C.: How glycan metabolism shapes the human gut microbiota. Nat. Rev. Microbiol., 10, 323-335 (2012)[PubMed]
著者プロフィール
略歴:2007年 慶應義塾大学大学院医学研究科にて博士号取得,同年より慶應義塾大学医学部 助教,2009年より米国Michigan大学Medical Schoolリサーチフェロー.
研究テーマ:腸管感染症および炎症性腸疾患における宿主免疫と腸内細菌の役割.
抱負:腸内細菌の腸疾患における役割や,腸内細菌の認識に関与するマクロファージおよび樹状細胞の機能を明らかにし,感染症や炎症性腸疾患の病態解明および新規の治療法の開発に貢献したい.
Gabriel Núñez
米国Michigan大学Medical School教授.
© 2012 鎌田信彦・Gabriel Núñez Licensed under CC 表示 2.1 日本